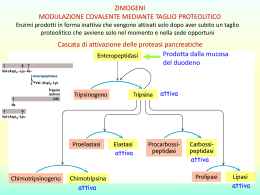
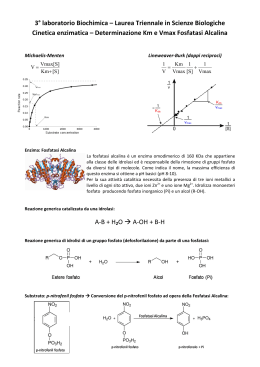
Gli enzimi Gli enzimi sono le proteine1 che catalizzano2 le reazioni chimiche che avvengono nei sistemi biologici 1 2 con l’eccezione dei ribozimi (RNA catalitici) un catalizzatore è una sostanza che promuove una reazione chimica senza subire alcuna modificazione permanente 1. Catalisi acido-basica • La catalisi acida generale è un processo in cui il trasferimento temporaneo di un protone da un acido abbassa l’energia libera dello stato di transizione di una reazione • Si parla di catalisi basica generale se la velocità di reazione viene accelerata dalla sottrazione temporanea di un protone da parte di una base 2. Catalisi covalente (nucleofilica) La catalisi covalente coinvolge la formazione di un legame covalente transitorio tra l’enzima e il substrato 3. Catalisi favorita da ioni metallici Gli ioni metallici possono : 1. Legarsi al substrato in modo da orientarlo correttamente 2. Partecipare a reazioni di ossido-riduzione mediante cambiamento reversibile del numero di ossidazione del metallo 3. Stabilizzare elettrostaticamente cariche negative Cinetica enzimatica [E] limitante [S] in eccesso Tutti gli enzimi possono essere analizzati per quantificare sia la loro velocità di reazione che la loro efficienza La relazione tra queste due grandezze è descritta dall’equazione di Michaelis-Menten From Wikipedia, the free encyclopedia Leonor Michaelis (January 16, 1875 – October 8, 1949) was a German biochemist and physician famous for his work with Maud Menten in enzyme kinetics and Michaelis-Menten kinetics. Born in Berlin (Germany), he studied medicine in Freiburg, where he graduated in 1897. In 1914 he published a paper suggesting that Emil Abderhalden's notorious pregnancy tests could not be reproduced, a paper which fatally compromised Michaelis' position as an academic in Germany (….) Besides his role in the formulation of the Michaelis-Menten equation (1913) he discovered Janus green as a supravital stain for mitochondria and the Michaelis-Gutmann body in urinary tract infections (1902) and found that thioglycolic acid could dissolve keratin, making him the father of the permanent wave. From Wikipedia, the free encyclopedia Maud Leonora Menten (March 20, 1879 – July 26, 1960) was a Canadian medical scientist who made significant contributions to enzyme kinetics and histochemistry. Her name is associated with the famous MichaelisMenten equation in biochemistry. She was among the first women in Canada to earn a medical doctorate. She completed her thesis work at University of Chicago. At that time women were not allowed to do research in Canada, so she decided to do research in other countries such as the United States and Germany. In 1912 she moved to Berlin where she worked with Leonor Michaelis, obtaining a Ph.D. in 1916. (…) Her most famous work (…) resulted in the Michaelis-Menten equations. Menten also invented the azo-dye coupling reaction for alkaline phosphatase, which is still used in histochemistry. She characterised bacterial toxins from B. paratyphosus, S. scarlatinae and Salmonella ssp.) and conducted the first electrophoretic separation of proteins in 1944. She worked on the properties of hemoglobin, regulation of blood sugar level, and kidney function. She was also an accomplished musician and painter. Leonor Michaelis e Maud Menten (1913) La cinetica di Michaelis-Menten descrive l'andamento della velocità di una reazione catalizzata da enzimi, al variare della concentrazione di substrato. (Questo modello è valido per enzimi non allosterici.) ES è un intermedio di reazione il cui basso valore di energia di attivazione permette di fare avvenire una specifica reazione catalizzata. Quando ES assume un valore di concentrazione che si mantiene costante nel tempo, si dice che è stato raggiunto lo stato stazionario (steady state). Quando [S] è tale che tutto E si trova in ES la seconda tappa limita la velocità complessiva della reazione, che diviene insensibile ad un aumento ulteriore di [S] L’equazione di Michaelis-Menten KM è uguale alla concentrazione di substrato a cui la Velocità di reazione è pari alla metà di quella massima (mol/L) La costante di Michaelis-Menten è una grandezza caratteristica di ciascun enzima. KM indica l'affinità tra un enzima e il suo substrato: < valore di KM < [S] per cui V = Vmax/2 (alta affinità dell'enzima per il substrato). Viceversa > valore di KM > [S] per cui V = Vmax/2 (minore affinità dell'enzima per il substrato). Quando tutto l’enzima (cioè l’enzima totale, Etot) partecipa alla reazione, ovvero la concentrazione del complesso Enzima-Substrato [ES] diventa [E] tot, la velocità della reazione catalizzata corrisponderà alla velocità massima Vmax. Si può allora definire una nuova costante : Kcat = Vmax / [ETOT] Kcat = Vmax / [ETOT] La costante catalitica Kcat indica la velocità del processo catalitico (il numero di molecole trasformate in un secondo) ed è detta anche numero di turnover Kcat = rappresenta una misura diretta della formazione del prodotto in condizioni ottimali (s-1) Kcat/KM = è una costante di velocità di secondo ordine ((mol/L) s-1) e fornisce una misura dell’efficienza e della specificità di un enzima Per unità di enzima (EU) si intende: la quantità di enzima che trasforma 1 μmole di substrato in 1 minuto primo a temperatura definita (di norma 37 C). Ogni enzima ha valori delle costanti caratteristici La SOD1 ha la più alta Kcat/KM di ogni altro enzima conosciuto (~7 x 109 M-1 s-1) La determinazione sperimentale di VMax (e quindi di KM) è necessariamente imprecisa. Tuttavia, l'equazione di Michaelis-Menten può essere espressa nella forma Grafico dei doppi reciproci (o di Lineweaver-Burk) Rappresentazione grafica dell'andamento funzione di 1/[S] retta con -1/KM intercetta sull'asse delle ascisse 1/Vmax intercetta sull'asse delle ordinate KM/Vmax = coefficiente angolare di 1/V in Anche la rappresentazione di Lineweaver-Burk causa imprecisioni nella determinazione di KM e VMAX, però è molto utile per descrivere il tipo di inibizione di un enzima Gli inibitori enzimatici sono molecole che si legano ad un enzima e causano la diminuzione della sua attività. Molti inibitori sono studiati come farmaci. Proteasi di HIV con ritonavir Gli inibitori sono classificati come reversibili e irreversibili. Gli inibitori reversibili si legano non covalentemente a E o a ES (attraverso legami ionici o idrogeno o per interazioni idrofobiche) Gli inibitori irreversibili modificano covalentemente aminoacidi presenti nel sito attivo di E Gli inibitori sono anche classificati come • • • • Competitivi Non-competitivi Incompetitivi Misti Inibizione competitiva Gli inibitori competitivi legano E nello stesso sito del substrato e hanno la stessa intercetta sull’asse y dell’enzima non inibito (Vmax non cambia) ma la pendenza è diversa e la intercetta sull’asse x cambia rispetto all’enzima non inibito (KM cambia). Inibizione non competitiva e incompetitiva Inibizione incompetitiva Gli inibitori non competitivi legano E in un sito diverso da quello del substrato e hanno la stessa affinità per E ed ES. KM non cambia ma Vmax diminuisce Gli inibitori incompetitivi legano solo ES Il complesso EIS è enzimaticamente inattivo Vmax e KM sono minori. Gli inibitori misti legano sia E che ES ma con affinità differente Vmax diminuisce e KM aumenta La regolazione dell’attività enzimatica Le vie metaboliche sono costituite da serie di reazioni catalizzate A E1 B E2 C E3 D La velocità di una via metabolica è spesso regolata da una “tappa di comando” che accende/spegne la via stessa La velocità della “tappa di comando” è regolata in diverse maniere: LENTAMENTE (ore o giorni) 1. Controllo genetico della concentrazione dell’enzima. VELOCEMENTE (secondi o minuti) 1. Controllo allosterico (da substrati, coenzimi, prodotti – anche di reazioni successive) 2. Modificazione covalente (ad es. fosforilazione) 3. Cicli del substrato (variazione della velocità di due reazioni opposte catalizzate da due enzimi diversi) Controllo (epi)genetico della concentrazione di un enzima. • A livello trascrizionale : struttura della cromatina, attivazione/disattivazione di un promotore • A livello del processamento dell’mRNA splicing alternativo, stabilità • A livello della traduzione localizzazione dell’mRNA, conservazione in RNP Controllo post-traduzionale della concentrazione di un enzima Ripiegamento tridimensionale corretto Assemblaggio delle subunità peptidiche Formazione di legami S-S fra gruppi laterali di cisteine Rimozione di aminoacidi: o sequenze segnale di indirizzamento o metionina iniziale o sequenze presenti nei precursori Aggiunta di carboidrati e successiva elaborazione Aggiunta di code lipidiche Aggiunta di cofattori Modificazioni covalenti Modificazioni post-traduzionali L’attività di molti enzimi è regolata da modificazioni post-traduzionali, che modificano l’affinità dell’enzima per il suo substrato - Glicosilazione; - Acetilazione (ad es. degli istoni); - Miristilazione (attacco di un ac. miristico, in genere in N-term); - fosforilazione/defosforilazione di residui -OH di Tyr, Ser o Thr (mediata da chinasi e fosfatasi) - Acilazione (a livello del C-term a livello del ER e del Golgi). - Gipilazione (attacco di Glicosil Fosfatidil Inositolo, GPI). - Formazione di ponti di solfuro (disolfuro isomerasi) - Metilazione (ad es. istoni, importante per il silenziamento geni) - Idrossilazione (per la formazione di ponti H fra proteine; es. proline nel collageno) Modificazioni covalenti comuni delle proteine Modification Donor molecule Example of modified protein Protein function Phosphorylation ATP Glycogen phosphorylase Glucose homeostasis; energy transduction Acetylation Acetyl CoA Histones DNA packing; transcription Myristoylation Myristoyl CoA Src Signal transduction ADP-ribosylation NAD RNA polymerase Transcription Farnesylation Farnesyl pyrophosphate Ras Signal transduction γ-Carboxylation HCO3- Thrombin Blood clotting Sulfation 3′-Phosphoadenosine5′-phosphosulfate Fibrinogen Blood-clot formation Ubiquitination Ubiquitin Cyclin Control of cell cycle Controllo della attività della glicogeno fosforilasi Controllo allosterico (da substrati, coenzimi, prodotti) Regolazione mediante retroinibizione da prodotto (feedback inhibition ) A E1 B E2 C E3 D La concentrazione di un prodotto (finale/intermedio) della via metabolica regola l’attività di un E “a monte” Se [D] è alta, E1 viene inibito da D stesso Enzimi allosterici (L’equazione di Michaelis-Menten non è valida) La regolazione allosterica (o allosteria) è la regolazione di un enzima o di una proteina (multimerica) mediata da una molecola detta effettore allosterico, che svolge tale funzione legandosi presso il sito allosterico. Un enzima dotato di siti allosterici è detto enzima allosterico. Il termine allosteria deriva dal greco allos, cioè "altro", e stereos, "struttura, solido", in riferimento alla separazione del sito allosterico di una proteina dal suo sito attivo. Quando l'effettore di una proteina è diverso dal suo substrato si parla di allosteria eterotropica, quando coincide si parla di allosteria omotropica. Un modulatore allosterico omotropico è tipicamente un attivatore, un modulatore allosterico eterotropico può essere un attivatore o un inibitore I modulatori allosterici inducono cambiamenti conformazionali (anche a lunga distanza) nella proteina legata. L'ossigeno è sia il substrato che l'effettore dell’Hb. Il sito allosterico è il sito attivo di una subunità contigua. Il legarsi dell'ossigeno ad una subunità induce un cambio conformazionale in quella subunità, che forza i restanti siti attivi accrescendo la loro affinità per ossigeno. Stato T Bassa affinità per O2 (deossiemoglobina) Stato R Alta affinità per O2 (ossieomoglobina) Il BPG diminuisce l’affinità della Hb per l’O2 e quindi favorisce la forma deossiNei capillari, il BPG favorisce il rilascio di O2 Il BPG è un modulatore allosterico eterotropico dell’Hb. Il cambiamento conformazionale indotto dal modulatore allosterico causa una variazione di affinità dell’enzima per il substrato o della proteina per il ligando. La Fosfofruttochinasi controlla la via glicolitica (nel muscolo scheletrico) 1. • PFK è un tetramero con due stati conformazionali (T e R) in equilibrio tra loro • L’ATP è sia substrato che inibitore (2 siti di legame diversi) • AMP, ADP e fruttosio-2,6bifosfato sono attivatori La regolazione allosterica viene talvolta sfruttata in farmacologia. Ad es. gli ansiolitici benzodiazepine (ad es : Valium, Xanax, Librium e Ativan) potenziano l’attività del neurotrasmettitore acido gammaaminobutirrico (GABA) legando il suo recettore GABAR in un sito diverso dal GABA e attivandolo (il GABAR è un canale inibitorio, quando è attivato diminuisce l’attività neuronale).
Scaricare