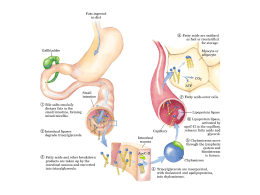
Krilling D Manuale Uso Interno D OMEGA-3 + D3 Krill oil D3 ITALCHIMICI 1 Krilling D Manuale Uso Interno Lipidi I lipidi sono costituenti di tutti gli organismi viventi. Nella loro composizione chimica sono presenti carbonio, idrogeno ed ossigeno (perciò sono detti Terziari). Sono caratterizzati da insolubilità in acqua e dalla capacità di produrre almeno un acido grasso per idrolisi. Sono distinti a livello biologico in lipidi di deposito (riserva energetica, funzione protettiva) e lipidi di struttura (componenti delle membrane cellulari). I lipidi si trovano in grassi animali e olii vegetali. Classificazione dei lipidi I lipidi si dividono in Semplici e Complessi LIPIDI COMPOSIZIONE SEMPLICI Esteri di acidi grassi + un alcool Gliceridi Ceridi Steridi Glicerolo + acidi grassi Alcool superiore + acido superiore Sterolo + acido grasso COMPLESSI Esteri di acidi grassi Fosfolipidi: Glicerofosfolipidi Sfingofosfolipidi Glicerolo+acidi grassi+acido ortofosforico+base azotata Aminoalcool+acido grasso+acido ortofosforico+base azotata Glicolipidi: Cerebrosidi Solfatidi Gangliosidi Aminoalcool+acido grasso+galattosio Aminoalcool+acido grasso+galattosio+solfato Aminoalcool+acido grasso superiore,+esosi+acido neuraminico Proteolipidi: Proteine+lipidi Gli Acidi Grassi Sono i costituenti di tutti i lipidi e si distinguono in Saturi, poiché non hanno doppi legami e sono idrofobi, ed Insaturi, che hanno doppi legami. Gli acidi grassi Insaturi si dividono a loro volta in Monoinsaturi (un solo doppio legame) e Polinsaturi con due o più doppi legami. Gli acidi grassi sono considerati a catena corta fino a 10 atomi di carbonio, a catena media fino a 14 e a catena lunga fino a 24. La presenza del doppio legame conferisce alla catena carboniosa una forte reattività poiché può accettare idrogeno con la trasformazione dell’acido grasso insaturo nel corrispondente saturo o assumere ossigeno formando epossidi e idroperossidi. Gli acidi grassi saturi si descrivono con Cx: y :n - Es. Acido butirrico C 4: n-0 ad indicare 0 doppi legami. Gli acidi monoinsaturi con Cx: y :n - Es. Acido oleico C 18:1 :n-3 ad indicare 1 doppio legame sul 3° atomo di Carbonio. Gli acidi polinsaturi con Cx: y :n - Es. Acido linolenico C 18:3 :n-3 ad indicare 3 doppi legami ad iniziare dal 3° atomo di C. Spesso per indicare il numero dei doppi legami s’inserisce nella formula la lettera greca ITALCHIMICI (omega). 2 Krilling D Manuale Uso Interno EFA, EPA, DHA, PUFA, OMEGA-3, OMEGA-6 Vediamo di mettere ordine in tutte queste sigle che si trovano in letteratura. Il punto di partenza per comprendere le sigle sono gli EFA (Essential Fatty Acids) detti anche Vitamine F. Gli EFA sono acidi grassi polinsaturi che devono essere introdotti con la dieta nell’organismo poiché questi non è in grado di sintetizzarli: Acido cis-Linoleico Acido -Linolenico C 18:2 n-6 C 18:3 n-3 DIETA Serie Omega-6 Serie Omega-3 Acido -Linolenico C 18 : 3 n-3 Acido cis- linoleico C 18 : 2 n-6 -6-desaturasi Acido -Linoleico C 18 : 3 n-6 C 18 : 4 n-3 Acido di-omo-Linolenico DGLA C 20 : 3 n-6 Acido stearonico C 20 : 4 n-3 -5-desaturasi PGE1 Acido Arachidonico C 20 : 4 n-6 Acido Eicosapentaenoico EPA C 20 : 5 n-3 PGE2 PGE3 Acido Adreico C 22 : 4 n-6 C 22 : 5 n-3 Serie Omega C 22 : 5 n-6 C 22 : 6 n-3 Acido Decosaesaonoico DHA Come accade per la maggior parte delle vitamine, l’acido cis-linoleico e l’acido -linolenico da soli non hanno alcuna attività biologica, a parte la produzione di energia per ossidazione. Per poter esseri attivi come EFA, devono essere trasformati in altri derivati da degli enzimi: Enolasi (che allunga la catena carboniosa) Desaturasi (che inserisce doppi legami nella catena carboniosa). L’enzima che favorisce o inibisce la trasformazione dell’acido cis-linoleico ad acido -linoleico e dell’acido -linolenico in acido stearonico è la desaturasi. La formazione delle PG1 e PG2 dipende quindi, in prima fase, dalla formazione dell’acido -linoleico, che trasformandosi in acido di-omo--linolenico ed arachidonico permeterà la biosintesi delle prostaglandine. Gli acidi grassi di questa via sono detti acidi della serie Omega-6. Dall’acido -Linolenico si hanno invece gli acidi della serie Omega-3 come l’acido eicosapemtaenoico (EPA), la formazione delle PG3 e l’acido decosaesaenoico (DHA). Dall’EPA si può comunque fornare l’acido arachidonico. Il DHA può a sua volta riconvertirsi in EPA, si pensa che il DHA sia la riserva per la formazione di EPA. ITALCHIMICI 3 Krilling D Manuale Uso Interno Abbiamo sino ad ora visto il significato dei termini EFA, EPA, DHA, Omega-3 ed Omega-6, non ci resta che illustrare i PUFA e l’olio di pesce. I PUFA (PolyUnsaturated Fatty Acids) sono generalmente identificati con gli acidi grassi della serie Omega-3 quando predominano nella dieta a base di olio di pesce e con gli acidi grassi della serie Omega-6 presenti nella dieta a base di carne e vegetali. Pertanto i PUFA Omega-3 avranno alti livelli di acido -Linolenico, di EPA ed DHA che sono considerati particolarmente importanti biologicamente. Questo tipo di PUFA sono stati molto studiati, partendo dalla ricerca degli effetti della dieta a base di pesce negli Eschimesi della Groenlandia. I PUFA introdotti con la dieta vengono incorporati nei fosfolipidi delle membrane cellulari. Stimoli traumatici, tossinici, batterici e farmacologici, attivano una fosfolipasi che idrolizza i fosfolipidi di membrana e libera gli acidi grassi menzionati, che divengono disponibili come substrati del sistema enzimatico prostaglandina-sintetasi e di altri sistemi enzimatici. Gli Eicosanoidi Gli eicosanoidi sono sostanze (super-ormoni) che controllano i sistemi ormonali. Sono rappresentati da diverse famiglie di sostanze (prostaglandine, tromboxani, leucotrieni, lipossine ecc.). Dobbiamo ai ricercatori Bergstrom, Samuelson e Vane (premio Nobel 1982) un valido studio di questi elementi che ci permette di comprenderne l'importanza. Gli Eicosanoidi derivati dall'Acido arachidonico (AA) (Omega-6) hanno la capacità di aumentare le reazioni allergiche, la proliferazione cellulare, la pressione sanguigna, le reazioni infiammatorie, l'aggregazione piastrinica, la trombogenesi e il vasospasmo. Quelli derivati dall'Acido eicosapentenoico (EPA) (Omega-3), hanno effetti opposti e quindi protettivi. Le Prostaglandine Le Prostaglandine fanno parte della famiglia degli Esonoidi e si propongono come sostanze di tipo ormonale. Esse gestiscono importati funzioni quali: permeabilità cellulare, processi di coagulazione, funzionalità del sistema nervoso, funzioni sessuali e riproduttive, mobilizzazione dei grassi, fragilità capillare vasocostrizione, risposte immunitarie e infiammatorie. Le Prostaglandine, a differenza degli ormoni sono sintetizzate ed operano nel luogo dove sono necessarie. Vengono normalmente suddivise nei tre gruppi seguenti: 1. Serie 1 (PGE1), considerate "buone", derivano dall'Acido dihomo-gamma-linoleico (DGLA) 2. Serie 2 (PGH2), considerate "cattive", derivano dall'Acido arachidonico (AA) 3. Serie 3 (PGI2), considerate "buone", derivano dall'Acido eicosapentenoico (EPA). ITALCHIMICI 4 Krilling D Manuale Uso Interno Le prostaglandine della Serie 1 e 3 (buone): sono vasodilatatrici, collaborano alla gestione dei processi coagulativi, svolgono azione antinfiammatoria, abbassano il Colesterolo LDL (Low density lipoproteins) (proteine di grasso a bassa densità che trasportano, principalmente, i fosfolipidi e il colesterolo libero), aumentano il Colesterolo HDL (High Density Lipoproteins) (proteine di grasso ad alta densità che trasportano i fosfolipidi e il colesterolo esterificato fino al fegato da dove viene eliminato attraverso la bile. L’esterificazione è una reazione tra un alcool e un acido. Le prostaglandine della Serie 2 (cattive) hanno l'effetto opposto. Giusto rapporto tra Omega-3 e Omega-6 Va precisato che gli AGE della serie Omega-6 e Omega-3 non sono intercambiabili; pertanto è necessario che vengano entrambi assunti con l'alimentazione. Non solo, ma va tenuto presente che gli Omega-6 e gli Omega-3 competono tra loro per l'utilizzo degli enzimi coinvolti nella loro desaturazione. Per tale ragione il consumo eccessivo di cibi ricchi in acidi grassi Omega-6 può compromettere la conversione dell'Acido Alfa-linolenico in Acido eicosapentenoico (EPA), e creare dei presupposti per disfunzioni o malattie. Le ricerche attuali suggeriscono che i livelli di AGE, e il loro equilibrio, possano giocare un ruolo fondamentale nella crescita e nello sviluppo. Sembra anche che possano essere determinanti nella prevenzione e nel trattamento di malattie croniche tra cui: patologie coronariche, ipertensione, diabete mellito di tipo II, artrite, cancro e altri disordini immunitari ed infiammatori. Gli Acidi grassi del Serie Omega-3, ed in particolare l'Acido eicosapentenoico (EPA) e l'Acido decosaesaenoico (DHA), sono assai importanti per la salute. Purtroppo, però, negli alimenti comuni se ne trovano delle quantità assai ridotte, gli unici alimenti che ne contengono sono il pesce e i suoi derivati. Per questo fatto, nella dieta tradizionale si usano ben 10 parti di Omega-6 contro una sola parte di Omega-3 (rapporto Omega-6/Omega-3 = 10:1), mentre dovrebbe essere di circa 6:1. Per correggere tale rapporto è necessario consumare più alimenti che contengono l'Acido Alfa-linolenico. Funzioni degli acidi grassi polinsaturi (PUFA) Sono i precursori di molecole segnale (eicosanoidi, endocannabinoidi). Hanno anche un'azione diretta sull'espressione genica tramite l'attivazione di: Peroxisome Proliferator-Activated Receptor (PPAR) Sterol Responsive Element- Binding Protein (SREBP) Gli acidi grassi Omega-3 hanno un'attività antiaterogena, antinfiammatoria, antitrombotica, ed aumentano le HDL. L'acido Decosaesaonoico o DHA e l'Acido Arachidonico (ARA) sono importanti componenti strutturali dei lipidi di membrana, molto diffusi nel sistema nervoso centrale. Infatti il 50% del peso secco del cervello è rappresentato da lipidi, soprattutto fosfolipidi contenenti acido Arachidonico (ARA). L'acido decosaesaenoico (DHA), svolge anche una funzione di rilievo nella retina, infatti l'80% dei PUFA delle sue membrane sono costituite dall'acido decosaesaenoico (DHA), che permette a queste membrane la rapida trasmissione della luce. ITALCHIMICI 5 Krilling D Manuale Uso Interno L'acido eicosapentaenoico o EPA e l'acido decosaesaenoico (DHA) svolgono anche un'azione protettiva nei confronti dell'aterosclerosi e proteggono dall'insorgenza di malattie cardio-vascolari. L'acido eicosapentaenoico (EPA) è il principale precursore delle prostaglandine della serie 3, che svolgono un'attività antiaggregante piastrinica. L'acido α-linolenico (Omega-3) inoltre, in numerosi studi si è dimostrato utile alla riduzione della mortalità cardio-vascolare. Un'integrazione in acidi grassi Omega-3 può essere utile nelle situazioni infiammatorie. Può essere consigliata un integrazione dietetica a tutti coloro che hanno processi infimmatori intensi, funzione immunitaria compromessa e possono aiutare a tenere in remissione il morbo di Crohn e la rettocolite ulcerosa Abbreviazioni: AA Acido arachidonico AGE Acidi grassi essenziali (EPA in inglese) DGLA Acido di-omo-gammalinolenico DHA Acido decosaesaenoico EPA Acido eicosapentenoico GLA Acido gamma linolenico LA Acido linoleico (ruolo strutturale e funzionale) LCT Acidi grassi a catena lunga (ruolo energetico) LDL Colesterolo LDL (Low Density Lipoproteins). Proteine di grasso a bassa densità che trasportano, principalmente, i fosfolipidi ed il colesterolo libero. LTB4 Eicosanoidi della serie 4 (cattivi) LTB5 Eicosanoidi della serie 5 (buoni) LNA Acido alfa-linolenico (ruolo strutturale e funzionale) HDL Colesterolo (High Density Lipoproteins). Proteine di grasso ad alta densità che trasportano i fosfolipidi ed il colesterolo esterificato fino al fegato da dove viene eliminato attraverso la bile. L’esterificazione è una reazione tra un alcool ed un acido. MCT Acidi grassi a catena media (ruolo energetico) PGE1 Eicosanoidi della Serie 1 (buoni) PGH2 e TXA2 Eicosanoidi della Serie 2 (cattivi) PGE3 e TXA3 Eicosanoidi della Serie 3 (buoni) PUFA Polinsatured Fatty Acids (AGE in italiano) . ITALCHIMICI 6 Krilling D Manuale Uso Interno Carenza acidi grassi essenziali Una carenza in acidi grassi Omega-6 porta a: lesioni cutanee anemia aumento dell'aggregazione piastrinica trombocitopenia danni epatici ritardata cicatrizzazione delle ferite aumentata suscettibilità alle infezioni diarrea ritardo di crescita nell'età evolutiva diminuzione della fertilità Una carenza in acidi grassi Omega-3 invece è caratterizzata da: sintomi neurologici ridotta funzionalità visiva lesioni cutanee ritardi di crescita alterazioni delle capacità cognitive alterazioni nel metabolismo dei neurotrasmettitori monoaminergici Classificazione degli acidi grassi polinsaturi (Istituto Superiore di Sanità) Atomi di Carbonio: Doppi legami Posizione doppio legame Nome comune Nome IUPAC Fonti Alimentari 18:2 9, 12 acido linoleico acido 9,12ottadecadienoico Olio di girasole 18:3 9, 12, 15 acido alfa-linolenico acido 9,12,15ottadecatrienoico Sardine, salmone, sgombro, olio di lino 18:4 6, 9, 12, 15 acido stearidonico acido 6,9,12,15ottadecatetraenoico Semi di canapa, olio di semi di ribes nero 20:4 5, 8, 11, 14 acido arachidonico acido 5,8,11,14eicosatetraenoico Grassi animali, Olio di pesce 20:5 4, 8, 12, 15, 18 acido timnodonico acido 4,8,12,15,18eicosapentaenoico Olio di pesce 22:5 4, 8, 12, 15, 19 acido clupanodonico acido 4,8,12,15,19docosapentaenoico Olio di pesce 22:6 4, 7, 10, 13, 16, 19 acido cervonico acido 4,7,10,13,16,19decosaesaenoico Olio di pesce ITALCHIMICI 7 Krilling D Manuale Uso Interno FABBISOGNI LARN LIVELLI DI ASSUNZIONE GIORNALIERI RACCOMANDATI DI NUTRIENTI PER LA POPOLAZIONE ITALIANA (L.A.R.N.), SOCIETÀ ITALIANA DI NUTRIZIONE UMANA Categoria Acidi grassi Peso Proteine essenziali Età (anni) (1) (kg) (2) (g) (3) (g) (4) Calcio Fosforo Potassio Ferro Zinco Rame Selenio Iodio Tiamina Riboflavina (mg) (mg) (6) (mg) (mg) (mg) (mg) (mg) (mg) (9) (mg) (mg) Niacina (N.E.) Vit.B6 Vit.B12 Vit.C Folati (mg) (10) (mg) (11) (mg) (mg) Vit.A (R.E.) Vit.D (mg) (mg)(13) (mg)(15) 𝛚6 𝛚3 10-25* Lattanti 0,5-1 7-10 15-19 4 0,5 600 500 800 7 4 0,3 8 50 0,4 0,4 5 0,4 0,5 35 50 350 Bambini 1-3 9-16 13-23 4 0,7 800 800 800 7 4 0,4 10 70 0,6 0,8 9 0,7 0,7 40 100 400 10 4-6 16-22 21-28 4 1 800 800 1100 9 6 0,6 15 90 0,7 1,0 11 0,9 1 45 130 400 0-10 Maschi Femmine * 7-10 23-33 29-42 4 1 1000 1000 2000 9 7 0,7 25 120 0,9 1,2 13 1,1 1,4 45 150 500 0-10 11-14 35-53 44-65 5 1 1200 1200 3100 12 9 0,8 35 150 1,1 1,4 15 1,3 2 50 180 600 0-15 15-17 55-66 64-72 6 1,5 1200 1200 3100 12 9 1 45 150 1,2 1,6 18 1,5 2 60 200 700 0-15 18-29 65 62 6 1,5 1000 1000 3100 10 10 1,2 55 150 1,2 1,6 18 1,5 2 60 200 700 0-10 30-59 65 62 6 1,5 800 800 3100 10 10 1,2 55 150 1,2 1,6 18 1,5 2 60 200 700 0-10 60+ 65 62 6 1,5 1000 1000 3100 10 10 1,2 55 150 0,8 1,6 18 1,5 2 60 200 700 10 9 0,8 35 150 0,9 1,2 14 1,1 2 50 180 600 0-15 11-14 35-51 43-58 15-17 52-55 18-29 56 30-49 50+ (7) 1 1200 1200 3100 56-57 5 1 1200 1200 3100 18 7 1 45 150 0,9 1,3 14 1,1 2 60 200 600 0-15 53 4,5 1 1000 1000 3100 18 7 1,2 55 150 0,9 1,3 14 1,1 2 60 200 600 0-10 56 53 4,5 1 800 800 3100 18 7 1,2 55 150 0,9 1,3 14 1,1 2 60 200 600 0-10 56 53 4,5 1 1500- (5)* 1000 3100 10 7 1,2 55 150 0,8 1,3 14 1,1 2 60 200 600 10* * Gestanti 59 5 1 1200 1200 3100 Nutrici 70 5,5 1 1200 1200 3100 12/18 * 4 (8)* 30 18 7 1,2 55 175 1 1,6 14 1,3 2,2 70 12 1,5 70 200 1,1 1,7 16 1,4 2,6 90 (12)* 400 350 (14) 700 950 10* 10* 1 I limiti superiori dell’intervallo di età s’intendono fino al compimento del successivo compleanno (ad esempio con "1 - 3 anni" si intende da 1 anno appena compiuto fino al compimento del 4° anno). L’ultima classe di età della donna è "50 e più" poichè con la menopausa cambiano i fabbisogni di due importanti nutrienti: il calcio e il ferro. Nell’uomo l’ultima classe di età è "60 e più". 2 Nei lattanti, bambini e adolescenti, gli intervalli di peso sono i valori di riferimento: il limite inferiore dell’intervallo corrisponde al peso delle femmine nella classe d’età più bassa, mentre il limite superiore corrisponde al peso dei maschi nella classe di età più elevata. Nell’adulto è stato riportato il peso desiderabile medio dei maschi e delle femmine nella popolazione italiana. 3 Per stimare il fabbisogno in proteine, il Livello di Sicurezza (LS) è stato corretto per la qualità proteica della dieta e moltiplicato per i pesi corporei riportati nella prima colonna. Sia nei bambini che negli adulti è comunque preferibile calcolare il fabbisogno sulla base del peso dell’individuo o del gruppo di individui, utilizzando la tabella apposita. Il valore di peso da utilizzare è quello osservato, con l’eccezione dei soggetti sottopeso ed obesi per i quali va utilizzato il peso desiderabile. 4 Il fabbisogno di acidi grassi ω6 aumenta dopo la 10a settimana di gravidanza. 5 Nelle donne in età post-menopausale si consiglia un apporto di calcio da 1200 a 1500 mg in assenza di terapia con estrogeni. Nel caso di terapia con estrogeni, il fabbisogno è uguale a quello degli anziani maschi (1000 mg). 6 Con l’eccezione del lattante, il livello di assunzione raccomandato di fosforo è uguale in grammi a quello del calcio, il che corrisponde ad un rapporto molare fosforo/calcio 1/1,3 7 Il livello di assunzione raccomandato di ferro è di 18 mg nelle adolescenti mestruate e di 12 mg nelle altre. 8 L’apporto di ferro in gravidanza che corrisponde alla minore morbosità e mortalità fetale e neonatale è tale da non potere essere facilmente coperto con un’alimentazione equilibrata, per cui si consiglia una supplementazione. 9 Poichè la dieta è spesso carente di iodio, per la copertura dei fabbisogni si consiglia l’uso di sale arricchito con iodio. 10 La niacina è espressa come niacina equivalenti in quanto comprende anche la niacina di origine endogena sintetizzata a partire dal triptofano (1 mg di niacina deriva da circa 60 mg di triptofano). 11 Il fabbisogno in vitamina B6 è stato calcolato sulla base di 15 mg/g di apporto proteico e considerando che circa il 15% dell’apporto energetico è assicurato dalle proteine sia nel bambino che nell’adulto. 12 Un aumento dell’apporto di folati nel periodo periconcezionale costituisce un fattore di protezione dalla spina bifida nel nascituro. 13 La vitamina A è espressa in mg di retinolo equivalenti (R.E.= 1mg di retinolo = 6mg di betacarotene = 12mg di altri carotenoidi attivi) 14 In gravidanza, per i noti effetti teratogeni legati ad eventuali dosi eccessive, vanno assunti supplementi di vitamina A solo dietro indicazione del medico, e comunque con dosi che non superino i 6 mg di R.E. 15 Per la vitamina D, gli intervalli comprendenti lo zero indicano che il gruppo di popolazione considerato dovrebbe essere in grado di produrre un'adeguata quantità di vitamina D in seguito all'esposizione alla luce solare. Il valore più elevato dell’intervallo è la stima dell’apporto raccomandato per gli individui con sintesi endogena minima. Il valore singolo indica che è prudente, per tutti i soggetti della classe considerata, assumere (con la dieta o mediante supplementazione) la quantità indicata di vitamina D. * Per coprire tali fabbisogni potrà talvolta essere conveniente consumare alimenti fortificati o completare l’apporto dietetico con una supplementazione. ITALCHIMICI 8 Krilling D Manuale Uso Interno OMEGA-3 e OMEGA-6 “ESSENZIALI” Cenni storici La storia degli acidi grassi essenziali (AGE), ha avuto inizio nel 1929 quando G. Burr e M. Burr scoprirono che l’acido linoleico (AL), capostipite della serie Omega-6, e l’acido alfa linolenico (ALA), capostipite della serie Omega-3, erano indispensabili per la salute dell’uomo. A loro fu dato il nome di acidi grassi “essenziali” in quanto l’organismo umano non è in grado di sintetizzarli per cui, per mantenere lo stato di benessere, deve introdurli con gli alimenti. Da tali acidi grassi essenziali, indicati come polinsaturi o PUFA derivano gli acidi grassi essenziali polinsaturi i più importanti dei quali sono: derivati dall’acido linoleico (AL): acido gamma linolenico (GLA), acido diomogammalinolenico (DGLA) ed acido arachidonico (AA) e, dall’acido alfa linoleico: l’ALA l’acido eicosapentaenoico (EPA) e l’acido decosaesaenoico (DHA). Dopo alcuni anni furono evidenziati i primi derivati di tali composti, denominati “prostaglandine”, perché trovati per la prima volta in piccole quantità nel liquido prostatico e nella prostata, e, successivamente, fu ottenuta la loro struttura. Nel 1979, furono identificati un insieme di acidi lipidici bioattivi, diversi dalle prostaglandine, all’inizio identificati come “sostanza a lenta reazione” o “slow reacting substance” (SRS) e poi denominati leucotrieni in quanto prodotti dai leucociti. Evoluzione delle conoscenze Nel 1982 S.K. Bergström, B.I. Samuelsson e J.R. Vane vinsero il premio Nobel per “le scoperte sulla biochimica e fisiologia delle prostaglandine, e su altre molecole analoghe biologicamente attive”. Successivamente furono scoperte le endoperossidasi, il trombossano A2, fu chiarita la biosintesi e la struttura dei leucotrieni e, più recentemente, sono state scoperte le lipossine, le resolvine, le protectine e le neuroprotectine. Mentre evolvevano queste conoscenze, numerose indagini hanno evidenziato che gli AGE svolgono due importanti funzioni fra loro strettamente collegate ed influenzate dall’apporto qualitativo e quantitativo dei lipidi alimentari: Funzione strutturale Funzione di trasporto e metabolica Funzione strutturale Gli acidi grassi essenziali e i loro derivati sono importanti componenti dei lipidi strutturali, nella costituzione dei fosfolipidi delle membrane delle cellule di tutto l’organismo ma, in particolare, dei neuroni, dei nervi, delle guaine mieliniche, della retina, dei vasi, delle cellule della crasi ematica. Da molti studi è emerso che l’AA è un componente essenziale di tutte le membrane cellulari: è deputato alla crescita del feto e i tessuti nervosi sono particolarmente ricchi di LC-PUFA. Per quanto riguarda il cervello, oltre il 60% del suo peso, è costituito da acidi grassi e la maggior parte degli acidi grassi Omega-3, che è associato ad un ottimale sviluppo cerebrale nella vita fetale e nelle varie fasi dell’infanzia, e concentrazioni molto elevate di tale LC-PUFA si trovano nella retina, dove è indispensabile per ricevere gli stimoli visivi. E’ tenacemente conservato nelle sinapsi, dove svolge un ruolo centrale per il loro funzionamento e la trasmissione dell’impulso nervoso. L’85% dei fosfolipidi di membrana del SNC contiene DHA che rende più fluide le membrane neuronali, favorendo le attività enzimatiche legate alle funzioni neurorecettoriali e modulando le attività dei neurotrasmettitori. L’integrità e la funzionalità dei neuroni, durante tutta la vita, dipende quindi dall’apporto alimentare degli acidi grassi essenziali dai quali, attraverso conversioni metaboliche, si generano i LC-PUFA n 6 e ω3. L’importanza dei LC-PUFA è documentata anche dal fenomeno della biomagnificazione dell’A.A. e del DHA dalla madre al feto per cui il livello materno degli AGE (AL ed ALA) rappresenta un punto iniziale cruciale delle correlazioni lipidiche materno-fetali, in quanto da ciò dipende la possibilità del loro passaggio al feto. Durante la gravidanza la placenta ha pertanto un compito determinante visto il fabbisogno di acidi grassi essenziali per la corretta nutrizione del feto, per l’espansione del volume ematico, per la costruzione di nuove cellule nei vari parenchimi fetali ma, soprattutto, per la strutturazione della sostanza grigia del cervello fetale che usa soltanto i LC-PUFA e non i precursori AGE. Nella crescita del cervello, che si sviluppa massimamente durante la vita fetale acquisendo circa 67 mg/die di DHA durante l’ultimo trimestre di gestazione, sono concentrate più del 50% delle energie totali spese in tale epoca). Da quanto ora esposto appare evidente che il neonato pretermine viene a trovarsi in una condizione svantaggiata perché non ha potuto vivere nel grembo materno il tempo necessario per accumulare ed utilizzare i suddetti elementi essenziali, in particolare la quantità adeguata di DHA dell’ultimo trimestre. ITALCHIMICI 9 Krilling D Manuale Uso Interno Inoltre il pretermine non ha ancora maturato i meccanismi enzimatici di desaturazione ed allungamento che permettono di ottenere, dai rispettivi precursori, quantità adeguate di AA e di DHA per cui li deve assolutamente introdurre dall’esterno. A conferma di ciò, il rischio di danni per il sistema nervoso centrale, per l’occhio e per l’orecchio aumenta dal 2 per 1000 nati vivi nel neonato a termine ad oltre il 200 per 1000 nei pretermine di peso inferiore a 1500 g. Inoltre le complicazioni per i pretermine e per i bambini di peso molto basso comprendono l’emorragia intraventricolare, la leucomalacia periventricolare, la retinopatia della prematurità, ed anche la displasia broncopolmonare, l’enterocolite necrotizzante ecc. quadri che hanno un comune denominatore: deficit nella componente strutturale delle cellule dei vari parenchimi. Poiché con i sistemi e le abitudini alimentari di oggi (carenza di pesce, ed eccessiva introduzione di grassi saturi, di acido linoleico, di grassi trans) il livello materno di DHA è di solito basso e la gravidanza si associa ad una mobilizzazione di DHA dai depositi, questi rischiano di non venire più rimpiazzati dopo il parto e di diminuire progressivamente con l’allattamento e il ripetersi delle gravidanze per cui si possono presentare più facilmente delle situazioni di una vera carenza con ripercussioni gravi nel prodotto del concepimento ed anche nella madre (crisi depressive). Funzione di trasporto e metabolica L’interesse per gli AGE ed i loro derivati ha subito un notevole impulso negli anni settanta quando alcuni ricercatori scoprirono che in Groenlandia gli Esquimesi, la cui dieta è molto ricca di pesce e olio di pesce e quindi di Omega-3, presentavano raramente problemi coronarici e cardiovascolari, malattie infiammatorie croniche ed autoimmuni, diabete, sclerosi multipla ecc. I numerosissimi studi che sono seguiti hanno inoltre evidenziato che i PUFA e i LC-PUFA hanno importanti funzioni di trasporto attraverso il sangue in quanto trasportano il colesterolo con le lipoproteine ad alta densità (HDL), a bassa densità (LDL) e a densità molto bassa (VLDL), con cui si legano formando degli esteri, portandolo nei vari parenchimi ed in particolare nel fegato e da questo all’intestino per essere eliminato. E’ inoltre emerso che i LC-PUFA ω3 (EPA e DHA) sono in grado di abbassare la concentrazione plasmatica di colesterolo, prevalentemente VLDL e LDL, e dei trigliceridi, fattori da tempo noti come elementi di rischio cardiovascolare. I PUFA e i LC-PUFA incorporati nelle membrane cellulari, regolano le connessioni nelle cellule e fra cellule lontane, ed interferiscono sui meccanismi di regolazione del sistema immunitario ed infiammatorio, di tutte le cellule dell’organismo, comprese quelle del sistema nervoso. I prodotti di derivazione ciclossigenasica e lipossigenasica quali trombossani, leucotrieni, prostaglandine, lipossine, resolvine, protectine e quindi di citochine pro ed antinfiammatorie, intervengono sul sistema immunitario e flogistico e, a cascata, sulla funzione cardiovascolare, bronchiale, del sistema nervoso, delle mucose, della cute ecc. con possibili danni non solo alle cellule sede del processo infiammatorio ma anche ai lipidi ematici. Per azione degli enzimi cicloossigenasi (COX) e lipoossigenasi (LOX), dal GLA e dal DGL, si formano i trombossani e le prostaglandine della serie-1 (TX1 e PG1) e i leucotrieni della serie-3 (LTA3, LTC3, LTD3) che hanno un’azione moderatamente infiammatoria. Dall’AA, che induce una risposta immune tipo Th2, si formano invece: trombossani della serie-2 (TXA2) con spiccata azione aggregante le piastrine; prostaglandine della serie-2 (PGG2) responsabili della produzione delle citochine con potente azione pro infiammatoria quali: IL-1, IL-1 mRNA, IL-6, interferon gamma (IFNgamma),TNFalfa; il fattore di attivazione delle piastrine (PAF), potente aggregatore delle piastrine, attivatore dei leucociti e del metabolismo dell’AA che sembrano giocare un ruolo di primo piano nella patogenesi dall’artrite reumatoide, all’asma, allo shock tossico, al rigetto del trapianto renale ecc. e, per azione della 5-lipoxygenase (5-LO) si forma da un lato il 5-HPETE (acido 5S-idrossiperossieicosatetraenoico), leucotriene instabile dal quale deriva per deidratazione il 5-HETE (acido 5-idrossieicosatetraenoico) che a sua volta favorisce la flogosi non allergica, e dall’altro il leucotriene A4 (LTA4). Da quest’ultimo derivano tutti i leucotrieni della serie-4 (LTB4, LTC4, LTD4, LTE4), con spiccata azione pro infiammatoria. I LCPUFA Omega-6 svolgono pertanto un’importante attività pro-infiammatoria ma da alcuni anni è stato evidenziato che, sempre dall’AA, per azione delle 15/12 lipossigenasi, si formano le lipossine A4 (LXA4) e le lipossine B4 (LXB4) con spiccata azione antinfiammatoria e immunomodulante. Agendo su macrofagi, cellule dendritiche, linfociti Th1 e Th2, prevengono e/o favoriscono la normalizzazione dei quadri allergici e le patologie croniche immunitarie. Riducono inoltre l’afflusso e il numero dei PMN negli essudati, bloccano in vivo la migrazione delle cellule T, inibiscono la secrezione di IL-1, IL-6, TNF-alfa e d’interferon gamma e promuovono l’apoptosi. L’idea che i LC-PUFA Omega-6 svolgano solo un’attività proinfiammatoria deve essere pertanto rivista. I PUFA Omega-3, ed in particolare l’EPA, sono invece, fra gli acidi grassi, i più potenti immunomodulatori e sopprimono la risposta immune cellulo mediata. ITALCHIMICI 10 Krilling D Manuale Uso Interno Dall’EPA, per azione delle COX e delle 5-LO si formano i trombossani e le prostaglandine della serie-3 (TX3 e PG3) e i leucotrieni della serie-5 (LTA5, LTB5, LTC5, LTD5) meno attivi rispettivamente delle PG-2 e LTA-4 e quindi con un’azione moderatamente aggregante e infiammatoria mentre le PGE3 hanno proprietà vasodilatatrici che contrastano la vasocostrizione causata dagli acidi grassi Omega-6 in eccesso. I PUFA ω3 si associano anche ad un livello più elevato di citochine anti infiammatorie l’IL-6r, IL-10 e il TGFbeta e ad un più basso livello di citochine proinfiammatorie, IL-6, IL-1ra, e TNFalpha, sopprimono la capacità dei monociti di sintetizzare marker proinfiammatori IL-1, IL-1 mRNA, IL-2, IL-6, interferon gamma (IFNgamma), TNFalfa e il fattore di attivazione delle piastrine, (PAF). Del tutto recentemente è stato inoltre evidenziato che dall’EPA, per azione delle 5-lipossigenasi si formano le Resolvine E, e per l’intervento dell’aspirina, i suoi epimeri che favoriscono la produzione di citochine antinfiammatorie, IL-10 e TGFbeta1, riducono l’afflusso di neutrofili, la produzione di citochine proinfiammatorie e la permeabilità vascolare, favoriscono l’infiltrazione di monociti e macrofagi che eliminano i neutrofili apoptotici ripulendo la sede dell’infiammazione. Un discorso a parte merita invece il DHA che non da luogo a prostaglandine e leucotrieni ma alle Resolvine D, con azione antinfiammatoria simile alle Resolvine E, e alle Protectine (PD) e Neuroprotectine (NPD), tutte con azione antinfiammatoria. Le PD e le NPD prodotte nella fase risolutiva dell’infiammazione acuta, hanno un’azione immunoregolatoria e protettiva nei vari parenchimi ed in particolare sulla retina e sul sistema nervoso. Tutto questo porta alla conclusione che gli acidi grassi Omega-3 sono coinvolti in tutti i processi infiammatori e per il loro potere antinfiammatorio potrebbero essere utili nelle patologie caratterizzate da aumento della citochina proinfiammatoria, IL-1, quali le malattie cardiovascolari, la depressione maggiore, le neoplasie, l’invecchiamento e nelle malattie autoimmuni, quali il morbo di Crohn, la colite ulcerosa, l’artrite reumatoide, l’asma, il lupus eritematoso, la psoriasi, la sclerosi multipla ecc. Supplementazione e prospettive terapeutiche Il ruolo dei PUFA e dei LC-PUFA in età fetale, per la strutturazione del cervello e di tutti i parenchimi sensibili, non richiede ulteriori conferme per cui deve essere tenuto sotto controllo il loro apporto dietetico o l’eventuale loro supplementazione nella madre, che potremmo definire di tipo “funzionale”, per impedire che, in caso di nascita pretermine o di una loro carenza anche pre gravidica, venga compromessa la composizione delle strutture nervose e quindi la funzione cerebrale e visiva del nuovo nato. Una recente revisione della letteratura suggerisce nei prematuri una supplementazione di AA e DHA che dovrebbe essere simile a quello fornito dal latte materno in un rapporto pari a 5-6 a 1 e in una quantità per l’AA lievemente superiore allo 0.3% e per il DHA allo 0.2%. Nei pretermine di età gestazionale inferiore a 33 settimane, i latti arricchiti con AA e DHA favorirebbero anche una normale crescita e mineralizzazione ossea. Oltre agli aspetti strutturali, il ruolo degli AGE e dei loro derivati nei processi infiammatori cronici ed immunitari, ha spinto numerosi ricercatori ad intraprendere dei tentativi terapeutici. Così, nel morbo di Crohn la somministrazione di olio di pesce contenente dosi adeguate di acidi grassi ω3, ha evidenziato una riduzione della frequenza delle ricadute con miglioramento del decorso della malattia sia in soggetti adulti sia in soggetti in età evolutiva. In un recente studio in doppio cieco, randomizzato, controllato contro placebo in soggetti in età pediatrica, la somministrazione di una miscela di acidi grassi Omega-3 e mesalazina (5-ASA), è risultata efficace nel prolungare lo stato di remissione della malattia. Uno studio in doppio cieco controllato e randomizzato in soggetti di età compresa fra 10 e15 anni affetti da asma, che vivevano tutti in un ambiente di tipo ospedaliero, assumevano gli stessi alimenti, e si trovavano quindi nelle stesse condizioni sperimentali, ha confermato che la somministrazione di olio di pesce con dosi adeguate di acidi grassi ω3, riduce la sintomatologia e la risposta all’acetilcolina e migliora il quadro clinico. La cosa, secondo gli Autori, sarebbe dovuta, almeno in parte, ad un riequilibrio del rapporto ω6/ω3. In soggetti con fibrosi cistica la somministrazione di acidi grassi Omega-3 PUFA, incorporandosi nelle membrane dei neutrofili, determinano un effetto antinfiammatorio riducendo la produzione di LTB4 da parte dell’AA dei neutrofili e molto verosimilmente attraverso altri meccanismi non del tutto noti. Anche nei soggetti con artrite reumatoide la somministrazione per os di olio di pesce o la soministrazione endovenosa di un’emulsione di pesce contenente PUFA Omega-3, ha portato ad un miglioramento delle condizioni cliniche della malattia, dando luogo ad un netto miglioramento della sintomatologia clinica (dolore, rigidità mattutina, stanchezza ecc.). ITALCHIMICI 11 Krilling D Manuale Uso Interno Un importante studio italiano, il GISSI, ha evidenziato che somministrando 1 g/die di acidi grassi Omega-3 è ridotto sia il rischio di aritmie sia di arresto cardiaco e quindi di morte, evenienze alquanto frequenti nei post-infartuati (12). Inoltre in caso di bassi livelli dietetici di EPA+DHA vi è il rischio di arresto cardiaco ma l’apporto di ALA più che essere elevato, dovrebbe essere bilanciato con l’AL e rappresentare lo 0.6-1% del totale delle calorie (circa 2 g/die nell’adulto) mentre l’AL non dovrebbe superare i 7 g/die. Per tale motivo, a scopo preventivo, l’American Heart Association raccomanda consumi di pesce che sono in rapporto al tipo di patologia, mentre per un’azione cardioprotettiva, volta a ridurre la morte improvvisa o l’infarto miocardico, dovrebbe essere assunto almeno 1 g al giorno di EPA più DHA con proporzioni di EPA e DHA pari a quelle che si trovano normalmente in natura (3 per 2 circa). Una evidente correlazione è stata rilevata anche tra il consumo di pesce e depressione maggiore, patologia molto rara nelle popolazioni che mangiano molto pesce, e anche il contenuto di DHA nel tessuto adiposo dei depressi è inversamente proporzionato con la gravità della malattia. Inoltre nei soggetti con depressione maggiore vi è un’aumentata produzione di prostaglandine e citochine, proinfiammatorie IL-1, IL-2, IL-6, IFN-gamma e in corso di stress vengono prodotte citochine infiammatorie IL-6, TNF-alfa ed IFN-gamma. Sembrerebbe pertanto che in caso di livelli degli acidi grassi Omega-3 troppo bassi, le vie chimiche essenziali verrebero saturate dagli Omega-6 ed alterate, concorrendo all’insorgere dei disturbi neuropsichiatrici. Fin dai tempi più antichi, gli acidi grassi Omega-3 hanno fatto parte della dieta dei nostri progenitori (paleo-dieta) e, come emerso da studi antropometrici, il genere umano è evoluto assumendo una dieta con scarse quantità di grassi e un mix bilanciato di Omega-6/Omega-3 in un rapporto pari a 12:1 e molto ricca di antiossidanti naturali. Vi sono pertanto fondati motivi per ritenere che questo, nel corso di molti millenni, ha condizionato la composizione strutturale di tutti i nostri parenchimi e la loro funzione. Negli ultimi 150 anni, poiché gli Omega-6 sono più rappresentati nei vari alimenti, abbiamo assistito ad una loro progressiva e rilevante aumentata assunzione, con lipidi animali, oli di semi ecc., ai quali si è associata una aumentata assunzione di grassi saturi e acidi grassi trans. Contemporaneamente, il progressivo e notevolmente ridotto apporto con la dieta di acidi grassi Omega-3 ha portato il rapporto ottimale Omega-6/Omega-3 di circa 5-6:1, con un apporto di energia pari al 3% da acidi grassi Omega-6 e 0.5% da acidi grassi Omega-3, a superare il rapporto di 20:1 e conseguente eccessiva produzione di prostaglandine e citochine proinfiammatorie. Dato che queste e l’infiammazione, unitamente a fattori genetici, sono alla base di molte patologie, si deve ritenere che l’elevato rapporto Omega-6/Omega-3 favorisca, a lungo andare, la patogenesi di malattie cronicodegenerative, cardiovascolari, autoimmuni, osteoporosi, tumori ecc. L’importanza degli Omega-3 nella dieta, è pertanto oggi evidente a partire dalla donna in gravidanza e nella prima infanzia per la funzione “strutturale”, come è evidente la necessità di ritornare ad un più fisiologico rapporto Omega-6/Omega-3 della dieta per quella che viene indicata come funzione “nutraceutica” degli alimenti. Per tale motivo viene oggi consigliato un adeguato apporto con la dieta, 2-3 volte alla settimana, o alimenti arricchiti di Omega-3 con diverse modalità, o adeguate assunzioni supplementari di EPA e DHA a scopo preventivo e/o terapeutico in rapporto alle varie condizioni patologiche. KRILL OIL - OMEGA-3 DI NUOVA GENERAZIONE L’olio di Krill è un lipide di nuova generazione estratto dai Krill, dei minuscoli crostacei (gamberetti), Euphausia Superba, che prosperano nelle acque gelide dell’Antartico. Questo estratto di acidi grassi ha nel suo corredo già compresi: omega 3, omega 6 ed omega 9, vitamina E, vitamina A, fosfolipidi ed astanxantina in proporzione umana. La Enzimotec, nostra fornitrice di Krill, possiede un sistema unico brevettato di estrazione dell’olio che permette di avere l'integrità della qualità e dell' intera struttura e l’assenza di prodotti di ossidazione e di degradazione. È il primo prodotto che apporta dei fosfolipidi integrati agli acidi grassi Omega-3. I costituenti di base delle membrane cellulari presenti nel Krill sono nella stessa proporzione e con la stessa struttura di quelli dell’organismo umano e sono quindi più biodisponibili dei soli fosfolipidi o degli Omega-3 dell’olio di pesce di circa 47 volte. Negli studi scientifici fatti sull'uomo, l’olio di Krill ha normalizzato o migliorato la funzione cardiovascolare, i tassi ematici dei lipidi e del glucosio, la produzione di energia, la funzione epatica e le performance neuronali e sportive. ITALCHIMICI 12 Krilling D Manuale Uso Interno In uno studio in doppio cieco, il Krill ha anche agito significativamente sugli sbalzi di umore ed i crampi associati a sindromi premestruali. I fosfolipidi integrati agli acidi grassi Omega-3 presenti in Krill riducono la produzione di prostaglandine di tipo imfiammatorio che provocano l'irritazione e conducono all'acidificazione dei grassi delle membrane cellulari. Il Krill è notevolmente stabile in ragione del suo tenore naturalmente elevato di antiossidanti, astaxantina e vitamina A . L'olio di krill contiene uno degli antiossidanti naturali più potenti, l'Astaxantina, un carotenoide che dà al crostaceo il caratteristico colore rossastro distintivo e lo protegge dalla radiazione solare. L'Astaxantina è equilibrante per il sistema immunitario, è un anti-cancerogeno ed antinfiammatorio. Previene malattie cardiache e protegge il derma. Secondo gli ultimi studi, l’astaxantina è molto più efficace del beta-carotene contro i radicali liberi. Tutela particolarmente bene le fragili membrane cellulari e mitocondriali: « L’astaxantina è molto più attiva della vitamina E, beta-carotene e luteina bloccando il processo di perossidazione causato dai radicali liberi ». Miki W. et al. Altri studi in vitro e in vivo, negli animali e nell’uomo, dimostrano l’efficacia antiossidante della astaxantina e la sua utilità nel prevenire le malattie neurovegetative derivate dallo stress ossidativo. Prove di laboratorio hanno stabilito che l’olio di krill è 300 volte più potente come antiossidante delle vitamine A ed E e 47 volte più potente dell'olio di pesce. ORAC valutazione potere antiossidante olio Krill ORAC è un test standardizzato di laboratorio usato per misurare il relativo potenziale di diversi antiossidanti. Il numero più basso è il meno efficace. Vitamina A 1,25 Vitamina E 1,25 Luteina 8 Olio di pesce 8 CoQ10 ORAC: Capacità di Assorbimento Radicale dell’Ossigeno 11 Astaxantina 51 Lycopene 58 378 Olio di krill 0 50 100 150 200 250 300 350 400 Poiché il Krill è al 100% biodisponibile per l'organismo umano, viene assorbito prontamente nelle nostre cellule ed il contenuto di antiossidanti, naturalmente presenti nel Krill, impedisce all'olio d’irrancidirsi ed assicura la protezione cellulare verso i danni dai radicali liberi. MODO D'USO Poiché l'olio del krill è più biodisponibile, il dosaggio giornalmente suggerito è soltanto un quinto rispetto all'olio di pesce. 1 solo softgel al mattino durante la colazione equivale a 12 softgel di Omega-3 di olio di pesce. ITALCHIMICI 13 Krilling D Manuale Uso Interno Krill: un rimedio per l'obesità Gli acidi grassi Omega-3 (di tipo EPA e DHA) contenuti nell'olio di krill sono utili rimedi per l'obesità. A dimostrarlo è una ricerca condotta da un team internazionale, composto da scienziati italiani, statunitensi, norvegesi e finlandesi che hanno concluso lo studio affermando che: «L’olio di Krill stabilizza il meccanismo metabolico dei soggetti obesi, contrastando anomalie e imperfezioni che portano a tale status e potrebbe sostituire altre terapie nel controllo del sistema degli endocannabinoidi contro la sindrome metabolica.» Krill agisce sugli endocannabinoidi Il krill è un insieme di piccoli organismi marini noti per il loro alto contenuto in Omega-3 ed antiossidanti. Infatti, come già detto, questi ultimi sono presenti in livelli 48 volte più elevati rispetto a quanto riscontrabile negli altri olii di pesce disponibili in commercio. Secondo gli autori dello studio assumere quotidianamente l'olio di krill porta benefici al sistema degli endocannabinoidi, costituito da molecole lipidiche e recettori cellulari che agiscono nel sistema nervoso regolando l'appetito, la sensazione di dolore, l'umore e la memoria. E sono gli stessi esperti del settore a sottolineare che aiutare a normalizzare i livelli di endocannabinoidi nei pazienti obesi potrebbe aiutare a contrastare alcuni problemi di salute che si evidenziano a lungo termine, come la sindrome metabolica. Per arrivare a questa conclusione i ricercatori hanno reclutato 63 soggetti in sovrappeso od obesi di età compresa tra i 35 e i 64 anni, cui è stato chiesto di assumere per quattro settimane due grammi al giorno di olio di krill – corrispondente a 309 mg al giorno di EPA e DHA in rapporto 2:1 -, di olio di pesce – il cosiddetto “menhaden oil”, corrispondente a 390 mg al giorno di EPA e DHA in rapporto 1:1 – o olio di oliva. Solo nei soggetti obesi che hanno assunto olio di krill è stata osservata una riduzione significativa dei livelli di 2-arachidonoilglicerolo (2-AG), un endocannabinoide che si accumula nel plasma delle persone obese. Secondo gli autori una possibile spiegazione del migliore effetto ottenuto con il krill in confronto all’olio di pesce potrebbe essere spiegato con una maggiore incorporazione degli acidi grassi Omega-3 derivati dal Krill nei lipidi che costituiscono il tessuto adiposo associato ai visceri. Questo porterebbe ad una diminuzione dell'acido arachidonico in seguito all'assunzione di olio di krill, con conseguente modificazione della sintesi degli endocannabinoidi. Conferme di una nota efficacia Gli effetti benefici dell'olio di krill riscontrati in questo studio confermano quanto avevano osservato i ricercatori dell'Università di Cagliari in studi condotti su ratti obesi. In conclusione Il krill è un piccolo crostaceo che compone lo zooplancton delle fredde acque antartiche, dove dà luogo ad una delle più grandi biomasse esistente. Conosciuto dalla popolazione scientifica come Euphausia superba, occupa il gradino più basso della catena alimentare: per questo motivo non accumula inquinanti e garantisce l’elevata purezza dei suoi derivati. ITALCHIMICI 14 Krilling D Manuale Uso Interno L’integrazione con Krilling D combina in un unico prodotto i benefici derivanti da 3 preziosi elementi: gli acidi grassi Omega-3: EPA e DHA in forma di fosfolipidi (innanzitutto fosfatidilcolina); il carotenoide Astaxantina, un pigmento rosso appartenente alla famiglia delle xantofille, molecole prodotte dal fitoplancton ed assimilate come tali dal krill. La vitamina D In in particolare: gli Omega-3 in forma di fosfolipidi svolgono un’importante azione antinfiammatoria; la fosfatidilcolina è efficace per la corretta funzionalità del sistema nervoso centrale, perché contribuisce a migliorare la memoria e l’acutezza mentale ed a contrastare i processi di degenerazione neurocerebrale; l’astaxantina esercita un potente effetto antiossidante. La sua azione contrasta l’aumentata produzione di radicali liberi, che si verifica in caso di stress ed infiammazione e riduce il deterioramento cellulare. Per la Vitamina D si rimanda a pag.49. Perché consigliamo l'omega 3 di krill e non il classico olio di pesce? Krill contiene una proporzione tra ω3 e ω6 di 15 : 1 L’Olio di pesce contiene una proporzione tra ω3 ed ω6 di 3 : 1 Krill contiene 30% di ω3 di cui 29,4% sono bioattivi e combinati con fosfolipidi che ne favoriscono l'assorbimento. L’Olio di pesce contiene il 30% di omega-3 ma solo il 19,2% è bioattivo. Krill contiene il 40% di fosfolipidi in Fosfatidilcolina fondamentale per le cellule celebrali. L'olio di pesce ne è assente. Krill è naturalmente privo di metalli pesanti ed altri contaminanti come il PCBs (sostanze diossino-simili che gli organismi accumulano nell'arco della loro vita, fenomeno definito 'body burden') infatti l'olio di pesce deve essere trattato e purificato prima di essere immesso in commercio. Krill è eccezionalmente stabile, 47 volte più dell'olio di pesce, questo ne permette la conservazione per quasi 2 anni. Krill ha potere antinfiammatorio, potentissime proprietà antiossidanti e protegge la pelle dai danni provacati dalle onde ultraviolette. Krill riduce il colesterolo ed i trigliceridi, eleva il livello di HDL (Lipoproteine ad Alta Densità) e riduce gli zuccheri nel sangue. N.B.: tutti gli studi scientifci inerenti sono disponibili nella rassegna della letteratura. ITALCHIMICI 15 Krilling D Manuale Uso Interno Studio sulla Qualità di Vita con Olio di Krill Lo studio sulla qualità della vita è stato fatto all’interno dello studio di Fase II sull’iperlipidemia. 120 partecipanti hanno assunto 1.0 o 1,5 g/die di olio di Krill in base al loro indice di massa corporea (BMI) o 3 g/die di olio di pesce. Ai partecipanti sono state somministrate 36 domande del questionario standardizzato sulla qualità di vita alla fine dei giorni: 30, 90 e 180. Questo questionario ha misurato: la funzione fisica, la fatica, il dolore, la funzione sociale, il ruolo emozionale, la capacità mentale, la salute generale e l'aspetto fisico. Il questionario, in uso dal 1998 e pubblicato in più di 4.000 diversi studi, è stato progettato per fornire risultati statisticamente validi. L’olio di Krill ha significativamente migliorato tutti gli indicatori della qualità della vita. Sampalis F, Bunea R, et.al. Altern Med Rev. 2003 May;8 (2):171-9. ITALCHIMICI 16 Krilling D Manuale Uso Interno Riduzione dei grassi % Riduzione dei grassi nel Cuore e nel Fegato I topi Zucker sono un modello per l’obesità e le disfunzioni metaboliche correlate.Topi adulti sono stati alimentati per 4 settimane con diete contenenti olio di krill, olio di pesce, o una dieta di controllo. Alla fine delle 4 settimane non sono state osservate differenze per la crescita complessiva ed il peso tra il gruppo di controllo ed i gruppi alimentati con Krill o olio di pesce, tuttavia c'era una significativa riduzione dell’ectopia del grasso epatico e del cuore. Nei topi nutriti con Krill o con olio di pesce, i trigliceridi epatici erano significativamente ridotti, invece i trigliceridi presenti nel cuore erano notevolmente inferiori nei topi nutriti con Krill ma non in quelli nutriti con olio di pesce.Tale riduzione è stata associata ad una minore concentrazione di endocannabinoidi AEA e 2-AG, il chè può spiegare la risposta infiammatoria ed il riequilibrio della deposizione di grasso corporeo nel cuore e nel fegato dei topi obesi. Batetta B, Griinari M, et.al. Endocannabinoids May Mediate the Ability of (n-3) Fatty Acids to Reduce Ectopic Fat and Inflammatory Mediators in Obese Zucker Rats. J Nutr, Vol 139, N 8, Aug 2009. ITALCHIMICI 17 Krilling D Manuale Uso Interno Effetti dell’olio di krill sulla Proteina C Reattiva (PCR) Uno studio prospettico randomizzato in doppio cieco di sperimentazione clinica di fase II è stato condotto per valutare gli effetti dell’olio di Krill sulla proteina C-reattiva (PCR), un biomarker infiammatorio. L’olio di krill a 300 mg/die ha ridotto significativamente la PCR del 19% dopo 7 giorni e del 30% dopo 14 giorni di trattamento. Confermando i benefici clinici di riduzione della PCR, i pazienti affetti da artrite, hanno avuto una riduzione, dopo 7 e 14 giorni, del punteggio WOMAC relativo al dolore del 24% e del 25%, una riduzione della rigidità articolare del 22% e del 28% e la riduzione del danno funzionale del 16% e del 18%. Deutsch L; Evaluation of the Effect of Krill Oil on Chronic Inflammation and Arthritic Symptoms; Journal of the American College of Nutrition,Vol. 26, No. 1, 39-48 (2007 Apr). Effetti sul Rischio Cardiometabolico della supplementazione con olio di krill, a tre diversi dosi, alla dieta grassa Un’indagine sui fattori di rischio cardiometabolico è stata condotta in topi maschi C57BL/6 nutriti con una dieta ricca di grassi per 8 settimane. Tutti i gruppi, incluso il controllo, hanno ricevuto una dieta ad alto contenuto di grassi, più 1,25%, 2,5% o 5% di olio di Krill. La supplementazione dietetica con olio di Krill ha causato una significativa riduzione di peso del fegato (epatomegalia) e del grasso totale epatico (steatosi epatica) a causa della riduzione, dose dipendente, dei trigliceridi e del colesterolo epatico. Così pure una riduzione del colesterolo e del glucosio nel sangue. L’adiponectina sierica è aumentata negli animali nutrirti con olio di Krill. Questi risultati suggeriscono che l’olio di Krill può essere d’utilità terapeutica nei pazienti con sindrome metabolica e/o steatosi epatica non alcolica. Tandy S, Chung R, et.al. Dietary Krill Oil Supplementation Reduces Hepatic Steatosis, Glycemia, and Hypercholestreolemia in High-Fat-Fed Mice. J Agr Food Chem; 9/17/2009 ITALCHIMICI 18 Krilling D Manuale Uso Interno Cenni di biochimica degli acidi grassi essenziali a catena lunga Gli acidi grassi essenziali (Essential Fatty Acids = EFA) in rapporto alla loro catena lunga, possono essere distinti in acidi grassi Omega-6 ed acidi grassi Omega-3. Le abbreviazioni Omega-6 ed Omega-3 fanno riferimento alla posizione, nella loro molecola, del primo doppio legame, contando dalla fine della catena opposta al gruppo carbossilico. Questi acidi grassi sono definiti “essenziali” perché non possono essere sintetizzati dall’organismo umano, ma devono essere ingeriti come tali, col cibo o come supplemento dietetico. Gli acidi grassi essenziali a catena lunga Omega-6 ed Omega-3 non sono interconvertibili metabolicamente nell’uomo. Queste due classi d’acidi grassi essenziali hanno distinte e spesso opposte funzioni fisiologiche. La natura essenziale dell’acido grasso linoleico (LA, 18:2 ω6) e dell’acido grasso α-linolenico (LNA, 18:3 ω3) è conosciuta dal 1929. Questi acidi grassi con catena a 18 atomi di carbonio (18C) sono necessari per la sintesi di più lunghi acidi grassi polinsaturi (Poly Unsatured Fatty Acids = PUFA) come l’acido arachidonico (AA, 20:4 ω6) e l’acido eicosapentaenoico (EPA, 20:5 ω3). Gli acidi grassi 18C sono presenti nei semi di lino, mentre, gli acidi grassi a catena più lunga come l’acido docosahexaenoico (DHA, 22:6 ω3) sono maggiormente presenti nei pesci (salmone, sardina, tonno, etc.). L’acido linoleico non è convertito, in modo metabolicamente significativo, in EPA e DHA, nell’uomo sano. E’, quindi, probabile che la suscettibilità, a molte delle condizioni patologiche che verranno di seguito descritte, possa essere legata, sul piano neurochimico, alla ridotta capacità di allungare e desaturare le catene di acidi grassi a 18 atomi di carbonio. Si può ipotizzare che, sino alla rivoluzione industriale, gli uomini hanno assunto, dalle fonti alimentari naturali, approssimativamente la stessa quantità di Omega-3 ed Omega-6. Le diete dei nostri predecessori erano sicuramente più povere di calorie e più ricche di fibre, frutta e vegetali, con poca carne e pesce. Il loro apporto dietetico di PUFA, AA, EPA e DHA era verosimilmente alto ed equilibrato. Nel corso dell’ultimo secolo, si è passati da un rapporto 1/1 tra Omega-3 ed Omega-6 ad un rapporto 1/20, nell’assunzione degli acidi grassi essenziali. L’industria alimentare ha prodotto cibo a più alto contenuto di Omega-6, in rapporto al diffuso utilizzo, per motivi economici, di olio di semi (mais, girasole, soia, etc.) che contengono molti Omega-6 e sono relativamente poveri di Omega-3. La stessa alimentazione animale ha visto il prevalere di fonti alimentari ad alto contenuto di Omega-6, con il risultato che anche le uova ed il pollame, prodotti industrialmente, hanno scarsi contenuti di Omega-3. La produzione industriale d’alimenti per l’uomo ha favorito l’uso di grassi difficilmente ossidabili e che hanno garantito maggiore conservabilità. Le sostanze alimentari ad alto contenuto di Omega-3 sono state scientemente evitate, perché più facilmente soggette ad irrancidimento, con conseguente riduzione della palatabilità del cibo. Nella produzione industriale, inoltre, gli acidi grassi polinsaturi naturali (PUFA) sono stati spesso sostituiti da acidi grassi trans, che sono molto difficilmente ossidabili e che non diventano rancidi, neanche dopo molto tempo. Sebbene questi acidi grassi sembrino al gusto del tutto simili ai grassi naturali, essi vengono prodotti molto differentemente dai grassi naturali e, soprattutto, inibiscono l’enzima coinvolto nella desaturazione ed elongazione dei PUFA a 18 atomi di carbonio in PUFA a 20 e 22 atomi di carbonio. Un eccesso d’Omega-6 può sopprimere la sintesi degli Omega-3 come EPA e DHA. L’eccesso di Omega-6 e l’assunzione d’acidi grassi trans riducono, così, fortemente la sintesi d’acidi grassi polinsaturi a lunga catena (n-22). ITALCHIMICI 19 Krilling D Manuale Uso Interno La conversione dell’acido linolenico, con 18 atomi di carbonio (LNA, 18:3 n-3) nell’EPA, a 20 atomi di carbonio, è un processo non efficiente, con una conversione pari a circa lo 0,2%. Entrambe le classi di acidi grassi (EFA) Omega-6 ed Omega-3 sono essenziali per la salute, ma lo è anche il loro equilibrio reciproco. Le diete che forniscono Omega-6, a danno degli Omega-3, possono facilitare, infatti, la produzione di prostaglandine pro-infiammatorie, mentre, diete a prevalente apporto d’Omega-3 stimolano la sintesi di prostaglandine anti-infiammatorie. Il rapporto tra Omega-6 ed Omega-3 influenza il metabolismo degli eicosanoidi, l’espressione genica e la comunicazione intercellulare. Gli eicosanoidi includono prostaglandine, citochine, mediatori delle citochine ed altri componenti della risposta immunitaria. L’equilibrio tra Omega-6 ed Omega-3 è critico perché essi competono reciprocamente per il sistema enzimatico ed hanno molte funzioni metaboliche opposte, mediate dai loro rispettivi eicosanoidi. Una prevalenza d’Omega-6 può indurre una condizione fisiologica che promuove l’infiammazione cronica, la formazione e diffusione neoplastica, le cardiopatie ischemiche, le cerebropatie vascolari, il diabete, l’artrite, le patologie autoimmuni ed alcune alterazioni funzionali neuronali, che includono diversi quadri neuropsichiatrici. Alcuni studi indicano che un apporto eccessivo d’Omega-6 induce uno stato fisiologico pro-trombotico e proaggregante piastrinico, che si caratterizza per un aumento nella viscosità ematica con vasospasmo, vasocostrizione e riduzione del tempo di sanguinamento. Gli Omega-3 hanno, al contrario, effetti antiinfiammatori, anti-trombotici, anti-aritmici, ipolipemizzanti e vasodilatatori. Acidi grassi insaturi, soprattutto Omega-3, hanno proprietà anti-aterogene mediate dall’attivazione endoteliale. Le funzioni fisiologiche degli EFA includono il controllo dell’infiammazione, le funzioni cardiovascolari, la reattività allergica, la risposta immune, la modulazione ormonale, lo sviluppo mielinico, nonché aspetti della cognitività e del comportamento. Effetti benefici degli Omega-3 sono stati evidenziati nella prevenzione secondaria della malattia coronarica, dell’ipertensione arteriosa, del diabete mellito di tipo 2, dell’artrite reumatoide, della rettocolite ulcerosa, della malattia di Crohn e della broncopatia cronica ostruttiva. Gli acidi grassi polinsaturi (PUFA) giocano un ruolo critico nel determinare le interazioni lipidi/proteine nelle membrane neuronali e sinaptiche, interferendo con la conformazione recettoriale, i canali ionici, gli enzimi ed i movimenti delle sostanze attraverso le membrane cellulari. Le membrane neuronali contengono alte concentrazioni di DHA ed AA. Entrambi questi EFA sono componenti cruciali della barriera fosfolipidica neuronale. I recettori neurotrasmettitoriali sono sostanze proteiche, immerse entro la matrice fosfolipidica delle membrane neuronali. La loro tridimensionalità spaziale, la loro conformazione sterica funzionale e la loro attività, dipende largamente dagli specifici acidi grassi, che danno struttura alla membrana. La composizione delle membrane neuronali, per quanto attiene gli acidi grassi polinsaturi (PUFA), dipende largamente dall’apporto dietetico. L’equilibrio reciproco tra gli EFA sembra essere tanto importante quanto il loro apporto dietetico complessivo, così che cambiamenti nell’ingestione dietetica di grassi può avere conseguenze dirette a livello del sistema nervoso centrale. L’acido docosahexaenoico (DHA, 22: 6 n-3) è fortemente concentrato nel sistema nervoso ed è essenziale per il suo corretto funzionamento. Un deficit di DHA in epoca pre o post-natale sembra correlarsi a disturbi retinici, con difetti dell’acuità visiva, disturbi cognitivi, disturbi comportamentali e psichiatrici. Numerosi studi su primati e su neonati indicano che il DHA è essenziale per il normale sviluppo funzionale della retina e del cervello. Il DHA non solo viene assunto selettivamente dal tessuto nervoso, ma presenta nel cervello un turnover molto rapido. Lo sviluppo pediatrico necessita di un sufficiente apporto dietetico di DHA, essendo la sua produzione a partire dai precursori sostanzialmente insufficiente. ITALCHIMICI 20 Krilling D Manuale Uso Interno Sebbene non esista una dose raccomandata quotidiana di assunzione dietetica di acidi grassi essenziali, un gruppo scientifico internazionale ha proposto un apporto ottimale (Adeguate Intake = AI) di Omega-3 e di Omega-6. Per le società occidentali, che producono e consumano cibo industriale, risulta opportuno integrare, comunque, con attenzione specifica, la dieta con alimenti ad alto contenuto di Omega-3. Gli acidi grassi non esterificati, rilasciati dai lipidi di membrana, appartengono ad un largo gruppo d’eicosanoidi, in grado di agire sugli ormoni e sui fattori di crescita, che controllano lo shift tra moltiplicazione e differenziazione cellulare. Gli EFA interferiscono su questo shift agendo, come secondi messaggeri o modulatori, sugli effetti esercitati da fattori di crescita e ormoni steroidei. Gli acidi grassi Omega-3 inibiscono la Protein-Kinasi-C AMPcdipendente (PKC) in cellule intatte. Gli Omega-3 inibiscono, in vitro, l’attività della PKC, della proteinkinasi II Ca++/calmodulina dipendente ed inibiscono l’attivazione, indotta da 5HT, della proteinkinasi attivata da mitogeno (MAPK). L’inibizione della proteinkinasi, regolata dal secondo messaggero, potrebbe rappresentare il meccanismo d’azione intra-neuronale degli acidi grassi Omega-3. Basti pensare che il litio e l’acido valproico sono conosciuti come inibitori della PKC, dopo somministrazione subcronica, in cellule in coltura ed in vivo. Entrambi DHA ed EPA, da soli o in combinazione, inibiscono l’attività della PKC a concentrazioni di 10 micromol/L, mentre l’acido arachidonico non ha alcun effetto. Questa sola considerazione rende razionale l’utilizzo degli Omega-3 nel trattamento dei disturbi bipolari. Gli Omega-3 sembrano essere utili, in tutte quelle condizioni in cui la patofisiologia include un’iperattività dei sistemi del secondo messaggero. Per esempio, gli Omega-3 agiscono con effetti antinfiammatori in modelli animali di lupus ed artrite reumatoide, inducendo un significativo miglioramento dei disordini autoimmuni. Studi biochimici hanno dimostrato che una terapia ad alte dosi di Omega-3 induce l’incorporazione di questi composti nei fosfolipidi di membrana, cruciale per la trasmissione dei segnali interneuronali, sopprimendo l’attività di secondo messaggero associato al fosfatidil-inositolo. Anche valproato e litio sembrano produrre effetti analoghi nel ratto. Una concentrazione di litio di 0.7 nM, a livello cerebrale, riduce il turnover di acido arachidonico (AA) entro i fosfolipidi di membrana del 75%. L’effetto sembra essere specifico, non essendo influenzato il turnover di DHA ed acido palmitico. Il turnover di AA è anche ridotto dalla somministrazione, a lungo termine, di litio ed acido valproico. La riduzione del turnover di AA indotta da litio corrisponde alla down-regulation della fosfolipasi A2 (PLA2), un enzima che selettivamente agisce sull’ AA, ma non sul DHA, a livello dei fosfolipidi. Il litio riduce anche l’attività cerebrale della ciclo-ossigenasi 2 e la concentrazione della prostaglandina E2, un metabolita dell’AA prodotto dall’azione della ciclo-ossigenasi 2. Le attività antimaniacali del litio e del valproato potrebbero essere conseguenza, di questo freno alla “cascata dell’acido arachidonico”, probabilmente implicata nella fisiopatogenesi della mania. Gli Omega-3 agiscono in opposizione a molti effetti dell’acido arachidonico. Ciò potrebbe confermarne ulteriormente l’efficacia potenziale degli n-3 come stabilizatori dell’umore. Il DHA ha, inoltre, un ruolo protettivo sull’apoptosi in modelli su coltura cellulare, incrementando la fasfatidilserina intracellulare (PS). Una riduzione di DHA porta ad una parallela riduzione di PS. Il DHA potrebbe giocare un ruolo importante nella regolazione della proliferazione cellulare e nelle funzioni di cell signaling, a livello neuronale, in rapporto agli effetti indotti sulla PS. Il tipico e pungente odore di pesce guasto deriva, soprattutto, dalla perossidazione dei PUFA n-3 derivati dal pesce mentre più stabile e quindi inodore è l’ ω3 derivato dal Krill. A livello del sistema nervoso i radicali liberi sono prodotti, normalmente, durante il processo metabolico. Sono particelle molto reattive sul piano chimico e potenzialmente destruenti le molecole neuronali più complesse, quali proteine, lipidi ed acidi nucleici. Le aree a più alto metabolismo ossidativo, ad alta concentrazione di PUFA e con presenza di metalli di transizione, come le sinapsi neuronali, sono particolarmente vulnerabili alla loro azione dannosa. ITALCHIMICI 21 Krilling D Manuale Uso Interno Complessi sistemi di difesa antiossidativa sono attivati per proteggere i neuroni dallo stress ossidativo. I sistemi antiossidativi enzimatici includono la superossido-dismutasi, la glutatione-perossidasi e la catalasi. I sistemi antiossidativi non enzimatici includono l’azione specifica svolta, tra l’altro, da: vitamina A e D, vitamina C e Vitamina E, beta-carotene, glutatione, urati, zinco ed oligoelementi. Alcuni studi hanno evidenziato una carenza funzionale di questi meccanismi antiossidativi in diversi disturbi mentali inclusa la schizofrenia. La disregolazione del metabolismo ossidativo neuronale, si associa ad un rilevante aumento dei markers metabolici di perossidazione lipidica, rilevati nel plasma, negli eritrociti e nel fluido cerebro-spinale. Queste anomalie metaboliche sono state associate ai sintomi negativi della schizofrenia, alle discinesie tardive, ai segni neurologici minori e ad alcuni aspetti patologici particolari, evidenziati con tecniche di neuroimaging. Il tessuto nervoso è costituito prevalentemente di sostanze lipidiche in cui prevalgono i grassi polinsaturi a lunga catena. I grassi alimentari, oltre a svolgere un ruolo energetico, forniscono anche componenti molecolari importanti e, talora indispensabili, sul piano morfo-funzionale per cervello e retina. Per garantire uno sviluppo normale del sistema nervoso è indispensabile garantire un adeguato apporto d’Omega-3, soprattutto nell’ultimo trimestre di gravidanza, ma anche nei sei mesi successivi al parto. Una dieta esclusivamente vegetariana può essere insufficiente a garantire il necessario apporto di questi nutrienti. Durante la vita intrauterina la placenta assorbe selettivamente AA e DHA dal sangue materno per trasferire queste molecole essenziali al feto. L’apporto di acidi grassi polinsaturi essenziali è dipendente dalla dieta per la madre e dalla fonte materna per il feto. Per garantire il fabbisogno d’acidi grassi essenziali, per madre e bambino, è opportuno controllare adeguatamente la dieta materna, tanto nel periodo gestazionale quanto durante l’allattamento al seno. La supplementazione con PUFA n-3 durante la gravidanza sembra aumentare significativamente il contenuto di fosfolipidi e d’Omega-3, nel plasma ombelicale durante la gravidanza, ma anche nel latte materno in fase d’allattamento. Un alto apporto di cibo ad alto contenuto d’Omega-3 potrebbe essere la causa del prolungarsi della gestazione, in media per una settimana, nelle donne delle isole Faeroes. Il parto è, infatti, condizionato dalla produzione di prostaglandine. Un supplementazione con olio di pesce, ad alto contenuto di Omega-3 (2,7 gr /die), dalla trentesima settimana di gestazione, ha indotto un maggior peso medio, alla nascita, di circa 107 gr. ed un prolungarsi della gestazione, in media di 4.0 giorni con alta significatività statistica (ANOVA P=.006) in un gruppo di 433 donne danesi, confrontate con un campione trattato con supplementazione a base di olio di oliva (1,0 gr/die). Una supplementazione d’Omega-3 sembra essere opportuna, nel terzo trimestre di gravidanza, poichè non induce effetti negativi sul feto o sul parto e svolge specifici effetti protettivi. Questa protezione si concretizza non tanto nel prolungarsi di pochi giorni della gravidanza, che di per sé può avere scarso significato clinico, quanto nel prevenire eventuali nascite pretermine. Inoltre, la supplementazione dietetica con Omega-3 sembra ridurre anche l’incidenza di paralisi cerebrale. In uno studio è stato valutato l’effetto di una dieta preventiva ricca di Omega-3 (2,7gr. di Omega-3/die contro placebo con olio d’oliva) a partire dalla ventesima settimana di gestazione, in 232 donne con un’anamnesi positiva per parto pretermine. L’assunzione di Omega-3 ha ridotto il rischio di parto pretermine, dal 33% al 21% (odds ratio 0.54). In un altro studio di coorte, svolto in Danimarca, su 8.729 donne in gravidanza, è stata valutata l’incidenza del parto pretermine, dividendo le donne in quattro gruppi, a seconda del consumo alimentare medio di pesce per settimana. L’incidenza di parto pretermine passava dal 7.1%, nel gruppo che non assumeva mai pesce, a 1.9% in quello che assumeva pesce almeno una volta per settimana. L’abilità a rispondere in senso adattivo agli stimoli ambientali sembra correlarsi direttamente, non solo all’apporto d’acidi grassi essenziali n-3 e n-6, ma anche al loro reciproco equilibrio. ITALCHIMICI 22 Krilling D Manuale Uso Interno Gli acidi grassi n-3 sono essenziali per un corretto sviluppo fetale e perinatale del sistema nervoso. Alcuni studi hanno evidenziato effetti comportamentali della carenza di Omega-3. Un apporto deficitario d’acidi grassi ω3 influenza i sistemi neurotrasmettitoriali, con effetti prevalenti sul tono dopaminergico a livello della corteccia frontale, in diversi modelli sperimentali animali. La via dopaminergica mesolimbica è meno attiva nei ratti con deficit di Omega-3, rispetto a ratti di controllo sani. Ciò potrebbe, tra l’altro, correlarsi funzionalmente ad alterazioni dell’omeostasi edonica (disedonia). In ratti neonati, deprivati dalla nascita di DHA ed AA, la loro successiva aggiunta alla dieta inverte gli effetti della carenza di Omega-3, sulla composizione lipidica delle membrane neuronali cerebrali e sulla neurotrasmissione dopaminergica, ma solo nella fase d’allattamento. Il recupero, cioè, non è più completo, nella fase successiva allo svezzamento. Altre osservazioni sperimentali, però, sostengono l’effetto terapeutico del DHA, nel ripristino dei livelli di catecolamine, anche dopo lo svezzamento. Numerosi studi confermano un’associazione positiva tra allattamento al seno materno e sviluppo cognitivo del bambino. E’ noto che il latte materno ha un alto contenuto in DHA ed EPA. L’Organizzazione Mondiale della Sanità ha raccomandato, da tempo, l’aggiunta di EPA e DHA al latte in formula per neonati. Sebbene il latte materno contenga DHA ed AA, le formulazioni di latte per neonati, sono state a lungo carenti di questi nutrienti, soprattutto negli USA. Solo nel 2001, infatti, la FDA statunitense ha approvato l’aggiunta di questi nutrienti al latte in formula per poppanti. Lo sviluppo intellettivo di neonati deprivati di questi nutrienti può risultare rallentato. In uno studio è stato evidenziato che i bambini, allattati nei loro primi quattro mesi di vita, con una formula che prevedeva l’aggiunta di PUFA, presentavano, a 10 mesi di vita, risultati migliori in un problem solving test, rispetto a coetanei che non avevano ricevuto la supplementazione. Uno studio prospettico longitudinale di coorte è stato svolto, in Danimarca, su soggetti nati a Copenaghen, dall’Ottobre 1959 al Dicembre 1961. Il campione di 2.280 persone è stato diviso in cinque gruppi, in rapporto alla durata del loro allattamento al seno materno. La maggiore durata dell’allattamento al seno materno è risultata associarsi significativamente (P=.003) a più alti livelli di Q.I. Verbale, Q.I. di Performance e Q.I. Totale, alla WAIS. Gli autori hanno suggerito che il contenuto in acidi grassi n-3, presenti nel latte materno, potrebbe giustificare, almeno in parte, quest’effetto lineare, per cui a più lungo allattamento corrisponde, in maniera lineare, un più alto Q.I. totale. Un altro studio ha evidenziato pattern di sonno più maturi, in bambini nati da madri, con più alti livelli plasmatici di DHA. Gli effetti di una dieta neonatale arricchita con DHA o AA, rispetto ad una dieta di controllo senza DHA o AA, sullo sviluppo cognitivo successivo, sono stati valutati in uno studio clinico controllato e randomizzato. Cinquantasei neonati (26 maschi, 30 femmine) sono stati arruolati nello studio, entro i primi cinque giorni di vita, ed hanno assunto la dieta stabilita sino alla diciassettesima settimana di vita. All’età di 18 mesi sono stati sottoposti a valutazione mediante Bayley Scales of Infant Development, 2nd edition (BSID-II). La dieta, arricchita con DHA ed AA, si associava ad un incremento medio di 7 punti, sull’Indice di Sviluppo Mentale (MDI) della BSID-II. I gruppi trattati con DHA, da solo o in associazione con AA, hanno mostrato un vantaggio significativo, sul piano cognitivo e motorio, con un trend in miglioramento anche del linguaggio. Una significativa correlazione è stata evidenziata tra livelli di DHA nelle emazie a 4 mesi d’età e l’Indice di Sviluppo Mentale della BSID-II. Gli autori dello studio interpretano il dato come ulteriore conferma che è il supplemento dietetico il fattore determinante gli effetti verificati sulla MDI della BSID-II. Le loro conclusioni sostengono che gli acidi grassi essenziali ω3, in particolare il DHA, assunti dai neuroni nella tarda gravidanza e nel primo periodo successivo alla nascita, sono prerequisiti essenziali per un normale sviluppo cerebrale. ITALCHIMICI 23 Krilling D Manuale Uso Interno L’importanza degli acidi grassi Omega-3 nello sviluppo normale del sistema nervoso in prematuri era già nota. Questo studio conferma la loro importanza anche in bambini sani ed in epoca post-natale. In un altro studio si è valutata l’acuità visiva e la stereoscopia a 17, 26 e 52 settimane dalla nascita, in neonati con dieta priva o arricchita con acidi grassi polinsaturi a lunga catena (LCPUFA). A 17 settimane l’acuità visiva risultava migliore nel gruppo trattato con supplementazione. Il dato correlava positivamente con la concentrazione plasmatica di DHA. Una migliore acuità visiva a 52 settimane risultò correlata positivamente a più alte concentrazioni di DHA, nel plasma e nelle emazie. L’apporto dietetico di Omega-3 influisce su diverse e complesse funzioni cerebrali, in rapporto al loro diretto effetto sui livelli di colesterolo, fosfolipidi e sfingomielina, nei sinaptosomi e nei microsomi neuronali cerebrali. Il consumo di lipidi risulta velocemente e continuamente correlato alla composizione di queste importanti strutture funzionali del neurone. Gli Omega-3 sono essenziali anche nella modulazione funzionale dell’appetito, della digestione, della termoregolazione e del sonno. Le carenze relative o assolute nell’apporto dietetico d’Omega-3 potrebbero svolgere, in età pediatrica, perciò, un ruolo specifico nella fisio-patogenesi dei disturbi visivi, attentivi, motori e neurolinguistici. Un deficit d’apporto dietetico e/o un disequilibrio tra acidi grassi essenziali ω3 e ω6 può correlarsi a diversi disturbi psicopatologici dello sviluppo, come deficit dell’apprendimento, disturbi neurolinguistici, deficit dell’attenzione con iperattività (ADHD) ed autismo. In soggetti, con bassi livelli d’acidi grassi ω3, sono stati descritti numerosi disturbi del comportamento e del sonno, oltre che deficit cognitivi e d’apprendimento. In uno studio, su 97 bambini dislessici, furono valutati i livelli plasmatici d’acidi grassi. I soggetti con più bassi livelli di Omega-3 presentavano peggiori capacità di lettura, spelling, abilità generale e working memory uditiva, soprattutto tra i soggetti maschi. Il deficit d’acidi grassi risultò significativamente elevato (p<.001) in soggetti dislessici, soprattutto nei maschi, rispetto ai controlli. In particolare, in questo studio fu evidenziata una stretta correlazione tra deficit d’acidi grassi e problemi neurolinguistici non solo visivi, ma anche uditivi e motori. Un altro studio ha evidenziato una diretta correlazione tra bassi livelli di acidi grassi Omega-3 e disturbi dell’apprendimento. Lo studio di Burgess et al. (2000) ha confermato che i bambini, con queste deficienze lipidiche, presentavano disturbi del comportamento, dell’apprendimento e del ritmo sonno-veglia, assenti nei bambini di controllo sani. In dislessici adulti, inoltre, uno studio di risonanza magnetica spettroscopica con fosforo-31 ha evidenziato segni d’alterato turnover dei lipidi di membrana. In uno studio controllato e randomizzato, 41 bambini dislessici, d’età compresa tra gli 8 ed i 12 anni, con difficoltà d’apprendimento e con punteggi sopra la media per l’ADHD, hanno ricevuto una supplementazione con acidi grassi o placebo. Dopo12 settimane, si sono evidenziati effetti favorevoli sui disturbi del comportamento e sull’apprendimento nei soggetti trattati con acidi grassi ω3 e ω6. Il deficit di PUFA si associa a sete eccessiva, frequenti minzioni, pelle secca e desquamata e disturbi comportamentali. Poiché questi segni clinici risultano frequenti nei soggetti con ADHD alcuni autori hanno ipotizzato una carenza di PUFA nei soggetti con ADHD. Un altro tipico segno della ADHD è una sorta di pseudointolleranza all’acido salicilico. Poiché i salicilati interferiscono con la ciclo-ossigenasi nel passaggio metabolico da PUFA a eicosanoidi, essi potrebbero esacerbare le problematiche connesse a bassi livelli di EPA e AA. Colquhoun & Bunday, già nel 1981, segnalarono, nei soggetti con ADHD, la frequente presenza di una condizione atopica, nonché una relativa deficienza di zinco. ITALCHIMICI 24 Krilling D Manuale Uso Interno Uno studio, su 53 pazienti affetti da ADHD e 43 soggetti di controllo, con età compresa tra 6 e 12 anni, ha evidenziato bassi livelli plasmatici di DHA ed AA, con ridotti livelli plasmatici anche di EPA e bassi livelli di AA nelle emazie. Secondo Stordy (2000), i disturbi del comportamento, tipici dei soggetti con ADHD, potrebbero essere l’espressione sintomatica di un inadeguato funzionamento delle membrane neuronali, per un deficit relativo delle componenti ad alto contenuto d’acidi grassi polinsaturi. I bambini con ADHD sembrano presentare un ridotto volume cerebrale. Questo ridotto sviluppo volumetrico potrebbe essere relato al deficit di acidi grassi essenziali, sebbene non si abbia a tutt’oggi nessuna evidenza scientifica in merito, non essendo stati effettuati studi specifici. Ciò nonostante garantire un adeguato apporto di fosfolipidi ai bambini, in fase di sviluppo, sembra essere ragionevole al fine di prevenire deficienze nutrizionali. I pochi studi di supplementazione dietetica a scopo terapeutico, riportano risultati deludenti, dopo somministrazione di acido gamma-linolenico, in pazienti con ADHD. Sedici pazienti affetti da ADHD, con età compresa tra 6 e 12 anni, in trattamento con psico-stimolanti sono stati trattati con supplementazione di DHA, in uno studio randomizzato in doppio cieco vs placebo. Alla fine dello studio, sebbene il livello plasmatico di DHA risultasse essere oltre due volte superiore, rispetto ai soggetti di controllo, non è stata evidenziata alcuna significativa variazione di parametri obiettivi o soggettivi della sintomatologia tipica del disturbo. Di recente sono stati evidenziati, al contrario, alcuni effetti terapeutici degli Omega-3 sul disturbo dell’attenzione con iperattività negli adulti. Nei soggetti con disturbi dello spettro autistico sono stati evidenziati bassi livelli di PUFA ω3 nelle membrane cellulari dei globuli rossi. Evidenze preliminari sembrano confermare, in questi soggetti, un eccesso dell’enzima PLA2 che rimuove gli acidi grassi polinsaturi dalle membrane fosfolipidiche. Alti livelli di quest’enzima sono stati evidenziati anche in soggetti dislessici e schizofrenici. E’ probabilmente difficile valutare l’efficacia clinica di un trattamento di supplementazione dietetica, se si considera la gran variabilità sindromica, esistente tra pazienti diversi, portatori del cosiddetto disturbo autistico, in questa fase della vita. Sicuramente la vita fetale e la prima infanzia sono periodi critici per lo sviluppo del tessuto nervoso. In quest’ottica un adeguato apporto di nutrienti essenziali, in particolare, di acidi grassi polinsaturi Omega-3, dovrebbe essere garantito durante la gravidanza, l’allattamento e l’infanzia, ma, verosimilmente, durante tutta la vita. Lo stress ossidativo può portare ad una perossidazione globale, con effetti più evidenti a livello neuronale, per la maggiore rilevanza funzionale delle membrane fosfolipidiche, in queste cellule. Lo stress ossidativo potrebbe essere uno dei principali fattori etio-patogenetici della malattia schizofrenica, se si considera che l’alterazione ossidativa dei lipidi può modificare la conformazione e funzionalità recettoriale, distorcendo la trasduzione dei messaggi, ed alterando, così, sostanzialmente le funzioni di information processing cerebrale. La perossidazione neuronale può alterare il trasporto di membrana, la produzione di energia a livello mitocondriale, l’espressione genica, oltre alla trasduzione dei segnali, mediata dalle molecole a funzione recettoriale, immerse nella matrice fosfolipidica delle membrane neuronali. E’, ovviamente, difficile distinguere quanto il disturbo funzionale, presente nella schizofrenia, possa essere secondario al danno ossidativo, da quanto consegua ad una deficitaria assunzione dietetica e da quanto derivi da un alterato metabolismo degli acidi grassi di membrana. Alcuni autori hanno sostenuto che il deficit d’Omega-3 evidenziato negli schizofrenici derivi da un alterato stress ossidativo, piuttosto che da deficit alimentari o metabolici di sintesi. Qualunque sia il meccanismo sotteso a questo deficit è evidente che alcune strategie terapeutiche possono essere di relativo beneficio. L’assunzione regolare di antiossidanti, per via dietetica, può prevenire o contrastare la ridotta incorporazione d’Omega-3 nelle membrane neuronali, conseguente allo stress ossidativo. A tal fine sono sicuramente utili supplementi alimentari a base di vitamina A, vitamina D, vitamina E, beta carotene e, ovviamente, acidi grassi essenziali Omega-3. ITALCHIMICI 25 Krilling D Manuale Uso Interno Ulteriori misure d’igiene possono essere diete a più basso apporto di calorie, con più bassi consumi di fumo ed alcol, con maggiore attività motoria. Lo stile di vita dei pazienti schizofrenici è spesso orientato in senso inverso, con pesanti consumi di sigarette e, talora, cibi calorici ed alcol, scarsa attività motoria ed assunzione di sostanze e farmaci pro-ossidativi. Sono stati evidenziati in schizofrenici cronici, ma anche in schizofrenici drug-naive, all’esordio dei sintomi, elevate concentrazioni di prodotti della perossidazione associati ad alterati livelli di antiossidanti, sia nel plasma che nel liquor. Queste evidenze suggeriscono che, nella schizofrenia, un ruolo etio-patogenetico rilevante possa essere esercitato dallo stress ossidativo. Un aumento della perossidazione lipidica plasmatica concorda con i bassi livelli d’acidi grassi polinsaturi, evidenziati a livello delle membrane fosfolipidiche eritrocitarie e neuronali. I livelli d’acido arachidonico e di DHA nelle membrane delle emazie sono relativamente bassi negli schizofrenici cronici, rispetto a soggetti normali di controllo. Non manca la segnalazione di effetti clamorosamente terapeutici, del trattamento con E-EPA in un paziente drug-naive, con miglioramenti clinici drammatici dei sintomi positivi e negativi, in una schizofrenia al suo primo esordio. La sintomatologia clinica sembra essersi correlata, in questo paziente, ad una normalizzazione della composizione dei fosfolipidi di membrana degli eritrociti, con riequilibrio delle componenti ω3 e ω6, ma anche ad una normalizzazione del contenuto in AA, probabilmente per inibizione della fosfolipasi A2 o per attivazione di una CoA-ligasi per gli acidi grassi. Il recupero di questo paziente si è associato, inoltre, ad una riduzione del turnover dei fosfolipidi di membrana, come evidenziato da uno studio seriale cerebrale alla MRI con fosforo-31. In venti schizofrenici cronici, la supplementazione dietetica con 10 gr/die di olio di pesce, a maggior contenuto di EPA, ha indotto un significativo miglioramento dei sintomi negativi (anedonia, affettività appiattita, apatia, rallentamento motorio) ma non variazioni significative dei sintomi positivi, alla Positive and Negative Syndrome Scale (PANSS). Il miglioramento sintomatologico si è associato ad un aumento dei livelli d’acidi grassi Omega-3 negli eritrociti. In uno studio su 19 giovani schizofrenici, alla loro ammissione, furono misurate le concentrazioni di PUFA a livello eritrocitario. La composizione dei fosfolipidi di membrana a livello eritrocitario sembra riflettere abbastanza fedelmente la stessa composizione a livello neuronale. Fu somministrata la scala di Montgomery Asberg per la depressione e la PANSS. Vennero verificati, inoltre, aspetti dietetici, ormonali ed l’uso di cannabinoidi, essendo questi fattori che possono interferire sul metabolismo degli acidi grassi. Il DHA e gli acidi grassi C22:5 ω3 e tutti gli acidi grassi ω9 risultarono significativamente più bassi nei pazienti, rispetto a soggetti sani di controllo. Non si trovarono, invece, significative differenze nel livello di AA. Le differenze di concentrazione degli acidi grassi non risultarono dipendere da variabili dietetiche, ormonali o da uso di cannabinoidi. In uno studio, in doppio cieco contro placebo a gruppi paralleli, con dosi fisse e durata di 12 settimane, è stata investigata l’efficacia e la tollerabilità dell’E-EPA come trattamento add on in pazienti schizofrenici cronici gravi. Quaranta pazienti, con sintomi persistenti dopo almeno sei mesi di trattamento antipsicotico stabile, assunsero E-EPA o placebo in aggiunta al loro precedente trattamento farmacologico. A 12 settimane il gruppo trattato con E-EPA presentò una significativa riduzione del punteggio totale della PANSS, ma anche del punteggio di discinesia, rispetto al gruppo placebo. Secondo gli autori, l’EPA potrebbe essere considerato un trattamento aggiuntivo efficace e tollerato nella schizofrenia. In uno studio simile sono stati valutati gli effetti dell’E-EPA sulla sintomatologia psicopatologica persistente in pazienti che ricevevano diversi farmaci antipsicotici. 115 pazienti, affetti da schizofrenia, definita secondo i criteri diagnostici del DSM IV, assumevano rispettivamente: 31 clozapina, 48 un antipsicotico atipico e 36 un neurolettico. Placebo oppure 1,2 o 4 gr / die di E-EPA furono dati in aggiunta alla terapia già in corso, per dodici settimane consecutive. L’E-EPA ridusse significativamente il livello di trigliceridi plasmatici, già elevati, soprattutto nei soggetti che assumevano clozapina. Nei soggetti che assumevano 2 gr / die di E-EPA, si evidenziò un miglioramento della sintomatologia esplorata mediante PANSS, con effetti più evidenti nei soggetti in trattamento con clozapina. ITALCHIMICI 26 Krilling D Manuale Uso Interno Fu evidenziata, inoltre, una correlazione diretta tra miglioramento sintomatologico e aumento negli eritrociti della concentrazione di AA. Nell’ipotesi che lo stress ossidativo possa svolger un ruolo nell’etio-patogenesi della schizofrenia è ragionevole supporre che l’assunzione dietetica di antiossidanti ed Omega-3 possa prevenire la malattia o almeno attenuarne il decorso e la sintomatologia. Probabilmente, un’opportuna supplementazione dietetica può svolgere un effetto parzialmente terapeutico, anche nei pazienti più gravi, migliorando alcuni aspetti comportamentali e, soprattutto, riducendone il deterioramento cognitivo. Una recente review Cochrane conclude la revisione sistematica della letteratura scientifica internazionale sull’argomento, sostenendo che l’uso degli acidi grassi polinsaturi Omega-3 resta ancora sperimentale. Più ampi e ben disegnati studi di verifica sono in corso. Nel tessuto cerebrale, di pazienti affetti da Morbo di Alzheimer, sono state evidenziate differenze quantitative e qualitative nella composizione in acidi grassi, in particolare nella concentrazione di DHA, rispetto a soggetti normali di controllo di pari età. (Conquer et al., 2000) Questi valori sono stati comparati a quelli ottenuti da un campione di soggetti anziani di controllo con normali livelli cognitivi. I livelli plasmatici di fosfolipidi, di PC, di DHA, degli acidi grassi ω3, ed il rapporto ω3/ω6 sono risultati significativamente più bassi nei soggetti con SDAT, OD e CIND. I livelli di DHA e di LPC sono risultati particolarmente ridotti nei soggetti con CIND. Bassi livelli serici di DHA sembrano rappresentare un fattore di rischio per lo sviluppo di una demenza senile, presentandosi non solo nei pazienti affetti da SDAT, ma anche nei soggetti con altre forme di demenza o con semplice impairment cognitivo senile. In uno studio, randomizzato contro placebo, della durata di sei mesi, sono stati valutati gli effetti dell’E-EPA in sette pazienti ospedalizzati, affetti da morbo di Huntington, in uno stadio (III°) avanzato di malattia. Alla fine dello studio, tutti i pazienti trattati con E-EPA hanno presentato un miglioramento dei movimenti patologici oro-faciali, valutati mediante Unified Huntington's Disease Rating Scale, mentre tutti quelli in trattamento con placebo avevano presentato un netto peggioramento (p<.03). Ad un follow up, con valutazione alla risonanza magnetica nucleare tridimensionale, è stata evidenziata una progressiva atrofia, nel gruppo trattato con placebo, mentre il gruppo trattato con E-EPA sembrava presentare, addirittura, un processo neuroplastico inverso. Ulteriori e più recenti evidenze cliniche confermano gli effetti protettivi, esercitati dagli Omega-3, nel deterioramento cognitivo senile e demenziale. La deplezione d’acidi grassi polinsaturi Omega-3, in particolare di DHA, interferisce significativamente su numerosi e diversi parametri funzionali neuronali. Numerosi studi hanno evidenziato un possibile ruolo di questa deplezione nell’etiopatogenesi di numerose patologie nervose e mentali, e, soprattutto, della depressione. Alcuni dati sembrano dimostrare che l’utilizzo d’Omega-3 può ridurre il rischio di depressione tanto quanto il rischio di malattia coronarica. Dati epidemiologici confermano il sovrapporsi delle aree del mondo, con minori consumi alimentari di pesce, e quelle con maggiore incidenza della malattia depressiva. La forte associazione tra malattia coronarica e depressione potrebbe trovare nella carenza di Omega-3 un comune fattore patogenetico. Numerose evidenze indirette sembrano suggerire una correlazione tra deficit d’Omega-3 e disturbi del comportamento. Il rapido ridursi dei lipidi circolanti, per effetto degli inibitori della HMG-CoA reduttasi, si associa a numerosi disturbi psicopatologici. ITALCHIMICI 27 Krilling D Manuale Uso Interno In un database norvegese il 15% degli effetti collaterali di tipo psichiatrico risulta essere indotto dalle statine. Questi effetti collaterali includono ansietà, aggressività, depressione dell’umore, nervosismo e disturbi del ritmo sonno-veglia. Ulteriori dati sono stati raccolti rispetto alla relazione tra serotonina ed Omega-3. In pazienti gravemente depressi sono stati evidenziati bassi livelli di 5HIAA, un metabolita della serotonina, nel liquor, nonché bassi livelli di colesterolo circolante. Le terapie che riducono il colesterolo, sembrano associarsi significativamente ad un più alto rischio di suicidio. Alcuni studiosi hanno sostenuto che i bassi livelli di colesterolo possono interferire sul turnover della serotonina. Le diete e le terapie che riducono i grassi circolanti, riducono anche i livelli d’acidi grassi polinsaturi essenziali. Sembra che i livelli d’acidi grassi essenziali circolanti correlino direttamente con i livelli di 5HIAA liquorali. Le aree geografiche dove l’assunzione, col cibo, di Omega-3 è più alta presentano, di converso, minore incidenza epidemiologica di depressione. L’alcolismo ed il periodo post-partum sono condizioni cliniche caratterizzate da bassi livelli d’Omega-3, nell’organismo. Entrambe queste condizioni cliniche si correlano ad una più alta incidenza di disturbi dell’umore. In soggetti depressi sono stati evidenziati bassi livelli d’Omega-3, soprattutto DHA, nei fosfolipidi eritrocitari, rispetto a soggetti sani di controllo. I pazienti depressi presentano, inoltre, un rapporto più alto tra AA ed EPA nel loro plasma e nei loro eritrociti. Questi dati, nel loro insieme, suggeriscono un possibile coinvolgimento dei livelli d’Omega-3 nella patogenesi della depressione. I dati in nostro possesso sull’efficacia terapeutica degli Omega-3 nel trattamento del disturbo depressivo sono ancora scarsi. Ciò nonostante, l’ipotesi di una loro efficacia è stata ripetutamente segnalata. La depressione sembra associarsi ad un aumento relativo dei livelli d’acidi grassi ω6 rispetto a quelli ω3, con incremento del rapporto ω6/ω3, ed una riduzione assoluta dei livelli plasmatici ed eritrocitari d’Omega-3. Alcuni autori hanno evidenziato, in soggetti depressi, una significativa alterazione del metabolismo ossidativo, con una correlazione diretta con i livelli serici e fosfolipidici dei PUFA ω6 ed una correlazione inversa con i livelli serici e fosfolipidici di EPA e DHA. I trattamenti antidepressivi non sembrano agire sugli acidi grassi essenziali. Nella depressione grave, a livello fosfolipidico, la carenza di PUFA ω3 si associa ad un incremento compensatorio di altri acidi grassi e di ω6 (c22:5 n-6). L’alterazione del metabolismo fosfolipidico, evidenziato nella depressione, se non trattato specificamente, persiste anche dopo un trattamento antidepressivo clinicamente efficace, mantenendo, comunque, un suo potenziale patogenetico. In un campione di 3.204 finlandesi sono stati studiati i sintomi depressivi, mediante Beck’s Depression Inventory, ed i consumi approssimativi d’Omega-3, con questionari strutturati specifici per l’apporto dietetico di pesce. L’analisi statistica di regressione multipla, corretta per i potenziali fattori confondenti, ha confermato che la probabilità di avere sintomi depressivi è significativamente più alta tra i soggetti con basso consumo di pesce. Alcuni Autori hanno suggerito una supplementazione di Omega-3, in senso terapeutico, nel trattamento delle depressioni subcliniche, delle depressioni di lieve o media entità sindromica, nonché come integrazione terapeutica nel trattamento delle depressioni più gravi. Di recente, sono apparsi in Letteratura studi sugli effetti terapeutici della supplementazione con EPA, nel miglioramento clinico del singolo paziente depresso. L’EPA è stato aggiunto alla terapia antidepressiva di un paziente grave con una storia di oltre sette anni di depressione, resistente ai trattamenti e con ripetuti episodi suicidari. L’aggiunta, al trattamento antidepressivo già in atto, dell’EPA ha indotto un marcato miglioramento dei sintomi depressivi, entro un mese dall’inizio. ITALCHIMICI 28 Krilling D Manuale Uso Interno Durante i nove mesi successivi di trattamento e studio, in questo paziente, la concentrazione relativa dei fosfo-mono-esteri cerebrali aumentò del 53%, il rapporto tra fosfo-mono-esteri e fosfo-di-esteri aumentò del 79%, confermando un riequilibrato turnover di fosfolipidi. Uno studio di neuro-imaging ha dimostrato che il trattamento con EPA si è accompagnato a ristrutturazioni morfologiche cerebrali con riduzione, in particolare, del volume dei ventricoli laterali. L’efficacia dell’EPA purificato, come terapia aggiuntiva nel trattamento della depressione ricorrente unipolare, è stata valutata da alcuni clinici. I risultati, ottenuti su un campione di venti pazienti, hanno confermato un sensibile e rilevante effetto dell’associazione, già dalla terza settimana di trattamento. In un altro studio sono stati trattati settanta pazienti affetti da depressione persistente e resistente alle terapie. I pazienti ricevevano in doppio cieco EPA o placebo in aggiunta alla corrente terapia antidepressiva già in atto. In questo studio, inoltre, gli effetti del trattamento aggiuntivo con EPA sono risultati più evidenti al dosaggio di 1000 mg/die, che al dosaggio di 2000 o 4000 mg/die. E’ stato ipotizzato, inoltre, uno specifico meccanismo d’azione degli Omega-3 nel trattamento della depressione per effetti indotti direttamente nella modulazione della proteina c-AMP response element binding (CREB) e del brain derived neurotrophic factor (BDNF). L’associazione tra deficit d’Omega-3 e depressione potrebbe rappresentare la corretta base interpretativa della robusta correlazione tra depressione e infarto miocardico. Molti dei quadri patologici, correlabili alla carenza di Omega-3 presentano, infatti, tra i loro sintomi clinici, uno slivellamento depressivo dell’umore. La depressione post-partum è stimata insorgere nelle donne in fase di puerperio con una prevalenza superiore al 20%. Fattori di rischio riconosciuti sono sia un’anamnesi positiva per depressione post-partum sia pregressi disturbi del tono dell’umore nella storia personale. La depressione post-partum, come definita dal DSM IV, insorge con i sintomi di una depressione maggiore, entro un mese dal parto. Nella letteratura psichiatrica siano riportati limiti temporali di insorgenza molto più ampi, che talora arrivano sino ad un anno dal parto. Una percentuale, tra il 25 % ed il 50%, di puerpere ha episodi di depressione, che durano oltre sei mesi. Le donne con una depressione post-partum presentano più alti livelli d’ansia e rispondono più tardi e meno bene alle terapie antidepressive, rispetto ai soggetti con depressione, non insorta nel puerperio. L’incidenza e la gravità sintomatologica della depressione post-partum sembra essere in crescita nei paesi occidentali. La fisiologia della gravidanza prevede la mobilizzazione degli acidi grassi polinsaturi, dai depositi materni al feto. Il DHA è trasportato attivamente, attraverso la placenta, mediante una proteina di legame, verso il feto, che necessita di sufficienti livelli d’Omega-3 per poter avere un normale sviluppo neurologico. Il DHA si accumula, nel nascituro, nei coni di accrescimento nervoso durante lo sviluppo prenatale, prevalentemente esterificato sotto forma di fosfatidil-etanolamina, esercitando, così, effetti neuroprotettivi e di riduzione dell’attività PLA2. E’ stato dimostrato che gli acidi grassi essenziali, soprattutto il DHA, durante la gestazione, decrescono progressivamente nella madre. I livelli di DHA nella madre possono ridursi di oltre il 50% e risultare ancora insufficienti sino ad oltre sei mesi dal parto. I parti multipli possono aggravare tale condizione. Una supplementazione dell’apporto dietetico di questi composti, in fase conseguentemente, opportuna e necessaria, tanto per la madre quanto per il feto. gravidica, risulta, Senza una supplementazione dietetica la madre tende ad una relativa insufficienza di Omega-3, soprattutto, di DHA. L’allattamento può prolungare nel tempo la carenza relativa d’Omega-3. La deplezione di DHA, nella tarda fase gestazionale, nel periodo immediatamente successivo al parto, nonché nella successiva fase d’allattamento, potrebbe contribuire all’insorgere della depressione postpartum. ITALCHIMICI 29 Krilling D Manuale Uso Interno La dieta materna influenza i livelli di DHA nel latte materno. Sembra che l’apporto dietetico quotidiano di DHA nelle donne nord-americane sia di circa 40-50 mg, mentre è stato calcolato in 200 mg nelle donne europee ed in 600 mg nelle donne giapponesi. Il livello di DHA nel latte materno può essere considerato, in un certo senso, un marker biologico dell’equilibrio metabolico, in acidi grassi polinsaturi Omega-3, della madre. Il basso apporto dietetico di DHA sembra correlare direttamente con l’incidenza di depressione post-partum. I dati di prevalenza della depressione post-partum sono stati valutati su 14.532 soggetti reclutati in 41 diversi studi. Questi dati sono stati comparati ai livelli di DHA, EPA e AA, nel latte materno, ed ai consumi dietetici medi di pesce, riportati in 23 paesi. Più alte concentrazioni di DHA nel latte materno (r = -0.84, p<.0001, n = 16 paesi) e più alti consumi di pesce (r = -0.81, p<0.0001, n = 22 paesi) correlano con una più bassa prevalenza di depressione postpartum. Il contenuto di AA ed EPA nel latte materno sembra, invece, non essere correlato alla prevalenza di depressione. E’ evidente l’opportunità di valutare sperimentalmente l’efficacia degli acidi grassi polinsaturi Omega-3, nella prevenzione e nel trattamento della depressione post-partum. Disturbi bipolari dell’umore rappresentano una condizione psicopatologica relativamente frequente e clinicamente rilevante. Diverse osservazioni cliniche ed alcuni studi epidemiologici hanno evidenziato una correlazione diretta, fra maggior consumo di cibi d’origine marina (pesce, crostacei etc.) e ridotta prevalenza di disturbo bipolare. Sono state messe a punto ricerche, allo scopo di valutare l’eventuale efficacia e sicurezza di una supplementazione dietetica con Omega-3, nel trattamento di soggetti affetti da disturbo bipolare. Uno studio ha evidenziato marcati effetti di stabilizzazione dell’umore, dopo assunzione di DHA ed EPA, in soggetti bipolari. Sono stati reclutati trenta pazienti, con età compresa tra 18 e 65 anni, di entrambi i sessi, affetti da disturbo bipolare I o II, secondo i criteri diagnostici del DSM IV, con almeno un episodio maniacale o ipomaniacale nell’ultimo anno. Circa il 40% dei pazienti arruolati in questo studio potevano essere considerati rapid cyclers. Tutti i pazienti hanno proseguito la terapia, farmacologia e/o psicoterapeutica, già in atto, con una supplementazione dietetica media di 9.6 g / die d’olio di pesce, ricco in Omega-3, oppure con un’equivalente quantità d’olio d’oliva, utilizzato come placebo di confronto. I quindici pazienti trattati con olio di pesce, oltre che per qualche disturbo gastro-enterico (alitosi tipica, nausea, etc.) si sono differenziati dal gruppo di controllo, per un significativo periodo di remissione della sintomatologia (P=0.002) valutata mediante Hamilton Depression Scale, Global Assessment Scale e Clinical Global Impression. Nel gruppo Omega-3 si sono registrate due ricadute cliniche, rispetto alle nove ricadute del gruppo di controllo. E’ stato evidenziato, perciò, nei pazienti bipolari trattati con Omega-3, un miglioramento della sintomatologia psicopatologica, nel breve termine, ma anche un effetto preventivo sulle ricadute, soprattutto su quelle depressive, piuttosto che sul recidivare di episodi ipomaniacali o maniacali. Altre ricerche hanno evidenziato un significativo miglioramento clinico dei soggetti con depressione bipolare, trattati con Omega-3 rispetto a quelli, appartenenti ad un gruppo di confronto, trattati con placebo. Gli Autori di un altro studio hanno portato a termine un trial clinico “in aperto” su un campione di 10 pazienti con depressione bipolare, trattati per un mese con Omega-3. L’analisi dei risultati ha mostrato un miglioramento significativo della sintomatologia depressiva in 8 dei 10 pazienti trattati. ITALCHIMICI 30 Krilling D Manuale Uso Interno Tuttavia, è difficile trarre conclusioni generali da un’osservazione clinica condizionata sia dall’esiguità del campione (10 pazienti) sia dalla mancanza di un gruppo di controllo, trattato con placebo. Un’elevata quota di pazienti, affetti da disturbo bipolare, presenta frequenti ricadute, nonostante l’efficacia terapeutica dei trattamenti specifici con stabilizzatori dell’umore, come litio e valproato. Tutti i farmaci, con effetto stabilizzatore sull’umore, sembrano inibire la traduzione del segnale, a livello del primo o del secondo messaggero. Ciò avvalora l’ipotesi che un aumento dei livelli d’attivazione neuronale svolge un importante ruolo nella fisiopatogenesi del disturbo. Numerose evidenze biochimiche confermano sia l’incorporazione tra i fosfolipidi di membrana degli acidi grassi essenziali Omega-3 sia un loro ruolo cruciale nella trasduzione dei segnali a livello neuronale. L’azione degli Omega-3 sembra associata ad una soppressione dell’attività neuronale, come secondo messaggero, del fosfatidil-inositolo, risultando in ciò sovrapponibile a quella esercitata da valproato e litio. L’assunzione di grandi quantità di Omega-3 si correla, a livello neuronale, con una riduzione della trasduzione di segnali, associati al fosfatidil-inositolo, all’acido arachidonico ed ad altri sistemi. Ulteriori ricerche saranno indispensabili, in futuro, per precisarne meglio l’eventuale efficacia in acuto e nel lungo termine, nella profilassi delle ricadute depressive ed espansive, e, soprattutto nella ricerca di specifici predittori di risposta favorevole. Diversi Autori, tuttavia, sulla base di numerosi e diversi studi clinici, considerano la supplementazione dietetica con acidi grassi essenziali Omega-3 ben tollerata e clinicamente efficace, nel migliorare il decorso dei disturbi dell’umore, in particolare della malattia bipolare, quanto meno nel breve termine. In uno studio, su 41 studenti è stata valutata l’efficacia di un trattamento ad alto contenuto di DHA, con circa 1,5 gr / die di principio attivo, nei tre mesi prima degli esami, valutando con metodo psicometrico l’ostilità espressa, all’inizio ed alla fine del trattamento, che coincideva all’incirca con gli esami stessi. Il gruppo di controllo, che assumeva capsule oleose con olio di soia, alla fine dello studio, cioè, in fase di stress da esame, presentava un incremento del 58% dell’ostilità espressa, mentre il gruppo trattato con DHA presentava una riduzione degli stessi indici del 14%. In uno studio, disegnato per valutare gli effetti del DHA sulla risposta allo stress, alcuni studenti (4 maschi e 3 femmine) hanno assunto 10 capsule al di, ad alto contenuto di DHA, per 9 settimane consecutive durante le quali erano sottoposti a 20 esami didattici stressanti. Un gruppo di controllo (4 maschi e 3 femmine) assunse capsule oleose analoghe non contenenti DHA. All’inizio ed alla fine dello studio furono misurati i livelli plasmatici d’adrenalina, noradrenalina e cortisolo. Le concentrazioni di noradrenalina risultarono significativamente ridotte (-31% p<.03) nel gruppo in trattamento con DHA. Le altre catecolamine non differirono significativamente. La frazione plasmatica d’adrenalina rispetto alla noradrenalina nei soggetti trattati con DHA aumentò significativamente (+78% p<.02). Sawazaki et al. (1999), nelle loro conclusioni, hanno sostenuto l’opportunità di supplementare la dieta dei soggetti sottoposti a stress di lunga durata, con elevati quantitativi di DHA. Uno studio, in doppio cieco, randomizzato contro placebo, effettuato su 231 giovani prigionieri, ha evidenziato una riduzione espressiva (-26.3% p=0.03) degli atti d’aggressività, da parte dei soggetti che ricevevano una dieta arricchita con vitamine, minerali ed acidi grassi essenziali, rispetto al gruppo di controllo. La presenza di una sindrome metabolica (SM) rappresenta un importante fattore di rischio per il diabete e per le malattie cardio-vascolari. La prevalenza di questa sindrome tra i pazienti in trattamento con antipsicotici atipici è stata di recente valutata, in maniera estensiva, su 430 pazienti schizofrenici che afferivano all’ospedale psichiatrico universitario di Lovanio in Belgio. ITALCHIMICI 31 Krilling D Manuale Uso Interno In accordo con i criteri del National Cholesterol Education Program (NCEP, Adult Treatment Protocol, ATPIII) presentavano questa sindrome il 28,4% dei pazienti. Usando i criteri diagnostici dell’International Diabetes Federation (IDF) la percentuale raggiungeva il 36%. La SM è stata studiata, di recente, in rapporto all’assetto metabolico lipidico. I risultati hanno confermato l’influenza esercitata, sull’insorgenza della SM, da tre fattori: un basso livello ematico d’acido linoleico (LA), un alto consumo dietetico di grassi saturi ed un insufficiente apporto di PUFA ω3. In un recente studio, è stato evidenziato che l’insorgere della SM in pazienti trattati con antipsicotici atipici è direttamente legato all’incremento ponderale, con effetti connessi tanto all’adiposità, quanto al metabolismo glicidico. Gli antipsicotici che inducono maggiore incremento ponderale, come olanzapina e clozapina, si associano ad un rischio nettamente più alto per l’insorgere di una SM. Ventotto pazienti, in trattamento con clozapina, sono stati sottoposti ad un regime dietetico con supplementazione di Omega-3 (1.8 g di EPA and 1.2 g di DHA / die). L’assetto lipidico è stato valutato, in uno studio in aperto, prima e dopo quattro settimane di assunzione Omega-3. Il trattamento in addizione con Omega-3 ha ridotto del 22% il livello di trigliceridi, inducendo un incremento del colesterolo totale del 6,6% ed un incremento del colesterolo LDL di circa il 22%. Un aumentato apporto di Omega-3 può migliorare alterazioni della trasduzione del segnale insulinico e prevenire alterazioni dell’omeostasi glicidica evitando l’insorgere di un diabete mellito di tipo-2. Questi effetti sono largamente mediati dalla riduzione degli acidi grassi polinsaturi ω3 (PUFA ω3) nel muscolo e nel fegato. I PUFA ω3 riducono i triacil-gliceroli plasmatici e migliorano il profilo lipoproteico, riducendo la frazione di piccoli, densi ed aterogeni LDL, ma non del colesterolo LDL. Probabili meccanismi d’azione degli Omega-3 e limiti al loro uso Le citochine sono importanti mediatori biologici. La loro produzione è, perciò, strettamente controllata. Un’eccessiva produzione di citochine contribuisce alla patogenesi di malattie acute e croniche di tipo infiammatorio, autoimmune, aterosclerotico e neoplastico. Studi sperimentali e clinici hanno dimostrato che la produzione delle citochine può essere ridotta, dagli acidi grassi polinsaturi essenziali a lunga catena ω3. Gli Omega-3 sono efficaci nel ridurre la severità sintomatologica di diverse malattie autommuni, infiammatorie, aterosclerotiche e dell’anoressia indotta da citochine. La riduzione delle citochine, se eccessiva, può, però, inficiare un’opportuna risposta immunitaria. Una tale condizione può associarsi ad una riduzione delle funzioni mediate dalle cellule T e dell’attività delle cellule natural killer e della citotossicità macrofagica. Ciò potrebbe anche spiegare alcuni effetti clinici, apparentemente paradossali, in cui dosi inferiori d’Omega-3 ottengono effetti migliori su alcuni parametri sintomatologici, in condizioni psichiatriche, rispetto a dosi più alte. Gli effetti negativi di un eccesso di Omega-3 sono equilibrati da un adeguato apporto di vitamina A, di vitamina D e di vitamina E. In alcuni studi clinici, i soggetti con diete più ricche di PUFA ω3 e ω6, in ogni modo, presentavano un’incidenza di patologie aterosclerotiche più bassa rispetto ai gruppi di controllo. Ciò nonostante una dieta con un apporto calorico di lipidi superiore al 10% non è raccomandabile, per gli effetti negativi su altri elementi dell’omeostasi metabolica. Al di sotto di questa percentuale nessun’evidenza è stata trovata su eventuali effetti negativi dell’assunzione dietetica di PUFA ω6 od ω3. ITALCHIMICI 32 Krilling D Manuale Uso Interno L’utilizzo di medicine complementari e pseudo-alternative, nei pazienti affetti da disturbi mentali è, purtroppo, una pratica diffusa e frequente. Questi rimedi complementari non sempre hanno un’evidenza scientifica che ne giustifichi l’uso, mancando spesso evidenze, non solo della loro efficacia, ma, talora, anche della loro innocuità. Le evidenze scientifiche sin qui raccolte sull’efficacia clinica, come terapia aggiuntiva, degli acidi grassi polinsaturi Omega-3, in diversi quadri psicopatologici e sul loro meccanismo d’azione, risulta molto interessante, fornendoci l’occasione per approfondire le nostre conoscenze su aspetti neurobiologici d’estrema rilevanza, relati al ruolo dei lipidi in un tessuto, quello nervoso, in cui la loro presenza anatomica e funzionale è preponderante. Probabilmente, la prossima ed imminente introduzione in terapia di farmaci, derivati dagli endocannabinoidi, molecole lipidiche, con specifici effetti di modulazione neuronale, riporterà l’attenzione di molti clinici e ricercatori, sul possibile ruolo svolto dalle membrane fosfolipidiche e dalla loro complessa fisiopatologia nell’etiopatogenesi di molti e diversi quadri psicopatologici. I fosfolipidi di membrana svolgono un ruolo essenziale, nel regolare il potenziale d’azione, la trasduzione dei segnali a livello sinaptico ed i complessi meccanismi dell’eccitazione o dell’inibizione neuronale. I canali di membrana, i recettori, i trasportatori e molte altre proteine di membrana sono, direttamente o indirettamente, influenzati dalla membrana fosfolipidica, in cui sono funzionalmente immersi. L’attività fisiologica di molte di queste molecole è regolata dalla fosforilazione proteica, per l’azione svolta da una classe d’enzimi denominata proteinkinasi. Gli effetti benefici, spesso sovrapponibili, d’alcuni antipsicotici atipici, d’alcuni antidepressivi e d’alcuni anticonvulsivanti, ma anche degli acidi grassi Omega-3 e d’alcuni cannabinoidi, potrebbero avere un loro importante e comune meccanismo d’azione negli effetti indotti sulle proteinchinasi, con conseguenti adattamenti morfo-funzionali delle membrane neuronali. Questi cambiamenti potrebbero aiutare la cellula a mantenere una condizione di relativa omeostasi eccitatoria. Ciò renderebbe ragione, inoltre, degli effetti di tipo neuroprotettivo esercitati da queste diverse sostanze. Un meccanismo d’azione comune, di questo genere, potrebbe giustificare, inoltre, l’efficacia di queste sostanze in condizioni cliniche e psicopatologiche relativamente distanti tra loro sul piano nosografico e patologico, quali demenze, schizofrenia, disturbi dell’umore e malattie cerebrovascolari. E’ verosimile che il vasto spettro dei disordini psichiatrici correlabili alla carenza di Omega-3 possa trovare, in futuro, un’interpretazione meno dietetica e più correttamente genetica, in rapporto agli enzimi coinvolti nel metabolismo degli acidi grassi, ma anche in rapporto ai complessi aspetti strutturali e funzionali propri da questi composti, a livello neurobiologico, nelle varie strutture citoplasmatiche e di membrana del tessuto nervoso. Gli effetti degli Omega-3 nella prevenzione e nel controllo della sindrome metabolica, aggravata dall’uso d’antipsicotici atipici, sono probabilmente mediati dall’attività di fattori di trascrizione e dall’espressione di geni coinvolti nella sintesi e nell’ossidazione lipidica. Numerosi altri effetti degli Omega-3 possono contribuire a ridurre la pericolosità clinica della sindrome metabolica quali la modulazione dell’infiammazione, l’attività esercitata sull’aggregazione piastrinica e sulla funzione endoteliale, nonché sulla pressione arteriosa. Gli studi di comparazione degli effetti sulla SM dei due principali Omega-3 sono molto limitati. E', tuttavia, ipotizzabile che il DHA sia efficace tanto quanto l’EPA nella correzione di numerosi fattori di rischio. Alla luce di quanto detto si può concludere con la considerazione che a livello biologico e soprattutto a livello biochimico e cellulare non esiste alcuna distanza tra psichiatria e neurologia e, ancor più, tra psichiatria e medicina e che l’assunzione del DHA e EPA possa costituire un positivo approccio biologico a diverse patologie. ITALCHIMICI 33 Krilling D Manuale Uso Interno ADHD - Sindrome da deficit di attenzione e iperattività ADHD (Attention/Deficit/HyperactivityDisorder), o più semplicemente ADD (Attention Deficit Disorder), è la sigla della sindrome da deficit di attenzione e iperattività. Il Disturbo da deficit d'attenzione ed iperattività (ADHD) è un disturbo neuropsichiatrico caratterizzato da inattenzione, impulsività ed iperattività motoria che rende difficoltoso ed in taluni casi impedisce il normale sviluppo e l’integrazione sociale dei bambini. Si tratta di un disturbo eterogeneo, complesso e multifattoriale che nel 70-80% dei casi coesiste con un altro o altri disturbi (fenomeno definito comorbilità). La coesistenza di più disturbi aggrava la sintomatologia rendendo complessa sia la diagnosi sia la terapia. Quelli più frequentemente associati sono il disturbo oppositivo-provocatorio ed i disturbi della condotta, i disturbi specifici dell'apprendimento (dislessia, disgrafia, etc.), i disturbi d'ansia e, con minore frequenza, la depressione, il disturbo ossessivo-compulsivo, il disturbo da tic, il disturbo bipolare. Per il trattamento di alcuni pazienti iperattivi e con deficit d'attenzione si sono rivelate efficaci alcune molecole psicoattive come il metilfenidato. Ma critiche sono piovute sull'uso di questi medicinali, i quali sono stati ritenuti responsabili di diversi casi di morte (infarto, suicidio, ecc.). Queste critiche hanno portato in Italia alla nascita di due campagne, una con funzioni di farmacovigilanza denominata "giù le mani dai bambini", la seconda con funzioni d’informazione sul rischio farmaci è denominata "perché non accada". La tesi della malattia Secondo la maggior parte dei ricercatori e sulla base degli studi degli ultimi quarant'anni il disturbo si ritiene abbia una causa genetica e sia anche legato a fattori morfologici cerebrali, fattori prenatali e perinatali, fattori traumatici. Tale tesi è contestata da chi sostiene che, ad oggi, nessun fenotipo (marcatore biologico) è stato individuato per l'ADHD, ed alcuna prova definitiva è stata fornita circa la tesi dell'origine genetica della sindrome. In molti casi si registra una remissione spontanea dei sintomi con l'avanzare dell'età del soggetto, anche in pazienti non sottoposti a terapia farmacologica. Sindrome Secondo altri la sindrome da iperattività non è una malattia, secondo il dott. Fred Baughman, neurologo infantile e membro dell'American Academy of Neurology: «… La "psichiatria biologica" in quarant’anni non ha mai confermato l'esistenza di “anomalie”, "squilibri chimici" o disturbi "neurologici", "biologici" o "genetici" in una sola delle sue diagnosi o delle condizioni di cui afferma l'esistenza ». Tale tesi è sostenuta anche da una parte significativa della comunità scientifica italiana: la Prof. Emilia Costa (1° Cattedra di Psichiatria dell'Università "La Sapienza" di Roma) afferma infatti che "tale diagnosi (di ADHD,) è inconsistente e vaga, e così come viene proposta ad oggi non andrebbe fatta". Tale posizioni sono confutate da molte società scientifiche. Problemi relazionali Per quanto riguarda i problemi relazionali, i genitori, gli insegnanti e gli stessi coetanei concordano che i bambini con ADHD hanno anche problemi nelle relazioni interpersonali. Vari studi di tipo sociometrico hanno confermato che bambini affetti da deficit di attenzione con o senza iperattività: ricevono minori apprezzamenti e maggiori rifiuti dai loro compagni di scuola o di gioco; pronunciano un numero di frasi negative nei confronti dei loro compagni dieci volte superiori rispetto agli altri; presentano un comportamento aggressivo tre volte superiore; non rispettano o non riescono a rispettare le regole di comportamento in gruppo e nel gioco; laddove il bambino con ADHD assume un ruolo attivo riesce ad essere collaborante, cooperativo e volto al mantenimento delle relazioni di amicizia, laddove, invece, il loro ruolo diventa passivo e non ben definito, essi diventano più contestatori e incapaci di comunicare proficuamente con i coetanei. ITALCHIMICI 34 Krilling D Manuale Uso Interno Trattamento sintomatico e controversie alla cura farmacologica Il trattamento sintomatico più impiegato per il trattamento dell'ADHD è il metilfenidato, un'anfetamina, ma esiste un forte dibattito all'interno degli stessi psichiatri sull'uso di queste sostanze stimolanti in bambini che sono iperattivi. In effetti, le linee-guida tendono a riconoscere l'utilità di integrare interventi educativi, psicologici, di supporto famigliare e - solo se realmente necessario - anche farmacologico. Il ricorso agli psicofarmaci deve «rappresentare l'extrema ratio e comunque una strada assolutamente da evitare in età giovanile. Molto meglio può fare l'attenzione della famiglia ». L'atteggiamento di esperti del settore, sottolinea l'utilità di approcciarsi ai farmaci in maniera corretta, senza "idealizzarli" (e quindi abusarne inutilmente), ma senza nemmeno "demonizzarli" (e quindi usandoli, in maniera consapevole e corretta, quando realmente necessari). Un recente "warning" della Food and Drug Administration ha indicato come potenziali effetti collaterali per l'assunzione a normale dosaggio terapeutico di questo tipo di psicofarmaci il leggero aumento di rischi sanitari, quali il rischio di ictus, l'insorgenza di crisi maniaco-depressive, o, in casi eccezionali ed in presenza di gravissimi fattori predisponenti, la morte improvvisa per arresto cardiaco. Esistono campagne, dal nome eloquente, "Giù le Mani dai Bambini", che criticano l'uso del metilfenidato in età evolutiva. Il progetto è supportato da diversi anni da alcune associazioni dell'ambito antipsichiatrico, associazioni di promozione sociale, cooperative, etc. ed ha goduto dell'appoggio di diversi "media" e di personalità del mondo dello spettacolo e della cultura. L’ Istituto Superiore di Sanità ha quindi costituito, per garantire una corretta informazione sanitaria ai genitori ed agli insegnanti dei bambini affetti da ADHD, un ricco sito informativo, con sezioni di approfondimento su tutti i temi relativi. Anche le Associazioni dei genitori di bambini con ADHD hanno messo online materiale informativo di merito, spesso in reazione alle informazioni imprecise fatte circolare dai gruppi antipsichiatrici. L'associazione delle famiglie con figli ADHD, l'AIFA, si occupa di dare supporto alle famiglie. Si tratta di una Onlus senza influenze religiose o economiche, composta da genitori che hanno come unico interesse quello di curare i propri figli. AIDAI, Associazione Italiana Disturbi dell'Attenzione ed Iperattività: La terapia dei bambini affetti da ADHD è quasi sempre figlia di un percorso interdisciplinare, che unisce le figure del Neuropsichiatra Infantile, del Pediatra e dello Psicologo dello Sviluppo da un punto di vista clinico, e di pedagogisti, educatori ed insegnanti da un punto di vista formativo. Fondamentale è sempre il coinvolgimento attivo della famiglia. Con un buon progetto di trattamento ed in presenza di un "buon gioco di squadra" tra queste figure, è molte volte possibile ottenere buoni risultati terapeutici anche senza l'ausilio dei farmaci. Il Manuale Diagnostico dei Disturbi Mentali (Diagnostical and Statistical Manual) dell'Associazione Psichiatrica Americana (APA) è un riferimento basilare, criticato per un conflitto d'interesse di alcuni autori che nello stesso tempo erano consulenti o ricercatori alle dipendenze di case farmaceutiche. L'ADHD, secondo i critici, sarebbe in questo senso una delle tante sindromi scoperte e introdotte nel prontuario negli ultimi 50 anni. Secondo questa critica sarebbe un disturbo senza una sintomatologia chiara e univoca, diagnosticabile a "piacere", elaborata ad inizi del secolo scorso e ripresa negli anni '80 per creare un nuovo mercato di farmaci. Ormai nella classe medica si è sviluppata una sensibilità alla questione tale da portare a porre tali diagnosi con molta attenzione, solo davanti a riscontri clinici evidenti. Al tempo stesso, la differenza tra "uso" ed "abuso" degli psicofarmaci, soprattutto in età evolutiva, è ben nota ai neuropsichiatri infantili, che sulla questione pongono ormai particolare attenzione. ITALCHIMICI 35 Krilling D Manuale Uso Interno Principali caratteristiche del problema Il Disturbo da Deficit di Attenzione/Iperattività, o ADHD, è un disturbo evolutivo dell’autocontrollo. Esso include difficoltà di attenzione e concentrazione, di controllo degli impulsi e del livello di attività. Questi problemi derivano sostanzialmente dall’incapacità del bambino di regolare il proprio comportamento in funzione del trascorrere del tempo, degli obiettivi da raggiungere e delle richieste dell’ambiente. E’ bene precisare che l’ADHD non è una normale fase di crescita che ogni bambino deve superare, non è nemmeno il risultato di una disciplina educativa inefficace, e tanto meno non è un problema dovuto alla «cattiveria» del bambino. L’ADHD è un vero problema, per l’individuo stesso, per la famiglia e per la scuola, e spesso rappresenta un ostacolo nel conseguimento degli obiettivi personali. E’ un problema che genera sconforto e stress nei genitori e negli insegnanti che si trovano impreparati nella gestione del comportamento del bambino. Sicuramente i genitori sono abituati a vedere come le altre persone reagiscono al comportamento del bambino iperattivo: all’inizio, gli estranei tendono ad ignorare il comportamento irrequieto, le frequenti interruzioni durante i discorsi degli adulti e l’infrazione alle comuni regoli sociali. Di fronte alle ripetute manifestazioni dell’assenza di controllo comportamentale del bambino, queste persone tentano di porre loro stesse un freno all’eccessiva “esuberanza”, non riuscendoci, concludono che il bambino sia intenzionalmente maleducato e distruttivo. Forse i genitori sono anche abituati alle conclusioni a cui gli estranei giungono, come ad esempio: «I problemi di quel bambino sono dovuti al modo in cui è stato educato; sarebbe necessaria una maggiore disciplina, maggiori limitazioni e anche qualche bella punizione. I suoi genitori sono incapaci, incuranti, eccessivamente tolleranti e permissivi, e quel bambino è il frutto della loro inefficienza». Se da un lato diventa necessario fare qualcosa per gestire il comportamento di questi bambini, è anche vero, d’altro canto, che diventa urgente far capire agli altri adulti quale sia la reale natura del problema dell’iperattività. E’ necessario che tutte le persone, che interagiscono con i bambini con ADHD, sappiamo vedere e capire le motivazioni delle manifestazioni comportamentali di questi ragazzini, mettendo da parte le assurde e ingiustificate spiegazioni volte ad accusare e ferire i loro genitori, già tanto preoccupati e stressati per questa situazione. Innanzitutto è necessario scoprire se il bambino, abbia veramente un Disturbo da Deficit di Attenzione/Iperattività (ADHD) oppure se sia semplicemente irrequieto e con la testa tra le nuvole. Nessuna persona, che non sia uno, si deve sentire autorizzata a decidere se quel bambino presenta o meno un ADHD. Numerose recenti ricerche hanno dimostrato che gli acidi grassi essenziali offrono un valido aiuto nei casi di ADHD, dislessia e disprassia. Un’interessante rassegna di A. J. Richardson riassume la storia dell’impiego degli Omega-3 nel trattamento delle difficoltà d’apprendimento nei bambini. Oltre vent'anni fa, un gruppo di ricercatori inglesi di sostegno ai bambini iperattivi aveva notato un legame diretto fra la carenza di acidi grassi essenziali e l'ADHD (Attention Deficit and Hyperactivity Disorder ossia disturbi da deficit di attenzione legati all'iperattività). I primi studi effettuati prevedevano l’utilizzo di una fonte ricca di acido gamma-linolenico (Omega-6 GLA, presente nell'olio di enagra o di borragine), ma, anche nel migliore dei casi, questo trattamento dimostrava un’efficacia del tutto marginale. ITALCHIMICI 36 Krilling D Manuale Uso Interno Anche il successivo impiego dell'acido decosaesaenoico (Omega-3 DHA) a basse dosi non rivelò effetti particolarmente benefici. Più di recente uno studio condotto da Stevens et al. alla Purdue University sui bambini iperattivi ha ampiamente dimostrato che un’integrazione a base di una miscela di acido eicosapentaenoico (Omega-3 EPA), acido decosaesaenoico (Omega-3 DHA) e gamma linolenico (omega-6 GLA) porta a un graduale ma significativo miglioramento dei problemi comportamentali e delle difficoltà di attenzione. Un altro studio condotto da Puri e Richardson dell'università di Oxford ha preso in esame gli effetti di una integrazione con EPA, DHA e GLA in bambini dislessici affetti da ADHD. I ricercatori hanno trovato anche in tal caso un netto miglioramento delle problematiche connesse a questa patologia con benefici cognitivi e comportamentali significativi. Il ruolo dell'acido eicosapentaenoico (EPA) Il successo ottenuto nel controllo dei sintomi di adulti depressi e schizofrenici con l'utilizzo di acido eicosapentaenoico (EPA) (17) ha spronato diversi ricercatori ad esaminare il ruolo degli acidi grassi nei disturbi comportamentali dei bambini utilizzando solo EPA come componente principale dei trattamenti suppletivi. Vi sono diverse evidenze sperimentali a favore dell'EPA come composto chiave nel trattamento di questa condizione. Questo è supportato dal fatto che un trattamento a base di DHA o DHA insieme ad altri Omega-6 non ha provocato miglioramenti comportamentali paragonabili a quelli ottenuti dalle miscele contenenti anche EPA Tuttavia l’associazione di acidi grassi essenziali EPA e DHA, con prevalenza di EPA, sembra offrire i migliori risultati. Uno studio in larga scala pubblicato nel 2005, l'Oxford Durham study, relativo a bambini affetti da disturbi comportamentali diagnosticati, ha dimostrato un netto miglioramento delle capacità di lettura, di scrittura e degli altri sintomi legati a stati di ADHD grazie alla integrazione della dieta con una miscela di acidi grassi composti da EPA, DHA e GLA. Conclusioni In conclusione si può affermare che ulteriori ricerche sono necessarie per definire con precisione il ruolo degli acidi grassi poli-insaturi sulle abilità cognitive dei bambini. Di certo è che i risultati ottenuti finora, con specifiche formulazioni, sono molto incoraggianti. ITALCHIMICI 37 Krilling D Manuale Uso Interno ADHD: numeri e statistiche - 1, il Registro Nazionale Italiano dove sono "schedati" i bimbi in terapia a base di psicofarmaci per la Sindrome da Iperattività e Deficit di Attenzione. - 8.103.000, i minori in età pediatrica in Italia, tra 0 e 14 anni (fonte: ISTAT) - 9% (pari a 730.000 unità), la percentuale di minori italiani che soffrirebbero di disagi o turbe mentali secondo i risultati del progetto di screening PRISMA 2004 (fonte: Ministero per la Salute) - 2% (pari a 170.000 unità), la percentuale di minori italiani che soffrirebbero della Sindrome da Iperattività e Deficit di Attenzione secondo i risultati del progetto di screening PRISMA 2004 (fonte: Ministero per la Salute) - 4% (pari a 340.000 unità), la percentuale di minori italiani che soffrirebbero della Sindrome da Iperattività e Deficit di Attenzione secondo le associazioni scientifiche (fonte: Società Italiana di Neuropsichiatria Infantile, Kataweb) - 11, le molecole antidepressive in uso in età pediatrica la cui somministrazione è stata recentemente interdetta in quanto ispiravano idee suicidarie nei bambini (fonte: EMEA, Agenzia Europea per il Farmaco) - 30.000, i bambini Italiani che ogni giorno assumono antidepressivi che inducono potenzialmente al suicidio, la cui somministrazione è stata interdetta dall'Agenzia Europea del Farmaco (fonte: Istituto Mario Negri di Milano) - 1 anno, il ritardo del Ministero della Salute Italiano nel dare riscontro ai primi "warning" sulla somministrazione di molecole antidepressive ai minori - 25%, il numero di giovani pazienti che hanno dimostrato difficoltà ad interrompere l'assunzione e dipendenza da molecole antidepressive (fonte: Ufficio studi Glaxo) - 173, il numero di autorevoli ricerche scientifiche universitarie già tradotte in italiano che mettono in allarme circa i rischi della somministrazione di psicofarmaci ai minori - 20, almeno uno per ogni regione, il numero dei Centri regionali per la somministrazione di psicofarmaci ai minori che sono stati attivati sul territorio italiano (fonte: Istituto Superiore di Sanità, Ministero per la Salute) - 12 il numero di Centri Regionali per la somministrazione di psicofarmaci ai minori attivati nella sola Regione Veneto (fonte: delibera di Giunta Regione Veneto sezione Ricerca Scientifica, area Centri ADHD) - 1.129 i bambini con ADHD seguiti nel 2011 nei 18 centri Lombardi. Di questi il 31% (350 bambini) è stato trattato con psicofarmaci. Nei centri afferisce solo una parte dei bambini, i più complessi, altrettanti, se non il doppio, sono seguiti nelle strutture di neuropsichiatria infantile nel territorio. (report Mario Negri 2012 dott. Bonati d.ssa Costantini) - 73.043.500, il numero di bambini ed adolescenti (0-18 anni) negli Stati Uniti (fonte: U.S. Census Bureau) - 11.000.000, i minori che ogni anno utilizzano psicofarmaci (per tutte le patologie) negli Stati Uniti (fonte: NIMH, Nexus, Los Angeles Times) - 20.000.000, il numero di ricette in USA ogni anno per soli psicofarmaci di tipo stimolante ai bambini (fonte: British Medical Journal, Nexus) - 10%, la percentuale della popolazione infantile USA che soffrirebbe dell'ADHD (fonte:International Narcotics Control Board, OMS) - 27% - 6%, la differente incidenza percentuale dei disturbi del comportamento in USA rispettivamente nei minori delle classi sociali a basso reddito e nei minori delle classi sociali agiate (fonte: NIMH, USA) - 2 miliardi di dollari, il giro d'affari per la vendita del solo metilfenidato, (Ritalin) negli Stati Uniti (fonte: DEA USA) - 3 il numero di mesi dopo i quali sono state rilevate alterazioni genetiche (triplicate le anormalità cromosomiche) nei bambini sottoposti a terapia con farmaci per l'ADHD (fonte: Università del Texas) - 12% i bambini che ricevono psicofarmaci già alle scuole elementari in Francia (fonte: Ministere de la Santè) ITALCHIMICI 38 Krilling D Manuale Uso Interno La vitamina D La vitamina D, notoriamente conosciuta come "vitamina del calcio e della luce” non è una vera vitamina, ma un ormone, " l’ormone steroideo dell’omeostasi del calcio ", dal momento che la maggior parte di essa è prodotta dal nostro organismo, in rapporto all’esposizione della pelle al sole. E’ noto, infatti, che la carenza di vitamina D provoca rachitismo nei bambini e può provocare osteoporosi e fratture ossee nei pazienti adulti. Oltre al suo ruolo nel mantenimento della salute delle ossa, la vitamina D è coinvolta nella differenziazione di tessuti durante lo sviluppo e nel corretto funzionamento del sistema immunitario. Evidenze scientifiche, in costante e continuo incremento, suggeriscono un ruolo benefico della vitamina D nella protezione contro le malattie autoimmuni, tra cui sclerosi multipla e diabete tipo I, così come verso alcune forme di cancro, in particolare del colon-retto e della mammella. Ad oggi vi è un incrementato interesse sul ruolo della vitamina D non solo per la sua azione sul metabolismo osseo o sull’omeostasi del calcio, ma anche per i suoi effetti immunomodulatori. Recentemente, infatti, è stato osservato sia un’alterazione a livello mondiale delle abitudini alimentari che ne determinano un deficit nutrizionale, sia un aumentato interesse sugli effetti non ormonali della vitamina D e sulla sua azione paracrina, oltre che la sua azione immunomodulatrice. Una stima delle citazioni annuali sulle emergenti funzioni della vitamina D publicate su PubMed ha riportato un numero di pubblicazioni pari approssimativamente a 4.800, se consideriamo il periodo tra Maggio 2008 e Maggio 2009, con stime superiori nell’anno 2010-2011 e con un 15% circa d’incremento d’interesse rispetto gli anni precedenti. La recente letteratura ha evidenziato che il deficit di vitamina D nei primi anni di vita si associa ad aumentato rischio di successivo sviluppo di malattie autoimmuni, atopiche ed infettive. Anche il difetto di vitamina D durante la vita fetale può avere conseguenze persistenti per l’organismo, dato che essa è responsabile del controllo dell’espressione genica di almeno 3% di tutto il nostro patrimonio genetico. Proprio per le sue proprietà immunomodulatrici emergenti, la vitamina D gioca un ruolo fondamentale sulle funzioni dell’intero organismo che vanno ben oltre la semplice omeostasi scheletrica. Vitamina D: sintesi La maggior fonte di vitamina D negli uomini è l’epidermide. La vitamina D3 è prodotta dalla pelle mediante reazioni UVB mediate, fotolitiche e non enzimatiche, che convertono il 7-deidrocolesterolo in provitamina D3. Tale forma di vitamina D va incontro a successive reazioni non-enzimatiche e ad isomerizzazione termica e conversione in vitamina D3, reazioni che avvengono anche a livello epidermico. Dalla cute, la vitamina D viene immessa nel circolo generale. A livello epatico, essa è convertita in 25-idrossi vitamina D (25OHD), detta anche 25(OH)colecalciferolo o calcidiolo, da uno o più citocromi altamente specifici denominati citocromi P450s e dall’enzima 25-idrossilasi. La 25OHD a livello renale, viene in seguito convertita dall’enzima 1,25 idrossilasi in D3, detta anche 1,25(OH)2 colecalciferolo o calcitriolo o D3, la forma biologicamente attiva della vitamina, che aumenta il riassorbimento del calcio a livello intestinale e osseo. La produzione di D3 nel rene è stimolata dal paratormone (PTH) e da bassi livelli di calcio e fosforo. Inoltre, la D3 regola negativamente i suoi stessi livelli nel siero, inducendo l’enzima CYP24A (25-24 idrossilasi), che metabolizza sia la D3 che la 25OHD (Figura 1). ITALCHIMICI 39 Krilling D Manuale Uso Interno Figura 1: rappresentazione schematica della foto produzione e del metabolismo della vitamina D e dei vari effetti biologici del metabolita attivo D3 sul metabolismo del calcio, del fosforo e dell’osso (Holick MF, Nutr Rev 2008). Deficit di Vitamina D Cambiamenti nel metabolismo ormonale della vitamina D e nella sua modalità d’azione avvengono improvvisamente quando l’ospite di origine umana deve mantenere l’omeostasi calcemica a fronte di uno stato di insufficienza o carenza di vitamina D ed una riduzione dell’assorbimento del calcio a livello intestinale. Un insufficiente assorbimento di calcio a livello intestinale provoca un lieve ma reale decremento dei livelli di calcemia. Tale decremento viene recepito dai recettori calcio-sensibili diffusi nelle membrane plasmatiche delle cellule delle paratiroidi, stimolando quest’ ultime a rilasciare paratormone (PTH) e ad incrementare l’espressione genica delle molecole coinvolte nella produzione di PTH. L’interazione del PTH con i rispettivi recettori (PTH/PTHrP), siti nelle membrane plasmatiche delle cellule epiteliali del tubulo renale prossimale, stimola l’incremento del gene per l’espressione dell’enzima CYP27B1 e la conversione del substrato disponibile di 25OHD a D3, metabolita attivo della vitamina D. Quest’ultimo viene immesso in circolo e trasportato da una proteina serica specifica, ed in seguito prende contatto con i relativi recettori nelle regioni Vitamina D-responsive, stimolando l’espressione di geni sensibili all’azione della vitamina stessa. L’eterodimero attivo, infatti, si lega a specifiche sequenze geniche denominate “elementi di risposta alla Vitamina D” (VDREs) e tale legame si accompagna alla formazione di complessi di grandi dimensioni che possono facilitare l’espressione del gene bersaglio (co-attivatori) o inibirne l’espressione (co-espressori). Tale interazione determina: incremento dell’assorbimento intestinale di calcio e fosforo; liberazione di calcio e fosforo dalla fase minerale dell’osso, con immissione degli stessi elementi in circolo. Quando il deficit di calcio sierico è corretto, l’asse D3 e PTH è in seguito down-regolato dal FGF 23 rilasciato dal tessuto osseo. A seguito di un’analisi dettagliata dei meccanismi fisiologici sopra descritti, Chapey e coll. per primi ed ulteriori autori della letteratura internazionale hanno concordato che la definizione di insufficienza di vitamina D deve tener conto del significativo incremento dei livelli sierici di PTH immunoreattivo (iPTH). ITALCHIMICI 40 Krilling D Manuale Uso Interno Attualmente, vi è un consenso generale nel considerare che l’incremento significativo del iPTH inizia quando le concentrazioni di D3 raggiungono livelli inferiori a 30 ng/ml o 75 nmol/lt; valori di 25(OH)2D tra i 30 ng/ml o 75 nmol/lt e 20 ng/ml o 50 nmol/lt sono considerati come espressione di insufficienza di vitamina D, mentre valori inferiori a 20 ng/ml o 50 nmol/lt vengono considerati espressione di franco deficit di vitamina D. In genere sono questi i valori di vitamina D sottoposti a valutazione clinica per effetti scheletrici apparenti Tabella 1: concentrazioni di vitamina D ottimali e concentrazioni riferibili a deficit della stessa vitamina e ad intossicazione Concentrazione di riferimento Concentrazione desiderabile Deficit di vitamina D Concentrazioni da intossicazione 20-100 ng/ml 30-60 ng/ml <20 ng/ml >150 ng/ml (Rovner, Arch Pediatr Adolesc Med. 2008;162:513-519; Bikle Trends Endocrinol Metab 2010;21(6):375-84). Considerando tale definizione di deficit di vitamina D 3, secondo lo studio di Saintoge, la prevalenza del deficit di D3 è aumentata dal 2 al 14%, con un rischio maggiore per i soggetti in sovrappeso ed un rischio doppio per le femmine rispetto ai maschi. Azione immunomodulatrice della Vitamina D Vitamina D ed immunità innata Nel 1986 Rook e coll. descrissero degli studi su macrofagi umani in coltura in cui dimostrarono che il metabolita D3 inibiva la crescita di Mycobacterium tuberculosis. Nonostante tale studio sia stato ampiamente citato, solo da circa due anni si ha una migliore comprensione dell’attività antimicrobica della vitamina D3. Nel primo di questi recenti studi, l’analisi genomica per identificare le cellule target del metabolita D3 dimostrò la presenza di vitamine D response elements (VDREs) nel promotore dei geni per la catelicidina, proteina appartenente alla classe degli agenti antimicrobici denominati “defensine”. Ulteriori studi confermarono l’abilità della D3 nell’induzione dell’espressione delle catelicidine in cellule della linea mieloide, della linea bronchiale epiteliale, ed in cheratinociti (Figura 2). Figura 2: Metabolismo della vitamina D e del suo metabolita attivo, D3, nell’azione di modulazione dell’immunità innata. ITALCHIMICI 41 Krilling D Manuale Uso Interno Significativamente, anche il report di Weber et al. indicava una possibile induzione delle catelicidine da parte della 25OHD, sottolineando il potenziale dell’induzione autocrina nella risposta antimicrobica delle cellule che esprimono enzimi attivati dalla vitamina D, quali CYP27B. Sebbene tale enzima possa essere identificato in diversi tipi cellulari, esso sembra svolgere una funzione significativa dipendente da stimolazioni cellulo-specifiche. Tale effetto è meglio illustrato da studi che hanno dimostrato un incremento del metabolismo della vitamina D e della sensibilizzazione all’ D3 in cellule esposte a stimoli patogeni. Il riconoscimento e la risposta verso un pattern di molecole associate a stimoli patogeni (pathogens activated molecule patterns- PAMPs), strutturate nel patogeno medesimo e capaci di stimolare il sistema immune innato, sono mediate da un ampio spettro di proteine di immunosorveglianaza quali i Toll-like Receptors (TLRs). Per chiarire la risposta immune innata al M. tuberculosis, Liu e colleghi utilizzarono un’analisi di DNA array che dimostrò dei cambiamenti nell’espressione genica a seguito di attivazione macrofagica del TLR2 causata da uno dei recettori transmembana di riconoscimento del patogeno (trans membrane pathogen-recognition receptors- PRRs) per il M. tuberculosis. A tal proposito, macrofagi di origine umana trattati con lipoproteine micobatteriche di 19 kDa, interagenti con i TLR2 sensibili ai pattern molecolari associati al patogeno, mostravano un incremento del CYP27B e dei VDREs, confermando un’induzione autocrina delle catelicidine e dell’uccisione batterica in risposta alla 25OHD. L’importanza di tale meccanismo come parte della risposta alle infezioni dell’immunità innata è stato confermato da esperimenti che hanno dimostrato la modulazione D3 mediata dell’espressione di catelicidina nei monociti esposti a M. tuberculosis. Sebbene tale studio dimostrò che la D3 è anche capace di indurre altri fattori associati all’uccisione batterica, quali l’ossido nitrico sintetasi (NOS), gli autori conclusero che l’attivazione di catelicidina è la via più importante mediante la quale la vitamina D interagisce con il sistema immune innato. Nonostante la crescente conoscenza del meccanismo d’interazione tra vitamina D ed immunità innata, negli ultimi anni sono emerse delle domande ancora irrisolte. Il meccanismo molecolare sottostante l’induzione TLR2-mediata dell’enzima CYP27B non è ancora chiaro. Forse la domanda maggiormente pertinente che insorge da questi studi sull’immunità innata riguarda il vantaggio biologico nell’uso di vie vitamina-D-mediate nell’uccisione batterica. Una possibile spiegazione sta nel fatto che l’D3, sintetizzata localmente da cellule quali i macrofagi, supporta l’immunità dell’ospite mediante l’incremento dell’espressione di defensine quali la catelicidina che sono routinariamente soppresse da patogeni specifici. Per esempio, le infezioni da Shigella di macrofagi e cellule epiteliali inibiscono l’espressione di catelicidine e di defensine-beta-1 umane come parte di un meccanismo apparente per evadere l’azione antibatterica dell’immunità innata. In queste circostanze, l’incremento della sintesi locale di D3 potrebbe agire come cursore dell’espressione di catelicidina e quindi mantenere la sorveglianza antibatterica. L’immunità vitamina-D mediata ha anche benefici nel potenziale feedback di controllo della stessa via di mediazione, agendo come limite della stessa attività antibatterica, prevenendo così un potenziale danno infiammatorio a seguito di un’attivazione eccessiva del sistema immune. Recenti studi hanno dimostrato che l’D3 può indurre ipo-responsività alle PAMPs mediante down regolazione dei TLR2 e TLR4 nei monociti. In parallelo con l’induzione di agenti antimicrobici, quali la catelicidina, la soppressione dell’espressione dei TLR potrebbe agire come limite alla risposta infiammatoria dei T linfociti che altrimenti potrebbe promuovere un’autoimmunità mediata dai linfociti T-helper 1 (Th1). La via vitamina-D mediata è essa stessa oggetto di regolazione feedback come conseguenza dell’espressione D3-mediata dell’enzima D3-24-idrossilasi (CYP24A), che catalizza la sintesi di metaboliti della vitamina D meno attivi. È interessante notare che l’attività dell’enzima CYP24A è virtualmente non dosabile nei macrofagi anche dopo trattamento con D3, principale stimolatore enzimatico. Invece, ulteriori studi hanno dimostrato che mentre la D3 prontamente stimola l’espressione di CYP24A nei macrofagi, non vi è alcun concomitante incremento nell’attività di questo enzima. Questo sembra essere dovuto all’induzione da parte della D3 di una forma variante dell’enzima (CYP24A-SV), ottenuta a seguito di splicing, caratterizzata da una sequenza protidica amino-terminale tronca nella quale la sequenza target mitocondriale è mancante. Sebbene tale variante sia prontamente capace di legare la 25OHD e/o la D3, è anche confinata nel citoplasma in uno stato metabolicamente inattivo e quindi sembrerebbe limitare l’eccessivo metabolismo della vitamina D, agendo da “buffer” citosolico per i suddetti metaboliti che altrimenti agirebbero come substrati per il CYP27B ed il CYP24A. Sulla base delle osservazioni precedentemente sottolineate, è possibile integrare il metabolismo della 25OHD con le risposte dei PRR ai PAMPS mediante meccanismo autocrino per incrementare l’uccisione batterica fagocitica, che avviene nelle cellule ospiti. ITALCHIMICI 42 Krilling D Manuale Uso Interno Tale meccanismo sembra avere un ruolo centrale nella risposta immune macrofago-mediata, ma non sembra essere esclusiva di tali cellule. Studi su cheratinociti hanno anche dimostrato l’induzione di catelicidina in risposta alla sintesi autocrina di D3. Così come avviene nei macrofagi, l’espressione del CYP27B nei cheratinociti può essere stimolata mediante il riconoscimento TLR2-mediato delle PAMPs, sebbene tale meccanismo richiede un’iniziale induzione dell’espressione di TLR2 (differentemente dai cheratinociti e dai macrofagi che esprimono il TLR2 costitutivamente). È interessante notare che la stessa D3 può svolgere l’azione suddetta, in contrasto alla soppressione dell’espressione di TLR2 nei macrofagi. Tali dati, quindi, pongono la domanda di come l’espressione del CYP27B nei cheratinociti possa essere presente anche in assenza di un segnale TLR2 costitutivo. La risposta sta nel fatto che la produzione di D3 da parte dei cheratinociti è anche stimolata da citochine quali il trasforming growth factor beta-1 e l’induzione di CYP27B mediante tale via alternativa sembra generare quantità sufficienti di D3 per regolare l’espressione di TLR2 da parte dei cheratinociti, i quali amplificano la produzione di catelicidina in modo simile a quello descritto per i macrofagi. Sulla cute umana, l’espressione di trasforming growth factor beta1 è strettamente associata alla riparazione di ferite, e quindi, la sua interazione vitamina D-mediata con la catelicidina sembra far parte di un meccanismo legato a tale riparazione, con incremento della sorveglianza immune. L’ampia applicabilità di tale meccanismo nell’incremento di D3 indotto dalla presenza di ferite, relativo alla presenza di siti barriera al di fuori della cute, non è ancora conosciuta, ed è interessante notare come le cellule del colon non riescono ad indurre la produzione di catelicidina in risposta all’incremento di D3. Le basi per la regolazione vitamina-D indotta dell’immunità innata nei cheratinociti richiede ancora ulteriori chiarimenti, soprattutto nell’induzione dell’espressione dei TLR mediata dalla D3. Una possibile spiegazione per tale regolazione nei cheratinociti potrebbe essere ricondotta al fatto che in tali cellule (a differenza di ciò che avviene nei macrofagi), si verifica una soppressione di CYP27B ed un’induzione di CYP24A in risposta alla D3, rendendosi quindi capaci di una regolazione più sensibile alla risposta alla vitamina D autocrina. Vitamina D ed immunità acquisita La presenza di VDREs nei linfociti umani è stata una delle prime osservazioni implicate nella risposta noncalciotropica della vitamina D. Il fatto che l’espressione di questi recettori avviene nei linfociti T e B attivati ha dato evidenza di un ruolo funzionale della vitamina D come modulatore del braccio dell’immunità acquisita. Riguardo i linfociti B, la capacità della D3 di sopprimere la proliferazione e la produzione di immunoglobuline fu inizialmente considerata un effetto indiretto della via mediata dai linfociti Th. Un report più recente ha, invece, dimostrato che la D3 esercita un effetto diretto sull’omeostasi dei linfociti B. Inoltre, a conferma dell’effetto diretto VDRE-mediato sulla proliferazione dei linfociti B e la produzione di immunoglobuline, tale studio evidenziò la capacità della D3 di inibire la differenziazione dei B linfociti in plasmacellule e linfociti B memoria, suggerendo un potenziale ruolo della vitamina D in patologie linfocita-B correlate, quali lupus eritematoso sistemico (LES). Gli autori di tale studio dimostrarono che i pazienti affetti da LES avevano livelli sierici di D3 significativamente più bassi rispetto ai controlli. La primaria funzione riconosciuta alla vitamina D nell’interazione con il sistema immune adattivo riguarda l’abilità della D3 di modulare la funzione e la proliferazione dei linfociti T. A seguito della dimostrazione della presenza di VDREs in linfociti T attivati e proliferanti, alcuni autori continuarono le ricerche dimostrando la presenza di una potente risposta antiproliferativa alla D3 in tali cellule. Tra i vari sottogruppi di linfociti T, i target principali della D3 sembrano essere proprio i linfociti Th. Studi iniziali dimostrarono che la D3 non solo agisce nella soppressione della proliferazione dei linfociti Th, ma modula anche la loro produzione di citochine quali IL-2. L’attivazione antigene-mediata di linfociti Th naive risulta nella genesi di linfociti Th0 pluripotenti che sintetizzano un ampio spettro di citochine, incluse IL-2, IL-4, IL-10 ed IFγ. I linfociti Th0 proliferanti sono inoltre capaci di differenziarsi in sottogruppi Th che esibiscono un profilo citochinico distinto Th1 (IL2, IFγ, TNFα -tumor necrosis factor-) e Th2 (IL-3, IL-4, IL-5, IL-10)), che rispettivamente supportano l’immunità cellulo-mediata ed umorale. Una proprietà chiave immuno-modulatrice della D3 è la sua capacità di inibire l’espressione di citochine Th2, aumentando l’espressione di citochine Th1, agendo sia direttamente sugli effetti dei linfociti T o indirettamente sugli effetti delle cellule presentanti l’antigene (APC). Il potente effetto della D3 nella promozione preferenziale dell’immunità cellulo-mediata di tipo Th1 piuttosto che su quella anticorpo-mediata di tipo Th2 è stato proposto come uno dei meccanismi chiave con cui la vitamina D può esercitare effetti benefici sulle patologie autoimmuni. Recenti studi hanno, comunque, mostrato che gli effetti della D3 sui linfociti sono molto più complessi ed includono la genesi di linfociti T regolatori CD4+ CD25+ (Treg). ITALCHIMICI 43 Krilling D Manuale Uso Interno Precedentemente riconosciute come cellule T soppressorie, secernenti IL-10, i linfociti Treg promuovono la tolleranza ad antigeni-self ed hanno quindi un ruolo chiave nelle patologie autoimmuni e nelle reazioni immuni di rigetto di trapianto. L’induzione dei Treg è pertanto un’azione benefica indotta dalla D3 tanto da essere proposta la sintesi di suoi analoghi nella promozione della tolleranza immune a seguito di trapianto d’organo. Sebbene l’abilità della D3 nel supportare la differenziazione delle cellule Treg potrebbe esercitare effetti diretti sui linfociti T, dati attuali suggeriscono che il più verosimile target immunologico della D3 sono proprio le cellule dendritiche (dendritic cells- DCs). Mediante la soppressione della maturazione delle cellule dendritiche e l’incremento della loro espressione di specifiche citochine quali IL-10, la D3 può migliorare la tolleranza attraverso la soppressione dello sviluppo dei linfociti Th e l’induzione dei linfociti Treg. Risposte DC simili potrebbero essere inoltre mediate dagli effetti della D3 sui fattori chemiotattici, quali il ligando di chemochine-CC (CCL) 22, che è secreto dalle cellule dendritiche che, come l’IL-10, supporta la genesi di Treg. È interessante notare che tali effetti tolerogenici della D3 sulle cellule presentanti l’antigene sembrano essere ristrette a specifiche classi di DCs riconosciute come DCs mieloidi. Tale classe di DCs esibisce un repertoire di PRR e di citochine differente da altre classi di DCs, riconosciute come DCs plasmacitoidi, e queste ultime sembrano non avere alcuna risposta tolerogenica alla D3. Nelle cellule dendritiche della classe mieloide, ma non plasmacitoidi, la D3 inibisce la segnalazione intracellulare di fattori nucleari quali il nuclear factor kB, suggerendo che tale via è cruciale per la funzione della vitamina D sulle cellule dendritiche. Il ruolo della vitamina D come coordinatore di altri fenotipi di linfociti T quali quelli secernenti l’IL-17 (linfociti Th17) non è stato completamente delucidato, ma è interessante notare che i topi diabetici non obesi (NOD), trattati con un analogo della D3, mostravano un decremento dell’espressione dell’IL-17. Recenti dati hanno dimostrato che la D3 può contribuire al processo di stimolazione dell’espressione di recettori delle chemochine-CC 10 da parte dei linfociti T (CCR), che riconoscono la chemochina CCL27 secreta dai cheratinociti. In tal modo, la D3 potrebbe supportare la traslocazione dei linfociti T sulla cute e/o la ritenzione di tali cellule nello stesso sito. In conclusione E’ oggi chiaro che la vitamina D ed i suoi metaboliti attivi agiscono a vari livelli del sistema immune, sia innato che adattivo, coinvolgendo le funzioni di plurimi gruppi cellulari appartenenti ai due sistemi, ed il suo ruolo sembra essere fondamentale nella gestione e nel controllo di patologie immuno-mediate. La vitamina D è cruciale per l'attivazione del nostro sistema immunitario: senza di essa, le cellule T non sono in grado di reagire e combattere le infezioni più gravi che minacciano l'organismo. E' quanto hanno scoperto alcuni ricercatori dell'Università di Copenhagen, in Danimarca. La maggior parte della vitamina D è prodotta naturalmente dall'esposizione della pelle al sole. È contenuta anche nell'olio di pesce, nelle uova di pesci grassi come salmone, aringhe e sgombro, nel Krill e può essere assunta consumando integratori dietetici. Non esistono studi definitivi per stabilire il dosaggio ottimale di vitamina D, anche se le attuali linee guida raccomandano di assumere una dose giornaliera compresa tra 25 e 50 microgrammi al giorno. Si stima inoltre che gran parte della popolazione abbia una bassa concentrazione sanguigna di questo importante elemento. Secondo il modello immunologico attuale, per poter proteggere il corpo dalla minaccia di virus e batteri le cellule T del sistema immunitario devono in primo luogo essere esposte a tracce dell'agente patogeno. Ciò avviene quando queste vengono "presentate" da altre cellule immunitarie dell'organismo, i macrofagi. Le cellule T si possono cosi legare al frammento e dividersi continuamente dando luogo a centinaia di copie identiche, tutte specializzate nel riconoscere e nel distruggere lo stesso agente esterno. "Quando una cellula T è esposta a un agente patogeno, espone un dispositivo di segnalazione noto come recettore per la vitamina D: ciò significa che la cellula T deve avere a disposizione la vitamina D, o l'attivazione cesserà. Se le cellule T non riescono a trovare sufficiente vitamina D nel sangue, non inizieranno mai ad attivarsi." Nel corso della ricerca, i cui risultati sono apparsi sull'ultimo numero della rivista Nature Immunology, i ricercatori danesi sono riusciti anche a tracciare la sequenza biochimica di trasformazione di una cellula T da inattiva ad attiva: ciò apre la strada alla possibilità di intervenire in diversi punti di tale cammino per modulare la risposta immunitaria. I risultati potrebbero rivelarsi preziosi in tutti gli studi che riguardano il sistema immunitario, dalla messa a punto di nuovi vaccini o di nuovi immunosoppressori per i trapiantati fino alla lotta alle malattie infettive e alle epidemie globali. ITALCHIMICI 44 Krilling D Manuale Uso Interno Vitamina D ed infezioni Ad oggi è chiaro che l’induzione del metabolismo extrarenale della vitamina D è un componente integrale della normale immunità TLR-mediata, e non semplicemente un fenomeno patologico associato a patologia infiammatoria o granulomatosa. La potente induzione della catelicidina antimicrobica e l’attività battericida associata in risposta alla 25OHD e alla D3 danno luogo ad una risposta localizzata cellulo-specifica, differente dalle classiche funzioni endocrine della vitamina D. L’efficacia di questo meccanismo autocrino come modulatore della risposta immune innata dipende, pertanto, da diversi fattori, inclusa la magnitudine della risposta al segnale PAMP-PRR. La regolazione del CYP27B e dei VDREs in risposta a specifiche infezioni, viene influenzata, a sua volta, da variazioni ereditate in uno o in entrambi tali geni. Un’altra variabile significativa che coinvolge sia il sistema endocrino, che paracrino ed autocrino è la disponibilità di substrato per la conversione enzimatica verso il prodotto attivo. Nel caso della vitamina D, la 25OHD non è solo il substrato dell’enzima CYP27B ma anche la forma della vitamina D maggiormente circolante. A conferma dell’importanza funzionale del metabolismo localizzato della 25OHD come determinante della normale immunità, gli studi di induzione della catelicidina hanno inoltre provveduto a dare il primo chiaro esempio di come variazioni dello status della vitamina D influenzano le risposte fisiologiche. A differenza delle concentrazioni sieriche di D3 che sono primariamente definite da regolatori endocrini dell’attività renale del CYP27B, i livelli circolanti di 25OHD costituiscono una riflessione diretta dello stato della vitamina D, che per ogni dato individuo dipende dall’assunzione di vitamina D sia tramite esposizione alla luce solare sia mediante l’assunzione con la dieta. Quindi, l’effetto diretto di tale metabolismo è che lo stato della vitamina D può variare significativamente nelle popolazioni come conseguenza di fattori geografici, sociali o economici. Ad oggi, il deficit di vitamina D è stato sempre considerato come l’unica conseguenza clinica significativa di tale variabilità. Le potenziali implicazioni di un deficit di vitamina D 3 fisiologica includono effetti sull’omeostati scheletrica, forza muscolare, rischio cancerogeno, patologie autoimmuni e cardiovascolari e patologie in gravidanza. Per ciò che concerne l’attività antibatterica innata della vitamina D, l’attenzione è stata focalizzata primariamente sulla potenziale protezione esercitata contro patologie infettive quali la tubercolosi. Studi clinici atti a determinare l’impatto dello stato di 25OHD e/o della terapia con vitamina D in soggetti affetti da tubercolosi non sono stati ancora condotti. Tuttavia, studi iniziali sugli effetti della 25OHD sulla funzionalità macrofagica in adulti sani hanno dimostrato che la supplementazione orale di una singola dose di 2.5 mg di vitamina D 3, presa prima della rimozione dei macrofagi dal test, potenzia l’attività dei macrofagi nel combattere l’infezione da bacillo di Calmette-Guérin (BCG) in vitro. In altri studi è stato proposto un ruolo fondamentale per la 25OHD nella diminuita contrazione d’infezioni delle vie aeree superiori. Tali osservazioni erano basate in parte su dati epidemiologici legati alle variazioni stagionali di vitamina D 3 ed in parte sulla stessa stagionalità delle infezioni respiratorie e dell’influenza. Studi clinici randomizzati hanno dimostrato gli effetti protettivi della vit. D3 contro raffreddore ed influenza. A differenza del modello descritto per la tubercolosi, un meccanismo mediante il quale la vitamina D può fronteggiare infezioni respiratorie dovute a virus influenzali non è stato ancora descritto. Dunque è ampio campo di speculazione che la vitamina D potrebbe costituire una nuova strategia per prevenire le infezioni respiratorie, anche se sono ancora necessari ulteriori studi per chiarirne la fisiopatologia nella prevenzione di tali infezioni. Vitamina D ed asma La scoperta che le cellule della maggior parte dei tessuti hanno un recettore per la vitamina D e che gran parte di esse possiede il complesso enzimatico per convertire la 25OHD circolante nella forma attiva, cioè nella D3, ha fornito nuove acquisizioni per conoscere meglio l’attività di questa vitamina. Di grande interesse è il suo ruolo nei processi di differenziazione cellulare e nelle patologie croniche, scheletriche, tumorali (cancro del colon-retto), cardiovascolari, autoimmuni, infettive e neurologiche. Numerose sono ormai anche le evidenze in letteratura che suggeriscono un suo possibile ruolo nella patogenesi dell’asma e conseguentemente sui potenziali effetti della carenza della medesima vitamina. È stato evidenziato recentemente come bassi livelli di vitamina D 3 siano associati ad un aumentato rischio di sviluppare patologie allergiche, iperreattività bronchiale ed asma. Le caratteristiche dell’infiammazione sono costituite da un aumentato numero di eosinofili, di mastociti, di macrofagi, di linfociti (Th2 nella fase acuta e Th1 nella fase cronica dell’asma) attivati dalla mucosa delle vie aeree e nel lume bronchiale. ITALCHIMICI 45 Krilling D Manuale Uso Interno Alla luce del rapporto inversamente proporzionale tra livelli sierici di vitamina D e rischio di sviluppare asma, alcuni autori suggeriscono il deficit di vitamina D come fattore predittivo fortemente significativo, insieme alla familiarità ed agli alti livelli sierici di IgE, nello sviluppo di asma allergico. D’altro canto esistono evidenze circa il ruolo benefico della vitamina D 3 sulla funzione polmonare e sulla risposta agli steroidi nel trattamento dell’asma. Uno studio ha dimostrato che l’aumento dei livelli ematici di vitamina D 3 si associa significativamente ad un miglioramento del FEV1 e ad un aumento dell’espressione del recettore MPK-1 (MAP chinasi-fosfatasi), enzima sfruttato dai glucocorticoidi, al fine di estrinsecare proprietà antiinfiammatorie. Le cellule epiteliali del polmone esprimono elevati livelli di base di 1 alfa-idrossilasi. Questo permette la conversione del calcidiolo inattivo al calcitriolo attivo localmente all’interno del polmone. Il calcitriolo inibisce, a livello delle cellule muscolari lisce dei bronchi, la sintesi ed il rilascio di determinate citochine, quali RANTES (una citochina che fa parte della superfamiglia della interleuchina-8), il fattore di crescita piastrinico e le metalloproteasi, favorendo la flogosi bronchiale e la proliferazione delle cellule muscolari lisce. Alcuni studi mostrano il coinvolgimento della Vitamina D 3 nella regolazione dei livelli di ossido nitrico a livello polmonare. Quest’ultima avviene sia in maniera indiretta, attraverso l’inibizione dell’espressione dell’enzima ossido nitrico sintetasi inducibile (iNOS) a livello del RNA-messaggero, sia in modo diretto, riducendo la produzione di NO da parte delle mast-cellule, dimostrando in modelli murini di prevenire lo sviluppo di asma allergico. D’altronde polimorfismi della vitamina D stanno guadagnando l’attenzione come causa d’insensibilità al trattamento supplementativo con vitamina D. VDR mappa sul cromosoma 12q, vicino alle regioni determinanti geneticamente l’asma. Ben sette sono i loci incriminati, tra questi quello più indagato è Apal. In conclusione si evince il ruolo regolatore della vitamina D sugli eventi che dominano la fase acuta e cronica dell’asma. Lavori recenti hanno evidenziato che, durante i processi di flogosi, il calcitriolo regola negativamente, con un processo paracrino ed attraverso il reclutamento ligando-indotto di deacetilasi istonica, l’espressione del fattore nucleare-kB, indispensabile sia per la differenziazione e maturazione di DC sia per innescare la risposta infiammatoria. Questo spiega l’effetto inibitorio dell’ormone attivo sulla maturazione di DC e sulla produzione di mediatori pro infiammatori. La vit. D3 ha effetti potenti e diretti anche sulla risposta cellulare B, determinando induzione di apoptosi ed inibizione della proliferazione, generazioni di cellule B memoria, differenziazione in plasmacellule e produzione di immunoglobuline. Pertanto è comprensibile come una carenza di vitamina D potrebbe essere associata ad un’incapacità di spegnere lo stato infiammatorio a seguito di un acuto insulto inalatorio, con sovra espressione di prostaglandine, leucotrieni, macrofagi e cellule T. Il determinismo della vitamina D sull’insorgenza dell’asma allergico sembrerebbe realizzarsi anche in epoca prenatale. È ben noto che la ridotta assunzione materna di vitamina D 3 durante la gravidanza è associata ad un’aumentata probabilità di asma ed eczema nel nascituro. Altri studi hanno però dimostrato che alti livelli di vitamina D, durante la gestazione, hanno aumentato il rischio nel nascituro, di sviluppare eczema ed asma. Tali dati contrastanti suggeriscono, in realtà, come il periodo di supplementazione di vitamina D 3 sembri influenzare la suscettibilità alle patologie atopiche e questo sembra avvenire per lo più nei soggetti di sesso femminile. Ciò trova giustificazione nel fatto che esiste una sinergia funzionale tra D3 e 17 beta-estradiolo. Quest’ultimo, in seguito al legame recettoriale, induce una sovra regolazione del recettore della vitamina D, inattiva il suo catabolismo (CYP24A1 madiato), ed aumenta i livelli sierici di vitamina D 3 binding-protein. Inoltre i soggetti di sesso femminile presentano una maggiore percentuale di grasso corporeo rispetto agli uomini, il che favorisce l’accumulo di vitamina D3, essendo quest’ultima di natura liposolubile. In ambito pediatrico è stata descritta un’associazione tra i livelli sierici di vitamina D ed i marker di severità della patologia asmatica, ed un’associazione fra i livelli di vitamina D e la capacità vitale forzata, in pazienti con asma intermittente. Inoltre, pazienti pediatrici con asma da sforzo avevano anche livelli di vitamina D3 più bassi rispetto ai soggetti negativi al test da sforzo. Sono sempre più numerosi gli studi che evidenziano come trattamenti con la vitamina D 3 migliorino il decorso di patologie determinate da uno squilibrio nella risposta immunitaria ed un suo possibile utilizzo è stato ipotizzato anche per il trattamento dell’asma. Diversi studi mostrano come la somministrazione della vitamina sia in grado, in modelli murini, di prevenire lo sviluppo di asma e ridurne la progressione. Inoltre, è stato dimostrato come in pazienti con asma cortico-resistente, la vitamina D3 sia in grado di ripristinare la sensibilità alla terapia, stimolando la produzione di IL-10. ITALCHIMICI 46 Krilling D Manuale Uso Interno Infine, dalla recente letteratura emerge l’effetto benefico della somministrazione della vitamina D 3 quale adiuvante nell’immunoterapia, in animali da laboratorio, e nella terapia corticosteroidea in studi clinici su pazienti adulti affetti da asma. In conclusione, occorrono ulteriori studi pediatrici al fine di valutare la possibilità di utilizzo della vitamina D 3 nel trattamento dell’asma e delle malattie allergiche, tuttavia i dati fin qui acquisiti appaiono molto promettenti. Vitamina D e malattie autoimmuni Un rapporto tra deficit di vitamina D e prevalenza di alcune malattie autoimmuni come il diabete mellito di tipo 1 (DM1), la sclerosi multipla (SM), l’artrite reumatoide (AR), il lupus eritematoso sistemico (LES) è stato già ampiamente dimostrato. Non solo la vitamina D ed i suoi analoghi possono prevenire lo sviluppo di malattie autoimmuni, ma possono anche essere utilizzati nel loro trattamento. La supplementazione di vitamina D3 infatti ha dimostrato di essere terapeuticamente efficace in diversi modelli sperimentali animali, come l’encefalomielite allergica, l’artrite collagene-indotta, il DM1, la malattia infiammatoria intestinale (IBD), la tiroidite autoimmune ed il LES. I bassi livelli sierici di vitamina D3 presenti in pazienti affetti da patologie autoimmuni potrebbero essere collegati ad altri fattori, oltre che nutrizionali, come la riduzione dell’attività fisica, la diminuita esposizione al sole, l’aumento della frequenza dei polimorfismi dei geni VDREs e gli effetti collaterali di farmaci assunti. Artrite reumatoide L'AR è una malattia autoimmune in cui il processo infiammatorio è sostenuto da linfociti di tipo Th1, che provocano l'attivazione e la proliferazione delle cellule endoteliali e sinoviali, il reclutamento e l'attivazione delle cellule infiammatorie, la secrezione di citochine e proteasi da parte dei macrofagi e delle cellule sinoviali fibroblasto-simili, e la produzione di autoanticorpi. E’ noto che la carenza di vitamina D si associa ad un aggravamento della risposta immunitaria Th1 e il suo possibile ruolo nella patogenesi dell’ AR si basa proprio su prove che mostrano un’aumentata espressione di VDREs su macrofagi, condrociti e cellule sinoviali delle articolazioni dei pazienti. La relazione tra i polimorfismi del gene VDR e l'inizio dell'attività AR e stata dimostrata in uno studio in cui pazienti con genotipi autosomici dominanti omozigoti o autosomici dominanti eterozigoti per VDRE avevano più elevati indici di qualità di vita (Health Assessment Questionary- HAQ), VES, dose di corticosteroidi e numero di farmaci antireumatici assunti rispetto ai pazienti con il solo genotipo autosomico recessivo omozigote. Alcuni lavori hanno dimostrato che l'integrazione con la dieta e/o la somministrazione orale di vitamina D impedisce lo sviluppo o il ritardo della progressione dell’artrite; il rischio di sviluppare AR sembra essere inversamente correlato alla maggiore assunzione di vitamina D. In realtà non vi è ampio consenso tra gli autori. Infatti, in un ampio studio prospettico, che ha valutato 186.389 donne tra il 1980 ed il 2002, non è stata evidenziata l’associazione tra maggiore assunzione di vitamina D ed il rischio di sviluppare AR o LES. Tuttavia, in pazienti con AR trattati con farmaci tradizionali (Disease Modifying Antirheumatic Drugs, DMARD) la supplementazione orale con dosi elevate di alfa-calcidolo per tre mesi ha ridotto la gravita dei sintomi nell’ 89% dei pazienti, il 45% dei quali ha raggiunto la remissione completa. Altri studi hanno riportato una relazione inversa tra attività di malattia e concentrazione di metaboliti della vitamina D nei pazienti affetti da artriti infiammatorie ed in condizioni basali è stato osservato un rapporto di proporzionalità inversa tra i livelli di vitamina D ed il numero di dolori articolari, indici di attività di malattia (Disease Activity Score-DAS28) e PCR. Per ogni aumento di 10 ng/ml di livelli sierici di vitamina D3 il DAS28 si è ridotto di 0,3 punti ed i livelli di PCR del 25%. Lupus eritematoso sistemico Diversi autori hanno dimostrato una maggior prevalenza di carenza di vitamina D nei pazienti con LES rispetto ai soggetti affetti da altre malattie autoimmuni e rispetto ai soggetti sani. In uno studio trasversale, Muller et al. hanno evidenziato che i livelli di vitamina D sono risultati significativamente inferiori nei pazienti con LES (in media 13 ng/mL) rispetto ai pazienti con AR (24 ng/mL), osteoartrosi (32 ng/mL), e controlli sani (27 ng/mL). Huisman et al. hanno osservato che il 50% dei pazienti con LES hanno carenza di vitamina D (< 20 ng/mL). I pazienti con LES presentano fattori di rischio multipli per deficit di vitamina D. La caratteristica fotosensibilità della malattia e la raccomandazione di applicare protezioni solari, sono responsabili di una più bassa esposizione al sole e di una minore produzione di vitamina D nella pelle. ITALCHIMICI 47 Krilling D Manuale Uso Interno Il trattamento cronico con corticosteroidi e idrossiclorochina sembra influenzare il metabolismo della vitamina D, anche se i dati non sono ancora così chiari. Inoltre, il grave coinvolgimento renale nella nefrite lupica, può influenzare l’idrossilazione di 25OHD nel rene. La più alta incidenza e la gravità del LES in individui di origine africana è stata ben documentata. Si ritiene che questa sia una conseguenza non solo di fattori genetici ma anche del minore tasso di conversione cutanea secondaria al colore della pelle. E' stato osservato che i livelli critici di vitamina D (< 10 ng/mL) sono più comuni nei pazienti con coinvolgimento renale e lesioni cutanee fotosensibili. È inoltre documentata l'associazione tra livelli sierici di vitamina D ed il grado di attività di malattia secondo SLEDAI (SLE Disease Activity Index) ed ECLAM (European Consensus Lupus Activity Measure). Thudi et al. hanno dimostrato che la valutazione funzionale di malattia mediante HAQ modificato e VAS è peggiore nei pazienti con diagnosi probabile o accertata di LES e carenza di vitamina D3. Questo stesso studio tuttavia non ha dimostrato un'associazione tra carenza di vitamina D e livelli di autoanticorpi anti-dsDNA. L'associazione tra deficit di vitamina D ed attività di malattia è stata dimostrata in uno studio brasiliano, condotto su 36 pazienti: i livelli di 25OHD erano più bassi (media 17,4± 12,5 ng/mL) nei pazienti con un'elevata attività di malattia (SLEDAI > 12) rispetto a quelli con attività di malattia lieve (SLEDAI < 3) e nel gruppo di controllo. In uno studio spagnolo con 92 pazienti affetti da LES, gli autori hanno osservato bassi livelli di vitamina D 3 (< 30 ng/ml) nel 75% dei pazienti ed una vera carenza (< 10 ng/ml) nel 45% di essi. Per spiegare la carenza di vitamina D nelle malattie autoimmuni, Carvalho et al. hanno indagato la presenza di anticorpi anti-vitamina D3 nel siero di 171 pazienti con LES: il 4% aveva anticorpi anti-vitamina D3, ma i livelli sierici di vitamina D3 erano simili nei pazienti con o senza tali autoanticorpi e tra le associazioni cliniche laboratoristiche ricercate, la presenza di anticorpi anti-ds DNA è stata l'unica che ha mostrato un forte legame con gli anticorpi anti-vitamina D. Fibrosi cistica Il ruolo anti-infiammatorio della vitamina D è già stato documentato, come visto, in diverse malattie, come la sclerosi multipla, l'artrite reumatoide, il diabete mellito, il lupus eritematodes , la psoriasi e il cancro della prostata. Nella fibrosi cistica gli studi sulla vitamina D si sono finora concentrati soprattutto sul ruolo di questa vitamina nel prevenire e nel curare l'osteoporosi, anche se il tema dell'infiammazione in questa malattia è cruciale alla sua evoluzione. Solo recentemente è stato dimostrato che l'aspergillosi broncopolmonare allergica (ABPA), tipica complicanza infiammatoria polmonare nella FC, legata ad una speciale ipersensibilità al fungo Aspergillus fumigatus , è correlata con bassi livelli di vitamina D nel sangue dei pazienti (2). In questo studio si è anche visto, con esperimenti in vitro, che l'aggiunta di vitamina D alle cellule T oggetto di studio riduce la risposta infiammatoria all'Aspergillus fumigatus, tanto da raccomandare trial clinici con vitamina D per prevenire l'ABPA nei pazienti FC. Nella fibrosi cistica è abitualmente raccomandata una supplementazione con vit.D. Infatti, in questa malattia vi è abituale carenza di vitamina D, dimostrata dai bassi o bassissimi livelli nel siero di 25-idrossivitamina D (25-OHD), che è la forma attiva della vitamina D nell'organismo. Si ritiene che i livelli utili di 25-OHD nel siero dovrebbero essere compresi tra 30 e 60 nanogrammi (ng) per ml. Le cause della carenza vitaminica in FC sono molteplici. In primis, lo scarso assorbimento intestinale della vit. D che assumiamo con i cibi, a causa dell'insufficienza pancreatica: la vit.D infatti è una vitamina liposolubile (come E, A e K) e in assenza o quasi di digestione dei grassi non può essere assorbita. Ma anche pazienti FC senza insufficienza pancreatica e pazienti regolarmente trattati con enzimi pancreatici non raggiungono in genere livelli sierici sufficienti di 25-OHD. Si chiamano in causa altri fattori: lo scarso contenuto di grasso dell'organismo dei malati (soprattutto quello sottocutaneo), abituale deposito di riserva della vit. D, il ridotto legame della vitamina alla specifica proteina che lo lega e lo trasporta ai siti di utilizzo, la ridotta idrossilazione della vitamina, necessaria per trasformarla nella sua forma attiva 25-OHD, ma anche la probabile scarsa esposizione alla luce solare. Sulla base delle informazioni ricavate dagli studi finora condotti, un gruppo di ricercatori di Chapel Hill dell'Università di North Carlina ha recentemente suggerito un interessante algoritmo per trattare la carenza di vitamina D nei pazienti FC, che di seguito riassumiamo. Controllare annualmente il livello sierico di 25-OHD. Se risulta superiore a 30 ng/ml continuare la supplementazione standard abituale (in genere 800 UI per giorno). Se è inferiore a 30 ng/ml si somministri una dose media di 12.000 UI una volta per settimana nei soggetti di età inferiore a 5 anni e di 50.000 UI per settimana nei pazienti oltre i 5 anni, per 12 settimane. Ricontrollare i livelli di 25-OHD e, se maggiori di 30 ng/ml , continuare con la dose media aggiustandola per mantenere 25-OHD sotto gli 80 ng/ml, livello di sicurezza per evitare eventuali tossicità della vitamina. Se al ri-controllo i livelli di 25-OHD sono inferiori a 30 ng/ml si passi alla dose alta, con 12.000 UI sotto i 5 anni e 50.000 UI sopra i 5 anni 2 volte la settimana. Nuovo controllo: se 25-OHD maggiore di 30 ng/ml continuare con dose alta aggiustandola per mantenere i livelli di sicurezza (sotto 80 ng/ml); se inferiore a 30 ng, considerare l'intervento controllato con fototerapia (raggi UV di particolare lunghezza d'onda). E' preferibile somministrare vitamina D3. ITALCHIMICI 48 Krilling D Manuale Uso Interno Diabete mellito di tipo I Diversi meccanismi effettori che portano alla distruzione delle β-cellule sono coinvolti nella fisiopatologia del DM1, inclusa la presenza di linfociti CD8+ e macrofagi che regolano la differenziazione delle cellule Th1 mediante secrezione di IL-12. In modelli sperimentali su topi non diabetici obesi (topi NOD), il deficit di vitamina D 3 accelera l'insorgenza di DM1; invece la supplementazione precoce di D3 in questo stesso modello, prima che l’infiltrazione di cellule T nel pancreas produca l'insulite autoimmune, impedisce lo sviluppo di diabete. Studi epidemiologici hanno dimostrato che l'integrazione alimentare di vitamina D 3 durante l'infanzia può ridurre il rischio di sviluppare DM1. Uno studio che ha effettuato un follow-up di 30 anni ha osservato una significativa riduzione nella prevalenza di DM1 in bambini che avevano ricevuto supplementazione giornaliera di vitamina D 3. Gastrite autoimmune Si tratta di una malattia organo-specifica caratterizzata dalla presenza di anticorpi circolanti contro l’enzima H+/K+ATPasi, pompa protonica delle cellule parietali (PC), e contro il fattore intrinseco (FI), prodotto di secrezione delle cellule parietarie (PC). La cronica autoaggressione contro questo enzima provoca perdita di cellule parietali e zimogeniche e risulta in una diminuzione della secrezione acida gastrica, ipergastrinemia e anemia da carenza di ferro. In uno stadio più tardivo della malattia insorge l’anemia perniciosa, causata dalla carenza di vitamina B12 che non viene più assorbita dall’intestino per la presenza nel siero e/o nel succo gastrico dei pazienti di autoanticorpi contro il FI. Questa malattia, spesso asintomatica, può causare atrofia della mucosa gastrica e nel 10% dei casi può evolvere verso un adenocarcinoma o un tumore carcinoide. Recentemente Antico et al. hanno studiato la concentrazione dell’ormone in un gruppo di pazienti affetti da AIG diagnosticata istologicamente, per verificare se l’ipovitaminosi D si associ anche con questa patologia. I livelli di vitamina D nei pazienti con gastrite autoimmune erano significativamente più bassi rispetto ai pazienti con gastrite non specifica o al gruppo di controllo, supportando l’ipotesi che l’ipovitaminosi D potrebbe costituire un fattore di rischio per lo sviluppo della malattia autoimmune e agire come fattore favorente una più severa aggressione da parte dei linfociti Th1 all’epitelio dello stomaco. La vitamina D nel cervello È noto che la vitamina D3 attraversa la barriera emato-encefalica e che i recettori per la vitamina D3 si trovano in tutto il cervello. Alte concentrazioni di vitamina D 3 sono state osservate in alcuni neuroni nel nucleo interstiziale della stria terminale e nel nucleo centrale dell'amigdala, che nel loro insieme costituiscono un sistema di neuroni bersaglio collegati da una componente della stria terminale. Concentrazioni nucleari di vitamina D3 sono state evidenziate anche nei neuroni del nucleo periventricolare della regione preottico-ipotalamica, compresa la sua estensione, il nucleo arcuato e paraventricolare parvocellulare, nel nucleo ventromediale del nucleo sovramammillare, nel nucleo reticolare del talamo, nell’ippocampo ventrale, nel nucleo caudato, nel grigio centrale mesencefalo-pontino, nel rafe dorsale, nei nuclei parabrachiali e nei nuclei motori dei nervi cranici, nella sostanza gelatinosa del nucleo sensoriale del trigemino, nelle cellule del Golgi tipo II del cervelletto ed in altre strutture. L’estesa distribuzione di neuroni bersaglio suggerisce che la vitamina D 3 regola la produzione di vari messaggeri aminergici e peptidergici e che influenza l'attività endocrino-autonomica di alcuni sistemi sensoriali e motori. La presenza di recettori specifici per la vitamina D 3 in molte regioni del sistema nervoso centrale, nelle cellule ipofisarie, in una moltitudine d’organi periferici, insieme agli effetti conosciuti o alle funzioni ipotizzate, richiede una revisione dei concetti classici correnti circa il ruolo biologico della vitamina D 3. La vitamina D3 è molto più che "l’ormone steroide dell’omeostasi del calcio". Alla luce delle nuove e più ampie informazioni derivate soprattutto dai risultati degli studi autoradiografici e istochimici, risulta che la vitamina D3 è un attivatore biologico completo, regolatore di diverse funzioni organiche. L’attivazione mediata della vitamina D3 è volutamente collegata e in sintonia con l'esposizione stagionale alla luce solare, con l’apparente obiettivo di ottimizzare e regolare all’ambiente lo sviluppo, la conservazione e la propagazione della vita. Ciò comporta la proliferazione e la maturazione di certi tessuti, l’omeostasi del calcio e il trofismo muscolare scheletrico per migliorare resistenza e movimento, e, infine, per facilitare la riproduzione. La regolazione del metabolismo del calcio è una, ma solo una componente dell’azione della vitamina D3. Il "calci-triolo" potrebbe essere più appropriatamente chiamato "sol-triolo", l’ormone steroideo correlato alla luce del sole, l'attivatore e il regolatore stagionale, il messaggero steroide somatotrofico stimolato dalla luce solare. ITALCHIMICI 49 Krilling D Manuale Uso Interno La vitamina D è importante per lo sviluppo e le funzioni del cervello In una revisione critica definitiva, alcuni Autori hanno sostenuto che vi sono ampie prove biologiche a sostegno dell’ipotesi che la vitamina D svolga un ruolo importante nello sviluppo del cervello e nelle sue funzioni. Ciò giustificherebbe la supplementazione nei soggetti che presentano cronicamente bassi apporti dietetici di vitamina D. McCann e Ames hanno sostenuto che, mentre la vitamina D ha un ruolo importante nello sviluppo e nella funzione del cervello, i suoi specifici effetti sul comportamento rimangono non del tutto conosciuti. Pur sottolineando la necessità di ulteriori studi, gli autori sostengono la supplementazione di vitamina D nei soggetti a rischio. La vitamina D è nota da tempo promuovere la salute delle ossa, regolando i livelli di calcio nel corpo. La carenza di vitamina D nei bambini molto piccoli può indurre rachitismo, che può essere facilmente prevenuto con supplementi di vitamina D. Solo recentemente la comunità scientifica è venuta a conoscenza di un ruolo più ampio per la vitamina D. Ora sappiamo che, oltre al suo ruolo nel mantenimento della salute delle ossa, la vitamina D 3 è coinvolta nella differenziazione dei tessuti durante lo sviluppo e nel corretto funzionamento del sistema immunitario. In realtà, più di 900 geni diversi sono ormai noti per essere in grado di legare il recettore della vitamina D 3, attraverso il quale la vitamina D3 media i suoi effetti. Oltre a proteggere contro il rachitismo, ci sono prove evidenti che confermano che un’abbondante assunzione di vitamina D3 aiuta a proteggere contro le fratture negli anziani. La vitamina D è presente soltanto in alcuni alimenti (ad esempio i pesci grassi) ed è anche aggiunta nel latte arricchito, ma la sua disponibilità biologicamente attiva è legata per lo più all’esposizione ai raggi ultravioletti (UVB) del sole. La radiazione UVB del sole nella pelle converte un precursore biochimico della vitamina D 3, nel calcitriolo, la forma attiva che svolge importanti effetti ormonali. La formazione di vitamina D attiva da parte della radiazione UVB può essere sei volte più efficiente in soggetti con la pelle chiara rispetto a chi ha la pelle scura. Fra gli afro-americani che vivono a latitudini settentrionali è, perciò, diffusa la carenza cronica di vitamina D. La pelle scura è stata selezionata nel corso dell'evoluzione perché protegge contro l’intensa radiazione UVB del sole ai tropici. La pelle bianca è stata selezionata per consentire nelle latitudini più settentrionali un’esposizione ai raggi UVB sufficiente alla sintesi di vitamina D. Così, i settentrionali di carnagione chiara sono a rischio nelle zone tropicali per le patologie, anche neoplastiche, della pelle indotte dai raggi UVB, mentre le persone di pelle scura nelle latitudini settentrionali con scarsa esposizione al sole sono a rischio di rachitismo, fratture ossee ed eventualmente di altre malattie, inclusi diversi tipi di cancro e di patologie neuro-psichiatriche a causa della mancanza di vitamina D. Per fortuna gli schermi solari e gli integratori di vitamina D per riparare a questi problemi sono economici. La vitamina D svolge importanti funzioni neurobiologiche in rapporto all'ampia distribuzione dei recettori della vitamina D in tutto il sistema nervoso. La vitamina D può influenzare la sintesi e l’espressione di alcune proteine nel cervello, di cui si conosce il diretto coinvolgimento nell'apprendimento, nella memoria, nel controllo motorio e forse anche sul comportamento materno e sociale. Molti esperti evidenziano che il livello attualmente raccomandato di vitamina D è troppo basso e deve essere incrementato per la protezione contro rachitismo, fratture ossee e forse contro alcune forme di cancro. Molti soggetti a rischio sembrano avere, infatti, bassi livelli di vitamina D nel sangue. Nonostante le attuali incertezze circa eventuali effetti deleteri di sovradosaggio della vitamina D, l'evidenza indica che l'integrazione è, tutto sommato, economica e prudente. Soprattutto nelle sottopopolazioni in cui i livelli di vitamina D possono essere eccezionalmente bassi, in particolare nella cura dei bambini, degli anziani e degli afro-americani e dei soggetti con pelle più scura. Vit. D e patologie del sistema nervoso La Vitamina D sembra avere un ruolo nei processi che possono essere importanti per il rischio di demenza, compresa la salute vascolare e la clearance dell’amiloide dal cervello. Date queste associazioni sembra "biologicamente plausibile" che ci possa essere un'associazione di bassi livelli di vitamina D con il rischio di demenza e di basse prestazioni cognitive nella popolazione generale. I risultati di una nuova analisi utilizzando i dati del Terzo National Health and Nutrition Survey (NHANES III) mostrano che la carenza di vitamina D è associata ad un aumentato rischio di declino cognitivo negli anziani americani. Alcuni investigatori hanno individuato un legame tra vitamina D e morbo di Parkinson. Utilizzando una coorte di oltre 3000 persone, i ricercatori hanno scoperto che bassi livelli di vitamina D aumentano il rischio di Parkinson, mentre alti tassi sembravano avere un effetto protettivo. ITALCHIMICI 50 Krilling D Manuale Uso Interno Altri studi hanno evidenziato il ruolo di 1,25 diidrossi-vitamina D3 nell’eziologia e terapia dei disturbi affettivi stagionali e di altri disturbi mentali, come schizofrenia, depressione e alcolismo. Esistono prove che la depressione maggiore è associata a bassi livelli di vitamina D e che la depressione è aumentata nel corso del secolo scorso durante il quale i livelli di vitamina D sono sicuramente diminuiti. Esistono prove che la depressione è associata a malattie cardiache, ipertensione, diabete, artrite reumatoide, cancro e bassa densità minerale ossea, tutte malattie che si pensano essere causate, almeno in parte, dalla carenza di vitamina D. La vitamina D, inoltre, ha profondi effetti sul cervello e sui neurotrasmettitori coinvolti nella depressione maggiore. Vit. D e luce solare Gli effetti della luce solare sui processi fisiologici e comportamentali sono mediati, in gran parte, attraverso il sistema pelle>vitamina D>sistema endocrino. Questi effetti sono probabilmente mediati attraverso azioni dirette della vitamina D3 sul cervello e sugli organi endocrini, indipendentemente dagli effetti sui livelli di calcio. Ciò appare rilevante per l'attivazione e la modulazione dei processi mentali e del sistema endocrino, relativi, in particolare, al bioritmo circum-annuale (stagionale) e circum-diano (giornaliero). Tali azioni sono dirette, cioè mediate da recettori specifici, e sembrano essere dose-dipendenti, in rapporto all'intensità della luce ed alla durata dell'esposizione. Ciò fa della luce (fotoni) un farmaco attivo sul sistema nervoso ed endocrino. La vitamina D3 sembra svolgere un ruolo nell'eziologia dei disturbi affettivi con ciclico esordio stagionale (disturbo affettivo stagionale). Incrementare false speranze di guarigione, da una devastante malattia mentale come la depressione maggiore, utilizzando la sola vitamina D non è corretto. Le evidenze suggeriscono che la vitamina D può migliorare il tono dell’umore, ma non abbiamo prove conclusive in merito ad effetti propriamente terapeutici sulla depressione maggiore. In quest’articolo di rassegna della vasta letteratura scientifica internazionale su questo tema, si evidenziano alcuni fattori chiave di cui i medici dovrebbero essere consapevoli. Vitamina D e Depressione La psichiatria è quella branca della medicina che spiega tutto, ma non prevede nulla. Questa è la definizione più in voga tra gli scienziati del National Institute of Mental Health (NIMH). “Cura la tua depressione con la vitamina D, la vitamina del sole!” Nessun messaggio può essere più crudele di questo, creando aspettative inevitabilmente deluse tra i tanti soggetti affetti da depressione maggiore. La depressione maggiore non può essere curata semplicemente con quantità fisiologiche di vitamina D, così come non può essere curata con la vasta gamma di rimedi “naturali”, d’integratori alimentari o di placebo. Non esiste la panacea. Indurre false speranze nella cura di una malattia devastante come la depressione maggiore non è, però, così grave se si confronta con alcuni dei più grandi crimini della psichiatria-psicoterapeutica del passato, come aver sostenuto che le madri degli schizofrenici avevano causato la malattia del loro bambino, oppure come aver indotto il recupero di falsi ricordi d’abuso sessuale, che tante famiglie innocenti ha distrutto. Ciò premesso, non è corretto e non è nostra intenzione indurre false speranze. Fatte queste premesse, potremmo chiederci che cosa sappiamo circa il rapporto tra depressione maggiore e vitamina D. Luce e depressione Nel 1989 W.E. Stumpf ha pubblicato un articolo pionieristico sul ruolo della 1, 25 diidrossi-vitamina D3 nell’eziologia e nella terapia dei disturbi affettivi stagionali e di altri processi mentali. E’ noto da tempo che la luce intensa nello spettro visibile (senza la produzione di vitamina D attivata dagli UVB) migliora nettamente l'umore, anche se è difficile condurre bene gli studi a causa della mancanza di una condizione di controllo. Ci si deve, quindi, porre il quesito: la vitamina D ha un effetto sull'umore che differisce dall’effetto della luce o che è ad esso complementare? Disturbo affettivo stagionale Gli sbalzi d'umore tipici del disturbo affettivo stagionale possono essere gravi e sono legati oltre che alla stagione, anche alla latitudine e all’esposizione al sole. ITALCHIMICI 51 Krilling D Manuale Uso Interno Harris e Dawson-Hughes hanno evidenziato su 125 donne che, rispetto al placebo, il trattamento con 400 UI d’ergocalciferolo (vitamina D2) al di non migliora le oscillazioni stagionali dell'umore. Gli autori non hanno valutato i livelli di 25 (OH) vitamina D, indotti dal trattamento. Sappiamo, però, che la dose di 400 UI d’ergocalciferolo utilizzata in questo studio è molto vicina a una dose omeopatica. Infatti, l’ergocalciferolo è una forma meno potente della vitamina D che in natura è la vitamina D 3, il colecalciferolo. Alcuni autori hanno sostenuto che la vitamina D non ha alcun effetto sul disordine affettivo stagionale, misurando nel sangue il metabolita sbagliato della vitamina D, cioè il calcitriolo (1,25 diidrossi D3), i cui livelli possono variare in diverse e varie condizioni. Il solo test di laboratorio che dovrebbe essere utilizzato, per misurare le riserve di vitamina D, il suo deficit o i suoi livelli adeguati è il dosaggio di vit. D3, che questi autori non hanno misurato. Nel 1998 in un esperimento controllato, alcuni ricercatori australiani hanno rilevato che 400 e 800 UI di colecalciferolo migliorano significativamente il tono affettivo, in soggetti sani. In uno studio randomizzato in doppio cieco, 44 soggetti sani hanno ricevuto 400 UI di colecalciferolo, 800 UI di colecalciferolo o placebo per 5 giorni, nel corso dell’inverno inoltrato. I risultati con misure d’auto-valutazione hanno evidenziato che la vitamina D3 incrementa l’affettività positiva di una piena deviazione standard con segni di riduzione dell’affettività negativa. Gli autori hanno concluso che la carenza di vitamina D3 fornisce una spiegazione convincente e semplice delle variazioni stagionali dell'umore. In uno studio ancora più interessante nel 1999, su un piccolo gruppo di pazienti con disturbo affettivo stagionale, 100.000 UI di vitamina D somministrate in singola dose orale hanno indotto miglioramenti delle scale di valutazione della depressione superiori a quelli indotti dalla light-therapy. Tutti i soggetti nel gruppo trattato con vitamina D miglioravano in tutte i sintomi valutati e, soprattutto, il grado di miglioramento del nucleo depressivo era correlato significativamente ai livelli misurati di 25 (OH) vitamina D. Alcuni autori tedeschi hanno trovato, in controlli sani, livelli medi nel siero di vit. D3 di 46 ng / L, mentre, i soggetti depressi presentavano livelli medi serici di 37 ng / L. Autori finlandesi non hanno trovato differenze stagionali tra pazienti con disturbo affettivo stagionale e controlli normali, ma non hanno trovato neanche variazioni stagionali dei livelli di vit. D 3 negli stessi pazienti. Nel 2003 è stata evidenziata una diretta correlazione tra i livelli di D 3 ed i punteggi di salute mentale in un gruppo di soggetti sani, adulti, anziani. Meno luce solare, più depressione L’ipotesi che una carenza di vitamina D possa causare alcune forme di depressione, viene rafforzata da alcune osservazioni epidemiologiche. L'incidenza di depressione è aumentata nelle società industrializzate d’occidente nel corso del secolo scorso. In quel periodo di tempo, infatti, si è progressivamente ridotta l’esposizione alla luce solare, per effetto dell’urbanizzazione, con la costruzione di edifici sempre più verticali e con sempre minore esposizione alle radiazioni ricche di ultravioletti. L’industrializzazione ha ridotto i lavori effettuati in ambienti esterni con conseguente minore esposizione ai raggi UVB. Le automobili (i vetri bloccano totalmente i raggi UVB), l’abbigliamento sempre più coprente (blocca la luce UVB), le creme solari e le sbagliate indicazioni mediche di non esporsi mai alla radiazione solare senza protezione hanno ridotto la fisiologica produzione cutanea di vit. D attiva e circolante. Tutti questi fattori contribuiscono a ridurre i livelli serici di vit. D. La depressione maggiore è notevolmente aumentata negli ultimi 80 anni. Questo è uno dei risultati più famosi e controversi degli studi in epidemiologia psichiatrica moderna. Tra patologie organiche e depressione: chi è nato prima? La depressione è associata ad altre condizioni che si pensa possano conseguire a una carenza di vitamina D, come le malattie cardiache, il diabete, l’ipertensione, l’artrite reumatoide, il cancro o l'osteoporosi. Ad esempio, vi è una forte associazione tra malattie cardiache e depressione, nonché numerose teorie per spiegarla. La più ovvia, cioè che la malattia cardiovascolare possa indurre in chiunque una depressione reattiva è l’unica che si è dimostrata non vera. La depressione, infatti, molto spesso precede la malattia di cuore, suggerendo l’esistenza di un terzo fattore con effetti etio-patogenetici su entrambi. Inoltre, è confermata una maggiore mortalità nei soggetti affetti da depressione, non solo per cardiopatie, ma anche per altre e diverse cause. Quando la cardiopatia è associata alla depressione, le possibilità logiche sono: la depressione causa le malattie cardiache, le cardiopatie causano depressione, oppure un fattore sconosciuto (x), forse la carenza di vitamina D, causa, almeno in parte, sia la depressione sia la malattia di cuore. ITALCHIMICI 52 Krilling D Manuale Uso Interno Che dire delle altre malattie associate a deficit di vitamina D? Cosa spiega la significativa associazione tra depressione e diabete, depressione e ipertensione arteriosa, depressione e artrite reumatoide, depressione e neoplasie, depressione e densità minerale ossea nelle donne in premenopausa? Alcuni recenti studi sull’associazione tra depressione maggiore e ridotta densità minerale ossea nelle donne suggeriscono che un fattore terzo sia potenzialmente responsabile tanto della bassa massa ossea quanto della depressione. Una possibile spiegazione può essere fornita proprio dalla constatazione che una carenza di vitamina D provoca, almeno in parte, tutte queste malattie. E’ ovvio come tutte queste malattie siano per loro natura a etio-patogenesi multifattoriale. Resta probabile, comunque che una parte della vulnerabilità possa conseguire a una carenza di vitamina D. La vitamina D aumenta rapidamente, di tre volte, in vitro, l'espressione genetica di tiroxina-idrossilasi (l'enzima limitante per la biosintesi delle catecolamine). La luce del sole d’estate aumenta il turnover della serotonina cerebrale il doppio di quello che fa la luce del sole d'inverno. Uno studio recente presenta risultati positivi sul tono dell’umore interpretabili sia come effetti diretti della luce nello spettro visibile sia come azione della vitamina D. Le evidenze cliniche disponibili ad oggi suggeriscono che la vitamina D può migliorare il tono l'umore, anche se le prove al riguardo non sono ancora del tutto conclusive. Gli studi con risultati positivi, circa gli effetti antidepressivi della vitamina D, sono stati effettuati nel trattamento del disturbo affettivo stagionale, non della depressione maggiore. La vitamina D potrebbe essere utile nel trattamento della depressione maggiore, ma è ancora troppo presto per dirlo con certezza. Per saperlo con relativa sicurezza bisognerebbe studiare i pazienti con grave depressione maggiore, cui dovrebbe essere valutato il livello serico di base della vit. D 3, che dovrebbero essere trattati per diversi mesi con dosi adeguate di vitamina D per innalzare il livello ad almeno 35 ng/mL, paragonando i risultati con un gruppo di controllo trattato con placebo. Tuttavia, bisognerebbe seguire i seguenti consigli: I pazienti depressi dovrebbero dosare i livelli serici di vit. D3. Se presentano livelli inferiori a 35 ng/mL (87 nM/L) sono in carenza di vitamina D3 e dovrebbero iniziare il trattamento. In condizioni di bassi livelli ematici di 25 (OH) vit. D, si è, di fatto, in carenza di vitamina D 3 e si dovrebbe comunque, iniziare il trattamento, considerata la possibilità di poter prevenire oltre alla depressione molte altre gravi patologie non solo psichiatriche. CONCLUSIONI Numerose osservazioni suggeriscono che la carenza di vitamina D può svolgere un ruolo importante nella regolazione del sistema immunitario e che la vitamina può essere utile nella prevenzione delle malattie immunomediate. Proprio per le sue proprietà non solo calcio-omeostatiche, ma immunoregolatrici, la vitamina D può essere considerata come parte integrante di un più complesso follow-up terapeutico delle patologie immuno-mediate. In atto, la recente letteratura, sta orientando gli sforzi per lo sviluppo di ulteriori studi per definire lo stato di deficit/insufficienza in determinati gruppi di pazienti, determinare i rischi e i benefici della supplementazione di vitamina D e stabilire frequenza e temporalizzazione del monitoraggio. In conclusione, sicuramente gli effetti della vitamina D sono benefici proprio per la sua azione che esulano dalla semplice omeostasi del calcio e che sono rivolte alla stimolazione del sistema immune, e tali effetti possono essere utilizzati proprio come adiuvanti di terapie specifiche per la cura di patologie infettive o atopiche. Sta, inoltre, rapidamente diventando chiaro che la vitamina D svolge diversi ruoli nella regolazione della salute ottimale del sistema nervoso centrale sia durante lo sviluppo del sistema nervoso sia durante tutta la vita. La vitamina D aumenta di tre volte rapidamente in vitro l'espressione genetica della tiroxina-idrossilasi (l'enzima limitante la biosintesi delle catecolamine). La vitamina D è ampiamente coinvolta nella funzionalità cerebrale con recettori specifici per tale sostanza, localizzati in neuroni e cellule gliali. I geni che codificano gli enzimi coinvolti nel suo metabolismo sono espressi nelle cellule del cervello. Gli effetti biologici riportati della vitamina D nel sistema nervoso includono la biosintesi di fattori neurotrofici, l'inibizione della sintesi dell’ossido-nitrico-sintasi inducibile ed aumento dei livelli di glutatione, suggerendo un ruolo di disintossicazione cerebrale per l'ormone, vitamina D. ITALCHIMICI 53 Krilling D Manuale Uso Interno Fibrosi cistica La fibrosi cistica (FC), o mucoviscidosi, o malattia fibrocistica del pancreas, è una malattia genetica autosomica recessiva, manifestandosi pienamente soltanto negli omozigoti e con nessuna sintomatologia clinica negli eterozigoti, causata da una mutazione del gene CFTCR (Cystic Fibrosis Transmembrane Conductance Regulator) che codifica una proteina di 1480 aminoacidi situata sulla membrana cellulare delle cellule epiteliali, la cui funzione, normalmente, è quella di trasportare il cloro attraverso le membrane cellulari a livello della membrana apicale delle cellule epiteliali di vie aeree, del pancreas, dell'intestino, delle ghiandole sudoripare, delle ghiandole salivari e dei vasi deferenti. Lo squilibrio ionico è causato da un'alterazione della secrezione da parte delle cellule epiteliali di ioni cloro e un conseguente maggior riassorbimento di sodio e acqua. È la malattia genetica ereditaria mortale più comune nella popolazione caucasica. Si conoscono più di 1000 diverse mutazioni del gene CFTR. La più frequente nella popolazione di origine caucasica è una delezione di 3 nucleotidi (CTT), che provoca la perdita dell'aminoacido fenilalanina codificato dal codone 508 (delta F508). Questa patologia si caratterizza per un'anomalia nel trasporto del cloro nella membrana delle cellule delle ghiandole a secrezione esterna. Di conseguenza queste ghiandole secernono un muco denso e vischioso e quindi poco scorrevole. Negli organi interessati, le secrezioni mucose, essendo anormalmente viscide, determinano un'ostruzione dei dotti principali, provocando l'insorgenza di gran parte delle manifestazioni cliniche tipiche della malattia, come la comparsa di infezioni polmonari ricorrenti, di insufficienza pancreatica, di steatorrea, di stati di malnutrizione, di cirrosi epatica, di ostruzione intestinale e di infertilità maschile; è una malattia molto grave. Epidemiologia ed eziologia In Italia si manifesta in un caso ogni 2700 nati vivi; i portatori sani, con la presenza di un solo gene della FC, sono circa il 4% della popolazione ed i nuovi bambini affetti da FC ogni anno sono circa 200. Il gene responsabile è localizzato sul braccio lungo del cromosoma 7. Le oltre 1400 mutazioni finora riconosciute sono legate alla proteina di canale al cloro CFTR e sono classificate in 6 classi: Classe I: non c'è produzione di proteina; Classe II: si ha produzione di un corto peptide non funzionante; Classe III: si produce un polipetide non funzionante; Classe IV: si produce una proteina difettosa ma in minima parte funzionante; Classe V: si produce una proteina normale ma in minime quantità; Classe WT: la proteina normale è prodotta nelle giuste quantità (soggetto sano); Più la classe ha un numero basso, più severa sarà la malattia. Le mutazioni di classe I, II e III danno anche insufficienza pancreatica, mentre le classi IV e V permettono che il pancreas funzioni. Alla proteina CFTR vengono riconosciute diverse funzioni: Canale del cloro AMP ciclico dipendente; Regolazione della funzione di altri canali, in particolare per il sodio; Regolazione dell'infiammazione. Regolazione del pH; Trasporto del glutatione; Diagnosi Prelievo dei villi coriali (nelle famiglie a rischio è possibile la diagnosi prenatale in questo modo). Screening neonatali. Esame del sudore secondo il metodo di Gibson e Cooke - si misura la concentrazione di Cloro in almeno 75 mg di sudore del paziente; se i valori sono superiori alla norma (60mEq/L) il test è sicuramente positivo. Sotto i 30mEq/L è sicuramente negativo. Tra i 30 e i 60 il test viene definito borderline e potrebbe essere necessario ripetere il test. Analisi del DNA (centri specializzati). Differenza dei potenziali nasali. ITALCHIMICI 54 Krilling D Manuale Uso Interno Aspetti clinici Manifestazioni cliniche della Fibrosi cistica. A livello polmonare non è comunque ancora stato ben chiarito quale sia il rapporto tra il difetto di trasporto ionico e la broncopneumopatia. Tutt'oggi esistono due diverse teorie: la prima implicherebbe un'attivazione del sistema immune deputato al killing batterico da cui deriverebbe una maggiore predisposizione alla persistenza degli agenti infettivi nel tratto respiratorio e l'evoluzione verso l'infezione cronica; la seconda deriverebbe dalla contrazione del liquido periciliare, dovuta ad un eccessivo riassorbimento di sodio e acqua dall'epitelio respiratorio, con conseguente formazione di placche di muco che occludono i bronchi. Esiste una grande varietà di quadri clinici. Nei casi più gravi la FC si manifesta con un ileo da meconio (15%) entro le prime 24 ore di vita. Normalmente la malattia insorge più tardivamente con sintomi respiratori e/o digestivi. Prime vie aeree Le secrezioni che possono ristagnare nel naso e i seni paranasali possono essere causa di rinite e pansinusite cronica. In un 7% dei casi è presentata poliposi nasale. Associata vi può essere una diminuzione dell'olfatto con una conseguente diminuizione del gusto. Polmone Il quadro clinico è dominato da un lento processo distruttivo polmonare. Nella maggior parte dei casi si manifesta nel primo anno di vita con tosse persistente, inizialmente secca di tipo pertussoide, associata a tachipnea e broncospasmo. L'esame obiettivo può subito dimostrare segni indiretti di ostruzione bronchiale: rientramenti intercostali, sovraclaveari, deformazione del torace con aumento del diametro antero - posteriore, polipnea, gemiti e fischi. L'infezione bronchiale cronica determina una progressiva distruzione del parenchima polmonare e la formazione di bronchiectasie. La tosse diventa quindi sempre più catarrale, con espettorato muco purulento. La risposta immunitaria dell'ospite e i fattori propri dei patogeni contribuiscono quindi insieme ad innescare un processo patogenetico che è alla base del processo distruttivo polmonare. Pancreas Il pancreas è colpito nell'80% dei casi con un ristagno dei succhi pancreatici nei dotti con formazione di cisti con una fibrosi che si va a creare attorno a questi (da qui fibrosi cistica). La carenza di succhi pancreatici nel canale intestinale porta a malassorbimento di grassi (con conseguente steatorrea), e di conseguenza delle vitamine liposolubili, delle proteine e, in minima parte, degli zuccheri. ITALCHIMICI 55 Krilling D Manuale Uso Interno Con il passare del tempo il pancreas, sempre più colpito, secerne una minor quantità d’insulina portando a una forma di diabete di solito insulino-dipendente. Un mancato assorbimento dei grassi comporta sequele anche gravi: Mancato assorbimento delle Vitamine liposolubili Rachitismo da mancato assorbimento di calcio (la vitamina D è indispensabile a questo scopo) Coagulazione alterata a causa del mancato assorbimento di vitamina K Crescita ridotta: i grassi infatti sono i nutrienti che forniscono il maggior apporto calorico Apparato riproduttivo Nella FC tutte le secrezioni prodotte dal corpo sono di densità maggiore rispetto ad un individuo "normale", infatti il 97-98% dei maschi adulti ha un liquido seminale più denso che non permette agli spermatozoi di muoversi liberamente ed adempiere alla fecondazione dell'ovulo, conseguentemente si ha infertilità. Le donne possono avere figli anche se la fertilità è comunque ridotta. Fegato La bile, più densa, ostruisce le vie biliari causando ittero (a bilirubina prevalentemente diretta) ed i processi infiammatori del parenchima epatico possono portare fibrosi intorno ai canalicoli biliari (5-15% dei casi). Possibile anche è la calcolosi biliare. Ghiandole sudoripare La quantità è normale ma la presenza di cloro e sodio è molto elevata. Il rischio di disidratazione, specialmente nel periodo estivo, è molto elevato e di conseguenza vanno date al bambino apposite soluzioni idro-saline. Prognosi Decisamente migliorata negli ultimi 50 anni; se fino al 1963 l'aspettativa di vita era inferiore ad un anno per la maggior parte dei pazienti, attualmente l'età media di sopravvivenza è intorno ai 50 anni anche se la qualità di vita di questi soggetti è in genere modesta. Trattamento Deve essere continua per tutto l'arco della vita e si basa su sei cardini fondamentali: Dieta Trattamento digestivo-nutrizionale Fisioterapia respiratoria e rimozione delle secrezioni bronchiali Terapia antibiotica delle infezioni respiratorie Trattamento delle patologie delle prime vie aeree Terapia medico-chirurgica delle complicanze con trapianto dei polmoni Dieta e trattamento digestivo nutrizionale La dieta deve essere ipercalorica, molto ricca di sali (principalmente in estate e durante gli episodi febbrili) e con aggiunta di vitamine fondamentali quali A,D,E e K. Devono essere somministrati durante i pasti gli enzimi pancratici (capsule). Tali enzimi devono essere somministrati, se possibile 1/3 a inizio pasto, 1/3 a metà pasto e 1/3 a fine pasto. Nei lattanti gli enzimi pancratici si estraggono dalla capsula e si miscelano con un po' di latte: i granuli non vanno polverizzati, perché sono gastroprotetti e, se polverizzati, non funzionano bene. Anche i neonati riescono a deglutirli, bisogna però controllare a fine pasto che non ne rimangano in bocca dove potrebbero danneggiare la mucosa. Nei bambini piccoli che non sanno deglutire le capsule si aprono e si miscelano con cibi aciduli. I ragazzi più grandi possono deglutire le capsule gastroresistenti. ITALCHIMICI 56 Krilling D Manuale Uso Interno MALATTIE DEL FEGATO FEGATO GRASSO (Steatosi epatica) eccessivo accumulo di lipidi negli epatociti, che rappresenta la più comune risposta del fegato ad un insulto lesivo. Sommario: Il fegato occupa una posizione centrale nel metabolismo dei lipidi. Un piccolo gruppo di acidi grassi liberi (Free Fatty Acid, FFA) di rapido utilizzo, introdotti con gli alimenti o rilasciati nel sangue dai chilomicroni o dalle cellule adipose, fornisce quasi tutta l'energia richiesta a digiuno. Gli FFA sono captati dal fegato ed entrano a far parte del pool epatico, che è in parte sintetizzato dal fegato stesso. Alcuni FFA sono ossidati a CO2 nel fegato a scopo energetico, ma la maggior parte viene rapidamente incorporata in lipidi complessi (p. es., trigliceridi, fosfolipidi, glicolipidi, esteri del colesterolo). Alcuni di questi lipidi complessi entrano a far parte di un pool, a lenta utilizzazione, che comprende i lipidi strutturali delle cellule epatiche e dei loro depositi. La maggior parte dei trigliceridi entra in un pool attivo, dove si combina con delle apoproteine specifiche formando le lipoproteine che vengono secrete nel plasma (p. es., lipoproteine a bassissima densità (Very Low Density Lipoproteins, [VLDL]). Il fegato è anche responsabile della degradazione dei lipidi (p. es., le lipoproteine a bassa densità, i chilomicroni residui). Una steatosi epatica si verifica quando l'accumulo dei lipidi supera il normale 5% del peso del fegato. Nel tipo macrovescicolare, grosse gocce di grasso rigonfiano le cellule epatiche, spostando il nucleo alla periferia della cellula, come negli adipociti. I trigliceridi sono i grassi che si accumulano più di frequente, perché hanno l'indice di turnover più alto tra tutti gli esteri degli acidi grassi epatici. La captazione epatica degli FFA dal tessuto adiposo e dalla dieta non ha limiti, mentre l'impiego degli FFA per l'ossidazione, l'esterificazione e la secrezione delle VLDL è limitato. Nel fegato grasso microvescicolare, si accumulano piccole gocce di grasso nelle cellule, che sembrano schiumose e con nuclei centrali. I trigliceridi si raccolgono in organelli subcellulari (p. es., reticolo endoplasmico), riflettendo un disturbo metabolico diffuso. Il danno mitocondriale limita l'ossidazione degli FFA, mentre la sintesi delle apoproteine necessarie per la secrezione delle VLDL è ridotta, causando un accumulo di trigliceridi. Nella fosfolipidosi, sono i fosfolipidi che si accumulano in occasione dell'uso di certi farmaci (p. es., l'amiodarone). Le cellule epatiche sono grandi e schiumose. Eziologia La steatosi diffusa del fegato, spesso a distribuzione zonale, è associata a molte situazioni cliniche. Nei paesi sviluppati, l'alcolismo, l'obesità e il diabete sono le più comuni cause di steatosi macrovescicolare. Altre cause includono la malnutrizione (specialmente la dieta povera di proteine dei bambini affetti dal kwashiorkor), i disordini metabolici congeniti (del glicogeno, del galattoso, della tirosina o dell'omocisteina), i farmaci (p. es., i corticosteroidi) o le malattie sistemiche febbrili. Il fegato grasso microvescicolare si verifica nella steatosi epatica della gravidanza, nella sindrome di Reye, per la tossicità di alcuni farmaci (acido valproico, tetracicline, salicilato) o per dei difetti metabolici congeniti (degli enzimi del ciclo dell'urea o che coinvolgono l'ossidazione mitocondriale degli FFA). ITALCHIMICI 57 Krilling D Manuale Uso Interno La steatosi focale è molto meno frequente e di più difficile riconoscimento. I noduli, formati dagli epatociti grassi, sono sottocapsulari. Di solito, sono un reperto accidentale all'ecografia o alla TC, presentandosi come delle lesioni multiple, occupanti spazio, del fegato. Possono formarsi nei pazienti apparentemente ad alto rischio per questa condizione (p. es., pazienti obesi o alcolisti). Patogenesi I trigliceridi si accumulano nel fegato a causa di un aumentato input dovuto ad una maggiore sintesi da parte dagli FFA o ad una ridotta secrezione, sotto forma di VLDL, da parte degli epatociti. L'aumentata sintesi di trigliceridi può essere causata da un aumentato trasporto o disponibilità degli FFA (dalla dieta o mobilizzati dal tessuto adiposo), da un incremento della sintesi di acetilcoenzima-A o da una riduzione dell'ossidazione degli FFA nel fegato. La ridotta eliminazione dei trigliceridi implica un ridotto legame con le apolipoproteine, i fosfolipidi e il colesterolo e causa una ridotta secrezione di VLDL. I numerosi, possibili meccanismi coinvolti nella patogenesi della steatosi epatica possono operare isolatamente o insieme. Nell'obesità, sono aumentate la distribuzione dei grassi alimentari o la mobilizzazione dal tessuto adiposo. La ridotta ossidazione degli FFA può contribuire alla steatosi epatica indotta dal tetracloruro di carbonio, dal fosforo giallo, dall'ipossia e da alcune carenze vitaminiche (niacina, riboflavina ed acido pantotenico). Un blocco nella produzione e nella secrezione delle lipoproteine è spesso la causa principale dell'accumulo dei trigliceridi nel fegato. L'alterata sintesi delle apolipoproteine è il fattore patogenetico più importante in numerosi tipi di steatosi epatica tossica o di quella indotta da un insufficiente apporto dietetico di proteine. L'inibizione tossica della sintesi proteica può portare alla steatosi epatica attraverso l'inibizione della sintesi o della traduzione del mRNA. Nella steatosi microvescicolare, piccole gocce di trigliceridi, FFA, colesterolo e fosfolipidi si raccolgono negli organelli subcellulari. Il difetto di base è sconosciuto, anche se i reperti anatomopatologici e clinici, prodotti da cause diverse, sono in qualche modo simili. La base biochimica può essere rappresentata da un'interferenza nella via ossidativa mitocondriale, che riduce l'ossidazione degli FFA e altera la sintesi delle apolipoproteine per l'assemblaggio delle VLDL. La steatosi epatica può risultare anche da un accumulo di altri lipidi neutri. Il grasso e il colesterolo (visti al microscopio a luce polarizzata come cristalli romboidali birifrangenti) sono presenti nella malattia di Wolman e nella malattia da accumulo degli esteri del colesterolo. La vacuolizzazione steatosica può essere moderata o importante. Nella malattia di Niemann-Pick, la sfingomielina fosfolipidica si accumula negli epatociti e nelle cellule del Kupffer. Le cellule appaiono schiumose. Anatomia patologica Quando l'accumulo dei grassi è rilevante, il fegato tende a essere grossolanamente aumentato di superficie liscia e pallida. Microscopicamente, l'architettura generale può essere conservata. I accumulano sotto forma di grosse gocce che si fondono e spingono il nucleo dell'epatocita Nell'esempio tipico, la steatosi epatica alcolica, le cellule epatiche sono piene di vacuoli di spingono il nucleo alla periferia, apparendo come grosse cellule adipose. volume, con trigliceridi si in periferia. grasso che Nella steatosi epatica microvescicolare, le piccole gocce di grasso si raccolgono nel reticolo endoplasmatico e nei lisosomi secondari che non si fondono. L'epatocita ha un citoplasma schiumoso e un nucleo centrale. ITALCHIMICI 58 Krilling D Manuale Uso Interno In caso di alterazione della sintesi proteica da epatotossine o da malnutrizione proteica, i lipidi tendono ad accumularsi nella zona periportale. Il grasso microvescicolare tende a raccogliersi nella zona centrale. Sintomi, segni e diagnosi La steatosi epatica macrovescicolare viene scoperta più frequentemente all'esame obiettivo, per il riscontro di un'epatomegalia non dolorabile, liscia e uniforme in un paziente diabetico, alcolista od obeso. Può causare fastidio e dolore al quadrante superiore destro dell'addome e ittero o può essere l'unica alterazione fisica riscontrata dopo una morte improvvisa, inaspettata e, presumibilmente, dovuta a cause metaboliche. C'è una scarsa correlazione tra la steatosi epatica e le alterazioni dei test biochimici di funzionalità epatica comunemente eseguiti. Si può verificare un lieve aumento a carico della fosfatasi alcalina o delle transaminasi. L'ecografia e specialmente la TC possono mostrare il grasso in eccesso. La diagnosi di certezza di steatosi epatica si fa solo con la biopsia epatica. Poiché questo accumulo di grasso nel fegato può costituire l'unica spia di un danno da epatotossine, della presenza di una malattia non diagnosticata o di una malattia metabolica, la diagnosi richiede un'ulteriore valutazione del paziente. Il fegato grasso non alcolico (steatosi epatica non alcolica) è un accumulo, diagnosticato sempre più frequentemente, di grassi nel fegato delle donne che tendono a essere obese o diabetiche. Si verifica anche dopo un intervento di bypass digiunale, con la malnutrizione e in associazione a certi farmaci (p. es., i glucocorticoidi, gli estrogeni sintetici, l'amiodarone, il tamossifene). Può essere presente un'epatomegalia. La diagnosi istologica si basa sulla modificazione grassa macrovescicolare e sull'infiammazione lobulare, a volte associata a fibrosi e ai corpi ialini di Mallory. La condizione è spesso identificata mediante una biopsia epatica eseguita per altre ragioni, di solito in pazienti asintomatici che presentano un aumento dell'aminotransferasi plasmatica di due o tre volte il valore normale. Per la diagnosi, deve essere evidente una scarsa assunzione di alcol. Il fegato grasso microvescicolare si manifesta con affaticamento, nausea e vomito presto seguiti dall'ittero, dall'ipoglicemia, dal coma e da una Coagulazione Intravascolare Disseminata (CID). Prognosi e terapia La steatosi epatica macrovescicolare è potenzialmente reversibile ed, in genere, non è pericolosa di per sé. È reversibile anche in caso di patologie potenzialmente fatali (p. es., nella steatosi epatica della gravidanza, il parto precoce può salvare la vita della paziente). La steatosi epatica alcolica può essere associata all'infiammazione ed alla necrosi (epatite alcolica) ed ad un danno permanente sotto forma di cirrosi. Il fegato grasso microvescicolare si manifesta in maniera acuta, ma è reversibile se il paziente sopravvive. Non si dispone di alcuna terapia specifica, se non quella consistente nell'eliminazione delle cause o nel trattamento delle anomalie che sostengono la steatosi epatica. Neanche l'obesità ed il diabete mellito sembrano condurre alla cirrosi in presenza di una steatosi epatica. Sebbene le epatotossine come l'alcol o il tetracloruro di carbonio (che provoca anche una necrosi) possano, alla fine, causare una cirrosi, non ci sono prove certe che la steatosi epatica di per sé conduca alla cirrosi. Si devono verificare anche altri eventi. Il fegato grasso non alcolico di solito ha una buona prognosi, senza un'evoluzione istologica o clinica. In alcuni casi, può mostrare un'accentuata fibrosi e un'evoluzione verso la cirrosi. Il trattamento include il calo ponderale per i pazienti obesi, anche se questo non si è dimostrato particolarmente vantaggioso. Quando viene riscontrata la voce steatosi epatica su una ecografia dell'addome superiore, è bene sapere che con questo termine si intende un aumento del contenuto di grasso all'interno delle cellule del tessuto epatico, avvenuto in seguito a un processo infiltrativo o degenerativo. Questa condizione viene anche definita più semplicemente fegato grasso. Il grasso epatico rappresenta il 5% del peso dell'organo; si parla di steatosi quando questa percentuale è superata a causa di un accumulo di grasso all'interno delle cellule epatiche. La formazione di steatosi è legata al ruolo che il fegato ha nel metabolismo dei grassi ed in particolare dei trigliceridi. La steatosi si verifica quando la cellula epatica accumula trigliceridi in conseguenza di una aumentata captazione di acidi grassi come accade in corso di diabete o in presenza di obesità, oppure in conseguenza di un aumento della sintesi endogena di acidi grassi come si verifica in corso di insulino-resistenza. ITALCHIMICI 59 Krilling D Manuale Uso Interno Un terzo meccanismo alla base dello sviluppo di steatosi è rappresentato da una ridotta eliminazione dei lipidi da parte del fegato come accade in corso di malnutrizione, by-pass digiuno-ileale e diabete. Inoltre, la steatosi epatica, in una percentuale variabile dal 8 al 20%, può evolvere verso processi infiammatori e/o necrotici (“steatoepatite non alcolica” o NASH da “nonalcoholic steatohepatitis”) con eventuale fibrosi progressiva (nel 10-50% dei casi) del fegato. Le due situazioni vanno pertanto distinte, in quanto la steatosi “non infiammatoria” è reversibile con la correzione dei fattori che l’hanno indotta; la steatoepatite per definizione, è complicata da uno stato infiammatorio e fibrotico, simile, come quadro clinico ed anatomo-patologico, a quello dell'epatopatia alcolica e può progredire verso la cirrosi (in circa il 10% dei pazienti in dieci anni). I meccanismi all’origine del danno epatico in questa condizione sarebbero un’alterazione del metabolismo degli acidi grassi indotta dall'insulina, l’ossidazione dei grassi o ancora un’anomala produzione di citochine, note molecole mediatrici dell’infiammazione. Una volta esclusa l’origine alcolica (che richiederebbe una trattazione a sé per la particolare tipologia e storia naturale della malattia), nei non bevitori la steatosi epatica è più frequentemente causata da: sovrappeso ed obesità, alto tasso di colesterolo e, soprattutto, di trigliceridi, nel sangue, diabete ed altre malattie metaboliche, malattie virali (in particolare l’epatite C) e numerosi farmaci (es. estrogeni, corticosteroidi). Molti casi di steatosi che si osservano nella pratica clinica quotidiana riconoscono, comunque, come causa o co-fattore un’alimentazione sbagliata. Il fegato, infatti, è una delle prime vittime dell'alimentazione scorretta, andando incontro alla steatosi a causa dei troppi grassi che l’organismo produce o che vengono introdotti con la dieta; il fegato, così, non riuscendo a smaltirli e a trasformarli in energia, è costretto ad accumularli. L’alta prevalenza nella popolazione dei fattori di rischio sopra menzionati spiega come la steatosi epatica sia una patologia in aumento o comunque di osservazione sempre più frequente: l'alimentazione, infatti, tende sempre più a peggiorare in quanto si riducono i cibi salutari come verdura, legumi e frutta per privilegiare quelli ricchi di grassi, elaborati e superconditi. Abitudini, peraltro, spesso aggravate da uno stile di vita poco attivo, che impedisce lo smaltimento delle sostanze energetiche introdotte con la dieta. Diagnosi La steatosi epatica non presenta sintomi o, comunque, non è associata a disturbi specifici, se non a volte un vago senso di dolore, “fastidio” o pesantezza al di sotto dell’arcata costale dx o all’emiaddome alto di destra; pertanto, molto frequentemente, il riscontro è casuale, in seguito ad esami del sangue eseguiti di routine o per altri motivi. La steatosi epatica si caratterizza, infatti, per un modesto rialzo delle transaminasi (ALT e AST), espressione biochimica del danno epatico, spesso associato ad un aumento concomitante delle gammaGT. Il fegato può mostrarsi ingrandito alla palpazione; l'ecografia, esame semplice ed immediato, mostra un fegato “brillante”, facilitando così una rapida diagnosi. Nel caso di steatosi epatica, tali dati, associati ai fattori predisponenti sopra descritti, sono già sufficienti per la diagnosi e per il conseguente approccio terapeutico (per esempio, in caso di steatosi secondaria a sovrappeso od obesità, il calo ponderale graduale favorirà la risoluzione della steatosi e la normalizzazione dei livelli di transaminasi). Nel sospetto che ci sia anche un’infiammazione e/o fibrosi (“steatoepatite non alcolica”), in assenza di altre cause di malattia epatica che la possano giustificare (es. un’epatite cronica da virus C oppure un abuso alcolico, magari sottovalutato), per i motivi sopra citati di rischio di progressione, si renderà necessaria la biopsia epatica. Questa servirà sia per la conferma diagnostica che per la valutazione prognostica (grado di infiammazione e di fibrosi) della malattia epatica. Terapia Per quanto abbiamo detto, non esiste una terapia specifica per curare la steatosi del fegato. Essendo, infatti, questa l’espressione di numerose malattie e, spesso del sovrappeso, la terapia deve essere rivolta alle cause. In particolare, le misure da adottare sono l'eliminazione dell'alcol, una corretta alimentazione (mista, non incentrata su grassi e carboidrati, ricca di frutta e verdura) che porti ad una riduzione del peso corporeo, integrata con l'attività fisica o sportiva, dove possibile. Nel caso di steatosi secondaria a diabete o ad altre patologie, la terapia sarà quella del diabete stesso o delle patologie primitive. ITALCHIMICI 60 Krilling D Manuale Uso Interno Il Dr. G.I. Shulman dellaYale University sul ruolo della resistenza insulinica ed il fegato, ha descritto il ruolo cruciale dell’accumulo di grasso epatico e muscolare nella patogenesi dell’insulina resistenza, iperglicemia, e diabete associati all’obesità e all’invecchiamento. È stato discusso uno studio recente che dimostra come nei pazienti obesi, la perdita di peso di appena 8 kg sia sufficiente a pulire il fegato dai grassi, migliorare la sensibilità all’insulina e normalizzare il glucosio a digiuno. Un ulteriore supporto a questa strategia viene da uno studio israeliano che riporta come la perdita di peso, basata su una dieta di 25 kcal/kg di peso corporeo ideale/giorno per 6 mesi, dà una significativa riduzione della steatosi epatica (dal 60% al 30%) e della fibrosi in 48 pazienti con NAFLD primaria. Alcuni pazienti ricevevano anche un inibitore della lipasi pancreatica, sebbene non sembri ci fossero benefici aggiuntivi dall’uso di questo farmaco. Shulman ha anche fatto riferimento a studi su diabetici che mostrano una riduzione del grasso epatico seguente al trattamento con tiazolidinedione, rosiglitazone, ed anche a studi pilota (non-randomizzati, noncontrollati) in pazienti con NASH sia con rosiglitazone e pioglitazone, che mostrano riduzione della steatosi epatica, della necro-infiammazione, e fibrosi. Chiaramente, dati di larghi studi randomizzati e controllati di questi farmaci in pazienti con NAFLD sono necessari prima che essi possano essere raccomandati di routine per il trattamento di soggetti non-diabetici con NAFLD. Consigli pratici: Ecco come si può tenere sotto controllo il "fegato grasso": 1. evitare gli alcolici ed i grassi animali (burro e grasso della carne); 2. ridurre l’apporto calorico nella dieta, fino a eliminare l’eventuale sovrappeso; 3. prevenire qualsiasi rischio di virus-epatite : vaccinazione contro l’epatite B ed evitare contagio da conviventi malati o portatori-sani dell’epatite-C, anche eliminando l’uso promiscuo di rasoi e altri oggetti di toilette; 4. attenzione ai farmaci, dei quali non si può mai prevedere la tolleranza in questi soggetti: meglio limitarsi ai farmaci abituali, di cui si conosca l’innocuità nel caso specifico, e in dose minima efficace soprattutto per gli antibiotici e perfino per alcuni fitofarmaci; 5. fare esercizio fisico ogni giorno (esempio 3-7 km a passo veloce); 6. curare le malattie metaboliche associate, specie il diabete e l’aumento dei trigliceridi; La steatosi epatica (o fegato grasso) è una patologia cellulare legata all'accumulo intracellulare di trigliceridi (steatosi) a livello del tessuto epatico che comporta una serie di danni fino alla necrosi della cellula. Il fegato è particolarmente sensibile ai processi steatosici per essere un organo chiave nel metabolismo dei lipidi, responsabile dell'inattivazione di numerose sostanze tossiche e la cui circolazione è prevalentemente venosa (quindi costantemente vicino ad una situazione d’ipossia). Tipologie Le steatosi epatiche possono essere classificate in base all'eziologia in steatosi da aumentato apporto di grassi, steatosi da ridotto smaltimento di grassi e steatosi da aumentata sintesi endogena di grassi. Steatosi da aumentato apporto di grassi: steatosi la cui causa risiede in una dieta iperlipidica o in un'aumentata mobilizzazione dei NEFA. Quest'ultima a sua volta può essere causata da molteplici fattori tra cui stress, ormoni, caffeina e digiuno prolungato (in questo caso si ha un quadro reversibile) o da altre patologie come diabete mellito e glicogenosi di tipo I (entrambe le patologie sono caratterizzate da un deficit insulinico con conseguente aumento della lipolisi e quindi dei NEFA circolanti; si tratta di un quadro irreversibile). ITALCHIMICI 61 Krilling D Manuale Uso Interno Steatosi da ridotto smaltimento di grassi: steatosi la cui causa può essere una dieta ipoproteica, una diminuita sintesi di apolipoproteine (ad esempio per avvelenamento da tetracloruro di carbonio, aflotossina B1 o puromicina), deficit di colina, deficit di vitamina B12, eccesso di vitamina PP o ipossia. Steatosi da aumentata sintesi: steatosi dovute ad un accumulo di lipidi di sintesi endogena a partire da acetato. Esempi clinicamente importanti sono le steatosi provocate da barbiturici (in grado di stimolare la sintesi di acidi grassi a partire da acetil-CoA) e quelle da abuso di alcool (l'etanolo viene infatti metabolizzato ad acetaldeide prima e ad acetato poi). Steatosi Epatica Alcolica L'alcool (etanolo) ha svariati effetti sul nostro organismo (ad esempio a livello del sistema nervoso centrale deprime i centri inibitori, mentre a livello gastrico ha un potente effetto infiammatorio), ma i peggiori sono quelli a livello epatico. Nel fegato l'etanolo viene metabolizzato ad acetaldeide seguendo tre possibili vie: Nei perossisomi viene metabolizzato dalle catalasi con produzione di una molecola di acqua. Si tratta di una reazione dannosa in quanto comporta la produzione di specie reattive dell'ossigeno (radicali liberi). Nel citoplasma viene metabolizzato dall'enzima alcool deidrogenasi (ADH). Si tratta di una reazione di ossidazione che comporta la riduzione di una molecola di NAD+ a NADH. Quest'aspetto non va sottovalutato perché il NADH prodotto andrà a favorire la reazione che permette di passare dal diossiacetone-3-fosfato (DOAP) al glicerolo-3-fosfato (G3P) che infine contribuirà alla sintesi di trigliceridi andando indirettamente a favorire la steatosi. In misura maggiore l'etanolo viene metabolizzato dal Drug Metabolysing System a livello microsomiale: il citocromo P450 catalizza la reazione di ossidazione dell'etanolo riducendo il proprio ione di ferro (che verrà poi riossidato per poter essere nuovamente riutilizzato). Occorre notare che questo particolare meccanismo, noto anche come MEOS, è un sistema inducibile quindi il numero degli enzimi presenti nel caso di un etilista cronico sarà molto elevato e l'etanolo verrà convertito ad acetaldeide molto più velocemente. L'acetaldeide è una molecola estremamente tossica per il nostro organismo e può seguire varie strade metaboliche: A livello mitocondriale può essere metabolizzata dall'enzima acetaldeidedeidrogenasi ad acetato. Si tratta di un'altra reazione di ossidazione che comporta la produzione di un'altra molecola di NADH con le conseguenze prima descritte. L'acetato così prodotto è la causa primaria dello sviluppo della steatosi di origine alcolica. L'acetaldeide non metabolizzata favorisce la lipoperossidazione, una reazione molto pericolosa in quanto può provocare danni a livello di vari organelli cellulari (come mitocondri e RER) e alla membrana cellulare (tra le cui componenti principali troviamo i fosfolipidi). Dal punto di vista della steatosi i danni ai mitocondri possono rallentare la β-ossidazione contribuendo in questo modo all'accumulo di lipidi intracellulare (e quindi alla steatosi), mentre i danni al RER provocano una diminuzione della sintesi proteica, ivi compresa la sintesi delle apolipoproteine. Un ulteriore effetto tossico dell'acetaldeide è quello di consumare gli antiossidanti a livello epatico, causando la deplezione di glutatione e SAM (S-adenosil-metionina). L'acetaldeide inibisce MAT (metionin-adenosin-transferasi) responsabile della sintesi di SAM a partire dalla metionina e indirettamente del glutatione stesso (infatti il glutatione si ottiene a partire dalla metionina con una lunga serie di reazioni). ITALCHIMICI 62 Krilling D Manuale Uso Interno Tutto questo ha principalmente due effetti: 1. La diminuzione del glutatione è sinonimo di minore difesa verso i radicali liberi e quindi un maggior rischio di danno cellulare, di mutazione e indirettamente di insorgenza di un tumore. 2. La deplezione di SAM comporta un’ipometilazione degli acidi nucleici della cellula e questo potrebbe essere correlabile con una maggiore probabilità di cancerogenesi. Infine l'acetaldeide ha anche la capacità di formare addotti proteici e lipidici, cosa che stimola la risposta linfocitaria e macrofagica del nostro organismo con conseguente produzione di citochine e specie reattive dell'ossigeno e quindi flogosi. Nel caso dell'etilista cronico si tratterà chiaramente di un'infiammazione cronica con conseguente stimolazione di collagenosintesi e proliferazione di cellule stellate, primo passo verso l'evoluzione cirrotica e la compromissione dell'organo. Steatosi epatica non alcolica (NAS) Presente negli obesi con un'incidenza del 57-74% e spesso associata al diabete di tipo II. All'ecografia molti soggetti presentano segni di steatosi epatica senza manifestazioni cliniche evidenti. I soggetti diabetici insulino-resistenti presentano una spiccata attività lipolitica, cui corrisponde un sovraccarico della β-ossidazione e quindi un contributo alla steatosi. L'eccesso di acidi grassi comporta la loro lipoperossidazione che può innescare un processo infiammatorio cronico (steatoepatite) che termina con l'evoluzione cirrotica e la compromissione dell'organo. In sintesi Che cos’è il Fegato Grasso Il fegato grasso è l’accumulazione di grasso nelle cellule del fegato. Il semplice Fegato Grasso, diagnosticato di solito con l’ecografia epatica, non è una malattia, poiché non danneggia il fegato, ma è una condizione che può essere identificata con l’ecografia epatica e, se necessario, attraverso il prelievo di un campione di tessuto epatico (biopsia epatica) che viene esaminato al microscopio. Un altro termine usato per descrivere questa condizione è infiltrazione grassa del fegato. Quali sono le cause del fegato grasso ? L’accumulo di grasso nel fegato è generalmente in connessione con l’uso eccessivo di alcool, con l’aumento eccessivo di peso o malattie metaboliche, come il diabete mellito. Il fegato grasso puo’ anche insorgere in seguito ad una dieta povera di nutrienti o alcune malattie, come la tubercolosi, l’operazione chirurgica di bypass intestinale per l’obesità, e certi farmaci come i farmaci anti-estrogeni utilizzati nelle donne operate di tumore al seno (es. tamoxifene) o altri farmaci, tra cui anche i corticosteroidi. Come viene identificato il fegato grasso ? Un fegato grasso è in genere sospettato in un paziente con le malattie o le condizioni sopra descritte. Il paziente può avere un fegato ingrossato o un minor innalzamento degli esami degli enzimi epatici (le famose transaminasi). Diversi studi dimostrano che il fegato grasso è una delle cause più comuni di lieve innalzamento degli enzimi epatici (ipertransaminasemia) riscontrabile durante i prelievi di sangue occasionali fatti di routine. L’ecografia epatica o la TAC o la risonanza magnetica sono in grado di fare diagnosi di steatosi epatica. Con l’ecografia epatica è tipica l’immagine di un fegato iperriflettente, cioè piu’ grigio chiaro, sulla scala dei grigi, denominato anche “fegato brillante”. Nel caso in cui la steatosi permanga nonostante i tentativi di cura e gli enzimi epatici rimangano persistentemente alterati, oggi si pone l’indicazione anche alla biopsia epatica, per dimostrare se esiste anche un’infiammazione, oltre all’accumulo di grasso, cioè la steatoepatite, che nel 15% dei casi puo’ evolvere verso la cirrosi ed il tumore del fegato. ITALCHIMICI 63 Krilling D Manuale Uso Interno Come può il grasso entrare nel fegato ? Non è ancora certo come avvenga l’accumulo di grasso nel fegato. Una recente teoria corredata da prove sperimentali per lo piu’ sull’animale sembra aver dimostrato che il meccanismo per cui il grasso si accumula nelle cellule del fegato passa, sia nel caso che la causa sia l’alcool (Steatosi epatica Alcolica o AFLD) che nel caso in cui la causa sia l’alimentazione e l’obesità (Steatosi epatica Non-alcolica o NAFLD) o i farmaci, sempre attraverso le stesse vie biochimiche-metaboliche. Un paziente ha un fegato grasso quando il grasso supera il peso del fegato del 5%. Una possibile spiegazione del fegato grasso include il trasferimento del grasso da altre parti del corpo, o un incremento dell’estrazione di grasso presente nel fegato dall’intestino. Altre spiegazioni sono che il fegato riduce la quota di grasso che esso degrada e rimuove. Mangiando del cibo grasso in se stesso non si produce comunque un fegato grasso, occorrono altri fattori, tra cui anche una predisposizione genetica. Può il fegato grasso condurre ad altre malattie del fegato ? Un semplice fegato grasso non è associato con una qualsiasi altra anomalia del fegato come la cicatrizzazione o l’infiammazione. E’ un comune ritrovamento in pazienti che sono molto in sovrappeso o sono affetti da diabete mellito. Pazienti che bevono troppo alcool per molti anni possono sviluppare un danno alcolico al fegato che include il fegato grasso. L’alcolismo può anche dare origine ad un’infiammazione del fegato (Epatite Alcoolica) e/o cicatrizzazione (Cirrosi alcolica). Vari esperimenti suggeriscono che mentre il fegato grasso è generalmente presente in pazienti con eccessiva assunzione di alcool, il fegato grasso non conduce di per sè a sviluppare un’Epatite Alcolica o una Cirrosi Alcolica. Un’infiammazione del fegato associata ad un’incremento del deposito di grasso può essere presente anche in soggetti astemi, solitamente obesi, e spesso nei pazienti diabetici. Questa malattia, che assomiglia all’Epatite Alcolica, è chiamata Steatoepatite-Non-alcoolica (NASH). Questo tessuto grasso nel fegato può andare incontro a morte cellulare (Steatonecrosi) ed il paziente può sviluppare la Cirrosi (Cicatrizzazione del fegato). Alcuni studi hanno mostrato che dal 20% al 40% delle persone obese svilupperanno la NASH. Comunque, solo perché un paziente è obeso non significa che svilupperà la NASH. Alcuni ricercatori hanno messo in relazione lo sviluppo della NASH con uno scarso controllo del diabete mellito, una rapida perdita di peso, o nelle donne, l’assunzione di ormoni (estrogeni). Può essere curato il fegato grasso ? Il trattamento del fegato grasso è in rapporto alla causa. E’ importante ricordare che un semplice fegato grasso non richiede trattamento, poiché non risulta danneggiare le cellule epatiche o portare ad una vera e propria malattia clinicamente evidente. Pazienti obesi con fegato grasso avranno una riduzione o la perdita di eccesso di grasso nelle cellule epatiche, cosi come in altre cellule del corpo, se dimagriscono e perdono peso. Pazienti che bevono alcool in eccesso avranno anch’essi una perdita di grasso nel fegato quando cesseranno di bere l’alcool. Un buon controllo del diabete mellito con la dieta, con i farmaci, o con l’insulina fa calare il contenuto del grasso nel fegato. ITALCHIMICI 64 Krilling D Manuale Uso Interno STEATOEPATITE NON ALCOLICA (O NASH) Che cos’è la Steatoepatite Non-alcoolica ? La Steatoepatite Non-alcoolica (NASH) è descritta come un’infiammazione del fegato associata con l’accumulazione del grasso nel fegato. Non è in relazione con altre cause di malattia cronica del fegato, che includono l’Epatite da virus B e C, i disordini autoimmuni, l’alcool, tossicità da farmaci e l’accumulo di rame (malattia di Wilson) o di ferro (emocromatosi). Differisce dal semplice accumulo di grasso nel fegato (chiamato fegato grasso o Steatosi Epatica) per il fatto che la progressione della malattia causa un danno alle cellule del fegato mentre il fegato grasso non lo fà. Poiché è stata riconosciuta in principio come un’entità specifica nel 1980, la NASH venne anche chiamata Epatite grassa del fegato, Malattia di Laennec nonalcoolica, steatonecrosi, Epatite diabetica ed oggi giustamente NASH Quali sono le cause della Steatoepatite Non-alcoolica ? Non c’è una causa specifica nota di NASH. Nel passato, il tipico paziente NASH era descritto come una persona di mezza età, preferenzialmente donna, obesa, con diabete mellito. In aggiunta il paziente può avere avuto un eccesso di grassi nel sangue (iperlipoproteinemia, ipercolesterolemia o ipertrigliceridemia), e può avere avuto altri problemi correlati con quella che oggi viene chiamata “sindrome metabolica” (ipertensione arteriosa, malattie cardiovascolari, etc.) Recentemente è stato riportato di pazienti con NASH che non sempre corrispondono a questa descrizione. Uno studio includeva uomini come anche donne che non erano in sovrappeso, non sofferenti di diabete mellito e che non hanno avuto un eccesso di lipidi nel loro sangue. Un altro gruppo diagnosticato con NASH erano bambini tra i nove e i sedici anni di età. La maggior parte dei bambini era sovrappeso, ma solo due su trenta aveva il diabete mellito. Pure incerto è se l’accumulo di grasso nel fegato sia la causa dell’infiammazione o se ci siano altre ragioni che causano l’epatite. Le ricerche in questo campo si stanno sviluppando moltissimo in questi ultimi anni. Come viene diagnosticata la Steatoepatite Non-alcoolica ? Molti pazienti con NASH sono inconsapevoli della loro condizione perché non mostrano nessun sintomo. Nel diagnosticare la NASH, il medico eliminerà prima le altre possibili cause di una malattia cronica del fegato. La diagnosi deve essere confermata da una biopsia epatica, una procedura dove il medico inserisce un ago entro il fegato, solitamente sotto controllo ecografico, ed estrae un campione di tessuto che viene esaminato sotto le lenti del microscopio. Qual’è la storia naturale di NASH ? Precedentemente, i medici credevano che la NASH fosse un disordine benigno che non progredisse o si sviluppasse lentamente. Recenti studi e l’esperienza di epatologi in tutto il mondo indica invece che la NASH può dare origine nel tempo alla presenza di tessuto fibroso del fegato nel 40% dei pazienti o addirittura a Cirrosi nel 10-15% dei pazienti. Le ragioni non sono note e, a tutt’oggi, molti studi sono in corso per cercare di capire perché alcuni pazienti affetti da NASH progrediscono in questa seria forma cronica di malattia del fegato mentre altri no. Come viene trattata la NASH ? Attualmente uno specifico trattamento per la NASH, universalmente convenuto, non esiste. Comunque, ai soggetti obesi, diabetici e con alte concentrazioni di grassi nel sangue, si raccomanda il calo ponderale ed il controllo del loro diabete e delle elevate concentrazioni lipidiche. Generalmente viene raccomandata una dieta ipocalorica, ipolipidica (cioè bassa in grassi e calorie) assieme a farmaci in grado di abbassare lo zucchero del sangue (ipoglicemizzanti orali) o insulina. Per i pazienti con NASH che non sono in soprappeso e non sono diabetici, una dieta leggera è spesso ugualmente raccomandata. Vari farmaci tra cui, alcuni probiotici, gli ipoglicemizzanti orali d’ultima generazione, gli acidi grassi omega-3, sono in corso di sperimentazione, in studi clinici controllati in varie parti del mondo, per poter sviluppare terapie sempre più efficaci. ITALCHIMICI 65 Krilling D Manuale Uso Interno La Sindrome Metabolica Per sindrome metabolica (detta anche sindrome X, sindrome da insulino-resistenza, CHAOS o sindrome di Reaven) s’ intende, in ambito medico, una situazione clinica ad alto rischio cardiovascolare che comprende una serie di fattori di rischio e di sintomi che si manifestano contemporaneamente nell'individuo. Questi sono spesso correlati allo stile di vita della persona (peso eccessivo, vita sedentaria) o a situazioni patologiche preesistenti (obesità, ipercolesterolemia - presenza di un elevato tasso di colesterolo nel sangue - ecc.). Colpisce un'elevata percentuale della popolazione a livello mondiale, principalmente d'età avanzata. Gli studi svolti confermano che gli individui colpiti dalla sindrome metabolica, che non cambiano drasticamente il proprio stile di vita, hanno un elevato tasso di mortalità legato a problemi cardiovascolari. Storia Il termine sindrome metabolica sembra risalire agli anni cinquanta, ma è divenuto di uso comune a partire dal 1970; tuttavia già nei primi anni venti erano stati constatati i legami presenti tra i fattori di rischio ed il diabete. Il medico marsigliese Jean Vague, nel 1947, aveva fatto un'interessante scoperta sulle persone affette da obesità: aveva notato che esse erano predisposte al diabete, aterosclerosi, gozzo (ingrossamento della tiroide) e calcolosi urinaria. Nella seconda metà degli anni sessanta Avogaro e Crepaldi con i loro collaboratori descrissero sei pazienti che presentavano moderati segni di obesità, ipercolesterolemia ed una marcata ipertriglicemia; tali segni migliorarono con una dieta ipocalorica povera di carboidrati. Nel 1977 Haller usò il termine "sindrome metabolica" per intendere un'associazione di obesità, diabete mellito e steatosi epatica, descrivendo in aggiunta i fattori di rischio dell'arterosclerosi. Nello stesso anno Singer usò il termine per indicare una concomitanza di sintomi quali: obesità, gozzo, diabete mellito, ipertensione arteriosa. Nel 1977-78 Gerald B. Phillips mise in discussione la tesi secondo cui i fattori di rischio all'origine dell'infarto del miocardio concorrano a formare una «costellazione di anormalità» e che questi non solo erano associate a malattie del cuore ma anche con obesità de altri fattori clinici, la cui identificazione avrebbe potuto prevenire le malattie cardiovascolari. Phillips ipotizzava che tale fattore avesse strette correlazioni con gli ormoni sessuali. Il nome della sindrome Nel 1988 Gerald M. Reaven ha definito sindrome X la manifestazione simultanea di: insulino-resistenza, iperinsulinemia, stati pre-diabetici o diabete mellito di tipo 2 conclamato, dislipidemia, obesità centrale, iperuricemia (una concentrazione alta di acido urico nel sangue), ed ipertensione arteriosa, considerandola una condizione clinica che precede lo sviluppo di complicanze vascolari. Ad essa si associa un'aumentata incidenza di cardiopatia ischemica, disfunzioni del ventricolo sinistro e scompenso cardiaco. Tutto ciò comporta un forte incremento del rischio di mortalità per cause cardiovascolari. Tale sindrome era conosciuta anche con il nome di Sindrome di Reaven, in suo onore. Le stesse patologie cardiovascolari inducono, a loro volta, insulino-resistenza ed aumentano la probabilità che si sviluppi nel tempo un diabete mellito di tipo 2. La sindrome X è stata definita anche sindrome da insulino-resistenza e successivamente sindrome metabolica cardiovascolare. Attualmente la sindrome è stata rinominata plurimetabolica e comprende l'associazione di: insulino-resistenza, iperinsulinemia, obesità centrale, intolleranza glucidica o diabete mellito di tipo 2, iperuricemia, dislipidemia e ipertensione arteriosa. Su quasi tutti i testi è ancora comune trovare la dicitura di sindrome metabolica, mentre in Australia tale sindrome è conosciuta con il nome di CHAOS. ITALCHIMICI 66 Krilling D Manuale Uso Interno Criteri per l'identificazione Nel 2005 l' International Diabetes Federation ha rivisto i criteri diagnostici, proponendo come metodo per identificare la patologia la presenza nello stesso paziente di 2 dei seguenti disordini: Glicemia a digiuno: oltre 100 mg/dl stadio IFG; Ipertensione arteriosa: oltre i 130/85 mm Hg o terapia ipotensivante; Ipertrigliceridemia: oltre i 150 mg/dl; Ridotto colesterolo HDL: 40 mg/dl nei maschi, 50 mg/dl nelle femmine o terapia ipolipemizzante, associati a una circonferenza vita oltre i 94 cm nei maschi, 80 cm nelle femmine per i pazienti di etnia Europide (i parametri variano in base al gruppo etnico d’appartenenza). A questi si aggiunge un importante fattore di rischio, l'età, che è determinante a partire dai 45 anni negli uomini e dai 55 nelle donne. Epidemiologia Le differenti definizioni della sindrome hanno determinato la rilevazione di una serie di valori di prevalenza nella popolazione, variabili dallo 0,8 al 35,3%. Molti studi epidemiologici infatti hanno valutato i vari aspetti della sindrome metabolica valutandoli singolarmente, e solo alcuni di essi l'hanno considerata come un "cluster" (termine di derivazione inglese usato in campo scientifico per indicare un gruppo) di fattori di rischio e, in quanto tale, ne hanno stimato la prevalenza nella popolazione generale. Ciò rende ragione dell'ampio range di prevalenza dei valori che vengono riportati nella letteratura medica. Studi svolti Secondo i dati di uno studio prospettico randomizzato di un campione tratto dalla popolazione di Brunico, comune della Provincia di Bolzano, con età superiore a 40 anni, circa il 19% degli Italiani non diabetici di età superiore ai 45 anni potrebbe essere affetto da sindrome metabolica. Inoltre risulta che il soggetto non diabetico affetto da tale stato morboso non si differenzia in maniera sensibile da chi non ha la sindrome per quel che riguarda sesso, colesterolo-LDL e fumo, cioè 3 dei 5 fattori classici di rischio cardiovascolare (gli altri 2 sono età e pressione arteriosa). Chi invece è affetto da sindrome ha un indice di massa corporea, ovvero il rapporto tra massa e altezza di un individuo con il quale si rileva il proprio peso forma, molto maggiore mentre minore è l'esercizio fisico svolto. Ad oggi abbiamo risposte certe circa la corrispondenza di esiti clinici infausti con la sindrome metabolica così individuata. Nel primo studio prospettico, condotto in Finlandia, un campione di individui di sesso maschile di età media al di sotto della quinta decade manifestava, nelle persone affette da tale patologia, secondo i criteri individuati in accordo con un'organizzazione mondiale della salute (NCEP-ATP III) un rischio di mortalità totale e cardiovascolare entro i 10 anni più di 3 volte superiore di chi non era affetto da tale malattia. A questo primo studio sono seguiti almeno altre quattro ricerche su campioni della popolazione generale, in cui erano rappresentati entrambi i sessi. Di comune accordo la comunità medica ha riportato che la sindrome costituisce un fattore di rischio indipendente per quel che riguarda la morbilità e la mortalità cardiovascolare. Sembra inoltre emergere che in termini proporzionali, ma non assoluti, la sindrome conferisca un rischio molto maggiore alle donne che agli uomini. In Italia In Italia, la sindrome metabolica interessa circa il 25% degli uomini e addirittura il 27% delle donne. Sono dei numeri altissimi, che equivalgono a circa 14 milioni di individui. ITALCHIMICI 67 Krilling D Manuale Uso Interno Eziologia Il circolo vizioso dell'insulino resistenza. Secondo le ultime analisi l'insulino-resistenza riveste un ruolo centrale nella genesi della sindrome. L'iperinsulinemia, suo derivato, è risultata un fattore di rischio indipendente per la cardiopatia ischemica; contribuisce all'esordio precoce del diabete, nonché alla sua progressione, e concorre alla comparsa delle numerose altre condizioni patologiche associate che si traducono in fattori di rischio cardiovascolare. Definizione Per insulino-resistenza si intende una condizione nella quale le quantità fisiologiche di insulina producono una risposta biologica ridotta, cioè una riduzione dell'azione precoce dell'insulina sul controllo glucidico dopo il pasto; ad esso è associata un'inadeguata soppressione insulinica durante il digiuno notturno, in presenza di una sintesi conservata. Ne segue un'alternanza tra insulino-resistenza e iperinsulinemia, verificabile con il riscontro di elevate concentrazioni insuliniche a digiuno e dopo i pasti. Una ridotta soppressione dell'insulina durante il digiuno notturno si verifica anche in caso di iperinsulinemia e non è necessariamente associata ad insulino-resistenza. L'insulino-resistenza, peraltro, non è sempre associata all'iperglicemia e non è dunque prerogativa esclusiva dei pazienti diabetici. La dimostrazione del ruolo fondamentale dell'insulino-resistenza e dell'iperinsulinemia nel determinare le patologie cardiovascolari è documentata dagli studi clinici. Studi effettuati Nello studio di Despres sono stati valutati alcuni parametri dalle analisi del sangue relativi al profilo lipidico (colesterolo totale, colesterolo HDL, trigliceridi, valori plasmatici di apolipoproteina B) e glucidico (valori ematici di insulina a digiuno) di 2.103 soggetti di sesso maschile, di età compresa fra 45 e 76 anni, presi a campione della popolazione del Québec. L'analisi fu eseguita a partire dal1973, lungo un periodo di cinque anni, per determinare l'associazione tra fattori di rischio cardiovascolare e cardiopatia ischemica nel corso di una lunga indagine. Durante lo studio è stata osservata un'insulinemia a digiuno decisamente più elevata (p < 0,001) nei pazienti in cui sono stati registrati eventi ischemici. L'associazione iperinsulinemia-cardiopatia aterosclerotica ha mantenuto questo tasso elevato anche dopo una correzione dei livelli di trigliceridi, apolipoproteina B, colesterolo LDL e colesterolo HDL. Perciò le elevate concentrazioni plasmatiche d’insulina in soggetti non diabetici, e quindi classificabili come "insulino-resistenti", erano associate a un incremento della cardiopatia ischemica indipendentemente dal profilo lipidico (benché un'alterazione di quest'ultimo in senso pro-aterogeno abbia un effetto sinergico l'iperinsulinemia). Altri autori, fra cui Lehto et al., hanno valutato l'associazione tra i valori di insulinemia a digiuno, l'eventuale presenza contemporanea di altri fattori di rischio cardiovascolare e il rischio di morte per cardiopatia ischemica in 510 pazienti affetti da diabete di tipo 2 (253 uomini e 257 donne). Nei soggetti di sesso maschile si è riscontrato un aumento significativo in termini statistici della mortalità per cause cardiovascolari se i valori di insulinemia erano superiori ai 140 pmol/l (p = 0,006); la stessa associazione non ha evidenziato però alcuna rilevanza statistica nelle donne (p = 0,090). Il valore predittivo dell'iperinsulinemia riguardo alla morte per cardiopatia ischemica è risultato indipendente dai convenzionali fattori di rischio cardiovascolare, ma non da quei fattori di rischio legati alla condizione patologica di insulino-resistenza/iperinsulinemia (obesità centrale, ipertrigliceridemia, ipocolesterolemia HDL), che sembrano piuttosto potenziarlo. ITALCHIMICI 68 Krilling D Manuale Uso Interno Oltre al ruolo svolto nel metabolismo glucidico, l'insulina contribuisce alla regolazione del metabolismo lipidico e proteico e della pressione arteriosa, interferendo con la funzione piastrinica e con l'equilibrio tra fattori protrombotici e modulatori della fibrinolisi endogena. Regola inoltre gli stimoli proliferativi sulle cellule muscolari lisce della parete vascolare e influenza la funzione endoteliale: tutto ciò spiega il possibile ruolo che l'insulino-resistenza esercita nel determinismo della sindrome metabolica. Non sono ancora noti né i meccanismi con cui si instaura l'insulino-resistenza né i siti di interazione insulinasuperficie cellulare-comparto intracellulare, nei quali la catena di segnali prodotti dall'ormone si interrompe, impedendo un adeguato utilizzo del glucosio circolante. L'insulino-resistenza si sviluppa quasi sicuramente molto prima della sindrome metabolica e di altre patologie cliniche più avanzate, come lo stesso diabete mellito di tipo 2 e l'arterosclerosi, apparendo in tutti i contesti come una realtà multifattoriale sia in merito alla genesi che ai danni potenziali. Stati pre-diabetici ed intolleranza glucidica Gli stati pre-diabetici ed il diabete mellito di tipo 2 conclamato sono essi stessi fattori di rischio cardiovascolare annoverati nell'ambito della sindrome metabolica. I pazienti con alterata tolleranza glucidica o con iperglicemia a digiuno mostrano le caratteristiche cliniche della sindrome da insulino-resistenza, con un rischio relativo di sviluppare complicanze macrovascolari (e in particolare cardiopatia ischemica) di due-tre volte superiore a quello di soggetti sani di pari età. Cause di morte Nei pazienti diabetici la patologia cardiovascolare e cerebrovascolare è responsabile del 65% dei decessi e di questo 65%, il 40% è imputabile a cardiopatia ischemica, il 15% ad altre forme di cardiopatia e il 10% ad eventi cerebrovascolari. Obesità Si definisce obeso un individuo la cui massa di tessuto adiposo sia eccessiva per la sua struttura corporea, costituisce, da solo, un fattore di rischio per la salute in genere. L'ingrandimento della cellula adiposa vede attivare una complessa risposta cellulare. Un ruolo primario è esercitato dalle adipochine (le molecole proteiche citochine, o molecole simil-citochiniche), la cui regolazione nell'adipocita risente della dimensione delle riserve energetiche cellulari. Fra esse, troviamo: Leptina, questo ormone, secreto dagli adipociti ha la caratteristica di inviare un segnale di sazietà all'ipotalamo, tale sensazione si diffonde a tutto l'individuo. Viene prodotto in base alla dimensione della cellula adiposa allo scopo di scongiurare l'incremento di volume cellulare. Esercita molteplici effetti favorevoli su dimensioni e distribuzione del tessuto adiposo, sulla fertilità femminile e regola alcuni processi infiammatori; TNF-alfa, (dove TNF è un acronimo di Tumour Necrosis Factor, fattore di necrosi tumorale) che viene prodotto dagli adipociti nelle condizioni di insulino-resistenza e di ipertrofia della cellula adiposa, provoca insulino-resistenza, questo perché altera la trasmissione del segnale insulinico mediante la repressione dell'espressione del genere di IRS1, uno dei fattori post-recettoriali responsabili dell'effetto intracellulare dell'insulina. Interleuchina-6, una molecola che induce la sensazione di stanchezza, che viene prodotta e rilasciata dal tessuto adiposo in quantità biologicamente significative; se ne riscontrano aumenti nell'obesità e negli stati di insulino-resistenza epatica, provocando l'attivazione di processi infiammatori; ITALCHIMICI 69 Krilling D Manuale Uso Interno Adiponectina, che viene prodotta e rilasciata dal tessuto adiposo in quantità biologicamente significative; l'espressione è inibita negli adipociti nelle condizioni di insulino-resistenza e di ipertrofia della cellula adiposa; ha azione diretta insulino-sensibilizzante sul fegato, è inversamente correlata all'insulino-sensibilità periferica e svolge azione anti-infiammatoria in antagonismo diretto rispetto a TNF-alfa e interleuchina-6. Le adipocitochine, sono delle proteine "messaggere" di segnali importanti per i meccanismi dell'infiammazione. Alterazioni del metabolismo lipidico Le alterazioni del profilo lipidico che caratterizzano la sindrome metabolica sono verosimilmente secondarie all'insulino-resistenza, che modifica la fisiologica soppressione del rilascio di acidi grassi da parte del tessuto adiposo nella fase post-prandiale. La maggiore disponibilità di precursori condiziona un aumento della sintesi di C-LDL da parte del fegato e una maggiore disponibilità di trigliceridi nella circolazione sistemica. L'insulino-resistenza si associa ad una ridotta attività delle lipoproteinlipasi di origine endoteliale che, in condizioni fisiologiche, contribuiscono alla sottrazione di trigliceridi dal flusso circolatorio e all'utilizzo dei prodotti del loro catabolismo come fonte energetica da parte dell'apparato muscolo-scheletrico. Anche le LDL sono più ricche di trigliceridi e assumono l'aspetto di particelle più piccole e dense di quelle presenti nei soggetti con normale sensibilità all'insulina, manifestando una maggiore aterogenicità. Con il termine catabolismo s'intende l'insieme dei processi di eliminazione che hanno come prodotti finali sostanze più semplici e povere di energia, liberando quella in eccesso sotto forma di energia chimica ed energia termica. Le modificazioni indotte dall'insulino-resistenza sul metabolismo lipidico favoriscono lo sviluppo di obesità, che nei pazienti con sindrome metabolica assume un aspetto centrale con distribuzione viscerale dell'adipe soprattutto a carico dell'addome (Borsa omentale e sottocutaneo). L'insulino-resistenza modifica l'equilibrio tra fattori protrombotici e regolatori della fibrinolisi endogena a favore dei primi, contribuendo anche attraverso questo meccanismo all'aterosclerosi precoce e all'instabilità delle placche ateromasiche. L'iperinsulinemia e un'eventuale iperglicemia agiscono in modo sinergico con l'insulino-resistenza nel favorire una generica condizione di "trombofilia". Tra le anomalie più comuni del sistema emocoagulativo si segnalano l'iperattività piastrinica, l'incremento dei livelli plasmatici di alcuni precursori trombinici così come della stessa trombina e del D-dimero, e infine l'aumento di alcuni inibitori fisiologici della fibrinolisi come l'inibitore dell'attivatore del plasminogeno-1 e l'inibitore trombin-attivabile della fibrinolisi. Per trombofilia si intende una malattia ematologica, dovuta ad una coagulazione eccessiva del sangue, sviluppando di conseguenza trombosi ed embolie, sia venose che arteriose. A tutto questo si associa un'importante disfunzione endoteliale che si esprime principalmente con una riduzione dei vasodilatatori fisiologici (ossido nitrico, prostacicline) e con un aumento dei fattori ad azione proaggregante e vasocostrittrice (endotelina-1). Ipertensione arteriosa L'ipertensione arteriosa è una delle componenti cliniche costanti nella sindrome metabolica. Nel diabete mellito può essere una condizione clinica associata che si comporta come un ulteriore fattore di rischio cardiovascolare, o la conseguenza della nefropatia diabetica, la quale esordisce con la microalbuminuria e progredisce successivamente verso la sindrome nefrosica e l'insufficienza renale cronica. Si definisce nefropatia diabetica l'insieme di alterazioni che coinvolgono il rene. ITALCHIMICI 70 Krilling D Manuale Uso Interno L'insulino-resistenza come causa dell'ipertensione arteriosa Valori tensione arteriosa Diastolica < 80 Ottimale < 85 Normale 85-89 Moderata > 89 Primo stadio d’ipertensione Sistolica < 120 Ottimale < 130 Normale 130-139 Medio - Elevata > 139 Primo stadio d’ipertensione Il ruolo dell'insulino-resistenza nella genesi dell'ipertensione arteriosa è documentato dall'osservazione che, in assenza di diabete mellito noto o clinicamente evidente, un'insulino-resistenza e un'iperinsulinemia sono state rilevate in oltre il 70% dei pazienti con ipertensione arteriosa essenziale, non necessariamente obesi. La prevalenza dell'ipertensione arteriosa nei pazienti con diabete mellito è circa doppia rispetto a quella della popolazione generale e tende ad aumentare in funzione dell'età, della durata della malattia diabetica, della presenza di obesità e di complicanze macro e microvascolari. La condizione d’insulino-resistenza/iperinsulinemia si associa alla riduzione della vasodilatazione endotelio-dipendente. L'aumento delle concentrazioni di insulina circolante favorisce il riassorbimento renale di sodio e di acqua, una maggiore risposta vasocostrittrice all'aldosterone e all'angiotensina II, una ridotta azione dell'ormone natriuretico atriale, la stimolazione dell'attività nervosa simpatica e la modificazione di fattori locali di regolazione del tono vascolare, con inevitabili ripercussioni sulla pressione arteriosa sistemica. Inoltre la stimolazione dei fattori di crescita mediata dall'iperinsulinemia, soprattutto di quelli che agiscono sulla muscolatura liscia vasale come l'insulin-like growth factor-1, contribuisce alla vasocostrizione periferica e quindi all'aumento delle resistenze vascolari periferiche totali. L'ipertensione arteriosa accelera la progressione dei danni microvascolari e macrovascolari indotti dal diabete e dagli altri fattori di rischio cardiovascolare e aumenta la probabilità di eventi clinici di tipo ischemico, come dimostrato nello studio osservazionale UKPDS36 (UK Prospective Diabetes Study). Esiste una correlazione positiva tra valori progressivamente più elevati di pressione sistolica e la maggiore incidenza di infarto miocardico, che risulta peraltro di circa due volte più frequente per ciascun punto di pressione sistolica media nei pazienti diabetici. Oltre ad accelerare i processi di aterosclerosi vascolare, l'ipertensione arteriosa danneggia anche il miocardio modificandone la struttura, la funzione diastolica e quella sistolica. Il risultato finale è il rimodellamento del ventricolo sinistro, fenomeno progressivo ed evolutivo verso l'insufficienza cardiaca. ITALCHIMICI 71 Krilling D Manuale Uso Interno È stata dimostrata una stretta associazione tra diabete mellito e ipertensione arteriosa con lo sviluppo d’ipertrofia ventricolare sinistra, con un conseguente impatto maggiore del solo diabete sullo spessore della parete e dell'associazione diabete/ipertensione sulla massa ventricolare totale. La funzione ventricolare sinistra è compromessa sia nei pazienti affetti dalla sola ipertensione che in quelli affetti dal solo diabete, anche se l'entità della compromissione è decisamente più rilevante in coloro che presentano entrambe le patologie. Anche i fenomeni di morte cellulare programmata (apoptosi) vengono facilitati dalla coesistenza di ipertensione arteriosa e di diabete mellito attraverso l'aumento delle concentrazioni di angiotensina 2 secondario all'iperattivazione del sistema rennina-angiotensina. D'altro canto l'aumento dello stress ossidativo secondario alla disfunzione endoteliale, associato all'insulinoresistenza, di per sé sembra facilitare il fenomeno dell'apoptosi a livello delle cellule miocardiche, che vanno incontro a necrosi, e contribuire in tal modo allo sviluppo della cardiomiopatia descritta nei pazienti diabetici. Conclusioni In definitiva i pazienti con sindrome metabolica presentano un rischio elevato di sviluppare precocemente l'aterosclerosi, una malattia cronica delle arterie, e le sue complicanze. Riconoscere tale condizione permette di identificare i soggetti il cui profilo di rischio impone drastiche misure di correzione dello stile di vita. Volendo raggiungere i normali valori del peso corporeo ideale, del profilo glico-lipidico e dei valori di pressione arteriosa, bisogna sia fare attività fisica e seguire una dieta equilibrata sia vietare il fumo e comportamenti scorretti e nocivi. Relazioni con la cardiopatia ischemica Il termine "fattore di rischio" apparve per la prima volta nel titolo di un articolo medico del 1963 e divenne successivamente ampiamente accettato anche per caratterizzare altre conseguenze dell'aterosclerosi, quali ictus e arteriopatia periferica. Il rischio cardiovascolare, così come definito da ampi studi osservazionali, non risulta in rapporto ad un solo determinante, ma appare correlato ad un ampio spettro di fattori di rischio che si manifestano in maniera diversa in ciascun individuo. Se un soggetto può presentare alcune di queste condizioni singolarmente espresse ad un livello elevato (per esempio grave ipercolesterolemia familiare, ovvero l'eccesso di colesterolo nel sangue o ipertensione arteriosa di grado severo), altri soggetti possono vedere accresciuto il loro rischio in quanto presentano una costellazione di caratteristiche solo lievemente alterate. Se pure queste ultime non appaiono da sole capaci di influenzare l'incidenza di malattie cardiovascolari, esse si potenziano reciprocamente e il rischio che ne deriva diventa clinicamente significativo. Si parla pertanto di «rischio cardiovascolare globale»: è chiaro che questa globalità è in funzione del tipo e del numero, oltre che del livello dei fattori di rischio considerati, e che potrà ulteriormente variare in funzione di condizioni non incluse o per valori dei fattori di rischio non considerati. Tutti i fattori implicati nella sindrome metabolica sono i principali fattori di rischio cardiovascolari. Diabete e rischio cardiovascolare Vari studi epidemiologici e patologici indicano il diabete come un fattore di rischio indipendente per le cardiopatie sia negli uomini sia nelle donne. La percentuale di morte delle persone affette da diabete per colpa di malattie cardiovascolari si attesta al 65%. Il diabete mellito è inoltre un fattore prognostico negativo per tutti i pazienti con malattia coronarica e in particolare per i pazienti sottoposti ad interventi coronarici percutanei (PCI). La restenosi, anomalia che si verifica quando si riformano placche aterosclerotiche nelle coronarie, in precedenza rimosse con un intervento chirurgico chiamato angioplastica, rappresenta il principale svantaggio degli interventi coronarici per via transcutanea da quando sono state utilizzate per la prima volta. ITALCHIMICI 72 Krilling D Manuale Uso Interno A seguito del danno causato dalla restenosi le cellule muscolari lisce vascolari (VSMCs, acronimo di Vascular Smooth Muscle Cells) modificano il loro fenotipo, prima contrattile ora sintetico (dedifferenziazione), proliferando nella tonaca media e formando così la neointima. Altri studi hanno invece dimostrato che le cellule di midollo osseo circolanti originano la metà del tessuto neointimale. Per fenotipo si intende la totale manifestazione fisica di un organismo, ottenuti da una combinazione fra il patrimonio genetico e le condizioni ambientali in cui vive. La neointima è una nuova struttura organica creata dall'accumulo di cellule muscolari lisce nella tonaca intima, causata sempre da un qualche danno all'organismo provocato da un intervento sulla persona (angioplastica, catetere a palloncino) Per prevenire la restenosi si utilizzano farmaci antiaggreganti (come l'aspirina), ipolipemizzanti (come le statine); si dovrebbe inoltre cessare il consumo di sigarette e similari e infine mantenere un corretto profilo glucidico (ridurre l'assunzione di carboirdati). L'NO (ovvero l'ossido nitrico) sembra svolgere un lavoro di "protezione" del sistema vascolare, inibendo l'attivazione delle piastrine, l'ispessimento della neointima, il reclutamento dei leucociti e l'ossidazione delle LDL. Di fatto, la perdita della vasodilatazione NO-dipendente è un aspetto importante nella disfunzione endoteliale caratterizzante il diabete, poiché inibisce l'attivazione delle piastrine, l'ispessimento della neointima, il reclutamento dei leucociti e l'ossidazione delle LDL. Si pensa che l'NO, con alcuni fattori di crescita, favorisca la proliferazione endoteliale, tanto nel corso del cambio endoteliale che nella creazione di nuovi vasi. Oltre al rischio concreto che corre una persona di sviluppare malattia aterosclerotica coronarica, esiste anche una cardiomiopatia diabetica che non si associa agli altri fattori di rischio cardiovascolare ma che deriva soltanto dalle alterazioni metaboliche della malattia diabetica. Diverse alterazioni molecolari sono state riscontrate nel diabete mellito. Il tessuto muscolare diabetico, mostra una riduzione dell'attivazione indotta dall'insulina di PI3 kinase e di AKT. Nel miocardio di persone diabetiche è anche presente una alterazione della risposta angiogenetica in seguito ad ischemia, anomalia che si fonde con la riduzione delle capacità riparative. Dislipidemie e rischio cardiovascolare Per dislipidemia si intende un qualsiasi difetto del metabolismo delle lipoproteine. Tra i fattori di rischio cardiovascolare, un ruolo di primo piano è riconosciuto ai disordini del metabolismo lipidico. La maggior parte dei pazienti che presentano aterosclerosi precoce non sono affetti da iperlipemie gravi, piuttosto manifestano aumenti di grado moderato di colesterolo LDL e trigliceridi o una riduzione di colesterolo HDL. Un aumento della colesterolemia, e in particolare dei livelli di LDL, rappresenta un determinante principale di malattia coronarica, specialmente quando inserito nel contesto del profilo di rischio complessivo. L'aumento del grasso viscerale, la cosiddetta obesità addominale, una pressione arteriosa elevata e l'insulinoresistenza sono tutti fattori spesso associati ad un incremento dei livelli plasmatici di trigliceridi e ad una riduzione del colesterolo HDL. La lipodistrofia di Dunnigan è un'anomalia genetica con caratteristiche che ricordano la sindrome metabolica. Studi clinici Studi clinici controllati hanno valutato l'effetto di varie strategie ipolipemizzanti, farmacologiche e non farmacologiche, sul profilo dei lipidi plasmatici in questi stessi soggetti, correlandone le modificazioni all'evolutività delle lesioni vascolari e alle caratteristiche degli eventi. Le più recenti linee guida (in particolare USA e Europea) hanno indicato l'opportunità di privileggiare il trattamento dei soggetti a maggior rischio cardiovascolare globale. In questo ambito il trattamento delle dislipidemie, anche lievi, si è mostrato capace di ridurre l'incidenza di eventi e la mortalità cardiovascolare. ITALCHIMICI 73 Krilling D Manuale Uso Interno Ipertensione e rischio cardiovascolare Livelli pressori pre-ipertensivi (fra i 120/80 ed i 139/89 mmHg) sono associati ad aumento del rischio di malattie cardiovascolari. Il rischio risulta comunque abbastanza eterogeneo: alcuni soggetti pre-ipertesi sono infatti maggiormente a rischio, come ad esempio anziani, obesi, diabetici ed afro-americani. Sembra che sia la pressione sistolica il fattore maggiormente predittivo di rischio cardiovascolare. Ciò è valido in un ampio range di età. Rispetto alla pressione sistolica, quella differenziale e la pressione arteriosa media non risultano altrettanto costantemente indicative come fattori predittivi del rischio cardiovascolare nelle varie fasce d'età. Un'eccessiva riduzione della pressione diastolica dovrebbe essere evitata nei pazienti con coronaropatie. Bisogna comunque rimanere aggressivi nella riduzione della pressione, soprattutto di quella sistolica, ma clinicamente non si deve dimenticare che se la pressione diastolica scende sotto i 70 mmHg è possibile andare incontro a compromissione del flusso coronarico ed all'aumento del rischio di un evento negativo. La perfusione coronarica avviene infatti prevalentemente durante la diastole, in contrasto con quanto avviene in tutti gli altri settori della circolazione. Il minor rischio di esiti negativi si osserva per una pressione di 128/74 mmHg. La sistole è una fase del ciclo cardiaco in cui il muscolo cardiaco si contrae, la pressione sistolica si riferisce infatti al valore pressorio del sangue arterioso più alto raggiunto durante il battito cardiaco La diastole è il periodo di rilassamento del muscolo cardiaco dopo la contrazione (ovvero la sistole), la pressione diastolica si riferisce infatti al valore pressorio del sangue arterioso più basso raggiunto durante il battito cardiaco Obesità e rischio cardiovascolare L'obesità è una situazione di accumulo anomalo o eccessivo di grasso nei tessuti adiposi del corpo che comporta rischi per la salute. La causa di fondo è un'eccedenza energetica che determina un aumento di peso; in altre parole le calorie introdotte sono superiori alle calorie bruciate. L'IMC (un acronimo con il quale si indica l'indice di massa corporea) si calcola dividendo il peso espresso in chilogrammi per altezza espressa in metri al quadrato (kg/m2). Normalmente l'IMC si dovrebbe attestare ad un valore che oscilla fra i 18,5 e i 25 ,superando il valore di 25 si entra nella fascia di rischio del soggetto, dove si possono riscontrare disturbi associati. Il rischio aumenta con l'aumentare del valore, diventando dapprima moderato fino a trasformarsi in alto. Una volta raggiunto il valore di 25 la persona viene definita come in soprappeso; Superato il valore di 30 si rientra nel termine “obeso” Sovrappeso e obesità sono influenzati da molti fattori tra cui la predisposizione ereditaria, fattori ambientali e comportamentali, invecchiamento e gravidanze. Entrano in gioco anche fattori biologici come ormoni, genetica, stress, farmaci e invecchiamento. L'obesità predispone l'individuo ad una serie di fattori di rischio cardiovascolare tra cui il diabete, l'ipertensione e l'aumento del tasso di colesterolo nel sangue. Il diabete di tipo 2 è quello maggiormente legato all'obesità e al sovrappeso. In effetti, il rischio di sviluppare il diabete di tipo 2 aumenta già con un IMC nettamente al di sotto della soglia dell'obesità (IMC = 30). Il rischio di diabete di tipo 2 aumenta parallelamente all'IMC, soprattutto nei soggetti con una predisposizione genetica a questa malattia e cala parallelamente alla perdita di peso. ITALCHIMICI 74 Krilling D Manuale Uso Interno Le persone definite obese possono più facilmente riscontrare valori alti di trigliceridi (ovvero un tipo di grassi presenti nel sangue) e bassi valori di colesterolo HDL, il cosiddetto “colesterolo buono”, e di elevati valori di colesterolo LDL, definito anche come "colesterolo cattivo". Le persone obese con un forte accumulo di grasso endo addominale (la cosiddetta forma a “mela") sono più facilmente soggette a tale situazione metabolica, ed hanno un elevato rischio di malattie coronariche. Con strumenti quali esercizio fisico e dieta e con conseguente diminuzione del peso, è prevedibile che la situazione lipidica nel sangue migliori Sono stati effettuati molti studi approfonditi sullo stretto rapporto che lega l'ipertensione (ovvero la pressione arteriosa elevata) e obesità, e nei paesi sviluppati l'ipertensione causata dall'obesità è calcolata sul 30-65% (a seconda degli studi). Infatti all'aumento del valore dell'IMC si riscontra un aumento della pressione arteriosa, il rapporto è stato calcolato che ad ogni 10 kg corrisponda un aumento della pressione di 2-3 mm. Tale simbiosi la si riscontra anche quando il peso diminuisce, ed il rapporto in questo caso diventa che ad ogni 1% di peso complessivo perso corrisponda una diminuzione della pressione di 1-2 Hg Vi è una predisposizione maggiore all'ipertensione nelle persone definite in soprappeso rispetto a quelle con peso normale. Tre volte superiore in genere e sei volte superiore per la fascia di età cha va dai 20 ai 44 anni. Esami da laboratorio Mentre per quanto riguarda la pressione come esame basta una normale visita medica, servono esami da laboratorio, possibili grazie ad un semplice prelievo di sangue dell'individuo, per l'indicazione degli altri fattori che costituiscono la sindrome metabolica. Tali esami sono: Glicemia, la misura della concentrazione di glucosio nel sangue. Il suo valore può essere misurato in mg/dl o in mmol/l: vengono considerati normali valori a digiuno compresi tra 70 mg/dl e 110 mg/dl, valori superiori a digiuno potrebbe essere sintomo di diabete; Colesterolo frazionato (HDL ed LDL) e totale; Trigliceridemia, (presenza di trigliceridi nel sangue.Il valore considerato normale è 40-170mg/dl); MicroAlbuminuria, misura della quota di Albumina escreta nelle urine, il cui valore non deve superare i 20mg nelle urine raccolte nelle 24h; Uricemia (presenza di acido urico nel sangue), il cui valore non deve essere superiore a 6,4 mg/dl (>380 micromol/L). Risonanza magnetica cardiovascolare Grazie all'alta definizione della risonanza magnetica cardiovascolare di perfusione, si è compreso per la prima volta che vi sono difetti di perfusione subendocardica. Raffrontando due risonanze, una di una persona normale l'altra di una persona affetta da sindrome metabolica si nota come il rapporto di riserva di perfusione miocardica fra endocardio ed epicardio è notevolmente inferiore mostrandone una ridotta riserva. Ecocardiografia L'ecocardiografia basale rappresenta un elemento insostituibile nella diagnosi delle cardiopatie. In particolare, nel campo della cardiopatia ischemica essa costituisce un elemento diagnostico, valutativo e prognostico di sempre crescente importanza. Spesso sostituisce il test ergometrico, in cui l'esercizio fisico è spesso poco tollerato dai pazienti. Inoltre il test ergometrico può presentare delle alterazioni patologiche elettro-cardiografiche di base che ne inficiano l'interpretazione, e può mostrare numerosi artefatti dovuti al movimento durante il test. ITALCHIMICI 75 Krilling D Manuale Uso Interno Numerosi studi hanno già messo in evidenza la maggiore specificità del test ecocardiografico al didipiridamolo rispetto al test elettrocardiografico al cicloergometro; la differenza di sensibilità tra i due test non sembra essere invece significativa. La diagnosi della cardiopatia ischemica rappresentata nella sua espressione più classica della angina da sforzo è legata alla possibilità di riprodurre in laboratorio l'ischemia miocardica. L'aumento dei determinanti del consumo di ossigeno del miocardio in presenza di stenosi coronarica critica, determina una cascata di eventi che vanno dalla riduzione del flusso fino all'angina. Inizialmente si manifesta una riduzione del flusso diretto verso la zona sottostante la stenosi con conseguente disparità di flusso tra zone normalmente irrorate e zone ischemiche. Seguono quindi nelle zone ischemiche alterazioni metaboliche con passaggio al metabolismo anaerobico, riduzione della contrazione miocardica, comparsa di alterazioni elettrocardiografiche ischemiche ed, eventualmente, angina. L'ischemia miocardica determina notevoli alterazioni funzionali miocardiche. Nel soggetto normale durante la sistole si determina una notevole riduzione concentrica delle dimensioni ventricolari, un progressivo ispessimento del miocardio, dovuto principalmente allo strato sottoendocardico. In caso d’ischemia l'ispessimento del miocardio si riduce fino a scomparire del tutto. Si osservano, inoltre, zone più o meno estese di alterazioni cinetiche, che vanno dalla ipocinesia (riduzione dei movimenti sistolici della parete) alla acinesia (assenza di movimenti sistolici) alla discinesia (movimento paradosso della parete miocardica verso l'esterno). Per la diagnosi d’ischemia miocardica entrambi i fenomeni vanno accuratamente osservati. Alcune zone del muscolo cardiaco possono essere acinetiche anche in condizioni di riposo. Questo può significare che quelle zone non sono più vive (necrotiche), ma si sono trasformate in cicatrice in seguito a un troppo prolungato mancato apporto di sangue (infarto), o che la riduzione del flusso (ischemia) è così grave, che le zone interessate possono sopravvivere solo evitando di contrarsi. Quando vengono sottoposte a uno stimolo, le zone acinetiche, ma ancora vitali, possono riprendere a contrarsi, differentemente da quelle necrotiche. L'ecocardiografia consente quindi di valutare se le zone che a riposo non si contraggono sono vive e rimangono ferme per “non soffrire” o se sono irrimediabilmente danneggiate (valutazione della vitalità miocardica). L'ecocardiogramma è stato studiato nella cardiopatia ischemica dapprima come eco monodimensionale ed in seguito come eco bidimensionale. Gli agenti stressanti sono rappresentati dall'esercizio fisico e dagli agenti farmacologici: dipiridamolo, dobutamina-9, ladenosina. Durante lo stress, sia esso fisico o farmacologico, vengono monitorati continuamente l'elettrocardiogramma e la pressione. Lo scopo dell'esame è quello di valutare cosa succede al cuore quando la richiesta delle sue prestazioni viene aumentata. La durata dello stress farmacologico dipende dal farmaco utilizzato, ma in genere non supera i trenta minuti. Valutazione dell'ischemia L'ischemia inducibile con lo stress (ergometrico o farmacologico) si evidenzia, all'ecocardiogramma, con: asinergie regionali transitorie; riduzione della frazione di eiezione. Criteri di gravità basso dosaggio di farmaco necessario ad indurre ischemia (bassa soglia); brevità del tempo dall'inizio dell'infusione al momento di comparsa dell'ischemia (bassa soglia); estensione dell'asinergia indotta dal farmaco (coronaropatia estesa); comparsa di segni di insufficienza cardiaca (coronaropatia estesa). ITALCHIMICI 76 Krilling D Manuale Uso Interno Terapie nella sindrome metabolica Trattamento specifico: prima di tutto occorre curare ogni singolo fattore di rischio, ovviamente non essendo obbligatoriamente necessaria la presenza di tutti i fattori, si curano sono quelli accertati. Obesità - Per ridurre l'ecessivo grasso spesso basta seguire una dieta equilibrata, effettuare esercizio fisico. Diabete - Per la cura si utilizza l'insulina e gli ipoglicenizzanti orali. Ipertrigliceridemia - Per ridurla si utilizzano gli omega, i fibrati e le statine. Quando i trigliceridi superano 400 mg/dl la scelta del farmaco più appropriato ricade sulla niacina e gli Omega Livello Trigliceridi Concentrazione Normale minore di 150 mg/dl Medio alto 150-199 mg/dl Alto 200-499 mg/dl Molto Alto pari o superiore a 500 mg/dl Trattamento specifico: Altri fattori Colesterolo: per contrastare la presenza di eccessivo colesterolo nel sangue si somministra uno dei farmaci della famiglia delle statine (atorvastatina, simvastatina, pravastatina, fluvastatina, ecc). La Lipoproteina (a) trasporta il colesterolo dai tessuti periferici al fegato, abbassarne il livello (solitamente alto nelle persone affette dalla sindrome metabolica) risulta difficile, per questo si consiglia di effettuare una terapia aggressiva con i farmaci ipolipemizzanti. Pressione: per ridurre la pressione si utilizzano farmaci specifici con vari meccanismi d’azione. Trattamento generale - Nei pazienti affetti da sindrome metabolica con ischemia dimostrata agli esami non invasivi, si è soliti trattare l'angina con i calcioantagonisti. In questi soggetti può essere anche efficace il trattamento del reflusso esofageo e dell'alterata motilità correlata. Gli estrogeni somministrati alle donne dopo la menopausa hanno migliorato il flusso coronarico e la vasodilatazione mediata dall'endotelio, tuttavia l'efficacia clinica di questo trattamento deve essere ancora dimostrata. Prevenzione - Molti fattori possono essere controllati o modificati dallo stile di vita di una persona. Un'attività fisica regolare (circa 30 minuti al giorno) migliora la captazione di insulina da parte dei tessuti, migliora in generale tutto il metabolismo dei carboidrati, nonché contribuisce alla diminuzione del peso corporeo che è notoriamente associato ad una diminuzione dei valori pressori. Una dieta povera di grassi e ricca di alimenti contenenti acidi grassi Omega-3, o con essi supplementata, diminuisce il colesterolo totale ed i trigliceridi, aumentando le HDL e di conseguenza migliorando l'assetto lipidico e l’indice di resistenza glicemico. Critiche e controversie - Negli studi fatti finora si è dimostrato che esistono molti criteri per la definizione di sindrome metabolica ma tutti strettamente connessi l'uno con l'altro. Definizione di Sindrome - In un dizionario famoso di medicina la sindrome è definita come un aggregato di sintomi e segni associati con un unico processo morboso che costituiscono insieme il disegno della malattia. Valutando questa definizione, la sindrome metabolica non dovrebbe rientrare nella classificazione tipica della parola “sindrome”, per questo è ultimamente definita sindrome plurimetabolica anche se più correttamente si dovrebbe chiamare plurisindrome metabolica. Nota: La sindrome metabolica è denominata CHAOS in Australia. ITALCHIMICI 77 Krilling D Manuale Uso Interno Krilling D Bibliografia 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. 31. 32. 33. 34. 35. 36. 37. 38. 39. 40. 41. 42. 43. 44. 45. 46. 47. 48. 49. 50. 51. 52. 53. 54. 55. 56. 57. 58. 59. 60. Bucher H C, Hengstler P, Schindler C, Meier G. Ω3 polyunsaturated fatty acids in coronary heart disease: a meta-analysis of randomized controlled trials. Am.J Med 2002; 112 (4): 298-304. Albert C M, Campos H, Stampfer M J, Ridker P M, Manson J E, Willett W C, Ma J. Blood levels of long-chain ω3 fatty acids and the risk of sudden death. N.Eng. J Med 2002; 346 (15): 1113-8. Marchioli R, Barzi F, Bomba E, Chieffo C, Di Gregorio D, Di Mascio R, Franzosi M G, Geraci E, Levantesi G, Maggioni A P,Mantini L, Marfisi R M, Mastrogiuseppe G, Mininni N, Nicolosi G L, Santini M, Schweiger C, Tavazzi L, Tognoni G, Tucci C, Valagussa F. GISSI-Prevenzione Investigators. Early protection against sudden death by ω3 polyunsaturated fatty acids after myocardial infarction: time-course analysis of the results of the Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto Miocardico (GISSI)-Prevenzione. Circulation 2002; 105 (16): 1897-9 Kang JX, Leaf A. Prevention of fatal cardiac arrhythmias by polyunsaturated fatty acids. Am J Clin Nutr 2000; 71: 202-207. Connor W E. Importance of ω3 fatty acids in health and disease. Am J Clin Nutr 2000; 71 (1Suppl): 171S-5S. Horrocks L A, Yeo Y K. Health benefits of docosahexaenoic acid (DHA). Pharmacol Res 1999; 40 (3): 211-25. Peet M, Glen I, Horrobin D F (eds). Phospholipid spectrum disorder in psychiatry. Carnforth: Marius Press 1999. Rudin D O. The major psychoses and neuroses as Omega-3 essential fatty acid deficiency syndrome: substrate pellagra. Biol Psychiatry 1981; 16 (9): 837-50. Rudin D O. The dominant diseases of modernized societies as Omega-3 essential fatty acid deficiency syndrome: substrate beriberi. Med Hypotheses 1982; 8 (1): Burr M L. Lessons from the story of ω3 fatty acids. Am J Clin Nutr 2000; 71 (1 Suppl): 397S-8S. Kris-Etherton P M, Taylor D S, Yu-Poth S, Huth P, Moriarty K, Fishell V, Hargrove R L, Zhao G, Etherton T D. Polyunsaturated fatty acids in the food chain in the United States. Am J Clin Nutr 2000; 71 (1 Suppl): 179S-88S. Salem N. Omega-3 fatty acids: Molecular and biochemical aspects. New Protective Roles for Selected Nutrients. New York: Alan E. Liss Inc. Salem N Jr, Litman B, Kim H Y, Gawrisch K. Mechanisms of action of docosahexaenoic acid in the nervous system. Lipids 2001; 36 (9): 945-59. Pawlosky R J, Hibbeln J R, Novotny J A, Salem N Jr. Physiological compartmental analysis of alpha-linolenic acid metabolism in adult humans. J Lipid Res 2001; James M J, Gibson R A, Cleland L G. Dietary polyunsaturated fatty acids and inflammatory mediator production. Am J Clin Nutr 2000; 71: 343-8. De Caterina R, Liao J K, Libby P. Fatty acid modulation of endothelial activation. Am J Clin Nutr 2000; 71 (1 Suppl): 213S-23S. Simopoulos A P. Essential fatty acids in health and chronic disease. Am J Clin Nutr 1999; 70 (3 Suppl): 560S-569S. Mahadik S P, Evans D R. Essential fatty acids in the treatment of schizophrenia. Drugs of Today 1997; 33 (1): 5-17. Mitchell D C, Gawrisch K, Litman B J, Salem N Jr. Why is docosahexaenoic acid essential for nervous system function? Biochem Soc Trans 1998; 26 (3): 365Simopoulos A P, Leaf A, Salem N Jr. Workshop on the Essentiality of and Recommended Dietary Intakes for Omega-6 and Omega-3 Fatty Acids. J Am Coll Nutr 1999; 18 (5): 487-9. Simopoulos AP. Human requirement for Ω3 polyunsaturated fatty acids. Poult Sci 2000; 79 (7): 961-70. Birch E E, Garfield S, Hoffman D R, Uauy R, Birch D G. A randomized controlled trial of early dietary supply of long-chain polyunsaturated fatty acids and mental Development in term infants. Dev Med Child Neurol 2000; 42 (3): 174-81. Birch E E, Hoffman D R, Castaneda Y S, Fawcett S L, Birch D G, Uauy R D. A randomized controlled trial of long-chain polyunsaturated fatty acid supplementation of formula in term infants after weaning at 6 wk of age. Am J Clin Nutr 2002; 75 (3): 570 Champoux M, Hibbeln J R, Shannon C, Majchrzak S, Suomi S J, Salem N Jr, Higley J D. Fatty acid formula supplementation and neuromotor development in rhesus monkey neonates. Pediatr Res 2002; 51 (3): 273-81. San Giovanni J P, Parra-Cabrera S, Colditz G A, Berkey C S, Dwyer J T. Meta-analysis of dietary essential fatty acids and long-chain polyunsaturated fatty acids as they relate to visual resolution acuity in healthy preterm infants. Pediatrics 2000; 105 (6): 1292-8. Rapoport S I, Chang M C, Spector A A. Delivery and turnover of plasma-derived essential PUFAs in mammalian brain. J Lipid Res 2001; 42 (5): 678-85.. Crawford M. Placental delivery of arachidonic and docosahexaenoic acids: implications for the lipid nutrition of preterm infants. Am J Clin Nutr 2000; 71 (1Suppl): Richards M P, Pettitt P B, Stiner M C, Trinkaus E. Stable isotope evidence for increasing dietary breadth in the European mid-Upper Paleolithic. Proc Natl Acad Sci U S A 2001; 98 (11): 6528-32. Nunez E A. Fatty acids involved in signal cross-talk between cell membrane and nucleus. Prostaglandins Leukot Essent Fatty Acids 1997; 57 (4-5): 429-34. Mirnikjoo B, Brown S E, Kim H F, Marangell L B, Sweatt J D, Weeber E J. Protein kinase inhibition by Omega-3 fatty acids. J Biol Chem 2001; 276 (14): 10888Chen G, Hasanat K A, Bebchuk J M, Moore G J, Glitz D, Manji H K. Regulation of signal transduction pathways and gene expression by mood stabilizers and antidepressants. Psychosom Med 1999; 61 (5): 599-617. Chen G, Masana M I, Manji H K. Lithium regulates PKC-mediated intracellular cross-talk and gene expression in the CNS in vivo. Bipolar Disord 2000; 2 (3): 217Seung Kim H F, Weeber E J, Sweatt J D, Stoll A L, Marangell L B. Inhibitory effects of Omega-3 fatty acids on protein kinase C activity in vitro. Mol Psychiatry 2001; 6 (2): 246-8. Venkatraman J, Meksawan K. Effects of dietary Omega-3 and Omega-6 lipids and vitamin E on chemokine levels in autoimmune-prone MRL/MpJ-lpr/lpr mice. J Nutr Biochem 2002; 13 (8): 479-81. Ergas D, Eilat E, Mendlovic S, Sthoeger Z M. Ω3 fatty acids and the immune system in autoimmunity. Isr Med Assoc J 2002; 4 (1): 34-8. Rapoport S I, Bosetti F. Do lithium and anticonvulsants target the brain arachidonic acid cascade in bipolar disorder? Arch Gen Psychiatry 2002; 59 (7): 592-6. Mahadik S P, Scheffer R E. Oxidative injury and potential use of antioxidants in schizophrenia. Prostaglandins Leukot Essent Fatty Acids 1996; 55 (1-2): 45-54. Mahadik S P, Mukherjee S. Free radical pathology and antioxidant defense in schizophrenia: a review. Schizophr Res 1996; 19(1): 1-17. Mahadik S P, Mukherjee S, Scheffer R, Correnti E E, Mahadik J S. Elevated plasma lipid peroxides at the onset of nonaffective psychosis. Biol Psychiatry 1998; Mahadik S P, Evans D, Lal H. Oxidative stress and role of antioxidant and Omega-3 essential fatty acid supplementation in schizophrenia. Prog Neuropsychopharmacol Biol Psychiatry 2001; 25 (3): 463-93. Crawford M A, Bloom M, Broadhurst C L, Schmidt W F, Cunnane S C, Galli C, Gehbremeskel K, Linseisen F, Lloyd-Smith J, Parkington J. Evidence for the unique function of docosahexaenoic acid during the evolution of the modern hominid brain. Lipids 1999; 34 (1 Suppl): S39-S47. Al M D, Van Houwelingen A C, Kester A D M, Hasaart T H M, De Jong A E P, Hornstra G. Maternal essential fatty acid patterns during normal pregnancy and their relationship to the neonatal essential fatty acid status. Br J Nutr 1995; 74: 55-68. Al M D, van Houwelingen A C, Hornstra G. Long-chain polyunsaturated fatty acids, pregnancy, and pregnancy outcome. Am J Clin Nutr 2000; 71: 285-91. Matorras R, Ruiz J I, Perteagudo L, Barbazan M J, Diaz A, Valladolid A, Sanjurjo P. Longitudinal study of fatty acids in plasma and erythrocyte phospholipids during pregnancy. J Perinat Med 2001; 29 (4): 293-7. Hibbeln J R. Seafood consumption, the DHA content of mothers' milk and prevalence rates of postpartum depression: a cross-national, ecological analysis. J Affect Disord 2002; 69 (1-3): 15-29. Helland I B, Saugstad O D, Smith L, Saarem K, Solvoll K, Ganes T, Drevon C A. Similar effects on infants of ω3 and ω6 fatty acids supplementation to pregnant and lactating women. Pediatrics 2001; 108 (5): E82. Olsen S F, Hansen H S, Sommer S, Jensen B, Sorensen T I, Secher N J, Zachariassen P. Gestational age in relation to marine ω3 fatty acids in maternal erythrocytes: a study of women in the Faroe Islands and Denmark. Am J Obstet Gynecol 1991; 164 (5): 1203 Olsen S F, Sorensen J D, Secher N J, Hedegaard M, Henriksen T B, Hansen H S, Grant A. Randomised controlled trial of effect of fish-oil supplementation on pregnancy duration. Lancet 1992; 339 (8800): 1003-7. Petridou E, Koussouri M, Toupadaki N, Youroukos S, Papavassiliou A, Pantelakis S, Olsen J, Trichopoulos D. Diet during pregnancy and the risk of cerebral palsy. Br J Nutr 1998; 79 (5): 407-12. Olsen S F, Secher N J, Tabor A, Weber T, Walker J J, Gluud C. Randomised clinical trials of fish oil supplementation in high risk pregnancies. Fish Oil Trials In Pregnancy (FOTIP) Team. Br J Obstet Gynecol 2000; 107 (3): 382-95. Olsen S F, Secher N J. Low consumption of seafood in early pregnancy as a risk factor for preterm delivery: prospective cohort study. BMJ 2002; 324: 447-9. Wainwright P E. Dietary essential fatty acids and brain function: a developmental perspective on mechanisms. Proc Nutr Soc 2002; 61 (1): 61-9. Zimmer L, Vancassel S, Cantagrel S, Breton P, Delamanche S, Guilloteau D, Durand G, Chalon S. The dopamine mesocorticolimbic pathway is affected by deficiency in ω3 polyunsaturated fatty acids. Am J Clin Nutr 2002; 75 (4): 662-7 Manna V, Daniele M T, Pinto M. Disedonia. Ruolo della disregolazione omeostatica edonica nelle dipendenze patologiche da sostanze ed in altri disturbi psicopatologici. Giornale Italiano di Psicopatologia 2003; 9 (1): 71-92. Kodas E, Vancassel S, Lejeune B, Guilloteau D, Chalon S. Reversibility of ω3 fatty acid deficiency-induced changes in dopaminergic neurotransmission in rats: critical role of developmental stage. J Lipid Res 2002; 43 (8): 1209-19. Takeuchi T, Fukumoto Y, Harada E. Influence of a dietary ω3 fatty acid deficiency on the cerebral catecholamine contents EEG and learning ability in rat. Behav Brain Res 2002; 131 (1-2): 193-203. Holman R T, Johnson S B, Ogburn P L. Deficiency of essential fatty acids and membrane fluidity during pregnancy and lactation. Proc Natl Acad Sci 1991; 88: Willatts P, Forsyth J S, Di Modugno M K, Varma S, Colvin M. Effect of long-chain polyunsaturated fatty acids in infant formula on problem solving at 10 months of age. Lancet 1998; 352: 688-91. Mortensen E L, Michaelsen K F, Sanders S A, Reinisch J M. The association between duration of breastfeeding and adult intelligence. JAMA 2002; 287 (18): Cheruku S R, Montgomery-Downs H E, Farkas S L, Thoman B, Lammi-Keefe C J. Higher maternal plasma docosahexaenoic acid during pregnancy is associated with more mature neonatal sleep-state patterning. Am J Clin Nutr 2002; 76 (3): 608-13. ITALCHIMICI 78 Krilling D Manuale Uso Interno 61. 62. 63. 64. 65. 66. 67. 68. 69. 70. 71. 72. 73. 74. 75. 76. 77. 78. 79. 80. 81. 82. 83. 84. 85. 86. 87. 88. 89. 90. 91. 92. 93. 94. 95. 96. 97. 98. 99. 100. 101. 102. 103. 104. 105. 106. 107. 108. 109. 110. 111. 112. 113. 114. 115. 116. 117. 118. 119. Wainwright P E. Do essential fatty acids play a role in brain and behavioral development? Neurosci Biobehav Rev 1992; 16 (2): 193-205. Richardson A J, Puri B K. The potential role of fatty acids in attentioωdeficit/hyperactivity disorder. Prostaglandins Leukot Essent Fatty Acids 2000; 63 (1-2): 79Richardson A J, Puri B K. A randomized double-blind, placebo-controlled study of the effects of supplementation with highly unsaturated fatty acids on ADHDrelated symptoms in children with specific learning difficulties. Prog Neuropsychopharmacol Biol Psychiatry 2002; 26 (2): 233-9. Richardson A J, Ross M A. Fatty acid metabolism in neurodevelopmental disorder: a new perspective on associations between attention-deficit/hyperactivity disorder, dyslexia, dyspraxia and the autistic spectrum. Prostaglandins Leukot Essent Fatty Acids 2000; 63 (1-2): 1-9. Stevens L J, Zentall S S, Abate M L, Kuczek T, Burgess J R. Omega-3 fatty acids in boys with behavior, learning, and health problems. Physiol Behav 1996; 59 Taylor K E, Richardson A J. Visual function, fatty acids and dyslexia. Prostaglandins Leukot Essent Fatty Acids 2000; 63 (1-2): 89 Taylor K E, Higgins C J, Calvin C M, Hall J A, Easton T, McDaid A M, Richardson A J. Dyslexia in adults is associated with clinical signs of fatty acid deficiency. Prostaglandins Leukot Essent Fatty Acids 2000; 63 (1-2): 75-8. Burgess J R, Stevens L, Zhang W, Peck L. Long-chain polyunsaturated fatty acids in children with attentioωdeficit hyperactivity disorder. Am J Clin Nutr 2000; 71 Richardson A J, Cox I J, Sargentoni J, Puri B K. Abnormal cerebral phospholipid metabolism in dyslexia indicated by phosphorus-31 magnetic resonance spectroscopy. NMR Biomed 1997; 10 (7): 309-14. Colquhoun I, Bunday S. A lack of essential fatty acids as a possible cause of hyperactivity in children. Med Hypotheses 1981; 7(5): 673-9. Stevens L J, Zentall S S, Deck J L, Abate M L, Watkins B A, Lipp S R, Burgess J R. Essential fatty acid metabolism in boys with attentioωdeficit hyperactivity disorder. Am J Clin Nutr 1995; 62 (4): 761-8. Stordy B J. Dark adaptation, motor skills, docosahexaenoic acid, and dyslexia. Am J Clin Nutr 2000; 71: 323-6. Castellanos F X, Lee P P, Sharp W, Jeffries N O, Greenstein D K, Clasen L S, Blumenthal J D, James R S, Ebens C L, Walter J M, Zijdenbos A, Evans A Giedd J N, Rapoport J L. Developmental trajectories of brain volume abnormalities in children and adolescents with attentioωdeficit/hyperactivity disorder. JAMA 2002; 288 (14): 1740-8. Aman M G, Mitchell E A, Turbot S H. The effects of essential fatty acid supplementation by Efamol in hyperactive children. J Abnorm Child Psychol 1987; 15: 75Arnold L E, Kleycamp D, Votolato N A. Gamma-linolenic acid for attention deficit hyperactivity disorder: Placebo-controlled comparison to D-amphetamine. Biol Psychiatry 1989; 25: 222-8. Voigt R G, Llorente A M, Jensen C L, Fraley J K, Berretta M C, Heird W C. A randomized, double-blind, placebo-controlled trial of docosahexaenoic acid supplementation in children with attentioωdeficit/hyperactivity disorder. J Pediatr 2001; 139 (2): 189-96. Young G S, Conquer J A, Thomas R. Effect of randomized supplementation with high dose olive, flax or fish oil on serum phospholipid fatty acid levels in adults with attention deficit hyperactivity disorder. Reprod Nutr Dev 2005; 45 (5): 549-58. Bell J G, Sargent J R, Tocher D R, Dick J R. Red blood cell fatty acid compositions in a patient with autistic spectrum disorder: a characteristic abnormality in neurodevelopmental disorders? Prostaglandins Leukot Essent Fatty Acids 2000; 63 (1-2): 21-5. MacDonell L E, Skinner F K, Ward P E, Glen A I, Glen A C, Macdonald D J, Boyle R M, Horrobin D F. Increased levels of cytosolic phospholipase A2 in dyslexics. Prostaglandins Leukot Essent Fatty Acids 2000; 63 (1-2): 37-9. Slade M, Priebe S. Are randomised controlled trials the only gold that glitters? Br J Psychiatry 2001; 179: 286-7. Connor W E, Neuringer M. The effects of ω3 fatty acid deficiency and rpletion upon the fatty acid composition and function of the brain and retina. Prog Clin Biol Res 1988; 282: 275-94. Peet M, Laugharne J, Rangarajan N, Horrobin D, Reynolds G. Depleted red cell membrane essential fatty acids in drug-treated schizophrenic patients. J Psychiatr Res 1995; 29 (3): 227-32 Mukerjee S, Mahadik S P, Scheffer R, Correnti E E, Kelkar H. Impaired antioxidant defense at the onset of psychosis. Schizophr Res 1996; 19 (1): 19-26. Khan M, Evans D, Gunna V, Scheffer R, Parikh V, Mahadik S. Reduced erythrocyte membrane essential fatty acids and increased lipid peroxides in schizophrenia at the never-medicated first-episode of psychosis and after years of treatment with antipsychotics. Schizophr Res 2002; 58 (1): 1-7. Rotrosen J, Wolkin A. Phospholipid and prostaglandin hypothesis of schizophrenia. In: Meltzer H Y, ed. Psychopharmacology: The Third Generation of Progress. New York: Raven Press 1987: 759-764. Horrobin D F, Manku M S, Hillman H, Iain A, Glen M. Fatty acid levels in the brains of schizophrenics and normal controls. Biol Psychiatry 1991; 30 (8): 795-805. Peet M, Laugharne J D, Mellor J, Ramchand C N. Essential fatty acid deficiency in erythrocyte membranes from chronic schizophrenic patients and the clinical effects of dietary supplementation. Prostaglandins Leukot Essent Fatty Acids 1996, 55 (1-2): 71-5. Richardson A J, Easton T, Puri B K. Red cell and plasma fatty acid changes accompanying symptom remission in a patient with schizophrenia treated with eicosapentaenoic acid. Eur Neuropsychopharmacol 2000; 10 (3): 189-93. Puri B K, Richardson A J, Horrobin D F, Easton T, Saeed N, Oatridge A, Hajnal J V, Bydder G M. Eicosapentaenoic acid treatment in schizophrenia associated with symptom remission, normalisation of blood fatty acids, reduced neuronal membrane phospholipid turnover and structural brain changes. Int J Clin Pract 2000; Laugharne J D, Mellor J E, Peet M. Fatty acids and schizophrenia. Lipids 1996; 31 (1 Suppl): S163-S165. Assies J, Lieverse R, Vreken P, Wanders R J, Dingemans P M, Linszen D H. Significantly reduced docosahexaenoic and docosapentaenoic acid concentrations in erythrocyte membranes from schizophrenic patients compared with a carefully matched control group. Biol Psychiatry 2001; 49 (6): 510-22. Emsley R, Myburgh C, Oosthuizen P, Van Rensburg S J. Randomized, placebo-controlled study of ethyl-eicosapentaenoic acid as supplemental treatment in schizophrenia. Am J Psychiatry 2002; 159 (9): 1596-8. Peet M, Horrobin D F. E-E Multicentre Study Group. A dose-ranging exploratory study of the effects of ethyl-eicosapentaenoate in patients with persistent schizophrenic symptoms. J Psychiatr Res 2002; 36 (1): 7-18. Joy C B, Mumby-Croft R, Joy L A. Polyunsaturated fatty acid supplementation for schizophrenia. Cochrane Database Syst Rev. 2003; 1 (2): CD001257. Joy C B, Mumby-Croft R, Joy L A. Polyunsaturated fatty acid supplementation for schizophrenia. Cochrane Database Syst Rev. 2006; 19 (3): CD001257. Puri B K, Bydder G M, Counsell S J, Corridan B J, Richardson A J, Hajnal J V, Appel C, Mckee H M, Vaddadi K S, Horrobin D F. MRI and neuropsychological improvement in Huntington disease following ethyl-EPA treatment. Neuroreport 2002; 13 (1): 123-6. Bourre J M. Roles of unsaturated fatty acids (especially Omega-3 fatty acids) in the brain at various ages and during ageing. J Nutr Health Aging 2004; 8 (3):163Bourre J M. Dietary Omega-3 fatty acids and psychiatry: mood, behaviour, stress, depression, dementia and aging. J Nutr Health Aging 2005; 9 (1): 31-8. Hibbeln J R, Palmer J W, Davis J M. Are disturbances in lipid-protein interactions by phospholipase-A2 a predisposing factor in affective illness? Biol Psychiatry 1989: 25 (7): 945-61. Hibbeln J R, Umhau J C, George D T, Shoaf S E, Linnoila M, Salem N Jr. Plasma total cholesterol concentrations do not predict cerebrospinal fluid neurotransmitter metabolites: implications for the biophysical role of highly unsaturated fatty acids. Am J Clin Nutr 2000; 71 (1 Suppl): 331S-338S. Hibbeln J R. Fish consumption and major depression. Lancet 1998; 351: 1213. Severus W E, Littman A B, Stoll A L. Omega-3 fatty acids, homocysteine, and the increased risk of cardiovascular mortality in major depressive disorder. Harv 4 Rev Psychiatry 2001; 9 (6): 280-93. Buajordet I, Madsen S, Olsen H. [Statins: the pattern of adverse effects with emphasis on mental reactions. Data from a national and an international database]. Tidsskr Nor Laegeforen 1997: 117 (22): 3210-3. Golomb B A. Cholesterol and violence: is there a connection? Ann Intern Med 1998; 128 (6): 478-87. Neaton J D, Blackburn H, Jacobs D, Kuller L, Lee D J, Sherwin R, Shih J, Stamler J, Wentworth D. Serum cholesterol level and mortality findings for men screened in the Multiple Risk Factor Intervention Trial. Multiple Risk Factor Intervention Trial Research Group. Arch Intern Med 1992; 152 (7): 1490-500. Hibbeln J R, Linnoila M, Umhau J C, Rawlings R, George D T, Salem Jr N. Essential fatty acids predict metabolites of serotonin and dopamine in CSF among healthy controls, early and late onset alcoholics. Biol Psychiatry 1998: 15; 44(4): 235Hibbeln J R, Umhau J C, Linnoila M, George D T, Ragan P W, Shoaf S E, Vaughan M R, Rawlings R, Salem Jr N. A replication study of violent and no-violent subjects: CSF metabolites of serotonin and dopamine are predicted by plasma essential fatty acids. Biol Psychiatry 1998; 44 (4): 243-9. Peet M, Murphy B, Shay J, Horrobin D. Depletion of Omega-3 fatty acid levels in red blood cell membranes of depressive patients. Biol Psychiatry 1998; 43 (5): Maes M, Smith R, Christophe A, Cosyns P, Desnyder R, Meltzer H. Fatty acid composition in major depression: decreased Omega-3 fractions in cholesteryl esters and increased C20:4 Omega-6 / C20:5 Omega-3 ratio in cholesteryl esters and phospholipids. J Affect Disord 1996; 38: 35-46. Adams P B, Lawson S, Sanigorski A, Sinclair A J. Arachadonic acid to eicosapentaenoic acid ratio in blood correlates positively with clinical symptoms of depression. Lipids 1996; 31 (suppl): S157-S161. Mischoulon D, Fava M. Docosahexanoic acid and Omega-3 fatty acids in depression. Psychiatr Clin North Am 2000; 23 (4): 785-94. Logan A C. Neurobehavioral aspects of Omega-3 fatty acids: possible mechanisms and therapeutic value in major depression. Altern Med Rev 2003; 8 (4): 410. Peet M. Eicosapentaenoic acid in the treatment of schizophrenia and depression: rationale and preliminary double-blind clinical trial results. Prostaglandins Leukot Essent Fatty Acids 2003; 69 (6): 477-85. Peet M, Stokes C. Omega-3 fatty acids in the treatment of psychiatric disorders. Drugs 2005; 65 (8): 1051-9. Maes M, Christophe A, Delanghe J, Altamura C, Neels H, Meltzer H Y. Lowered Omega3 polyunsaturated fatty acids in serum phospholipids and cholesteryl esters of depressed patients. Psychiatry Res 1999; 85 (3): 275-91. Tanskanen A, Hibbeln J R, Tuomilehto J, Uutela A, Haukkala A, Viinamaki H, Lehtonen J, Vartiainen E. Fish consumption and depressive symptoms in the general population in Finland. Psychiatr Serv 2001; 52 (4): 529-31. Peet M, Horrobin D F. A dose-ranging study of the effects of ethyl-eicosapentaenoate in patients with ongoing depression despite apparently adequate treatment with standard drugs. Arch Gen Psychiatry 2002; 59 (10): 913-9. Puri B K, Counsell S J, Hamilton G, Richardson A J, Horrobin D F. Eicosapentaenoic acid in treatment-resistant depression associated with symptom remission, structural brain changes and reduced neuronal phospholipid turnover. Int J Clin Pract 2001; 55 (8): 560-3. ITALCHIMICI 79 Krilling D Manuale Uso Interno 120. Puri B K, Counsell S J, Richardson A J, Horrobin D F. Eicosapentaenoic acid in treatment-resistant depression. Arch Gen Psychiatry 2002; 59 (1): 91-2. 121. Nemets B, Stahl Z, Belmaker R H. Addition of Omega-3 fatty acid to maintenance medication treatment for recurrent unipolar depressive disorder. Am J Psychiatry 2002; 159 (3): 477-9. 122. Parker G, Gibson N A, Brotchie H, Heruc G, Rees A M, Hadzi-Pavlovic D. Omega-3 fatty acids and mood disorders. Am J Psychiatry 2006; 163 (6): 969-78. 123. Horrobin D F, Bennett C N. Depression and bipolar disorder: relationships to impaired fatty acid and phospholipid metabolism and to diabetes, cardiovascular disease, immunological abnormalities, cancer, ageing and osteoporosis. Possible candidate genes. Prostaglandins Leukot Essent FattyAcids 1999; 60 (4):217-34. 124. Horrobin D F, Bennett C N. New gene targets related to schizophrenia and other psychiatric disorders: enzymes, binding proteins and transport proteins involved in phospholipid and fatty acid metabolism. Prostaglandins Leukot Essent Fatty Acids 1999; 60 (3): 141-67. 125. Pariser S F. Women and mood disorders. Menarche to menopause. Ann Clin Psychiatry 1993; 5 (4): 249-54. 126. Altshuler L L, Hendrick V, Cohen L S. Course of mood and anxiety disorders during pregnancy and the postpartum period. J Clin Psychiatry.1998;59(Suppl2): 127. Hendrick V, Altshuler L, Strouse T, Grosser S. Postpartum and nonpostpartum depression: differences in presentation and response to pharmacologic treatment. Depress Anxiety 2000; 11 (2): 66-72. 128. Regan J, Alderson A. Criminal responsibility or lack of cultural awareness? The Andrea Yates story. Tenn Med 2002; 95 129. Campbell F M, Gordon M J, Dutta-Roy A K. Placental membrane fatty acid-binding protein preferentially binds arachidonic and docosahexaenoic acids. Life Sci 1998; 63 (4): 235-40. 130. Dutta-Roy A K. Transport mechanisms for long-chain polyunsaturated fatty acids in the human placenta. Am J Clin Nutr 2000; 71: 315-22. 131. Martin R E, Wickham J Q, Om A S, Sanders J, Ceballos N. Uptake and incorporation of docosahexaenoic acid (DHA) into neuronal cell body and neurite/nerve growth cone lipids: evidence of compartmental DHA metabolism in nerve growth factor-differentiated PC12 cells. Neurochem Res 2000; 25 (5): 715-23. 132. Martin R E. Docosahexaenoic acid decreases phospholipase A2 activity in the neuritis / nerve growth cones of PC12 cells. J Neurosci Res 1998; 54 (6): 805-13. 133. Hornstra G, Al D M, Van Houwelingen A C, Foremaωvan Drongelen M. Essential fatty acids in pregnancy and early human development. Eur J Obstet Gyn Reprod Biol 1995; 61: 57-62. 134. Otto SJ, Van Houwelingen A C, Antal M, Manninen A, Godfrey K, Lopez-Jaramillo P, Hornstra G. Maternal and neonatal essential fatty acid status in phospholipids: an international comparative study. Eur J Clin Nutr 1997; 51: 232-42. 135. Makrides M, Neumann M A, Gibson R A. Effect of maternal docosahexaenoic acid (DHA) supplementation on breast milk composition. Eur J Clin Nutr 1996; 50 136. Noaghiul S, Hibbeln J R. Cross-national comparision of seafood consumption and rates of bipolar disorders. Am J Psychiatry 2003; 66: 2222-7. 137. Stoll A L, Severus E, Freeman M P, Rueter S, Zboyan H A, Diamond E, Cress K K, Marangell L B. Omega-3 fatty acids in bipolar disorder: A preliminary doubleblind, placebo-controlled trial. Arch Gen Psychiatry 1999; 56: 407-12. 138. Frangou S, Lewis M. The Maudsley bipolar disorder project: a double-blind, randomized, placebo-controlled study of ethyl-EPA as an adjunct treatment of depression in bipolar disorder. Bipolar Disorders 2002; 4: 123-9. 139. Oscher Y, Bersudsky Y, Belmaker R H. Omega-3 eicosapentaenoic acid in bipolar depression: report of a small opeωlabel study. J Clin Psychiatry 2005; 66: 140. Stoll A L, Severus E. Mood stabilizers: shared mechanisms of action at post-synaptic signal transduction and kindling processes. Harvard Rev Psychiatry 1996; 141. Chen G, Manji H K, Hawver D B, Wright C B, Potter W Z. Chronic sodium valproate selectively decreases protein kinase C alpha and epsilon in vitro. J Neurochem 1994; 63: 2361-4. 142. Sperling R I, Benincaso A I, Knoell S T, Larkin J K, Austen K F, Robinson D R. Dietary Omega-3 polyunsaturated fatty acids inhibit phosphoinositide formation and chemotaxis in neutrophils. J Clin Invest 1993; 91: 651-60. 143. Tappia P S, Ladha S, Clark D C, Grimble R F. The influence of membrane fluidity, TNF receptor binding, cAMP production and GTPase activity on macrophage cytokine production in rats fed a variety of fat diets. Mol Cell Biochem 1997; 166: 135-43. 144. Hirashima F, Parow A M, Stoll A L, Demopulos C M, Damico K E, Rohan M L, Eskesen J G, Zuo C S, Cohen B M, Renshaw P F. Omega-3 fatty acid treatment and T(2) whole brain relaxation times in bipolar disorder. Am J Psychiatry 2004; 161 (10): 1922-4. 145. Chiu C C, Huang S Y, Chen C C, Su K P. Omega-3 fatty acids are more beneficial in the depressive phase than in the manic phase in patients with bipolar I disorder. J Clin Psychiatry 2005; 66 (12): 1613-4. 146. Hamazaki T, Itomura M, Sawazaki S, Nagao Y. Anti-stress effects of DHA. Biofactors 2000; 13 (1-4): 41-5. 147. Hamazaki T, Sawazaki S, Nagasawa T, Nagao Y, Kanagawa Y, Yazawa K. Administration of docosahexaenoic acid influences behavior and plasma catecholamine levels at times of psychological stress. Lipids 1999; 34 (1 Suppl): S33- S37. 148. Sawazaki S, Hamazaki T, Yazawa K, Kobayashi M. The effect of docosahexaenoic acid on plasma catecholamine concentrations and glucose tolerance during long-lasting psychological stress: a double-blind placebo-controlled study. J Nutr Sci Vitaminol (Tokyo) 1999; 45(5): 149. Gesch C B, Hammond S M, Hampson S E, Eves A, Crowder M J. Influence of supplementary vitamins, minerals and essential fatty acids on the antisocial behaviour of young adult prisoners. Randomised, placebo-controlled trial. Br J Psychiatry 2002; 181: 22-8. 150. Zanarini M C, Frankenburg F R. Omega-3 Fatty Acid Treatment of Women With Borderline Personality Disorder: A Double-Blind, Placebo-Controlled Pilot Study. Am J Psychiatry 2003; 160: 167-9. 151. Pintus A, Maggini C. Linee-guida del trattamento farmacologico del disturbo borderline di personalità. Nòos Aggiornamenti in Psichiatria 1995; 1 (2): 111 - 9. 152. American Psychiatric Association. Practice guideline for the treatment of patients with borderline personality disorder. Am J Psychiatry 2001;158(10 Suppl):1-52 153. Manna V, Daniele M T, Pinto M. Farmacoterapia del disturbo borderline di personalità. Giornale Italiano di Psicopatologia 2004; 10: 376-9 154. Manna V, Daniele M T, Pinto M. Oltre i limiti della personalità limite. Ruolo dell’impulsività nel disturbo borderline di personalità. Giornale Italiano di Psicopatologia 2005; 11: 74-86. 155. Buss A H, Perry M: The Aggression Questionnaire. J Personal Soc Psychol 1992; 63: 452-8. 156. De Hert M A, van Winkel R, Van Eyck D, Hanssens L, Wampers M, Scheen A, Peuskens J. Prevalence of the metabolic syndrome in patients with schizophrenia treated with antipsychotic medication. Schizophrenia research 2006; 83 (1): 87-93. 157. Warensjö E, Sundström J, Lind L, Vessby B. Factor analysis of fatty acids in serum lipids as a measure of dietary fat quality in relation to the metabolic syndrome in men. American Journal of Clinical Nutrition 2006; 84 (2): 442-8. 158. Haupt D W. Differential metabolic effects of antipsychotic treatments. European Neuropsychopharmacology 2006; 1 (Suppl 3): S149-S155. 159. Caniato R N, Alvarenga M E, Garcia Alcaraz M A. Effect of Omega-3 fatty acids on the lipid profile of patients taking clozapine. Australian and New Zealand Journal of Psychiatry 2006; 40 (8): 691-7. 160. Carpentier Yvon A, Portois Laurence, Malaisse Willy J. Ω3 fatty acids and the metabolic syndrome. American Journal of Clinical Nutrition 2006; 83 (Suppl 6): 161. Thies F, Nebe von Caron G, Powell J R, Yaqoob P, Newsholme E A, Calder P C. Dietary supplementation with eicosapentaenoic acid, but not with other longchain ω3 or ω6 polyunsaturated fatty acids, decreases natural killer cell activity in healthy subjects aged >55 y. Am J Clin Nutr 2001; 73 (3): 539-48. 162. Eritsland J. Safety considerations of polyunsaturated fatty acids. Am J Clin Nutr 2000; 71: 197-201. 163. Werneke U, Turner T, Priebe S. Complementary medicines in psychiatry: review of effectiveness and safety. Br J Psychiatry 2006; 188: 1 164. Fugh-Berman A, Cott J M. Dietary supplements and natural products as psychotherapeutic agents. Psychosom Med 1999; 61 (5): 712-28. 165. Ryback R. Bioelectrical modulators and the cell membrane in psychiatric medicine. Psychopharmacol Bull 2001; 35 (4): 5 166. Burr G, Burr M. A new deficiency disease produced by the rigid exclusion of fat from the diet. J. Biol. Chem. 1929; 82: 345167. Samuelsson B. From studies of biochemical mechanism to novel biological mediators: prostaglandin endoperoxides, thromboxanes, and leukotrienes. Nobel Lecture. Biosci Rep. 1983; 3: 791-813. 168. Serhan CN, Gotlinger K, Hong S, Arita M. Resolvins, docosatrienes, and neuroprotectins, novel Omega-3-derived mediators, and their aspirin triggered endogenous epimers: an overview of their protective roles in catabasis. Prostaglandins Other Lipid Mediat. 2004; 73: 155-72. 169. Caramia G, Nobilini A. Il ruolo degli acidi grassi essenziali in età pediatrica. Fano Pediatrica 1990; 49-55. 170. Warthon B. Food for the brain. Atti VIII Congresso Internazionale Bambino Progetto Salute. Ancona-Portonovo 1991; 44 171. Cocchi M. Cervello, retina e fertilità. Il Segnale Editore 1998. 172. Caramia G, Cocchi M, Frega N. Recenti progressi in nutrizione. Progress In Nutrition 2000; 2: 25-40. 173. Lucas A. Long-term programming effects of early nutritioωimplication for the preterminfant. J Perinatol. 2005; 25 Suppl: 2-6. 174. Hibbeln JR, Davis JM, Steer C, Emmett P et al. Maternal seafood consumption in pregnancy and neurodevelopmental outcomes in childhood (ALSPAC study): an observational cohort study. Lancet 2007; 369: 578-85. 175. Innis SM. Polyunsaturated fatty acids in human milk: an essential role in infant development. Adv Exp Med Biol. 2004; 554: 27-43. 176. Cocchi M, Tonello L. Considerazioni Biologiche, Biochimiche e Matematiche sull’applicazione di una Rete Neurale Artificiale nello studio del rapporto fra Acidi Grassi delle Piastrine e Depressione Maggiore. J. of Biol. Res. In stampa. 177. GISSI-Prevenzione Investigators. Dietary supplementation with ω3 polynsaturated fatty acids and vitamin E after myocardial infarction: results of the GISSIPrevenzione Trial. Lancet 1999; 354: 447-55. 178. Albert CM. Fish oil: an appetising alternative to anti-arrhythmic drugs? Lancet 2004; 363: 1412-3. 179. Caramia G, Frega N, Mozzon M, Malavolta M et al. Aspetti nutrizionali e condizioni clinico-patologiche. Attualità e possibilità terapeutiche. Atti XVIII Congresso Internazionale Bambino Progetto Salute. Ancona. 2001; pp. 278-97. 180. Serhan CN, Savill J. Resolution of inflammation: the beginning programs the end. Nat. Immunol. 2005; 12: 1191-97. 181. Ferrucci L, Cherubini A, Bandinelli S, Bartali B et al. Relationship of plasma polyunsaturated fatty acids to circulating inflammatory markers. J Clin Endocrinol Metab. 2006; 91: 439-46. 182. Fleith M, Clandinin MT. Dietary PUFA for preterm and term infants: review of clinical studies. Crit Rev Food Sci Nutr. 2005; 45: 205-29. 183. Romano C, Cucchiara S, Barabino A, Annese V et al. Usefulness of n-3 fatty acid supplementation in addition to mesalazine in maintaining remission in pediatric ITALCHIMICI 80 Krilling D Manuale Uso Interno Crohn’s disease: A double-blind, randomized, placebo-controlled study. World J Gastroenterol 2005; 11: 7118-21. 184. Caramia G. Attualità degli acidi grassi Omega-3 nella fibrosi cistica. Atti 5° Convegno Nazionale Acidi Grassi Omega-3, CLA e Antiossidanti. Ancona, 23-25 Giugno. Progress in Nutrizion 2005; 1S: 63. 185. Puri BK. Attentioωdeficit hyperactivity disorder: a natural way to treat ADHD. Hammersmith Press London UK. 2005. 186. Simopoulos AP. Evolutionary aspects of diet, the Omega-6/Omega-3 ratio and genetic variation: nutritional implications for chronic diseases. Biomed Pharmacother. 2006; 60: 502-7. 187. Richardson, A.J., Clinical trials of fatty acid treatment in ADHD, dyslexic, dyspraxia and the autistic spectrum. Prostaglandins, Leukotrienes and Essential Fatty Acids 70, 2004; 383-390.5. Zhang, Jian, Hebert James R., Muldoon, Matthew F., Dietary Fat Intake Is Associated with Psychosocial and Cognitive Functioning of School-Aged Children in the United States. American Society for Nutritional Sciences, 2005, 1967-1973. 188. Peet, Malcolm, Eicosapentaenoic acid in the treatment of schizophrenia and depression: rationale and preliminary double-blind clinical trial results. Prostaglandins, Leukotrienes and Essential Fatty Acids 69, 2003; 477-485. 189. 20. Jensen, Craig L., Heird, William C. Lipids with an emphasis on long-chain polyunsaturated fatty acids. Clinics in Perinatology 29, 2002, 261-281. 190. Hodge L, Salome CM, Peat JK. Consumption of oily fish and childhood asthma risk. Med J. Aust. 1996; 164:137-140. 191. Wong KA W, Clinical Efficacy of ω3 Fatty Acid Supplementation in Patients with Asthma, Journal of the American Dietic Association, 2005, 98-104. 192. Mihrshahi S. Peat LK. Et al. Effect of Omega-3 fatty acid concentrations in plasma on symptoms of asthma at 18 months of age. Pediatric Allergy & Immunology Dec 2004, 15(6), 517-522. 193. Dunstan JA, Mori TA, Barden A, et al. Fish oil supplementation in pregnancy modifies neonatal allergeωspecific responses and clinical outcomes in infants at high risk of atopy: a randomized trial. J Allergy Clim Immunol Dec 2003; 112(6): 1178194. Arnan, M.G., Mitchell, E.A. Turbott, S.H. the effects of essential fatty acid supplementation by Efumol in hyperactive children, Journal of Abnormal Child Psychology. 15(1), 1987, 286-287. 195. Arnold, L.E., et al. Gamma-linolenic acid for attentioωdeficit hyperactivity disorders placebo-controlled comparison to d-amphetamine, Biological Psychiatry 25(2), 1989, 222-228. 196. Voigt, R.G. et al., A randomized, doble-blind, placebo- controlled trial of docosahexuenoic acid supplementation in children with attentioωdeficit/hyperactivity disorder, Journal of Pediatrics 139(2) 2001, 189-196. 197. Stevens, L., et al, EPA supplementation in children with inattention, hyperactivity and other disruptive behaviours, Lipids 38 (10) 2003, 1007-1021. 198. Richardson, A.J. Puri, B.K., A randomized double-blind, placebo-controlled study of the effects of supplementation with highly unsaturated fatty acids on ADHDrelated symptoms in children with specific learning difficulties. Program of Neuropsychopharmacology, Biological psychiatry, 26 (2) 2002, 491 50 199. Richardson, Alexandra L., DPhil (Oxon), and Montgomery, Paul. The Oxford-Durham Study: A Randomized, controlled Trial of Dietary Supplementation With Fatty Acids in Children With Developmental Coordination Disorder, Pediatrics Vol. 115 No. 5 May 2005, 1360-1366. 200. McCann JC, Ames BN. FASEB J. 2008; 22: 982-1001. 201. Vieth R et al. Am J Clin Nutr 2007; 85: 649-50. 202. Bodnar LM et al. J.Nutr 2007; 137: 447-52. 203. Stumpf WE, Privette TH. Psychopharmacology (Berl). 1989; 97(3): 285–94. 204. Harris S, DawsoωHughes B. Psychiatry Res. 1993 Oct; 49 (1): 77–87. 205. Oren DA et al. Psychopharmacology (Berl). 1994 Dec; 116 (4): 515–6. 206. Lansdowne AT, Provost SC. Psychopharmacology (Berl). 1998 Feb; 135(4): 319–23. 207. Gloth FM et al. J Nutr Health Aging. 1999; 3(1): 5–7. 208. Schneider B et al. J Neural Transm. 2000; 107(7): 839–42. 209. Partonen T et al. Biol Psychiatry. 1996 May 15; 39(10): 865–72. 210. Kenny AM et al. J Am Geriatr Soc. 2003 Dec; 51(12): 1762–7. 211. Klerman GL, Weissman MM. JAMA. 1989 Apr 21; 261(15): 2229–35. 212. Zittermann A. Br J Nutr. 2003 May; 89 (5): 552–72 213. Rugulies R. Am J Prev Med. 2002 Jul; 23(1): 51–61. 214. Abbas AK, Murphy KM, Sher A. Functional diversity of helper T lymphocytes. Nature. 1996;383(6603):787-93. 215. Algert CS, Bowen JR, Lain SL, Allen HD, ViviaωTaylor JM, Roberts CL. Pregnancy exposures and risk of childhood asthma admission in a population birth cohort. Pediatr Allergy Immunol. 2011;22(8):836-42. doi: 10.1111/j.1399-3038.2011.01206.x. 216. Aloia JF, Li-Ng M. Re: epidemic influenza and vitamin D (Correspondance). Epidemiol Infect. 2007;135(7):1095-6; author reply 1097-8. 217. Antico A, Tozzoli R, Giavarina D, Tonutti E, Bizzaro N. Hypovitaminosis D as predisposing factor for atrophic type A gastritis: a case-control study and review of the literature on the interaction of vitamin D with the immune system. Clin Rev Allergy Immunol 2012;42(3):355-64. 218. Arnson Y, Amital H, Shoenfeld Y. Vitamin D and autoimmunity: new etiological and therapeutic considerations. Ann Rheum Dis 2007;66:1137219. Arshi S, Ghalehbaghi B, Kamrava SK, Aminlou M. Vitamin D serum levels in allergic rhinitis: any difference from normal population? Asia Pac Allergy. 2012;2(1):45220. Barrat FJ, Cua DJ, Boonstra A, Richards DF, Crain C, Savelkoul HF, de Waal-Malefyt R, Coffman RL, Hawrylowicz CM, O'Garra A. In vitro generation of interleukin 10-producing regulatory CD4(+) T cells is induced by immunosuppressive drugs and inhibited by T helper type 1 (Th1)- and Th2-inducing cytokines. J Exp Med. 2002;195(5):603-16. 221. Bener A, Ehlayel MS, Tulic MK, Hamid Q. Vitamin D deficiency as a strong predictor of asthma in children. Int Arch Allergy Immunol. 2012;157(2):168-75. 222. Bergman P, Walter-Jallow L, Broliden K, Agerberth B, Söderlund J. The antimicrobial peptide LL-37 inhibits HIV-1 replication. Curr HIV Res. 2007;5(4):410-5 223. Bikle DD. Vitamin D: newly discovered actions require reconsideration of physiologic requirements. Trends Endocrinol Metab. 2010;21(6):375-8 224. Boonstra A, Barrat FJ, Crain C, Heath VL, Savelkoul HF, O'Garra A. 1alpha,25-Dihydroxyvitamin d3 has a direct effect on naive CD4(+) T cells to enhance the development of Th2 cells. J Immunol. 2001;167(9):4974-80. 225. Borba VZC, Vieira JGH, Kasamatsu T, Radominski SC, Sato EI, Lazaretti-Castro M. Vitamin D deficiency in patients with active systemic lupus erythematosus. Osteoporos Int 2009;20:427-33 226. Bozzetto S, Carraro S, Giordano G, Boner A, Baraldi E. Asthma, allergy and respiratory infections: the vitamin D hypothesis. Allergy. 2012;67(1):10-7. doi: 10.1111/j.1398-9995.2011.02711.x. 227. Brehm JM, Celedón JC, Soto-Quiros ME, Avila L, Hunninghake GM, Forno E, Laskey D, Sylvia JS, Hollis BW, Weiss ST, Litonjua AA. Serum vitamin D levels and markers of severity of childhood asthma in Costa Rica. Am J Respir Crit Care Med. 2009;179(9):765-71. 228. Bultink IE, Lems WF, Kostense PJ, Dijkmans BA, Voskuyl AE. Prevalence of and risk factors for low bone mineral density and vertebral fractures in patients with systemic lupus erythematosus. Arthritis Rheum 2005;52:2044-50 229. Cannell JJ, Vieth R, Umhau JC, Holick MF, Grant WB, Madronich S, Garland CF, Giovannucci E. Epidemic influenza and vitamin D. Epidemiol Infect. 2006;134(6):1129-40. 230. Cantorna MT, Mahon B. Mounting evidence for vitamin D as an environmental factor affecting autoimmune disease prevalence. Exp Bio Med (Maywood) 2004;229:1136-42 231. Carvalho JF, Blank M, Kiss E, Tarr T, Amital H, Shoenfeld Y. . Antivitamin D in SLE: preliminary results. Ann N Y Acad Sci 2007;1109:550-7 232. Chapuy MC, Preziosi P, Maamer M, Arnaud S, Galan P, Hercberg S, Meunier PJ. Prevalence of vitamin D insufficiency in an adult normal population. Osteoporos Int 1997; 7:439-443. 233. Chen S, Sims GP, Chen XX, Gu YY, Chen S, Lipsky PE. Modulatory effects of 1,25-dihydroxyvitamin D3 on human B cell differentiation. J Immunol. 2007;179(3):1634-47. 234. Chinellato I, Piazza M, Sandri M, Peroni D, Piacentini G, Boner AL. Vitamin D serum levels and markers of asthma control in Italian children. J Pediatr. 2011;158(3):437-41. 235. Chinellato I, Piazza M, Sandri M, Peroni DG, Cardinale F, Piacentini GL, Boner AL. Serum vitamin D levels and exercise-induced bronchoconstriction in children with asthma. Eur Respir J. 2011;37(6):1366-70. 236. Costenbader KH, Feskanich D, Holmes M, Karlson EW, Benito-Garcia E. Vitamin D intake and risks of systemic lupus erythematosus and rheumatoid arthritis in women. Ann Rheum Dis 2008;67:530-5 237. EURODIAB study group. Vitamin D supplement in early childhood and risk for type I (insuliωdependent) diabetes mellitus. Diabetologia 1999;42:51-4 238. Giulietti A, Gysemans C, Stoffels K, van Etten E, Decallonne B, Overbergh L, Bouillon R, Mathieu C.Vitamin D deficiency in early life accelerates Type 1 diabetes in non-obese diabetic mice. Diabetologia 2004;47:451-62 239. Gombart AF, Borregaard N, Koeffler HP.Human cathelicidin antimicrobial peptide (CAMP) gene is a direct target of the vitamin D receptor and is strongly upregulated in myeloid cells by 1,25-dihydroxyvitamin D3. FASEB J 2005;19:1067-1077. 240. Gomez-Vaquero C, Fiter J, Enjuanes A, Nogués X, Díez-Pérez A, Nolla JM. Influence of the Bsml polymorphism of the vitamin D receptor gene on rheumatoid arthritis clinical activity. J Rheumatol 2007;34:1823-6 241. Gorman S, Tan DH, Lambert MJ, Scott NM, Judge MA, Hart PH. Vitamin D(3) deficiency enhances allergeωinduced lymphocyte responses in a mouse model of allergic airway disease. Pediatr Allergy Immunol. 2012 Feb;23(1):83-7. doi: 10.1111/j.1399-3038.2011.01146.x. 242. Gregori S, Casorati M, Amuchastegui S, Smiroldo S, Davalli AM, Adorini L. Regulatory T cells induced by 1 alpha,25-dihydroxyvitamin D3 and mycophenolate mofetil treatment mediate transplantation tolerance. J Immunol. 2001;167(4):1945-53. 243. Harris Jr ED, Schur PH. Pathogenesis of rheumatoid arthritis. In: Basow DS (ed). UpToDate, Waltham 2007:123-34 ITALCHIMICI 81 Krilling D Manuale Uso Interno 244. Herr C, Greulich T, Koczulla RA, Meyer S, Zakharkina T, Branscheidt M, Eschmann R, Bals R. The role of vitamin D in pulmonary disease: COPD, asthma, infection, and cancer. Respir Res. 2011 Mar 18;12:31. 245. Holick MF. Vitamion D: a D-lightful health perspective. Nutr Rev 2008;66:S182-194. 246. Huisman AM, White KP, Algra A, Harth M, Vieth R, Jacobs JW, Bijlsma JW, Bell DA. Vitamin D levels in women with systemic lupus erythematosus and fibromyalgia. J Rheumatol 2001;28:2535-39 247. Islam D, Bandholtz L, Nilsson J, Wigzell H, Christensson B, Agerberth B, Gudmundsson G. Downregulation of bactericidal peptides in enteric infections: a novel immune escape mechanism with bacterial DNA as a potential regulator. Nat Med. 2001;7(2):180-5. 248. Kamen DL, Cooper GS, Bouali H, Shaftman SR, Hollis BW, Gilkeson GS. Vitamin D deficiency in systemic lupus erythematosus. Autoimmun Rev 2006;5:114-7 249. Kuchuk NO, van Schoor NM, Pluijm SM, Chines A, Lips P. vitmin D status, parathyroid function, bone turnover, and BDM in postmenopausal women with osteoporosis: global perspective. J Bone Miner Res 2009;24:693-701. 250. Lemire JM, Adams JS, Sakai R, Jordan SC. 1 alpha,25-dihydroxyvitamin D3 suppresses proliferation and immunoglobulin production by normal human peripheral blood mononuclear cells. J Clin Invest. 1984;74(2):657-61. 251. Lemire JM, Adams JS, Kermani-Arab V, Bakke AC, Sakai R, Jordan SC. 1,25-Dihydroxyvitamin D3 suppresses human T helper/inducer lymphocyte activity in vitro. J Immunol. 1985 ;134(5):3032-5. 252. Leventis P, Patel S. Clinical aspects of vitamin D in the management of rheumatoid arthritis. Rheumatology 2008;47:1617-21 253. Liu YJ. IPC: professional type 1 interferoωproducing cells and plasmacytoid dendritic cell precursors. Annu Rev Immunol 2005;23:275-306 254. Liu PT, Stenger S, Li H, Wenzel L, Tan BH, Krutzik SR, Ochoa MT, Schauber J, Wu K, Meinken C, Kamen DL, Wagner M, Bals R, Steinmeyer A, Zügel U, Gallo RL, Eisenberg D, Hewison M, Hollis BW, Adams JS, Bloom BR, Modlin RL. Toll-like receptor triggering of a vitamiωD-mediated human antimicrobial response. Science 2006;311:1770-1773. 255. Liu PT, Stenger S, Tang DH, Modlin RL. Cutting edge: vitamin D-mediated human antimicrobial activity against Mycobacterium tuberculosis is dependent on the induction of cathelicidin. J Immunol. 2007;179(4):2060-3. 256. Manolagas SC, Werntz DA, Tsoukas CD, Provvedini DM, Vaughan JH. 1,25- dihydroxyvitamin D3 receptors in lymphocytes from patients with rheumatoid arthritis. J Lab Clin Med 1986;108:596-600 257. Marineau AR, Wilkinson KA, Newton SM, Floto RA, Norman AW, Skolimowska K, Davidson RN, Sørensen OE, Kampmann B, Griffiths CJ, 258. Wilkinson RJ. IFΩgamnma and TNF-independent vitamin D-inducible human expression of mycobacteria: the role of cathelicidin LL-37. J Immunol 2007;179:2060259. Martineau AR, Wilkinson RJ, Wilkinson KA, Newton SM, Kampmann B, Hall BM, Packe GE, Davidson RN, Eldridge SM, Maunsell ZJ, Rainbow SJ, Berry JL, Griffiths CJ. A single dose of vitamin D enhances immunity to mycobacteria. Am J Respir Crit Care Med. 2007;176(2):208-13. 260. Merlino LA, Curtis J, Mikuls TR, Cerhan JR, Criswell LA, Saag KG; Iowa Women's Health Study. 261. Vitamin D intake is inversely associated with rheumatoid arthritis. Arthritis Rheum 2004;50:72-7 262. Mithal A, Wahl DA, Bonjour JP, Burckhardt P, DawsoωHughes B, Eisman JA, El-Hajj Fuleihan G, Josse RG, Lips P, Morales-Torres J. Global vitamin D status and determination of hypovitaminosis D. Osteoporosis Int 2009;20:1807-1820. 263. Nagpal S, Na S, Rathnachalam R. Noncalcemic actions of vitamin D receptor ligands. Endocr Rev 2005;26:662- 87. 264. Nielen MMJ, Schaardenburg D, Lems WF, van de Stadt RJ, de Koning MH, Reesink HW, Habibuw MR, van der Horst-Bruinsma IE, Twisk JW, Dijkmans BA. Vitamin D deficiency does not increase the risk of rheumatoid arthritis. Arthritis Rheum 2006;54:3719-24 265. Overbergh L, Decallonne B, Waer M, Rutgeerts O, Valckx D, Casteels KM, Laureys J, Bouillon R, Mathieu C. 1alpha, 25-dihydroxyvitamin D3 induces an autoantigeωspecific T-helper 1/T-helper 2 immune shift in NOD mice immunized with GAD65 (p524-543). Diabetes. 2000;49(8):1301-7. 266. Penna G, Adorini L. 1 Alpha,25-dihydroxyvitamin D3 inhibits differentiation, maturation, activation, and survival of dendritic cells leading to impaired alloreactive T cell activation. J Immunol. 2000;164(5):2405-11. 267. Penna G, Amuchastegui S, Giarratana N, Daniel KC, Vulcano M, Sozzani S, Adorini L. 1,25-Dihydroxyvitamin D3 selectively modulates tolerogenic properties in myeloid but not plasmacytoid dendritic cells. J Immunol. 2007;178(1):145-53. 268. Patel S, Farragher T, Berry J, Bunn D, Silman A, Symmons D. Association between serum vitamin D metabolite levels and disease activity in patients with early inflammatory polyarthritis. Arthritis Rheum 2007;56:2143-9 269. Provvedini DM, Tsoukas CD, Deftos LJ, Manolagas SC. 1 alpha,25-Dihydroxyvitamin D3-binding macromolecules in human B lymphocytes: effects on immunoglobulin production. J Immunol. 1986;136(8):2734-40. 270. Quarles LD. Endocrine functions of bone in mineral metabolism regulation. J Clin Invest 2008;118:3820-3828. 271. Raby BA, Lazarus R, Silverman EK, Lake S, Lange C, Wjst M, Weiss ST. Association of vitamin D receptor gene polymorphisms with childhood and adult asthma. Am J Respir Crit Care Med. 2004;170(10):1057-65. 272. Reichel H, Koeffler HP, Bishop JE, Norman AW25-Hydroxyvitamin D3 metabolism by lipopolysaccharide-stimulated normal human macrophages. J Clin Endocrinol Metab. 1987;64(1):1-9. 273. Ren S, Nguyen L, Wu S, Encinas C, Adams JS, Hewison M. Alternative splicing of vitamin D-24-hydroxylase: a novel mechanism for the regulation of extrarenal 1,25-dihydroxyvitamin D synthesis. J Biol Chem. 2005;280(21):20604-11. 274. Rigby WF, Stacy T, Fanger MW. Inhibition of T lymphocyte mitogenesis by 1,25-dihydroxyvitamin D3 (calcitriol). J Clin Invest. 1984;74(4):1451-5. 275. Robinson CL, Baumann LM, Gilman RH, Romero K, Combe JM, Cabrera L, Hansel NN, Barnes K, Gonzalvez G, Wise RA, Breysse PN, Checkley W. The Peru Urban versus Rural Asthma (PURA) Study: methods and baseline quality control data from a cross-sectional investigation into the prevalence, severity, genetics, immunology and environmental factors affecting asthma in adolescence in Peru. BMJ Open. 2012;2(1):e000421. 276. Romagnani S. Regulation of the T cell response. Clin Exp Allergy. 2006;36(11):1357-66. Review. 277. Rook GA, Steele J, Fraher L, Barker S, Karmali R, O'Riordan J, Stanford J. Vitamin D3, gamma interferon, and control of proliferation of Mycobacterium tuberculosis by human monocytes. Immunology 1986;57:159-163 278. Rothers J, Wright AL, Stern DA, Halonen M, Camargo CA Jr. Cord blood 25-hydroxyvitamin D levels are associated with aeroallergen sensitization in children from Tucson, Arizona. J Allergy Clin Immunol. 2011;128(5):1093-9.e1-5 279. Rovner AJ, O'Brien KO. Hypovitaminosis D among healthy children in the United States: a review of the current evidence. Arch Pediatr Adolesc Med. 2008;162(6):513-9. 280. Ruiz-Irastorza G, Egurbide MV, Olivares N, Martinez-Berriotxoa A, Aguirre C. Vitamin D deficiency in systemic lupus erythematosus: prevalence, predictors and clinical consequences. Rheumatology 2008;47:920-3 281. Sadeghi K, Wessner B, Laggner U, Ploder M, Tamandl D, Friedl J, Zügel U, Steinmeyer A, Pollak A, Roth E, Boltz-Nitulescu G, Spittler A. Vitamin D3 dowωregulates monocyte TLR expression and triggers hyporesponsiveness to pathogeωassociated molecular patterns. Eur J Immunol. 2006;36(2):361-70. 282. Saintonge S, Bang H, Gerber LM. Implications of a new definition of vitamin D deficiency in a multiracial us adolescent population: the National Health and Nutrition Examination Survey III. Pediatrics. 2009;123(3):797-803. 283. Sakaki T, Kagawa N, Yamamoto K, Inouye K. Metabolism of vitamin D3 by cytochromes P450. Front Biosci. 2005;10:119-34. 284. Salomon B, Lenschow DJ, Rhee L, Ashourian N, Singh B, Sharpe A, Bluestone JA. B7/CD28 costimulation is essential for the homeostasis of the CD4+ CD25+ immunoregulatory T cells that control autoimmune diabetes. Immunity 2000;12:431-40 285. Schauber J, Dorschner RA, Coda AB, Büchau AS, Liu PT, Kiken D, Helfrich YR, Kang S, Elalieh HZ, Steinmeyer A, Zügel U, Bikle DD, Modlin RL, Gallo RL. Injury enhances TLR2 function and antimicrobial peptide expression through a vitamin D-dependent mechanism. J Clin Invest. 2007;117(3):803-11. 286. Searing DA, Leung DY. Vitamin D in atopic dermatitis, asthma and allergic diseases. Immunol Allergy Clin North Am. 2010;30(3):397-409. 287. Sigmundsdottir H, Pan J, Debes GF, Alt C, Habtezion A, Soler D, Butcher EC. DCs metabolize sunlight-induced vitamin D3 to 'program' T cell attraction to the epidermal chemokine CCL27. Nat Immunol. 2007;8(3):285-93. 288. Szodoray P, Nakken B, Gaal J, Jonsson R, Szegedi A, Zold E, Szegedi G, Brun JG, Gesztelyi R, Zeher M, Bodolay E. The complex role of vitamin D in autoimmune diseases. Scand J Immunol 2008;68:261-9 289. Thudi A, Yin S, Wandstrat AE, Li QZ, Olsen NJ.Vitamin D levels and disease status in Texas patients with systemic lupus erythematosus. Am J Med Sci 2008;335:99-104 290. Trinchieri G, Sher A. cooperation of Toll-like receptor signals in innate immune defense. Nat Rev Immunol 2007;7:179-190. 291. Varney VA, Evans J, Bansal AS. Successful treatment of reactive airways dysfunction syndrome by high-dose vitamin D. J Asthma Allergy. 2011;4:87-91. 292. Yim S, Dhawan P, Ragunath C, Christakos S, Diamond G. Induction of cathelicidin in normal and CF bronchial epithelial cells by 1.25-dihydroxyvitamin D3. J Cyst Fibros 2007;6:403-410. 293. Wang TT, Nestel FP, Bourdeau V, Nagai Y, Wang Q, Liao J, Tavera-Mendoza L, Lin R, Hanrahan JW, Mader S, White JH. Cutting edge: 1.25-dihydroxyvitamin D3 is a direct inducer of antimicrobial peptide gene expression. J Immunol 2004;173:2909-2912 294. Weber G, Heilborn JD, Chamorro Jimenez CI, Hammarsjo A, Törmä H, Stahle M. Vitamin D induces the antimicrobial protein hCAP18 in human skin. J Invest Dermatol 2005;124:1080-1082. 295. H.M. Lakka (2002). The metabolic syndrome and total and cardiovascular disease mortality in middle-aged men. JAMA 288: 2709 (in). 296. E. P. Joslin (1921). The prevention of diabetes mellitus. JAMA 76: 79–84 (in en) 297. E. Kylin (1923). Studien ueber das hypertonie-hyperglykemie-hyperurikämiesyndrome. Zentralbl Inn Med 44: 105-127 (in de). 298. J. Vague (1947). La différenciation sexuelle, facteur déterminant des formes de l'obésité. Presse Med 30: 339-340 (in fr). 299. P. Avogaro, G. Crepaldi, G. Enzi, A. Tiengo (1967). Associazione d’iperlipidemia, diabete mellito e obesità di medio grado. Acta Diabetol Lat 4: 572-590 300. H. Haller (1977). Epidemiologie und assocziierte Risikofaktoren der Hyperlipoproteinamie. Z Gesamte Inn Med 32(8): 124-128 (in de). 301. P. Singer (1977). Zur Diagnostik der primaren Hyperlipoproteinamien. Z Gesamte Inn Med 32(9): 129-133 (in de). PMID 906591. ITALCHIMICI 82 Krilling D Manuale Uso Interno 302. G. B. Phillips (1977). Relationship between serum sex hormones and glucose, insulin, and lipid abnormalities in men with myocardial infarction. Proc Natl Acad Sci U.S.A 74: 1729-1733 (in en). PMID 193114. 303. G. B. Phillips (1978). Sex hormones, risk factors and cardiovascular disease. Am J Med 65: 7-11 (in en). PMID 356599. 304. G. M. Reaven (1988). Role of insulin resistance in human disease. Diabetes, Banting lecture 37: 1595-1607 (in en). PMID 3056758. 305. A. I. Adler, I. M. Stratton, H. A. Neil; et al (2000). Association of systolic blood pressure with macrovascular and microvascular complications of type 2 diabetes (UKPDS 36): prospective observational study. BMJ 321: 412-419 (in en). 306. Tale termine si riferisce al gruppo di persone coinvolte nell'indagine medica che non sono esposte al rischio o all'agente terapeutico in maniera casuale 307. Harano, M. Suzuki, Y. Koyama, et al (2002). Multifactorial insulinresistance and clinical impact in hypertension and cardiovascular diseases. J Diabetes Complications 16: 19-23 (in en). 308. J. P. Despres, B. Lamarche, P. Mauriege, et al (1996). MHyperinsulinemia as an independent risk factor for ischemic heart disease. N Engl J Med 334: 952-957 309. S. Letho, T. Ronnemaa, K. Pyorala, M. Laakso (2000). Cardiovascular risk factors clustering with endogenous hyperinsulinaemia predict death from coronary heart disease in patients with type 2 diabetes. Diabetologia 43: 148-155 (in en). 310. H. Taegtmeyer, P. McNulty, M. E. Young (2002). Adaptation and maladaptation of the heart in diabetes. Part I: General concepts. Circulation 105: 1727-1733 311. J. R. White, S. N. Davis, R. Cooppan, et al (2003). Clarifying the role of insulin in type 2 diabetes management. Clinical Diabetes 21: 14-21 (in en). 312. Matsuzawa, Shimomura I, Kihara S, Funahashi T (2003). Importance of adipocytokines in obesity-related diseases.. Horm Res 60: 3:56313. J. S. Yudkin, C. D. Stehouwer, J. J. Emeis, S. W. Coppack (1999). C-reactive protein in healthy subjects: associations with obesity, insulin resistance, and endothelial dysfunction: a potential role for cytokines originating from adipose tissue?. Arterioscler Thromb Vasc Biol 19: 972314. J. S. Yudkin, M. Kumari, S. E. Humphries, V. Mohamed-Ali (2000). Inflammation, obesity, stress and coronary heart disease: is interleukin-6 the link?. Atherosclerosis 148: 209-214 (in en). 315. P. A. Tataranni, E. Ortega (2005). A burning question: does an adipokine-induced activation of the immune system mediate the effect of overnutrition on type 2 diabetes?Diabetes 54: 917-927 (in en). 316. M. E. Trujillo, P. E. Scherer (2005). Adiponectin--journey from an adipocyte secretory protein to biomarker of the metabolic syndrome. J Intern Med 257: 167-175 317. C. D. Gardner, S. P. Fortmann, R. M. Krauss (1996). Association of small low-density lipoprotein particles with the incidence of coronary artery disease in men and women. JAMA 276: 875-881 (in en). 318. R. H. Eckel, M. Wassef, A. Chait, et al (2002). Prevention Conference VI. Diabetes and cardiovascular disease. Writing Group II: pathogenesis of atherosclerosis in diabetes. Circulation 105: E138-E143 (in en). 319. Y. Hori, E. C. Gabazza, Y. Yano, et al (2002). Insulin resistance is associated with increased circulating level of thrombin-activatable fibrinolysis inhibitor in type 2 diabetic patients. J Clin Endocrinol Metab 87: 660-665 (in en). 320. M. C. Stuhlinger, F. Abbasi, J. W. Chu, et al (2002). Relationship between insulin resistance and an endogenous nitric oxide synthase inhibitor. JAMA 287: 14201426 (in en). 321. P. Delafontaine (1998). Growth factors and vascular smooth muscle cell growth responses. Eur Heart J 19 (suppl. G): G18-G22 (in en). 322. J. N. Bella, R. B. Devereux, M. J. Roman, et al (2001). Separate and joint effects of systemic hypertension and diabetes mellitus on left ventricular structure and function in American Indians (the Strong Heart Study). Am J Cardiol 87: 1260-1265 (in en). 323. A. Frustaci, J. Kajstura, C. Chimenti, et al (2000). Myocardial cell death in human diabetes. Circ Res 87: 1123-1132 (in en). 324. W. B. Kannel (1977). An overview of the risk factors for cardiovascular disease. In: J. Genest, E. Koiw, O. Kuchel (eds).Hypertension: physiopathology and treatment. New York, NY McGraw-Hill: 888-910 (in en). 325. Shepherd J, Blauw GJ, Murphy MB, et al, for the Prospective Study of Pravastatin in the Elderly at Risk. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomised controlled trial. Lancet 2002; 360: 1623-30 326. (Ann Intern Med 2006; 144: 884-93) 327. (Am J Med 2006; 119: 133-41) 328. (Am J Hypertens 2006; 19: 47-52) 329. World Heath Organisation, Physical status: the use and interpretation of anthropometry. Report of a WHO Expert Committee. WHO Technical Report Series, No 854, 1995. 330. Martinez, J.A., Body-weight regulation: causes of obesity. Proceedings of the Nutrition Society, 2000. 59(3): p. 337-345. 331. Parillo, M. and G. Riccardi, Diet composition and the risk of Type 2 diabetes: epidemiilogical and clinical evidence. British Journal of Nutrition, 332. Panting JR (2002). Abnormal subendocardial perfusion in cardiac syndrome X, detected by cardiovascular magnetic resonance imaging. J Med 346: 346-1948 333. A. Cerchi, E. Onnis, P.A. Cerchi: Cardiopatia ischemica e valutazione strumentale del coronaropatico; 23-12-2004. 334. Zoghbi WA, Cheirif J, Kleiman NS. Verani MS, rakhtenbroit A: Diagnosis of ischemic heart disease with adenosine echocardiography. J Am Coll Cardiol 1991; 18: 335. Roger VL, Pellikka PA, Oh JK, Miller FA, Seward JB, Tajik AJ: Stress echocardiography. Part I. Exercise echocardiography: techniques, implementation, clinical applications and correlations (Review). Mayo Clinic Proceedings 1995; 70(I):5. 336. Muratori F, Vignati F, Di Sacco G (2003). La terapia farmacologica dell'obesità.. ADI Magazine 4: 488- 500. (in it). 337. Damci T, Yalin S, Balci H; et al (2004). Orlistat augments postprandial increases in glucagon-like peptide 1 in obese type 2 diabetic patients. Diabetes Care 27: 338. Klein S, Fontana L, Young L (2004). Absence of an effect of liposuction on insulin action and risk factors for coronary heart disease. J Med 350: 2549-57. (in en). 339. Davidson JK (2002). Terapia e complicanze del diabete mellito. Momento Medico. 340. Gillian DM, Quyyumi AA, Cannon RO Effects of physiological levels of estrogen on coronary vasomotor function in postmenopausal women (anno?); 89: 2545 341. Reis e Goth ST, Blumenthal Ethinyl estradiol acutely attenuates abnormal coronary vasomotor responses to acetylcholine in postmenopausal women (anno?); 342. Cannon RO Quyyumi AA, Mincemoyer R.. Inipramine in patients with chest pain despite normal corory ancgiograms. N Engl J Med (anno ?); 330: 1411. 343. Lakka TA, Laaksonen DE, Physical activity in prevention and treatment of the metabolic syndrome, volume=32, 1 pagine 76-88 anno 2007 344. Feldeisen SE, Tucker KL, Nutritional strategies in the prevention and treatment of metabolic syndrome volume=32, 1, pagine 46-60 anno 2007 345. Expert Panel on Detection, Evalutation, and Treatment of High Blood Cholesterol in Aduls. Executive summary of the Third Report of the National Choletserol Education Program (NCEP) (Adult Treatment Panel III) Jama 2001, 285, 2486-2497 346. Grundy SM, Brewer HB Jr, Cleeman JL, Smith SC Jr, Lenfrant C. American Heart Association; National Heart, Lung, and Blood Institute. Definition of metabolic syndrome: report of the National Heart, Lung, and Blood Institute/ American Heart Association conference on scientific issues related to definition. 2004, 109, 433347. World Health Organisation, Definition, diagnosis, and classification of diabetes mellitus, and its complication. Report of a WHO consultation. Ginevra: World Health Organisation 348. Reaven GM. The metabolic syndrome: requiescat in pace. 2005, 51, 931-938 349. Grundy SM. The metabolic syndrome still lives 2005, 51, 1352-1354 350. Reaven G. Just being alive is not good enough, 2005 51, 1354-1357 351. Stedman's Medical Dictionary, 27ma edizione Baltimora: Lippincott, Williams & Wilkins, 2000, pagina 1746 352. Joseph C. Sengen, Concise Dictionary of Modern Medicine, New York, McGraw-Hill. ISBN 978-88-386-3917-3 353. Harrison, Principi di Medicina Interna (il manuale - 16ª edizione), New York - Milano, McGraw-Hill, 2006. ISBN 88-386-2459-3 354. Hurst, Il Cuore (il manuale - 11ª edizione), Milano, McGraw-Hill, 2006. ISBN 978-88-386-2388-2 355. Eugene Braunwald, Malattie del cuore (7ª edizione), Milano, Elsevier Masson, 2007. ISBN 978-88-214-2987-3 356. J. A. Martinez, Body-weight regulation: causes of obesity, Proceedings of the Nutrition Society, 2000. 357. Y. Harano; M. Suzuki; Y. Koyama; et al, Multifactorial insulinresistance and clinical impact in hypertension and cardiovascular diseases. J Diabetes Complications, 2002. ISBN 88-299-1486-X 358. Journal of Cardiovascular medicine 8 (6): 94. (giugno 2007) . 359. W. B. Kannel. An overview of the risk factors for cardiovascular disease. J. Genest, E. Koiw, O. Kuchel (eds). Hypertension: physiopathology and treatment. New York, NY. McGraw-Hill: 94. 360. Von Essen MR, et al. Vitamin D controls T cell antigen receptor signaling and activation of human T cells. Nat Immunol. 2010;11:344-9. 361. Kreindler JL, et al. Vitamin D3 attenuates Th2 responses to Aspergillus fumigatus by CD4+T cells from cystic fibrosis patients with allergic bronchopulmonary aspergillosis. J Clin Invest.2010;120:3242-3254. 362. Hall W, et al. Vitamin D deficiency in cystic fibrosis. Int J Endocrinol. 2010; Article ID 218691. Epub 2010 Jan 28. 363. Khazai NB, et al. Treatment and prevention of vitamin D insufficiency in cystic fibrosis patients: comparative efficacy of ergocalciferol, cholecalciferol, and UV light. ITALCHIMICI 83
Scarica