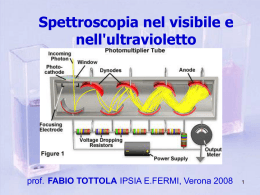
• Spettrofotometria UV-vis • Spettroscopia IR Questa spettroscopia, come già detto, si occupa delle transizioni fra diversi stati elettronici della molecola. Queste transizioni sono generalmente accompagnate a transizioni sia vibrazionali che rotazionali, per cui gli assorbimenti sono costituiti da moltissime righe molto vicine tra loro, tanto da apparire un continuo, cioè una banda. La “struttura fine” dovuta alle transizioni rotazionali e vibrazionali non è generalmente rilevabile, se non nel caso di spettri elettronici di gas rarefatti eseguiti con spettrografi ad alta risoluzione. Nei composti ORGANICI l’assorbimento UV-vis avviene per transizioni elettroniche tra orbitali molecolari popolati e orbitali vuoti. s* anti-legame p* anti-legame n non-legame p s legame legame Transizioni s s * Non si osservano nella regione UV-vis: sono necessarie radiazioni con l > 150 nm Queste transizioni corrispondono alle energie di rottura dei legami C-C, C-H, C-O, C-X... Transizioni n s * Per composti che hanno doppietti disponibili; ad es. composti con O, N, S e alogeni. Gli assorbimenti sono tipicamente nella regione tra 150-250 nm e non sono molto intensi. Transizioni n p * e p p * Per composti insaturi; ad es. composti con doppi e tripli legami e aromatici. Questi assorbimenti cadono nella regione tra 200-700 nm e sono molto intensi. In presenza di doppi legami coniugati, si verifica una delocalizzazione elettronica con conseguente diminuzione energetica tra un livello e l'altro: per queste transizioni occorreranno radiazioni a l minore, quali ad esempio quelle nel campo visibile. Spettri di assorbimento simili a quelli per le sostanze organiche. I nitrati danno assorbimenti intensi; si possono inoltre ottenere spettri di assorbimento UV-vis per specie che hanno orbitali d incompleti. Gli assorbimenti più intensi sono comunque quelli dei complessi dei metalli di transizione; in tal caso infatti si ha l’interazione tra gli orbitali dei leganti e gli orbitali d del metallo. Complessi per trasferimento di carica Complesso tra una specie elettron-donatore ed una elettron-accettore. Si ha un parziale trasferimento di elettroni dal donatore all’accettore (simile ad una struttura di risonanza) in uno stato eccitato. La transizione tra questo stato eccitato e lo stato fondamentale cade nella regione UV-vis. Queste specie mostrano bande molto intense, tanto che molti metodi di analisi spettrofotometrica si basano sulla formazione di tali complessi. Es. Fe2+ /ortofenantrolina Le radiazioni IR hanno un’energia insufficiente per promuovere transizioni elettroniche. L’assorbimento IR quindi è limitato ai livelli rotazionali e vibrazionali delle molecole. N.B. L’energia richiesta per causare una transizione rotazionale è piccola e cade nel lontano IR (< 100 cm-1): per i gas l’assorbimento in questa regione dà origine a spettri a righe ben definiti, mentre nei liquidi e nei solidi, le collisioni intermolecolari e le interazioni causano l’allargamento fino a un continuo. Pertanto nella spettroscopia IR si prendono in esame soltanto le transizioni vibrazionali. Dipendono da: • Numero di atomi • Tipo di atomi • Tipo di legame tra gli atomi Le vibrazioni possono essere suddivise in due categorie fondamentali: • STIRAMENTO (stretching): variazione continua della distanza interatomica lungo l’asse di legame • DEFORMAZIONE (bending): variazione dell’angolo tra 2 legami A causa dell’elevato numero di possibili moti vibrazionali delle molecole gli spettri IR possono essere molto complessi, soprattutto per grosse molecole. La spettroscopia IR viene usata prevalentemente per l’identificazione di composti organici, mediante riconoscimento di gruppi funzionali che assorbono a frequenze caratteristiche (analisi qualitativa). Gli spettri sono caratteristici per ogni sostanza (ione o molecola) ANALISI QUALITATIVA L’intensità della radiazione assorbita è proporzionale alla concentrazione della sostanza in esame ANALISI QUANTITATIVA Per effettuare analisi qualitative si fa uso di raggi policromatici a spettro continuo, separati tramite monocromatori nelle varie componenti (radiazioni monocromatiche). Le singole radiazioni monocromatiche si fanno passare, una alla volta, attraverso la sostanza in esame, la quale assorbirà in modo diverso le diverse radiazioni. Riportando i valori registrati in un grafico lunghezza d'onda-assorbimento, si ottiene lo spettro di assorbimento della sostanza esaminata. Spettri UV-vis di K2Cr2O7 e KMnO4 Spettro IR dell’ottano Poiché ogni sostanza ha un particolare spettro di assorbimento, l'esame di tali spettri permette di identificare una sostanza (per confronto diretto con campioni noti o tramite banche dati di spettri) o di controllarne il grado di purezza. Quando un raggio luminoso di potenza radiante P0 viene assorbito da un campione, la sua potenza si riduce e solo una parte (P) viene trasmessa. Si definisce TRASMITTANZA (T) la frazione di luce incidente che viene trasmessa dal campione, cioè T = P/P0 Generalmente anziché usare la trasmittanza nelle analisi chimiche è comodo far riferimento all’ASSORBANZA (A) definita come: A = - log T. L’assorbanza è importante perché è direttamente proporzionale alla concentrazione della specie presente nel campione responsabile dell’assorbimento della luce. L’equazione che correla l’assorbanza con la concentrazione è la legge di LAMBERT-BEER: A= bc c = concentrazione molare (M, mol/L), b = cammino ottico (generalmente misurato in cm), = assorbività molare o coefficiente di estinzione (M-1 cm-1). È una costante. Dipende dalla natura della sostanza e dalla l. L’assorbanza è pertanto una grandezza adimensionale b P0 P Soluzione di concentrazione c La legge di Lambert-Beer è valida per radiazioni monocromatiche e soluzioni diluite È valida solo per soluzioni diluite (< 10-2 M) All'aumentare della concentrazione aumenta il numero di particelle in soluzione ed aumenta anche il numero di urti fra queste; le forze interioniche e/o intermolecolari aumentano e possono formarsi molecole o aggregati di particelle più complesse, diverse per struttura da quelle in esame, per cui si potrà avere uno spostamento del massimo di assorbimento. dipende dall’indice di rifrazione del mezzo che, per concentrazioni elevate, dipende a sua volta dalla concentrazione. Limiti strumentali Radiazione incidente non perfettamente monocromatica Radiazioni parassite che raggiungono il rivelatore A' log P0 Ps P Ps Ps = radiazione parassita non assorbita
Scaricare