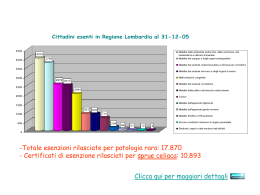
UPDATE MALATTIA CELIACA La malattia celiaca:introduzione Dott.ssa Valeria Criscuoli 22 ottobre 2011 Definizione E’ una enteropatia immuno-mediata scatenata da fattori ambientali (la gliadina ) in individui geneticamente predisposti (portatori di geni codificanti le molecole HLADQ2 o HLA-DQ8) Il glutine in particolare presenta due componenti: la frazione gluteninica idro-solubile, poco coinvolta nella tossicità, e la frazione prolaminica alcool-solubile che appare implicata nella patogenesi della malattia (proteine gliadine e glutenine >>prolammine) Le proteine del glutine implicate nell’insorgenza della malattia sono la gliadina per il frumento, la secalina per la segale e l’ordeina per l’orzo; caratteristica comune a tutte queste sostanze è l’elevato contenuto in glutamina (>30%) e prolina (>15%) Le prolammine del frumento sono suddivise in α-, β-, γ-, ω-gliadine, con un peso molecolare che varia da 30000 a 75000 daltons; la gliadina A è la componente più importante delle α-gliadine e sembra essere la frazione più direttamente responsabile dell’insorgenza della malattia La patogenesi Zonuline (zonula occludens toxin) Regola le giunzioni intercellulari L’espressione della zonulina è aumentata nell’intestino durante la fase acuta della malattia celiaca La disregolazione di questa proteina potrebbe disturbare la funzione intestinale di barriera La zonulina determinerebbe un’apertura delle tight junctions intestinali durante la fase precoce di malattia consentendo l’ingresso di allergeni a livello di sottomucosa IGA Anti-zonulina sono presenti nel 21% dei celiaci Fasano. The Lancet, Volume 355, Issue 9214, 29 April 2000, Pages 1518-1519 Transglutaminasi:autoantigene predominante La transglutaminasi tissutale (tTG )è un enzima intracellulare rilasciato dalle cellule infiammatorie, endoteliali e fibroblasti, cellule epiteliali in risposta ad uno stimolo infiammatorio (-> gliadina o altri irritanti). Il passo successivo è l’interazione tra la transglutaminasi rilasciata e la gliadina che è un substrato eccellente per la tTG dando vita ad un complesso gliadina- tTG e neoepitopi antigenici Una volta secreto reagisce e deamina i peptidi della gliadina le quali vengono presentate dalle cellule presentanti l’antigene DQ2+ e DQ8+ alle T cell CD4+ alimentando lo stimolo infiammatorio. La patogenesi Rappresentazione schematica dei cinque stadi di lesione associati con la ipersensibilità al glutine. Le lesioni variano istologicamente da alterazioni lievi caratterizzato da un aumento dei linfociti intraepiteliali (tipo 0 ) fino ad una mucosa piatta con totale atrofia mucosale ,completa perdita dei villi e iperplasia delle cripte (tipo 3 ). La lesione tipo 4 è vista nel linfoma T cellulare Marsh MN. Gastroenterology 1992; 102:330. atrofico Parziale atrofia infliltrativo Cofattori ambientali Infezioni intestinali possono causare un transitorio aumento della permeabilità del piccolo intestino e quindi aumentare l’immunogenicità del glutine 1. Aumentata frequenza di infezioni da Rotavirus potrebbe aumentare il rischio di malattia in bambini geneticamente predisposti (Stene Am J Gastroenterol 2006; 101 2333-40). E’ stato identificato un peptide consensus che viene riconosciuto da anticorpi di pazienti celiaci e risulta avere omologia con la proteina neutralizzante maggiore VP7 di Rotavirus Colonizzazione da parte di batteri a bastoncello in bambini con malattia celiaca (Forsberg Am J Gastroenterol 2004; 99:894904 Inserimento precoce del glutine durante lo svezzamento Allattamento al seno Uno studio svedese caso-controllo ha dimostrato come l’introduzione del glutine nella dieta mentre il bambino è ancora allattato al seno sia un fattore protettivo indipendente contro lo sviluppo della malattia ( Ivarsson A Am j Clin Nutr 2002 ;75 :914-21) Epidemiologia Studi epidemiologici condotti tramite accurati screening sierologici nella popolazione generale, hanno dimostrato che la malattia celiaca ha una frequenza maggiore di quanto pensato. Incidenza della malattia celiaca x 100000 abitanti 300 250 200 150 100 50 N° Casi 0 Ireland England Sweden Italy USA Epidemiologia 2 La più alta prevalenza riportata in Europa è in Finlandia di 1:99 In Irlanda di 1:122 e in Italia di 1:175 Sebbene la malattia celiaca si pensava fosse poco presente negli Stati Uniti, studi su donatori americani hanno rivelato un dato di prevalenza sovrapponibile a quella europea ( 1 su 250). ( Not T,Scand J Gastroenterol. 1998;33(5):494) Programmi di screening basati sulla ricerca anticorpale hanno dimostrato un’alta prevalenza di malattia celiaca Uno dei piu’ grandi studi di screening è stato condotto su 17.201 bambini in età scolare ( 6 – 15 anni) reclutati in diverse regioni d’Italia e rappresentativi del 69% della popolazione elegibile. La prevalenza è stata di 1:184 con un rapporto tra non diagnosticati e diagnosticati di 7:1. Catassi C, Acta Paediatr Suppl. 1996;412:29. Basandosi su questi dati è stato stimato che il numero di pazienti affetti sia di 220.000 Epidemiologia 3 Il rapporto F/M 2:1 La suscettibilità genetica è confermata dall’alta incidenza familiare Rischio tra i parenti di I grado è di circa 10-15 % Tra gemelli monozigoti è del 75% ( ruolo dei fattori ambientali) Tra fratelli con identico HLA è del 40% King AL Molec Genet Metab 2000;71:70-5 Un grande studio americano su 13,145 soggetti sottoposti a screening (4508 parenti di I grado di pazienti celiaci, 1275 parenti di II grado , 3236 pazienti sintomatici, e 4126 individui non a rischio) Tra i pazienti a rischio la prevalenza di malattia celiaca era di 1:22 tra parenti di I grado, 1:39 tra parenti di II grado, 1:56 in pazienti sintomatici, 1 :133 tra pazienti non a rischio. Fasano Arch Intern Med. 2003;163(3):286 Epidemiologia 4 L’età di esordio ha una curva bimodale con il primo picco tra 8 e 12 mesi ed il secondo durante la terzaquarta decade di vita. Studi recenti suggeriscono tuttavia che il rischio di sviluppare malattia si ha a qualsiasi età anche negli anziani. La prevalenza stimata in Inghilterra su popolazione adulta-anziana(45-76 anni) e’ di 1.2%. Circa il 20% delle nuove diagnoi era su pazienti >60 Modello ipotetico che mostra l’interazione della gliadina a differenti livelli Mediatori proinfiammatori Glutine Mucosa vulnerabile Suscettibilità mucosale geneticamente determinata Modificazioni enteropatiche precoci Fattori ambientali: Infezioni Stage I Tossicità diretta Atrofia dei villi conclamata HLA-DQ2/8 Stage II Tossicità immuno-mediata Malattia celiaca clinicamente manifesta Malattia celiaca silente Malattia celiaca latente Popolazione sana morfologia digiunale DR3-DQ2 DR5/7-DQ2 DR4-DQ8 Suscettibilità genetica La punta dell’iceberg Lesioni mucosali evidenti Morfologia mucosale normale
Scaricare