Integrine Continuazione 1. ASSE INTEGRINEFILAMENTI DI ACTINA http://jcs.biologists.org/content/122/2/199/F1.large.jpg Migrazione cellulare http://ous-research.no/home/institute/news/10650 Integrins in cell migration – the actin connection Vicente-Manzanares M, Choi CK, Horwitz AR. Integrins in cell migration—the actin connection. J Cell Sci. 2009 Jan 15;122(Pt 2):199-206. http://jcs.biologists.org/content/122/2/199.figures-only Contrazione della muscolatura liscia http://faculty.etsu.edu/forsman/Histology%20of%20musclefor%20web_files/image006.jpg Molecular organization of integrin/cytoskeletal adhesion junctions in smooth muscle. Actin filaments are linked to integrin proteins via actin cross-linking proteins that bind to the cytoplasmic tails of integrin proteins. Scaffolding proteins regulate the assembly of protein complexes at adhesion junctions in response to contractile stimulation. Proteins that assemble into macromolecular complexes at adhesion junctions regulate actin polymerization. HSP, heat shock protein; ILK, integrin-linked kinase; FAK, focal adhesion kinase; N-WASp, neuronal Wiskott-Aldrich syndrome protein. http://ajpcell.physiology.org/content/295/3/C576 L’asse integrine – actina (1) Al contrario di quanto avviene con α6β4, la maggior parte delle integrine in seguito a legame con un ligando sono collegate funzionalmente al citoscheletro di actina. Un ligando fondamentale delle integrine associate all’actina è la fibronectina (FN) che nell’Uomo e nei topi è riconosciuta da 11 eterodimeri di integrine. La fibronectina è una grande glicoproteina che esiste in due forme: Fibronectina cellulare: presente nei tessuti dove si assembla in una matrice fibrillare. Fibronectina plasmatica: prodotta dagli epatociti e secreta nel sangue dove rimane in forma solubile non fibrillare, oppure, quando penetra nei tessuti r,imane incorporata nella ECM La fibronectina si trova solo nei Vertebrati ed è fondamentale per lo sviluppo della vascolarizzazione dove si trova fra l’endotelio e le cellule perivascolari. Wickstrom et al. In: Extracellula matrix Biology, Cold Spring Harbor Perspectives in Biology, 2012 Wickstrom et al. In: Extracellula matrix Biology, Cold Spring Harbor Perspectives in Biology, 2012 L’asse integrine – actina (2) La fibronectina (FN) è un dimero legato da ponti disolfuro e la sua deposizione in una matrice fibrillare è un processo cellulare che dipende in modo critico dalle integrine. Le integrine α5β1, αvβ3, α4β1 e αIIbβ3 inducono la fibrillogenesi in vitro. Queste integrine si legano alla FN, che è secreta come struttura compatta globulare in cui i siti di legame per altre molecole di FN sono sepolti all’interno della proteina («siti criptici»). Il legame è seguito dall’attivazione del segnalamento mediato da integrine, portando al reclutamento di proteine citoplasmatiche per formare complessi di adesione focale (FCs). Diversi componenti delle adesioni focali sono proteine che legano e modulano l’actina permettendo il reclutamento e la riorganizzazione del citoscheletro di actina verso questi siti e la loro maturazione in FAs. Wickstrom et al. In: Extracellula matrix Biology, Cold Spring Harbor Perspectives in Biology, 2012 L’asse integrine – actina (3) La principale integrina che contribuisce alla formazione di fibrille di FN, la α5β1, lascia le adesioni focali (FA) e si muove lungo la F-actina per formare adesioni fibrillari. In questo modo facilita la generazione di tensione meccanica tramite il citoscheletro di actina, portando allo stiramento della molecola di FN legata che provoca la comparsa in superficie di siti di auto-assemblamento precedentemente criptici e, successivamente al legame di altre molecole di FN, con la risultante produzione di fibrille di FN. Wickstrom et al. In: Extracellula matrix Biology, Cold Spring Harbor Perspectives in Biology, 2012 http://www.ks.uiuc.edu/Research/fibronectin/images/fn-int.jpg Streching a fibronectin type III module FN-III1. Click here for a movie (MPEG, 1.7M) showing the unfolding of the module. http://www.ks.uiuc.edu/Research/fibronectin/ Immunofluorescence image captured by two-photon microscopy showing cell nuclei (blue), fibronectin (green), and actively proliferating cells (red) in a three dimensional “tissue body”. https://www.urmc.rochester.edu/labs/DaleckiLab/news/?display=2010 Fibronectin, one of the typical ligands of integrin, may induce cell attachment and cell spread. On activated integrins binding to the fibronectin, .. http://mcr.aacrjournals.org/content/6/2.cover-expansion Integrine 2. ATTIVAZIONE Kinbara K, Goldfinger LE, Hansen M, Chou FL, Ginsberg MH. Ras GTPases: integrins' friends or foes? Nat Rev Mol Cell Biol. 2003 Oct;4(10):767-76. Attivazione delle integrine (1) Le integrine manifestano tre stati di attivazione principali: inattivo (bassa affinità), attivo (alta affinità) e occupato dal ligando. Nel modello detto «switchblade» (cambia lame) un’integrina inattiva è ripiegata su se stessa, facendo che la tasca di legame con il ligando sia sotterrata. Le integrine sono attive quando dritte, posizione in cui espongono interamente la tasca di legame con il ligando. Coombe & Dye. In: Cell Adhesion Molecules, CRC Press Conformazioni inattiva e attiva (a) Evans, 2009: http://jcs.biologists.org/content/122/2/215/F1.large.jpg http://www.nature.com/nrm/journal/v11/n4/box/nrm2871_BX1.html http://www.mechanobio.info/figure/1384245207230.jpg.html Vedi Fig. 19-45 Alberts nuovo La struttura delle subunità di una integrina attiva, che collega la matrice extracellulare al citoscheletro di actina. La testa della molecola di integrina si collega direttamente ad una proteina extracellulare tipo fibronectna; la coda intracellulare dell’integrina si collega alla talina, che a sua volta si collega all’actina filamentosa. Un insieme di altre proteine intracellulari di ancoraggio, che includono la -actinina, la filamina e la vinculina, aiutano a rafforzare il legame. Attivazione delle integrine (2) Quando sono inattive, le integrine si legano ai ligandi con bassa affinità. Questa interazione a bassa affinità stimola segnali intracellulari che attivano la proteina del citoscheletro talina, che si lega alla coda citoplasmatica della subunità β. Questo legame rompe l’associazione inibitoria fra le catene α e β, permettendo che le regioni citoplasmatiche e transmembrana delle due catene si separino e porta alla condizione in cui il dominio extracellulare cambi da una conformazione ripiegata ad una forma distesa che permette un legame ad alta affinità con il ligando. Nonostante le integrine si leghino ai loro ligandi con alta affinità in seguito all’attivazione «inside-out», il legame stabile richiede che i loro domini citoplasmatici siano ancorati al citoscheletro. Il legame integrina-ligando scatena l’aggregazione delle integrine sulla superficie cellulare e porta al reclutamento di enzimi e di molecole adattatatrici che formano complessi di adesione che collegano le integrine al citoscheletro. Coombe & Dye. In: Cell Adhesion Molecules, CRC Press LE INTEGRINE POSSONO CAMBIARE DA UNA CONFORMAZIONE ATTIVA AD UNA INATTIVA (1) Una cellula che striscia in un tessuto – ad es. un fibroblasto o un macrofago o una cellula epiteliale che ha subito una transizione epitelio-mesenchimale e migra lungo la lamina basale – deve essere in grado sia di stabilire che di rompere i collegamenti con la matrice, e di farlo rapidamente in modo da viaggiare rapidamente. Allo stesso modo, un leucocita circolante deve essere in grado di attivare che di disattivare la sua capacità di legarsi alle cellule endoteliali in modo da strisciare fuori da un vaso sanguigno in un sito di infiammazione, nelle circostanze appropriate. Inoltre, se si deve applicare delle forze laddove esse sono richieste, il fare e disfare dei collegamenti extracellulari in tutti questi casi devono essere accoppiati all’assemblaggio e disassemblaggio rapido dei collegamenti al citoscheletro all’interno della cellula. LE INTEGRINE POSSONO CAMBIARE DA UNA CONFORMAZIONE ATTIVA AD UNA INATTIVA (2) Le molecole di integrine che attraversano la membrana e mediano i collegamenti non possono essere oggetti semplicemente passivi ed inerti con porzioni appiccicose ad entrambe le estremità. Esse debbono essere in grado di alternare fra un stato attivo in cui rapidamente formano collegamenti e uno stato inattivo in cui non lo fanno; inoltre, il collegamento con i loro ligandi da un lato della membrana deve alterare la propensione a legare un diverso insieme di ligandi dall’altro lato. LE INTEGRINE POSSONO CAMBIARE DA UNA CONFORMAZIONE ATTIVA AD UNA INATTIVA (3) La base di questi fenomeni dinamici é la regolazione allosterica; quando un integrina si lega o si distacca dai suoi ligandi, essa subisce dei cambiamenti conformazionali che influenzano sia le estremità intracellulari che extracellulari della molecola. Le alterazioni strutturali da una parte sono accoppiate ad alterazioni strutturali dall’altra, cosicchè le influenze possono essere trasmesse in qualsiasi direzione attraverso la membrana cellulare. Le pinze per il legname che i boscaioli usano per afferrare i ceppi possono essere prese per analogia. Pinze per ceppi. Vedi figura ceppo Alberts nuovo Quando si prendono le maniglie, le pinze afferrano il ceppo; se si chiudono le pinze sul ceppo, le maniglie si avviccinano. Inoltre, quanto maggiore é la tensione sulle lingue laterali, tanto più forte è la presa ad entrambe le estremità. In una molecola di integrina, i dettagli del legame sono differenti, ma i principi meccanici sono simili: i cambiamenti conformazionali nelle estremità opposte della molecola sono accoppiati, e avvicinando le maniglie si ha una presa più forte. LE INTEGRINE POSSONO CAMBIARE DA UNA CONFORMAZIONE ATTIVA AD UNA INATTIVA (4) Le alterazioni strutturali delle integrine possono essere dimostrate prendendo una preparazione purificata di molecole di integrine esaminandole ad alta risoluzione con microscopia elettronica. Se le integrine sono mantenute in un mezzo ricco di Calcio simile al liquido extracellulare normale, ma senza un ligando extracellulare, e in seguito rapidamente preparate per la microscopia elettronica, esse si presentano come oggetti a forma di V strettament ripiegati. Se invece si aggiunge al mezzo un piccolo peptide sintetico contenente la sequenza che imita il dominio di legame con l’integrina di una proteina della matrice extracellulare naturale, le integrine si legano a questa molecola e si estendono adottando una forma diversa in cui le due gambe non sono più piegate strettamente, ma invece si distendono e si separano una dall’altra, reggendo una regione di testa ben sopra di esse. LE INTEGRINE POSSONO CAMBIARE DA UNA CONFORMAZIONE ATTIVA AD UNA INATTIVA (5) Queste coppie di strutture possono essere paragonate con dati pù dettagliati di cristallografia di raggi X che rivelano che le due gambe corrispondono alle catene e β delle integrine. La regione della testa, dove esse si incontrano, contiene il sito di legame per il ligando extracellulare. Il legame con il suo ligando distorce questa regione in modo da favorire la scelta di una conformazione “attiva”, distesa; vice-versa, la scelta di della conformazione distesa crea un sito di legame più favorevole, con maggiore affinità per il ligando. In che modo questi cambiamenti nella regione extracellulare dell’integrina si collegano agli eventi che occorrono all’estremità intracellulare della molecola di integrina? Nella loro conformazione ripiegata, inattiva, le porzioni intracellulari delle catene e β rimangono molto vicine e aderiscono una all’altra. Quando il dominio extracellulare si allarga, questo contatto si rompe e le porzioni intracellulari (e transmembrana) di queste catene si separano. Come risultato, il sito di legame per la talina sulla coda della catena β viene esposto. Il legame con la talina porta a sua volta all’assemblamento di filamenti di actina ancorati all’estremità intracellulare dell’integrina. In questo modo, quando una integrina si aggrappa al suo ligando fuori dalla cellula, la cellula reagisce collegando il suo citoscheletro alla molecola di integrina, in modo tale da potere applicare delle forze a questo punto di attacco. Ciò viene noto come attivazione “outside-in”. La catena di causa ed effetto può anche funzionare in senso opposto, dall’interno verso l’esterno invece che dall’esterno verso l’interno (segnalamento «inside-out»). La talina compete con la catena per il suo sito di legame sulla coda della catena β. Perciò, quando la talina si lega alla catena β, essa disfa il legame -β, permettendo alle due gambe della molecola di integrina di scattare e di separarsi. Ciò guida la porzione extracellulare dell’integrina verso la sua conformazione estesa, attiva. Questa attivazione “inside-out” viene scatenata da molecole regolatorie intracellulari. Queste includono il fosfoinositide PIP2, che si ritiene sia in grado di attivare la talina in modo tale che essa si lega in modo forte alla catena β dell’integrina. In questo modo, un segnale generato all’interno della cellula scatena un processo tramite il quale le molecole di integrina afferrano e tengono saldamente i loro ligandi extracellulari. Le molecole intracellulari come il PIP2 sono esse stesse prodotte in risposta a segnali ricevuti dall’esterno della cellula mediante altri tipi di recettori di superfcie, quali i recettori accoppiati a proteine G e i recettori ad attività tirosina chinasica, che possono quindi controllare l’attivazione delle integrine. Viceversa, l’attivazione delle integrine mediante legame alla matrice può influenzare il ricevimento dei segnali mediati da altre vie di signalling. L’interazione di tutte queste vie di comunicazione, trasmettendo i segnali in entrambe le direzioni attraverso la membrana cellulare, permette che abbiano luogo interazioni complesse fra le cellula e il ambiente fisico-chimico. Ligandi multivalenti Hynes RO, Naba A. Overview of the matrisome--an inventory of extracellular matrix constituents and functions. Cold Spring Harb Perspect Biol. 2012 Jan 1;4(1):a004903. http://www.stonybrook.edu/biochem/BIOCHEM/facultypages/holdener/figures/mesd/fig9talin.gif Seminario Talina (p235) (1) Fornisce un collegamento tra i microfilamenti di actina. E’ una proteina di dimensioni abbastanza grandi (MW 270 kDa; 235 kDa nei gel, donde il nome originario di p235). Nuclea l’assemblaggio di actina e si lega alla vinculina oltre che a un gran numero di proteine leganti l’actina e altre proteine sopratuttto nelle adesioni focali. Oltre che legarsi alla vinculina, che di per se si associa ai lipidi, la talina è anche in grado di legarsi direttamente ai lipidi. http://www.bms.ed.ac.uk/research/others/smaciver/Encyclop/Abp-t/Talin.htm Seminario Talina (2) E’ una proteina dimerica testa-coda che adotta una forma a manubrio. E’ facilmente digerita (trombina, calpaina II) in due domini si 47 kDa e di 200 kDa. Il frammento di 47 kDa è il N-terminale e si lega a lipidi anionici (PIP2) La coda C-terminale di maggiori dimensioni forma un gran numero di ripetizioni. Si ritiene che contenga tre siti diversi di legame con l’actina. Il rapporto della talina con l’actina è complesso: Da una parte riduce la lunghezza dei filamenti di actina e la viscosità delle soluzioni di actina. Dall’altro è in grado di nucleare l’assemblaggio dell’actina. L’interazione actina-talina è molto sensibile al pH. Integrine 3. Trasduzione segnali & Meccanotrasduzione http://jcs.biologists.org/content/115/19/3729/F1.expansion.html SEGNALAMENTO MEDIATO DA INTEGRINE L’interazione delle integrine con la matrice extracellulare nei punti di contatto o di adesioni focali porta all’aggregazione delle integrine e al reclutamento di molecole di segnalamento e di filamenti di actina ai domini citoplasmatici delle integrine. L’adesione cellulare alla matrice di per può attivare diverse molecole di segnalamento che includono la “focal adhesion kinase” (FAK), le MAP chinasi Erk e c-Jun kinase (JNKs) e i membri Rho della famiglia delle GTPasi, incluso RhoA, Rac1 e CDC42. Le integrine regolano l’adesione cellulare, lo “spreading” delle cellule sulla matrice , la proliferazione, la sopravvivenza (o l’apoptosi) e alterazioni morfologiche di diversi tipi cellulari (ad es. cellule epiteliali, endoteliali, fibroblasti e altri tipi di cellule mesenchimali). Lee JW, Juliano R. Mitogenic signal transduction by integrin- and growth factor receptor-mediated pathways. Mol Cells. 2004 Apr 30;17(2):188-202. http://www.nature.com/nrm/journal/v6/n1/box/nrm1549_BX1.html Integrine/actina e trasduzione di segnale (1) Oltre a catalizzare l’assemblaggio della matrice, il legame delle integrine alla fibronectina (FN) o ad altri ligandi porta all’induzione di diversi tipi di segnalamento intracellulare. Questi includono l’attivazione di vie classiche di segnalazione tramite fosforilazione di residui di tirosina e serina in substrati specifici, che ha come risultato finale la regolazione della sopravvivenza, crescita o differenziamento cellulari. Questo segnalamento opera in stretta collaborazione con il segnalamento indotto da fattori di crescita, rendendo difficile la comprensione dei segnali che specificamente scaturiscono dalle integrine legate. Un ulteriore modo di segnalamento è il reclutamento di actina filamentosa (F-actina) si siti di adesione tramite integrine, un processo strettamente accoppiato al rimodellamento attivo del citoscheletro di actina. Wickstrom et al. In: Additional perspectives on Extracellula Biology, Cold Spring Harbor Laboratory Press, Integrine/actina e trasduzione di segnale (2) Il legame integrine-actina è molto importantee per il funzionamento delle integrine sotto diversi aspetti: 1. La polimerizzazione activa dell’actina, la formazione di legami incrociati e l’ulteriore generazione di forza sono fondamentali per la maturazione delle adesioni mediate da integrine che si creano e sono di vita breve in adesioni focali stabili e in grado di trasmettere il segnale. 2. E’ richiesto per il preciso controllo spazio-temporale delle protrusioni cellulari e loro retrazione durante la migrazione cellulare. 3. Permette alle cellule di adottare o modificare la loro forma caratteristica, ad esempio, per diventare polarizzate. 4. E’ critico per l’assemblaggio della matrice di fibronectina http://www.nature.com/nrm/journal/v3/n4/fig_tab/nrm779_F3.html http://0-physrev.physiology.org.library.pcc.edu/content/88/2/489/F1.large.jpg Hynes RO. Integrins: bidirectional, allosteric signaling machines. Cell. 2002 Sep 20;110(6):673-87. Francavilla C, Maddaluno L, Cavallaro U. The functional role of cell adhesion molecules in tumor angiogenesis. Semin Cancer Biol. 19:98-309, 2009. L’interazione con le proteine della matrice extracellulare (es. fibronectina e vitronectina) o con immunoglobuline sulle superficie cellulare [es. «intercellular adhesion molecule 1» (ICAM-1) e «vascular adhesion molecule-1» VCAM-1)] promuove l’aggregazione delle integrine e conseguente trasduzione di segnale mediata dalle integrine. In conseguenza del legame, le integrine (che non hanno attività enzimatiche o chinasiche specifiche) attivano complesse vie di segnalamento associandosi con chinasi e proteine adattatrici nei complessi delle adesioni focali. I complessi delle adesioni focali, identificati come strutture specializzate di adesione, sono composti da: Integrine Proteina chinasi, quali le «focal adhesion kinase», FAK, e il «nonreceptor tyrosine kinase receptor Src Proteine adattatrici (es. Shc) Intermediari di segnalamento (es. famiglia Rho delle GTPasi) Proteine citoscheletriche che legano l’actina (es. talina, la α-actinina, la paxillina, la tensina e la vinculina) Altre proteine di segnalamento. Il signaling mediato dalle integrine regola l’espressione genica, la crescita cellulare, il differenziamento e la sopravvivenza. Francavilla C, Maddaluno L, Cavallaro U. The functional role of cell adhesion molecules in tumor angiogenesis. Semin Cancer Biol. 19:98-309, 2009. Francavilla C, Maddaluno L, Cavallaro U. The functional role of cell adhesion molecules in tumor angiogenesis. Semin Cancer Biol. 19:98-309, 2009. Un’impedita regolazione del signaling mediato dalle integrine può contribuire alla progressione della malattia in diverse tipologie di patologie, che includono le malattie autoimmuni, le disfunzioni trombotiche e il cancro. Alberts figura 19-49 importante Attivazione delle integrine mediante comunicazione intrecciata con altre vie di segnalazione. Dei segnali ricevuti dall’esterno della cellula mediante altri tipi di recettori di superficie, quali recettori accoppiati a proteine G e recettori ad attività tirosina chinasica, possono alterare la conformazione della talina e quindi attivare le integrine Il segnalamento mediato da integrine dipende dalla attività tirosina chinasiche non recettoriali delle proteine FAK (“focal adhesion kinase”) e src, nonchè dalla funzioni di proteina adattatrici FAK, src e Shc per iniziare eventi di segnalamento a valle. Sono illustrate le comuni cascate di chinasi ma per semplicità sono omesse la cooperatività e l’attivazione incrociata fra le differenti cascate. Un ammonimento all’interpretazione del ruolo delle integrine nella mediazione della sopravvivenza è che gli effetti delle chinasi sono spesso studiati mediante l’uso di costrutti attivi costituzionalemente. Non è chiaro se questo approccio simola precisamente le vie di segnalamento mediato dalle integrine... Stupack & Cheresh, 2002 Sono assenti nello schema anche un gran numero di proteine citoscheletriche, quali la α-actinina, l’actina, la vinculina,la talina e la paxcillina, che fungono da adattatori, reclutatori e impalcature su cui questi eventi Integrin Signaling via Focal Adhesion Kinase http://www.ncbi.nlm.nih.gov/books/NBK9908/figure/A1783/ Seminario Focal adhesion kinases (FAKs) (1) Parsons JT. Focal adhesion kinase: the first ten years. J Cell Sci. 2003 Apr 15;116(Pt Seminario: Focal adhesion kinases (FAKs) (2) La FAK comprende un dominio catalitico centrale fiancheggiato da grandi domini N- e C-terminali non catalitici. Il dominio N-terminale ha somiglianza di sequenza con una famiglia di proteine che contiene domini detti FERM (erythrocyte band four.1 ezrinradixin-moesin). Di solito, i membri di qeusta familia collegano flicoproteine transmembrana al citoscheletro di actina, Nel caso della FAX il ruolo del dominio FERM non è chiaro. In vitro il N-terminale della FAX si lega a sequenze del dominio citoplasmatico delle subunità β delle integrine, ma non ci sono prove di un simile collegamento in vivo. Il dominio N-terminale media inoltre l’interazione con forme attivate del recettore per l’Epidermal Growth Factor (EGF). Diversi dati indicano che il dominio FERM può dirigere la FAK a siti di aggregazione di integrine o di recettori per fattori di crescita e regolare l’attività catalitica e la localizzaione subcellulare della FAK. Parsons JT. Focal adhesion kinase: the first ten years. J Cell Sci. 2003 Apr 15;116(Pt Seminario: Focal adhesion kinases (FAKs) (3) La regione C-terminale della FAK è ricca di siti di interazione proteina-proteina. Una sequenza con circa 100 residui di AA designata «FAT» (Focal Adhesion Targetting») indirizza la FAK verso complessi adesivi di nuova formazione o già formati. L’integrità di questa regione è essenziale per il segnalamento della FAK. Il dominio FAT è inoltre un sito di legame per la proteina delle adesioni focali paxilina. Poichè la paxlina si lega direttamente ai domini citoplasmatici dei recettori integrinici nonchè alla proteina delle adesioni focali vinculina, la paxillina può fungere da «docking partner» per la FAK nei complessi di adesione. Il dominio chinasico della FAK condivide somiglianza di sequenza con altre tirosina chinasi sia recettoriali che non. Parsons JT. Focal adhesion kinase: the first ten years. J Cell Sci. 2003 Apr 15;116(Pt Seminario: La FAK come interrutore per molteplici segnali di uscita La fosforilazione della FAK in risposta al’ingagio delle integrine con un ligando porta alla formazione di fosfotirosine che fungono da siti di ancoraggio per diverse classi di molecole di segnalamento e può essere importante per il legame indotto da cambiamenti conformazionali di proteine ad altri motivi strutturali all’interno dei domini non-catalitici C- e N-terminali. La fosforilazione di Tyr397 crea un sito ad alta affinità per il dominio SH2 delle famiglia di chinasi Src e porta al reclutamento e attivazione della Src mediante formazione di un complesso bipartito di chinasi. Questo complesso porta alla fosforilazione su tirosine di siti addizionali della FAK e su proteine liganti la FAK quali Cas e paxilina. La fosforilazione della Tyr397 inoltre sembra essere importante per il reclutamento di altre proteine contenenti SH2, che inclusono la subunità di 85kDa della phosphoinositide 3-kinase (PI 3-kinase), la fosfolipasi C (PLC)γ e la proteina adattatrice Grb7. Parsons JT. Focal adhesion kinase: the first ten years. J Cell Sci. 2003 Apr 15;116(Pt Parsons JT. Focal adhesion kinase: the first ten years. J Cell Sci. 2003 Apr 15;116(Pt Seminario ADESIONI FOCALI Seminario: Adesione focale/Contatto focale Zona di adesione specializzata fra la cellula e il substrato sottostante. Complessi macromolecolari proteici che collegano la matrice extracellulare al citoscheletro di actina mediante le integrine. Un gran numero di proteine specifiche sono concentrate nei contatti focali Queste sono di solito proteine strutturali, del citoscheletro ma anche di segnalamento. Seminario: Adesioni focali (1) Quando fibroblasti e cellule epiteliali sono coltivati in vitro su una piastra la superficie inferiore della cellula non è uniformemente schiacciata contro il substrato. La cellula è ancorata alla superficie solo in corrispondenza di alcuni siti sparsi e ben definiti: adesioni focali. Le adesioni focali sono strutture dinamiche che possono disassemblarsi rapidamente se la cellula è stimolata a muoversi o ad entrare in mitosi. In un’adesione focale la membrana plasmatica contiene degli ammassi delle proteine di adesione dette integrine, per lo più α v β3 . Seminario: Adesioni focali (2) I domini citoplasmatici delle integrine sono collegati tramite vari adattatori ai filamenti di actina. Le adesioni focali possono fungere come un sensore che raccoglie informazioni sulle caratteristiche fisiche (meccaniche) e chimiche (composizione proteica, glicoproteica, proteoglicanica, glicosaminoglicanica) e le trasmette all’interno delle cellule. Tali informazioni possono indurre cambiamenti di adesione cellulare, proliferazione, differenziamento e sopravvivenza. Le adesioni focali sono inoltre implicate nella locomozione cellulare, durante le quali le integrine sviluppano interazioni transienti con il substrato extracellulare. Le adesioni focali creano e rispondono a sollecitazioni meccaniche. Le adesioni focali sono osservate più comunemente in vitro, sebbene tipi analoghi di contatti adesivi si trovino nel tessuto muscolare e nei tendini. Co alignment of actin stress fibers and focal adhesions Focal adhesions in cell motility
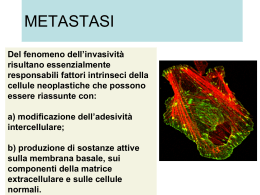
Scaricare