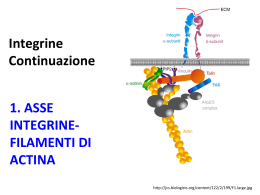
Molecole Adesione Integrine 1. Introduzione http://www.uphs.upenn.edu/news/News_Releases/mar07/integrin-highres.jpg Le integrine interrogano costantemente il loro ambiente circostante mediante la loro capacità di interagire con la matrice extracellulare Desgrosellier JS, Cheresh DA. Integrins in cancer: biological implications and therapeutic opportunities. Nat Rev Cancer. 10:922, 2010. Engler AJ, Humbert PO, Wehrle-Haller B, Weaver VM. Multiscale modeling of form and function. Science. 2009 Apr 10;324(5924):208-12. http://www.uic.edu/classes/bios/bios100/f06pm/lect06.htm Il segnalamento mediato da integrine regola: proliferazione differenziamento Motilità Sopravvivenza Integrine [1] Principali molecole di collegamento delle cellule con la Matrice ExtraCellulare (MEC) e di risposta a segnali provenienti dalla MEC Sono costituite da due subunità glicoproteiche transmembrana ( e ) di dimensioni 120-170 kDa e 90-100 kDa, rispettivamente, associate in modo non-covalente, entrambe delle quali contribuiscono al legame con la MEC o con le altre cellule. Alcune integrine sembrano legarsi soltanto ad un singolo tipo di macromolecola della matrice (ad es. fibronectina o laminina) Altre invece si legano a più di un tipo: ad es. collagene + fibronectina + laminina. Alberts Integrine [2] Alcune integrine riconoscono la tripleta di aminoacidi RGD (arginina - glicina - acido aspartico) Altre riconoscono altre sequenza aminoacidiche o domini proteici La stessa molecola di integrina in tipi cellulari diversi può avere diverse cinetiche di legame con il ligando. Ci sono fattori aggiuntivi, specifici per il tipo cellulare, che interagiscono con le integrine per modulare la loro attività Alberts Integrine [3] Il legame Integrina – Ligando è Ca2+ o Mg2+ - dipendente (ci sono da 3 a 4 siti di legame per ione divalente nel dominio extracellulare della catena ). Il tipo di catione influenza l’affinità per il ligando e la specificità del legame con il ligando La stessa proteina extracellulare può essere riconosciuta da diverse integrine. Ad es: o Fibronectina: riconosciuta da > 8 integrine o Laminina: “ “ >4 “ Alberts Integrine (4) Sono noti attualmente almeno 24 tipi diversi di integrine, dati dalla combinazione di 8 tipi diversi di subunità 18 tipi diversi di subunità La diversità delle integrine è aumentata dalla possibilità di “splicing” alternativo sullo stesso mRNA. Alberts Integrine FUNZIONI Principali funzioni delle integrine Collegamento della cellula alla matrice extracellulare (MEC). Trasduzione di segnale tra la MEC e la cellula. Hanno inoltre una gran varietà di attività biologiche, che includono il pattugliamento immunologico, la migrazione cellulare e il legame alle cellule di certi virus, quali l’adenovirus, l’ecovirus, lo hantavirus e virus che provocano patologie alla bocca e al piede. Una importante funzione delle integrine si vede nella molecola GPIIbIIIa, un’integrina presente sulla superficie delle piastrine, responsabile dal collegamento alla fibrina all’interno di un coagolo sanguigno in formazione. Questa molecola aumenta in modo dramatico la sua affinità di legame per la fibrina/fibrinogeno mediante associazione delle piastrine con i collageni esposti nel sito della ferita. Dopo associazione delle piastrine con il collagene, la GPIIbIIIa cambia conformazione, permettendole di legarsi alla fibrina e ad altri componenti del sangue per formare la matrice del coagolo e fermare la perdita di sangue. FUNZIONI DELLE INTEGRINE NEI LEUCOCITI (1) FUNZIONI DELLE INTEGRINE NEI LEUCOCITI (2) FUNZIONI DELLE INTEGRINE NEI LEUCOCITI (3) Integrine CONCETTI GENERALI http://www.uib.no/rg/matrix/nyheter/2009/05/integrins-during-evolution Integrine Grande famiglia di molecole di adesione coinvolte nell’adesione cellula-cellula e nelle interazioni delle cellule con proteine della matrice extracellulare (ECM) (es. laminina, collagene, fibronectina, vitronectina). I domini extracellulari sono di solito collegati alle proteine della ECM; I domini intracellulari sono collegati funzionalmente al citoscheletro. Mediano la comunicazione fra gli ambienti extra- e intracellulari: L’interazione integrina-citoscheletro influenzano l’affinità e l’avidità delle integrine verso i ligandi nella ECM («inside-out signalling») Le interazioni ECM-integrine portano ad alterazioni nelle forma e composizione dell’archittetura cellulare («outside-in signalling»). Tutte le interazioni integrina-ligando dipendono alla presenza di cationi divalenti (Ca2+, Mg2+ e Mn2+). Coombe & Dye. In: Cell Adhesion Molecules, CRC Press http://www.nature.com/nrm/journal/v11/n4/box/nrm2871_BX2.html Struttura: subunità α e β [1] Sono glicoproteine transmembrana eterodimeriche, che consistono in due subunità α e β legate in modo noncovalente. Nell’Uomo sono state descritte 18 subunità α e 8 subunità β che si assemblano in 24 integrine diverse. Le subunità α e β non condividono alcuna omologia, essendo due polipeptidi distinti con strutture a domini specifiche. I domini extracellulari di entrambe le subunità contribuiscono al sito di legame dell’eterodimero con il ligando. Coombe & Dye. In: Cell Adhesion Molecules, CRC Press Struttura di un’integrina. (A) La struttura complessiva illustrate è quella della regione della testa “head region” [domini “propeller” e “thigh” della subunità α- e i domini βA ibridi (noti anche come βI), e PSI della subunità β-] sostenuti da due gambe “legs” che contengono domini “calf1” e “calf2 nella subunità α- e ripetizioni EGF e il dominio di coda-β della subunità β. Il legame con i ligandi ha luogo sull’interfaccia fra il dominio “propeller” e il dominio βA. Askari JA, Buckley PA, Mould AP, Humphries MJ. Linking integrin conformation to function. J Cell Sci. 2009 Jan 15;122(Pt 2):165-70. Struttura: subunità α e β [2] Il dominio extracellulare della subunità α contiene sette ripetizioni di circa 60 residui, che si ripiegano formando una struttura ad elica («propeller»), con sette pale formate da foglietti β disposte attorno ad un asse centrale. Un sotto-insieme di catene α delle integrine ha un dominio di inserzione (αA) che contiene un sito di legame per i cationi, localizzato fra le ripetizioni due e tre dell’elica. Il C-terminale dell’elica è un dominio tipo immunoglobulinico, detto «Thigh» (coscia), seguito da due moduli a «β-sandwich», Calf-1 e Calf-2 («calf»: polpaccio) e un piccolo dominio transmembrana. I domini intracellulari delle subunità α mostrano poca omologia, tranne che per un motivo conservato prossimo alla regione transmembrana che si associa con la coda citoplasmatica della subunità β. Coombe & Dye. In: Cell Adhesion Molecules, CRC Press Struttura: subunità α e β [3] La regione extracellulare delle subunità β delle integrine contengono un dominio ibrido, un dominio «plexin-semaphorin-integrin» (PSI), quattro ripetizioni tipo «Epidermal Growth Factor» (EGF) e un dominio di coda β. Il dominio ibrido è un dominio «Ig-like» che comprende un motivo tipo αA (dominio βA) inserito fra due β-foglietti. Il dominio βA contiene un motivo di legame ai metalli che si lega a cationi divalenti quando la subunità α non contiene il dominio di inserzione αA. Il dominio PSI forma un β-foglietto antiparallelo a due filamenti fiancheggiato da due corte eliche e contribuisce all’attivazione delle integrine. Le code citoplasmatiche delle catene β delle integrine sono corte e altamente conservate e contengono due motivi di fosforilazione. Le code reclutano proteine quali la talina, che si lega ai filamenti di actina, con ciò collegando le integrine al citoscheletro di actina. Le interazioni integrine-citoscheletro sono essenziali per l’attivazione delle integrine. Coombe & Dye. In: Cell Adhesion Molecules, CRC Press L’eterodimero delle integrine La struttura extracellulare degli eterodimeri di integrine consiste in una «testa» e in due «gambe». La «testa», che media le interazioni integrina-ligando, è il principale punto di contatto tra le subunità α e β. I contatti sono formati da interazioni fra la elica (catena α) con il dominio βα (catena β). Le «gambe» sono formate dai domini Thigh («coscia») e Calf-1 («polpaccio) della subunità α e i domini PSI, EGF, e βTD della subunità β. Le «ginocchia» permettono alle integrine di adottare una conformazione ripiegata o dritta, che è fondamentale per l’attivazione delle integrine. Ulteriori contatti fra le subunità α e β hanno luogo fra Calf-1 e EGF3, fra Calf-2 e EGF4, fra Calf2 e βTD e fra le code citoplasmatiche di α e β. Coombe & Dye. In: Cell Adhesion Molecules, CRC Press http://www.nature.com/nrm/journal/v11/n4/images/nrm2871-i1.jpg Arnout et al., 2005 Legame integrina-ligando (1) Le integrine possono legarsi a cationi divalenti mediante due domini diversi: αA e βA. Il dominio αA si trova nelle catene α (α1, α2, α11, αM, αX e αD) e quando presente media il legame con i cationi. Se il dominio αA è assente, il legame con il catione ha luogo mediante il dominio βA che si trova in tutte le catene β. La tasca di legame con il ligando si forma all’interfaccia fra le lame 2 e 3 del dominio a elica della subunità α e il dominio βA della catena β. Il suo orientamento si altera leggermente a seconda che la subunità α abbia o meno il dominio αA. Coombe & Dye. In: Cell Adhesion Molecules, CRC Press Legame integrina-ligando (2) Le integrine sono classificate a seconda della presenza o assenza del dominio αA. Quattro catene α contenenti αA (α1, α2, α10 e α11) si combinano con β1 per dare una sottofamiglia distinta di legame con laminina/collagene. Le integrine non contenenti αA (α3β1, α6β1, α7β1 e α6β4) sono recettori selettivi per la laminina (glicoproteina della lamina basale) e si legano a siti sulla laminina diversi da quelli a cui si legano le integrine contenenti il dominio αA. Le integrine αV e α5β1, α8β1 e αIIIβ3 riconoscono la sequenza RGD (arginina-glicina-acido aspartico), che è importante per il legame delle integrine alla fibronectina, vitronectina e collagene. Coombe & Dye. In: Cell Adhesion Molecules, CRC Press Legame integrina-ligando (3) Nonostante molte integrine che si legano a RGD interagiscano con gli stessi ligandi, esse si legano con affinità diverse, riflettendo la precisione dell’incastro del motivo RGD con le tasche di legame con il ligando, creati dalle diverse combinazioni tra catene α e β. Le integrine α4β1, α4β7, α9β1 e αEβ7 riconoscono un motivo acido LDV (leucina - acido aspartico – valina) che si trova nella fibronectina e in alcuni membri della IgSF. Le integrine β2 (αDβ2, αLβ2, αMβ2 e αXβ2) si legano ad un motivo LEV simile, in cui l’acido aspartico (D) è sostituito dal glutamato (E). Coombe & Dye. In: Cell Adhesion Molecules, CRC Press Definizioni Affinità: forza di legame tra una integrina singola e il suoi ligando. Questa può essere alterata da alterazioni conformazionali nella struttura dell’integrina. Avidità: misura della forza complessiva di legame di integrine aggregate. Evans R, Patzak I, Svensson L, De Filippo K, Jones K, McDowall A, Hogg N. Integrins in immunity. J Cell Sci. 2009 Jan 15;122(Pt 2):21525. http://bme.virginia.edu/ley/vla-4.html Pharmigen/Transduction Laboratories: cell Adhesion Molecules Catene 1 Formano dimeri con 9 tipi di catena (si trovano in quasi tutte le cellule dei Vertebrati): 51: recettore per la fibronectina (VLA) 61: recettore per la laminina. Il più importante membro della subfamiglia delle integrine 1 dei leucociti é il Very Late Antigen-4 (VLA-4, CD49d/CD29, 41). Il VLA-4 si lega al suo ligando VCAM-1, ed é il principale responsabile dell’adesione dei linfociti all’endotelio vascolare e del reclutamento dei leucociti alle zone infiammate. Pharmigen/Transduction Laboratories: cell Adhesion Molecules Pharmigen/Transduction Laboratories: cell Adhesion Molecules Pharmigen/Transduction Laboratories: cell Adhesion Molecules Catene 2 (a) Le integrine 2 sono espresse esclusivamente dai leucociti e subiscono un’alterazione conformazionale che coinvolge la fosforilazione della subunità nel processo di attivazione. Tuttavia, questa fosforilazione non é nè necessaria nè sufficiente per l’attivazione conformazionale. Lo stato di attivazione é controllato dal sito GFFKR (Gly-PhePhe-Lys-Arg) immediatamente adiacente al dominio transmembrana della catena . Pharmigen/Transduction Laboratories: cell Adhesion Molecules Catene 2 (b)- CD18 Le integrine 2 includono 4 diversi eterodimeri CD11a/CD18 [Lymphocyte Function-Associated Antigen-1] (LFA-1) l’integrina 2 predominante. CD11b/CD18 (Mac-1), esclusiva dei granulociti e monociti CD11c/CD18 (p150,95) CD11d/CD18. Una mutazione nel gene che codifica per la molecola 2 (CD18) provoca una malattia genetica, la LAD, Leukocyte Adhesion Deficiency. I pazienti con LAD hanno infezioni batteriche ricorrenti dovuto all’incapacità di reclutare attivamente i granulociti in risposta alle infezioni. Pharmigen/Transduction Laboratories: cell Adhesion Molecules Integrine β2 http://bme.virginia.edu/ley/images/integrins.gif http://bme.virginia.edu/ley/lfa-1.html http://bme.virginia.edu/ley/mac-1.html Pharmigen/Transduction Laboratories: cell Adhesion Molecules Pharmigen/Transduction Laboratories: cell Adhesion Molecules Catene 3 Sono espresse da diversi tipi cellulari (es. piastrine) Si legano a diverse proteine della matrice extracellulare, incluso fibrinogeno nel processo di coagulazione del sangue Malattia di Glanzmann: deficienza di catene 3, eccessivo sanguinamento. Pharmigen/Transduction Laboratories: cell Adhesion Molecules Pharmigen/Transduction Laboratories: cell Adhesion Molecules Pharmigen/Transduction Laboratories: cell Adhesion Molecules http://www.ncbi.nlm.nih.gov/books/NBK26809/figure/A3032/?report=objectonly + emodesmosomi Pharmigen/Transduction Laboratories: cell Adhesion Molecules Integrine LEGAME CON IL CITOSCHELETRO http://www.ncbi.nlm.nih.gov/books/NBK9874/figure/A2057/ 52 Legame con il citoscheletro (1) Le integrine fungono da collegamenti (o “integratori”) transmembrana, mediando le interazioni fra il citoscheletro e la matrice extracellulare richieste per permettere alle cellule di aggrapparsi alla matrice. La maggior parte delle integrine è collegata ai filamenti di actina. L’integrina α6β4, che si trova negli emidesmosomi, è un eccezione, dato che è collegata funzionalmente ai filamenti intermedi. Dopo il legame di una integrina al suo ligando nella matrice, la coda citoplasmatica della subunità β si collega a diverse proteine intracellulari di ancoraggio, che includono la talina, la α-actinina e la filamina. A loro volta, queste proteine di ancoraggio si possono legare strettamente all’actina o ad altre proteine di ancoraggio come la vinculina, perciò collegando funzionalmente l’integrina ai filamenti di actina della corteccia cellulare. Legame con il citoscheletro (2) Nelle condizioni giuste, questo collegamento porta all’aggregazione delle integrine e alla formazione di adesioni focali tra la cellula e la matrice extracellulare. Se il dominio citoplasmatico della subunità β viene deleto con tecniche di DNA ricombinante, le integrina più corte si legano ancora ai loro ligandi, ma non mediano più un’adesione forte, e non sono più in grado di aggregarsi nelle adesioni focali. Sembrerebbe che le integrine si debbano collegarsi al citoscheletro per collegare fortemente le cellule alla matrice, così come le caderine debbono interagire con il citoscheletro per collegare le cellule in modo efficace. Il collegamento al citoscheletro potrebbe aiutare le integrine ad aggregarsi, producendo un legame di aggregazione più forte; inoltre blocca l’integrina in una conformazione che le permette di collegarsi al suo ligando specifico in modo più stretto. Legame con il citoscheletro (3) Così come le caderine promuovono l’adesione cellula-cellula senza formare giunzioni aderenti mature, le integrine possono mediare l’adesione cellula-matrice senza formare adesioni focali mature. In entrambi i casi, tuttavia, le molecole di adesione transmembrana possono ancora legarsi al citoscheletro. Per quanto riguarda le integrine, questo tipo di adesione ha luogo quando le cellule si espandono o migrano e dà origine alla formazione dei complessi focali. Perchè i complessi focali maturino in adesioni focali è necessaria l’attivazione della piccola GTPasi Rho. L’attivazione di Rho porta al reclutamento di ulteriori filamenti di actina e di integrine verso il sito di contatto. Collegamento con il citoscheletro ASSE INTEGRINE – FILAMENTI INTERMEDI http://www.biology-online.org/js/tiny_mce/plugins/imagemanager/files/boa002/AN-nothingF01.jpg; Vedi fig. 19-46 Alberts nuovo Emidesmosomi. (A) Gli emidesmosomi “graffettano” le cellule epiteliali alla lamina basale, collegando la laminina fuori dalla cellula ai filamenti di cheratina all’interno della cellula. (B) Componenti molecolari di un emidesmosoma. Un’integrina specializzata (integrina 6β4) attraversa la mmbrana, collegando i filamenti di cheratina intracellularmente mediante proteine di ancoraggio chiamate plectina e distonina, con la la laminina extracellularmente. Il complesso adesivo contiene inoltre, in parallelo all’integrina, un membro insolito (in quanto proteina di membrana) della famiglia dei collageni, il collagene di tipo XVII; questo ha un dominio di attraversamento della membrana collegato alla sua pozione di tipo collagene extracellulare. Difetti in qualsiasi di questi componenti possono dare origine a patologie vescicolose della pelle. Asse Integrine – Filamenti intermedi (1) Le membrane basali («Basement Membranes», BMs) sono strati densi di matrice extracellulare che fungono da barriere strutturali che separano le cellule epiteliali, cellule endoteliali, assoni dei nervi periferici, cellule adipose e cellule muscolari dal sottostante stroma. Le BMs fornisce sostegno strutturale, separano i tessuti in compartimenti e regolano il comportamento cellulare. Tutti i tipi cellulari producono componenti della BM: collagene di tipo IV, laminina, fibronectina, proteoglicani ad eparan solfato e nidogeno/entattina oltre a componenti minori. La composizione molecolare della BM varia nei differenti tessuti conferendo ad essi una specificità di segnalamento importante per definire le funzioni specializzate delle cellule epiteliali ed endoteliali nei diversi organi. Tutte le BM contengono laminine, una famiglia di 16 glicoproteine eteropolimeriche generate dalla combinazione di catene 5α, 4β e 3γ. Wickstrom et al. In: Extracellula matrix Biology, Cold Spring Harbor Perspectives in Biology, 2012 Asse Integrine – Filamenti intermedi (2) Quando presenti in concentrazione sufficiente, le laminine possono autoassemblarsi in polimeri che interagiscono con altre componenti della ECM, nonchè con recettori sulla superficie cellulare quali le integrine e il distroglicano. Le isoforme di laminina presenti nei tessuti sono regolate in modo tessuto-specifico e regolato nel tempo durante lo sviluppo embrionale. La laminina-332 (che contiene catene α3, β3 e γ2; preferenzialmente nota come laminina-5) è un componente delle BM epiteliali, e quindi è presente nella pelle, mucosa squamosa stratificata, amnio, e cornea. La sua principale funzione è quella di mantenere l’integrità epiteliale e la coesione epitelio-mesenchima in tessuti esposti a forze meccaniche elevate. Questa funzione è facilitata dalla capacità unica della laminina-332 di interagire con integrine distinte. La sua interazione conl’integrina α3β1 porta all’assemblaggio dei canonici punti di adesione focale (FA), mentre l’interazione con le integrine α6β4 porta alla formazione di emidesmosomi. Wickstrom et al. In: Extracellula matrix Biology, Cold Spring Harbor Perspectives in Biology, 2012 Asse Integrine – Filamenti intermedi (3) Emidesmosomi: struttura e assemblaggio (1) Gli emidesmosomi sono complessi multiproteici presenti negli epiteli semplici e stratificati. Ci sono due tipi che si distinguono in base alla composizione molecolare. Tipo I (emidesmosomi classici): si trovano negli epiteli stratificati (es. pelle) e contengono tre proteine transmembrana: Integrina α6β4, tetraspanina CD151, e collagene di tipo XVII («antigene 180 bullous pemphogoid, [PD]). Tipo II: si trovano negli epiteli semplici (es. Intestino) e contengono solo l’integrina α6β4. Wickstrom et al. In: Extracellula matrix Biology, Cold Spring Harbor Perspectives in Biology, 2012 Asse Integrine – Filamenti intermedi (3) Emidesmosomi: struttura e assemblaggio (2) L’aspetto unico degli emidesmosomi è che essi collegano la ECM alla rete dei filamenti intermedi (FI). Quest’interazione è stabilita da due proteine della famiglia delle placchine: la plectina e la BP230 (anche nota come BPAG1); solo la plectina è presente sia negli emidesmosomi di tipo I che di tipo II. Le plectine sono grandi proteine citoplasmatiche, che nel loro Cterminale contengono sei ripetizione di tipo placchina. Le interazioni della plectina con i filamenti intermedi è mediata da una sequenza di residui basici che collega la 4a e la 5a ripetizione placchina. Il N-terminale delle plectine contiene tuttavia due domini «calponinhomology» (CH) che costituiscono un dominio di legame con l’actina. Mediante il dominio di legame con l’actina le plectine si possono associare sia con il dominio citoplasmatico dell’integrina α6β4 oppure con i filamenti di actina, però in modo mutuamente esclusivo, che spiega l’assenza di actina negli emidesmosomi. Wickstrom et al. In: Extracellula matrix Biology, Cold Spring Harbor Perspectives in Biology, 2012 Herrmann H, Aebi U. Intermediate filaments and their associates: multi-talented structural elements specifying cytoarchitecture and cytodynamics. Curr Opin Cell Biol. 2000 Feb;12(1):79-90. Integrina α6β4 Plectina http://xtal.cicancer.org/research.html Collagene di tipo XVII (noto anche come BP180) (1) Proteina transmembrana che gioca un ruolo critico nel mantenimento del collegamento tra gli elementi strutturali intracellulari e extracellulari coinvolti nell’adesione dell’epidermide. E’ un eterotrimero con tre catene α1 (XVII). Proteina transmembrana di tipo II (C-terminale rivolto verso l’esterno della cellula). Ogni catena di 180 kDa contiene un dominio intracellulare globulare di circa 70 kDa che interagisce con la subunità β4 delle integrine, con la plectina e con la BP230 ed è necessaria per il collegamento stabile degli emidesmosomi ai filamenti intermedi di cheratina. http://en.wikipedia.org/wiki/Collagen,_type_XVII,_alpha_1 Seminario: Asse Integrine – Filamenti intermedi (3) Emidesmosomi: struttura e assemblaggio (3) L’interazione della plectina con la coda citoplasmatica dell’integrina α6β4 è considerato il passo iniziale per la formazione degli emidesmosomi. La coda dell’integrine α6β4 è insolitamente lunga e non condivide alcuna omologia con le altre subunità β delle integrine. La sua interazione con la plectina induce un’alterazione conformazionale nella coda dell’integrina. Poichè il reclutamento del collagene di tipo XVII e della placchina BP230 ai desmosomi richiede una previa interazione della plectina con la β4, questo cambiamento conformazionale potrebbe facilitare le interazioni di entrambe le proteine con l’integrina. http://en.wikipedia.org/wiki/Collagen,_type_XVII,_alpha_1 Seminario Collagene di tipo XVII (noto anche come BP180) (2) Il grande ectodominio C-terminale di circa 120 kDa consiste in 15 subdomini collagenosi, caratterizzati dalle tipiche sequenze ripetute G-XY dei collageni. La struttura globale dell’ectodominio è quella di una triplice elica flessibile con una significativa stabilità termica. La parte prossimale alla membrana dell’ectodominio, all’interno degli aminoacidi 506-519, è responsabile del legame con la subunità α6 dell’integrina – aspetto apparentemente importante per l’integrazione del collagene di tipo XVII nell’emidesmosoma. Il maggiore dominio colalgenoso, Col15, che contiene 232 aminoacidi (aa 567-808) contribuisce significativamente a stabilizzare l’omotrimero del collagene XVII. Il C-terminale del collagene XVII si lega alla laminina 5 e la corretta integrazione della laminina 5 nella ECM richiede il collagene XVII. http://en.wikipedia.org/wiki/Collagen,_type_XVII,_alpha_1 http://1.bp.blogspot.com/-_bygTPOeoTo/ULZfA9573I/AAAAAAAAAMw/hamuKgX6KQw/s640/hemidesmosome_scheme01.jpg http://www.oulu.fi/iho/kuvat/projekti2/1.jpg
Scaricare