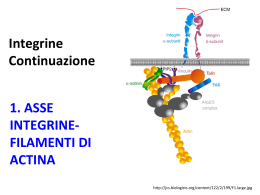
METASTASI Del fenomeno dell’invasività risultano essenzialmente responsabili fattori intrinseci della cellule neoplastiche che possono essere riassunte con: a) modificazione dell’adesività intercellulare; b) produzione di sostanze attive sulla membrana basale, sui componenti della matrice extracellulare e sulle cellule normali. METASTASI c) Locomozione delle cellule neoplastiche per mezzo di pseudopodi; d) produzione di fattori che inducono la formazione del sistema vascolare nel tumore. Durante la transizione dal tessuto normale a carcinoma in situ ed invasivo, lo stroma locale ospite gioca un ruolo attivo. L'interazione fra l'epitelio e i compartimenti mesenchimali produce una zona della membrana epiteliale basale interrotta da cui la cellula maligna emerge ed invade l'altro tessuto. METASTASI cellule del tumore e dello stroma scambiano: fattori di crescita: fattore di crescita tumorale -b (TGF-b), fattore di crescita epidermico (EGF), citochine e chemiotattici: IL-6, fattore di crescita degli epatociti e fattore di invasività (SF/HGF), fattori di angiogenesi: fattore di crescita dell’endotelio vascolare (VEGF), fattore base di crescita dei fibroblasti (bFGF) Proteasi: le metalloproteinasi della matrice (MMPs) e l'attivatore del plasminogeno urochinasi (uPA). Funzioni della Matrice Extracellulare • 1980- supporto cellulare • 1990- regolazione della migrazione, motilità e adesione, differenziazione e sviluppo embrionico • 2005- ”full partner” nel regolare eventi cellulari:proliferazione, apoptosi, risposta agli stress, angiogenesi, regolazione della proteasi Matrice Extracellulare • Struttura extracellulare formata da materiale secreto dalla membrana plasmatica, la composizione assoluta varia fra i tessuti differenti e le differenti parti dei tessuti • Composizione: laminine, collageni, proteoglicani, altri secreti cellulari • Il legame del complesso collageno-proteoglicani alla superficie cellulare avviene attraverso molecole di legame, per esempio fibronectina, laminina • Queste molecole sono ancorati alla cellula soprattutto attraverso una famiglia di recettori transmembrane, chiamati integrine Le cellule tumorali attivano i fibroblasti, la proliferazione delle cellule endoteliali e il reclutamento dei leucociti. I fibroblasti attivati e le cellule endoteliali secernono MMPs, fattori di crescita e componenti dell’ECM; i leucociti liberano citochine e chemiochine. Le MMP accelerano la degradazione dell’ECM, il rilascio di fattori di crescita e aumentano il rimodellamento. L’effetto sulla cellula tumorale: migrazione, invasione, sopravvivenza e proliferazione Degradazione di ECM secrezione locale di enzimi proteolitici Proteasi della serina u-PA = attivatore del plasminogeno urochinasi converte Il plasminogeno, proteolizzandolo in plasmina attiva : degrada una serie di proteine, quali la fibrina, fibronectina, collagene, laminina. L’espressione di uPAR è stimolata da fattori di crescita,quali TGFb , EGF, HGF Recettore u-PA (uPAR) è presente sui leucociti sulle cellule di tumore è richiesto per la metastasi, la capacità di invasione marker di prognosi negativa in molti cancri A) Le cellule umane del cancro della prostata secernono uPA (red). u-PA lega il recettore di uPA (uPAR) sulla superficie delle cellule del cancro della prostata (green). B) Le cellule umane del cancro della prostata sono state transfettate con DNA che codifica la forma inattiva di uPA (yellow). Occupando i recettori di uPA, il uPA inattivo impedisce la proteasi attiva legarsi alla superficie delle cellule. Entrambi i tipi di cellule secernono uPA attivo, e producono i tumori una volta iniettati negli animali da laboratorio. Ma le cellule (A) metastatizzano, mentre le cellule (B) no. Ruoli delle MMP secrete dalle cellule tumorali e dello stroma nella metastatizzazione crescita e angiogenesi invasione vasale e nella migrazione crescita e angiogenesi di metastasi distali Espressione delle MMPs BASSO livello di espressione Fisiologico remodelling del tessuto Guarigione ferite Angiogenesi Nei depositi di grasso ALTO livello di espressione : in vari tumori umani e linee cellulari La produzione delle MMPs da parte dello stroma è regolata dalle cellule tumorali attraverso l’espressione di chimochine, citochine e l’induttore extracellulare di metalloproteasi di matrice. Metalloproteinasi di Matrice (MMPs) MMPs sono sono una famiglia di circa 17 endopeptidasi zincodipendenti. MMPs sono classificate in cinque sottoclassi a seconda della loro specificità per un substrato: collagenasi interstiziali, gelatinasi, stromelisine metalloproteinasi di membrana e elastasi. Possono essere secrete o legate alla membrane MT-MMP Tutte le MMPs sono sintetizzate in forma latente. Richiedono attivazione extracellulare. Classificazione di MMPs MMPs sono classificate in cinque sottoclassi a seconda della loro specificità per un substrato Collagenasi (MMPs 1, 8, 13,18) --- fibre di collagene Gelatinasi (MMP-2, MMP-9) --Gelatina, collageno tipo IV, fibronectina, elastina, laminina, vitronectina Stromelisine (MMP-3, 10, 11, 7) --Gelatina, fibronectina, caseina, laminina, elastina, MMP-2/ TIMP-2 , aggrecani Elastasi (MMP-12) -- Elastina, gelatina, collageno IV, fibronectina, laminina, vitronectina, proteoglicani MMPs legate alla membrane (MMP 14, 15,16, 17) – Pro-MMP2, pro-MMP13 Attivazione delle MMPs Il processo di attivazione delle MMPs consiste di una reazione a due steps: un iniziale cleavage a livello della regione propeptidica che porta alla rimozione del peptide N-terminale, ed il secondo step, una reazione autoproteolitica che genera l’enzima attivo stabile. Oltre ad un’autoattivazione le MMPs possono essere il substrato di altre MMPs. AND ANGIOGENESIS Riguardo al MMPs ruolo delle MMPs nell’angiogenesi è conflittuale MMP-9 è stata trovata essere upregolata nelle isole angiogeniche e la sua espressione si correla con l’aumento del complesso VEGF/VEGFR. MMPs possono anche regolare negativamente l’angiogenesi. Le MMP-7 e 9 possono convertire il plasminogeno nel potente inibitore angiogenico angiostatina. MMPs AND APOPTOSIS Le MMPs inducono l’apoptosi in almeno due modi: (i) attraverso la degradazione della ECM e la perdita dei segnali di sopravvivenza essenziali (ii) attraverso la solubilizzazione di ligando specifici inducenti la morte. E’ stato visto che la capacità della MMP-7 di contribuire all’apoptosi si correla con l’abilità si liberare il ligando di Fas (FasL), che induce l’apoptosi in cellule che esprimono Fas Inibitori naturali delle MMP MMP-2 e MMP-9 inibitori tissutali delle metalloproteinasi (TIMPs) TIMP-1 Fattori di crescita per alcune cellule tumorali TIMP-2 ? essenziale per l’attivazione di MMP-2 in alcuni sistemi, Elevati livelli di TIMP sono riportati in associazione con la progressione del cancro e identificati come indicatori di prognosi povera in molti tipi di tumore! TIMP-3 e TIMP-4 TIMP-3 Strettamente legato al ECM, inibisce l’apoptosi indotta da TNF-a Mediante la stabilizazione dei recettori TNF-a sulla superficie cellulare TIMP-4 Ha un ruolo nell’omeostasi della ECM stimola l’apoptosi quando overespressa Per capire come un segnale cellulare possa essere trasmesso attraverso l’interazione cellula-cellula o cellulamatrice extracellulare, basta ricordare che tali rapporti richiedono sempre la partecipazione di specifiche proteine di membrana, in grado di sostenere l’organizzazione della connessione tra cellule o della matrice extracellulare. Famiglie di proteine di adesione • Caderine cell-cell • Selectine cell-cell • Immunoglobuline superfamiglia cell-cell • Integrine cell-matrice e cell-cell adesione CELL-CELL Cad. repeats MOLECOLE DI ADESIONE CELLULARE Caderine Ca 2+ -dip. omofiliche adesioni unità funzionale = dimero Ig and Fn III repeats superfamiglia Immunoglobine (CAM) omofiliche o eterofiliche lectin repeats Selectine eterofiliche I-CAM Integrine eterodimeri, eterofiliche Si lagano a ECM, Ig-CAM, caderine adesione, polarizzazione, migrazione Caderine PROTEINE di ADESIONE CELLULARE CALCIO DIPENDENTI E- (epithelial) N- (neuronal) P- (placental) E-caderina è la più importante Legame omotipico: si lega soltanto a molecole identiche sulla superficie cellure adiacente o forma "zipper" multimolecolare E-caderina staining in pelle umana E-caderina è un soppressore dell’invasione e delle metastasi Nuovo modello, 5-domini di interazione Siti che legano il Ca Precedente modello, dimerizzazione fra L’N-terminale soltanto β-cat γ-cat α-cat filamenti di actina Carcinoma gastrico Il carcinoma gastrico può assomigliare al carcinoma del colon o essere diffuso I carcinomi diffusi non formano ghiandole ma si infiltrano come singole cellule 50% dei carcinomi gastrici del tipo diffuso contengono mutazioni di E-cad ed in tutti i casi espressione di E-cad è persa Cancro gastrico con la mutazione germinale del sito di legame della E-cad Seconda mutazione in E-caderina nel carcinoma gastrico diffuso mucosa normale stained per E-cad Tumore gastrico diffuso quasi nessun staining Metilazione del promotore di E- cad Le molecole adesive appartenenti alla famiglia delle integrine organizzano una complessa rete di molecole citoplasmatiche che regola la sopravvivenza, la proliferazione e il movimento cellulare Cellula – ECM Integrine Ca2+/Mg2+ dipendenti Meccanismi Integrina-dipendenti Adesione e diffusione Motilità/migrazione Differenziazione Proliferazione Coagulazione Estravasasione Leucocitaria Generazione segnali di sopravvivenza Protezione contro l’apoptosi (anoikis) Tumorigenesi Metastasi Catena b Catena a Cys-rich INTEGRINE Integrina è un eterodimero transmembrana Lega la matrice extracellulare e il citoscheletro Espressa a concentrazioni molto alte sulla superficie cellulare Due subunità glicoproteiche: a e b associate covalentemente Entrambi richeste per il legame alla matrice Sulla catena a 3-4 domini che legano Ca2+ o Mg2+ Al momento sono state riconosciute 18 subunità alfa e 9 beta che possono formare 25 eterodimeri differenti. b1 aE a1 a2 a3 a4 a5 a6 a7 a8 a9 a10 a11 b7 b4 b5 av b3 b2 b6 aIIb aL aM aX aD b8 b9 Struttura delle Integrine ligandi: Legame con molecole della ECM a b es. fibronettina, collageno, vitronectina, ligandi solubili es. fibrinogeno membrana plasmatica citoplasma Legame al citoscheletro e molecole di segnalamento proteine che legano l’actina es. vinculina, a-actinina, talina, Proteine che legano i filamenti intermedi es. plakoglobina Molte molecole di segnalamento es. tirosine chinasi L’ottimale segnalamento dell’integrina richiede sia occupazione dell’integrina sia la clasterizzazione dell’integrina CITOPLASMA Tensin FAK RGD Occupazione Actin stress fibres Talin a-actinin Vinculin Tensin FAK RGD RGD RGD RGD Clasterezzazione Occupazione e clasterizzazione a-actinin actin Tensin Pax Small GTPases FAK -Rho,Rac,cdc42 G src SS Cation-bindingM2+ D site G SP R G CITOPLASMA Tensin Pax FAK G src SS M2+ D G SP R G ECM glycoprotein eg fibronectin A seconda della taglia e della localizzazione le strutture possono essere contatti focali, adesioni focali, o adesioni fibrillari. I segnali trasdotti attraverso i complessi focali e le adesioni focali sono implicati in una serie di processi cellulari La proteina integrina, è in grado di modificare la propria struttura tridimensionale nei punti in cui la matrice extracellulare o le connessioni tra cellule subiscono alterazione, attivando un segnale intracelluare che porta, ad esempio, alla proliferazione cellulare Analogamente, una modificazione della struttura tridimensionale della proteina integrina può determinare l’attivazione di un secondo messaggero in grado di iniziare la sintesi di nuove proteine, come miosina ed actina Complesso Adesione Focale COMPONENTI STRUTTURALI Talina è la struttura base delle adesioni focali, lega actina, vinculina, e FAK. a-actinina è una proteina di collegamento che può legare anche la vinculina. Vinculina lega actina e tensina. Segnalamento attraverso Integrina a b FAK Grb-2 PI3-K MAPK Proliferation Survival Akt Struttura di FAK (Focal Adhesion Kinase) tirosina chinasi non-recettore (come la famiglia Src –nuotante nel citosol Crk Nck Csk Cas Sos Integrin ? talin paxillin Crk FAT Region Amino Terminal Domain Kinase Domain Y925 Y397 Src Grb-7 Carboxy-terminal Domain Grb-2 PI3-K Sos FAT Region = Focal Adhesion Targeting Region Integrine, FAK, e MAPK Intracellulare Matrice Extracellulare fibronectina b integrina a fibronectina 1 P src Paxillina fak MEMBRANA 2 3 P 4 Src 5 (rac, rho, ras) 1 Aggregazione integrine 2 Autofosforilazione di fak Intracellulare Organizazione del citoscheletro Segnalamento via ECM 3 Associazione fak/src 4 5 5 Nucleo src fosforila fak risposte mitogenetiche 5 AND... FAK Dopo il legame al complesso attivato dell'integrina, FAK autofosforila la sua tirosina c-Src è una tirosin chinasi non recettore citosolica solitamente inattiva per la configurazione auto-impacchettata Questo fosfotirosina permette che FAK leghi i dominii SH2 di Src o Fyn fosforilandoli FAK legandosi attiva c-Src aprendola C-Src fosforila FAK di nuovo! c-Src chinasi FAK chinase solo legame SH2 domain of Grb2 Attivazione di JNK/NF-kB (proteina adattatrice recruta RasGEF SOS alla membrana) attivano Ras-MAPK Sopravvivenza Cellulare p85 subunità di PI-3K attivazione PKB/AKT Sopravvivenza e Propagazione Attivazione di JNK/NF-kB JNK è un modulatore delle funzioni delle cellule epiteliali che è implicato in risposte opposte. Quando è attivato dalle integrine porta alla progressione del ciclo cellulare attraverso l’espressione di geni AP1. Le integrine attivano anche il fattore di trascrizione NF-kB, che promuove la sopravvivenza e l’angiogenesi. L'overespressione di integrine è un forte sostegno per le cellule del tumore Integrina α5β3 fortemente espressa sul fronte invasivo del melanoma maligno e dei vasi sanguigni angiogenici. Espresso a debolmente in nevi e vasi sanguigni quiescenti Integrina α6β4 fortemente espressa NON espressa durante la progressione dei carcinomi tiroidei nelle cellule tiroidee benigne Integrina α5β1 Ha un azione soppressiva del tumore. La sua espressione è persa in molti tumori Integrine e Cancro • Il profilo delle integrine cambia nella progressione di molti tumori solidi • Spesso, specifiche integrine sono perse • Transfezione per ripristinare l’espressione dell’integrina decrementa la tumorigenicità Espressione di avb6 in epitelio orale normale e carcinoma delle cellule squamose x33 epitelio normale x33 carcinoma Squamoso FAK Knockout mice • Embrioni letali – Embrioni hanno severi difetti morfogenici – Il numero delle adesioni focali è INCREMENTATO • Non difettano nella formazione delle adesioni focali, come fibroblasti FAK-/- fanno eccezionalmente larghe adesioni focali • Il difetto sembra essere nella dissoluzione dell’adesione focale, critica per la migrazione cellulare FAK e Cancro • In molti tumori solidi, l’espressione di FAK è aumentata • FAK può essere un marker di tumori invasivi e metastatici • Aumentate sopravvivenza e migrazione, funzioni dell’aumentata espressione di FAK fa di esso un attraente target per lo sviluppo di piccole molecole inibitorie come agenti antineoplastici FAK e SOPRAVVIVENZA • L’ingranaggio di FAK dall’integrina stimola un pathway della sopravvivenza • Il distacco delle cellule epiteliali dalla ECM provoca un tipo di apoptosi. ANOIKIS • La trasduzione del segnale procede attaverso altri enzimi di segnalamento che promuovono la sopravvivenza: FAK-PI3Kinasi-Akt-Bad-antiapoptosi • Questa funzione può essere la principale di FAK
Scaricare