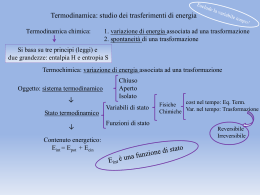
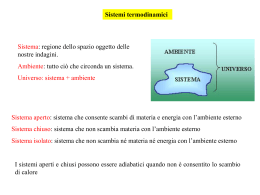
Il calore scambiato è una funzione di percorso e non di stato. Ma le funzioni di stato sono molto più comode! E’ possibile definire una funzione di stato che ci dia informazioni sul calore scambiato? In alcuni casi si! Vf Dal primo principio: A V=cost. q U qV=U p ext dV Vi Il calore scambiato a volume costante coincide con la variazione di energia interna Tuttavia, in genere le reazioni avvengono a p=cost. anziché a V=cost. A p=cost.: Vf q U p ext Vf dV U pext dV U f U i pext V f Vi Vi U f p f V f U i piVi Vi Definisco una nuova funzione di stato (entalpia): H = U + pV qp = H Il calore scambiato a pressione costante coincide con la variazione di entalpia È quasi come se l’entalpia rappresentasse il calore contenuto nel sistema (da cui il nome, che deriva dal greco per “calore dentro”). Ovviamente non è così! Il differenziale di una funzione composta si ottiene applicando le stesse regole della derivazione: d(xy) = xdy + ydx Così: dH = d(U+pV)= dU + pdV + Vdp A p costante: dH = dU + pdV = qp Poiché: qp = n Cp,m dT = dH Capacità termica molare a pressione costante: C p ,m dH m dT In generale la capacità termica è funzione della temperatura. Tf H (T f ) H (Ti ) q p n C p , m dT Ti Solo per piccoli intervalli di temperatura è possibile considerare la capacità termica indipendente dalla temperatura e porre in maniera approssimata: Tf H (T f ) H (Ti ) n C p , m dT Ti n C p , m (T f Ti ) H = U + pV = nRT H = U + (pV) = U + (nRT) a) n=costante, temperatura variabile: H = U + nRT Come l’energia interna, anche l’entalpia di un gas ideale dipende solo dalla temperatura. b) T costante, n variabile (specie gassosa in una reazione chimica) H = U + RTn(g) Per fasi condensate: (pV)=0 → H ≈U Esempio: H2O(s) → H2O(l) n=1 p=1atm H(273)=1.436 kcalmol-1 (H2O,s)=0.9170 gcm-3 (H2O,l)=0.9998 gcm-3 Vm(l)= 18.01/0.9998=18.02 cm3mol-1 T=273K Vm(s)= 18.01/0.9170=19.65 cm3mol-1 Vm=Vm(l)-Vm(s)=18.02-19.65 = -1.63 cm3mol-1 pVm =1(-1.63) = -1.63 atm cm3mol-1 = -39.410-3 calmol-1 U = H - pV = 1436 + 0.04 ≈ 1436 calmol-1 Capacità termica molare a volume costante: Cv,m Cv , m dU m dT Tf U (T f ) U (Ti ) U n Cv ,m dT dU ndU m n Cv ,m dT Ti Capacità termica molare a pressione costante: Cp,m C p ,m dH m dT Tf dH n C p ,m dT H (T f ) H (Ti ) H n C p ,m dT Ti Per un gas ideale: H = U + nRT dH = dU + nRdT nCp,mdT = nCv,mdT + nRdT Cp,m – Cv,m = R = studio del calore scambiato durante una qualunque trasformazione fisica o chimica. Trasformazioni a volume costante: qV = U Trasformazioni a pressione costante: qp = H Poiché la maggior parte delle reazioni chimiche viene condotta a pressione costante, la funzione entalpia è quella più utilizzata negli studi termochimici. H > 0: processo endotermico H(stato finale) > H(stato iniziale) qp > 0 calore assorbito dal sistema H < 0: processo esotermico H(stato finale) < H(stato iniziale) qp < 0 calore ceduto dal sistema Stato di riferimento o stato standard: forma pura di una sostanza nel suo stato più stabile alla pressione di 1 bar e ad una data temperatura. H° (entalpia standard) = variazioni di entalpia quando le specie iniziali e finali si trovano nei rispettivi stati standard. Tutte le entalpie standard sono grandezze molari (per una mole) standard di vaporizzazione: H2O(l)→ H2O(g) H°(vap)=40.66 kJmol-1 a 373K = variazione di entalpia associata alla vaporizzazione di una mole di liquido puro alla pressione di un bar e alla temperatura di 373K. • entalpia • entalpia standard di fusione: H2O(s)→ H2O(l) H°(fus)=6.0 kJmol-1 a 273K = variazione di entalpia associata alla fusione di una mole di solido puro alla pressione di un bar e alla temperatura di 273K. sostanza Tf(K) He 3.5 Ar 83.8 CH4 90.7 H2O 273.15 CH3OH 175.5 CH3CH2OH 158.7 C6H6 278.7 Hg 243.3 ΔH0f (kJ·mol-1) 0.02 1.2 0.94 6.01 3.16 4.60 9.87 2.29 Tb(K) 4.22 87.3 111.7 373.2 337.2 351.5 353.3 629.7 ΔH0b (kJ·mol-1) 0.08 6.5 8.2 40.7 35.3 43.5 30.8 59.3 = variazione di entalpia relativa ad una reazione chimica in cui sia i prodotti che i reagenti sono nel loro stato standard. reagenti H° prodotti H°<0 esotermica prodotti H°>0 endotermica reagenti Combustione = Reazione di ossidazione completa a CO2(g) e H2O(l) Ex. CH4(g) + 2O2(g) CO2(g)+2H2O(l) sostanza ΔH° (kJ·mol-1) Acido citrico -1985 Acido piruvico -950 Alcool etilico -1368 Glicina -969 Glucosio -2808 Urea -632 H-H O-H F-F Cl-Cl H-F H-Cl H-I ΔH0(A-B) kJ·mol-1 436 O=O 428 N≡N 155 H-CH3 242 HC≡CH 565 HO-OH 431 H-NH2 299 I-I A-BA+B 497 945 435 962 213 431 151 L’entalpia standard di una reazione è data dalla somma delle entalpie standard delle reazioni nelle quali può essere decomposta. Ex. Entalpia standard della glicolisi dalle entalpie di combustione del glucosio e dell’acido lattico glicolisi C6H12O6(s)→2CH3CH(OH)COOH(s) Glucosio [2 C3H6O3(s)] Acido lattico C6H12O6(s) + 6O2(g) → 6CO2(g) + 6H2O(l) C3H6O3(s) + 3O2(g) → 3CO2(g) + 3H2O(l) ΔH0c=-2808 kJ·mol-1 ΔH0c=-1344 kJ·mol-1 Sommando le reazioni: C6H12O6(s) + 6O2(g) → 6CO2(g) + 6H2O(l) 6CO2(g) + 6H2O(l) → 2C3H6O3(s) + 6O2(g) Si ottiene proprio la reazione di glicolisi: C6H12O6(s) → 2 C3H6O3(s) 6CO2(g) + 6H2O(l) La cui variazione entalpica è quindi: ΔH0r(glicolisi) = ΔH0c(glucosio) - 2 ΔH0c(ac. lattico) = = -2808 -2(-1344) = -120 kJ·mol-1 = entalpia standard di reazione relativa alla formazione di un composto a partire dagli elementi considerati nel proprio stato di riferimento. 6C(s,grafite) +3H2(g)→C6H6(l) H 0f 49kJ mol 1 L’entalpia standard di formazione degli elementi considerati nel proprio stato di riferimento è nulla a qualsiasi temperatura. sostanza H (kJ·mol-1) 0 f H2O(l) -285.83 H2O(g) -241.82 C6H6(l) 49.0 Alanina -604.4 Timina -462.8 Adenina +96.9 Glicina -1268 Glucosio -2808 Urea -333.14 L’entalpia standard di reazione è data dalla somma delle entalpie standard di formazione dei prodotti meno quella dei reagenti, ognuno moltiplicato per il proprio coefficiente stechiometrico. H H 0 r Pr odotti 2HN3(l)+2NO(g) 0 f H 0 f Re agenti H2O2(l) +4N2(g) 4N2(g)+H2(g)+O2(g) Tf Per un componente: H (T f ) H (Ti ) n C p ,m dT Ti Per una reazione chimica: Tf H (T f ) H (Ti ) C p dT Ti Dove: C p iC p,i iC p,i prodotti reagenti Trascurando la dipendenza delle capacità termiche dalla temperatura: H (T f ) H (Ti ) C p (T f Ti ) H r0 (T2 ) Reagenti (T2) Prodotti (T2) CpT (reagenti) CpT (prodotti) Reagenti (T1) Prodotti(T1) H r0 (T1 ) H r0 (T2 ) C p ( R) (T1 T2 ) H r0 (T1 ) C p ( P) (T2 T1 ) H r0 (T2 ) H r0 (T1 ) [C p ( P) CP ( R)] (T2 T1 ) •Classificate come endotermica o esotermica: •Una combustione per cui H°=-2020kJ/mol •Una dissoluzione per cui H°=+4.0kJ/mol •La vaporizzazione •La fusione •La sublimazione •Il gas da campeggio è costituito tipicamente da propano (C3H8), la cui entalpia standard di combustione è -2220kJ/mol, mentre l’entalpia standard di vaporizzazione del liquido è +15 kJ/mol. Calcolate l’entalpia standard e l’energia standard di combustione del liquido, a T ambiente (298.15 K). •Una mole di H2O gassosa viene condensata isotermicamente e reversibilmente ad acqua liquida, a 100 °C e 1 atm. L’entalpia standard di vaporizzazione dell’acqua a 100 °C è 40.656 kJ/mol. Calcolare w, q, U e H.
Scaricare