Università degli Studi di Modena e Reggio Emilia
Clinica di Malattie dell’Apparato Respiratorio
Direttore Prof. L. M. Fabbri
Corso Integrato di Malattie dall’Apparato Respiratorio e
Chirurgia Toracica
Anno Accademico 2005-2006
ASMA BRONCHIALE
Global
INitiative for
Asthma 2005
www.ginasthma.com
Rapporto del Gruppo di Lavoro del GINA
Categoria di evidenza Fonti di evidenza
A
Studi clinici randomizzati
Grande numero di dati
B
Studi clinici randomizzati
Piccolo numero di dati
C
Studi non randomizzati
Studi osservazionali
D
Giudizio di un gruppo di esperti
Asma bronchiale
• Definizione ed eziopatogenesi
• Epidemiologia e fattori di rischio
• Diagnosi
• Classificazione
• Trattamento
Asma bronchiale: definizione
L’asma è una malattia infiammatoria cronica delle vie aeree
caratterizzata da:
• Episodi ricorrenti di dispnea, respiro sibilante, tosse
e senso di costrizione toracica
• Ostruzione bronchiale (di solito reversibile
spontaneamente o dopo trattamento farmacologico)
• Iperreattività bronchiale
• Infiltrazione di cellule infiammatorie, rilascio di mediatori e
rimodellamento strutturale delle vie aeree
Asma bronchiale: definizione
La gravità delle manifestazioni cliniche
dell'asma é in genere correlata all’entità
dell'ostruzione bronchiale, ma può essere
percepita in modo diverso da diversi
individui o nelle diverse fasi della malattia
Meccanismi alla base della
definizione di Asma
Fattori di rischio
(per lo sviluppo di asma)
INFIAMMAZIONE
Iperreattività
Broncostruzione
delle vie aeree
Fattori di rischio
(per le riacutizzazioni)
Sintomi
Meccanismi cellulari coinvolti
nell’infiammazione delle vie aeree
RUOLO CENTRALE DEL LINFOCITA T NELLA
PATOGENESI DELL’ASMA
IFNý
IFNý , IL - 12
Linfocita Th1
Monocita + Batteri
Linfocita Th0
IL -4
Linfocita Thp
Linfocita Th2
IL - 4
Mastocita + IgE + Allergene
Differences between asthma and COPD
ASTHMA
Sensitizing agent
COPD
Smoking
Asthmatic airway
inflammation
CD4+ T-lymphocytes
COPD airway inflammation
CD8+ T-lymphocytes
Marcrophages
Eosinophils
Neutrophils
Completely
reversible
Airflowlimitation
limitation
Airflow
Completely
irreversible
COPD
A
Asthma
B
B
C
D
Fabbri LM et al Am J Respir Crit Care Med 2003;167 418-424
Characteristics of patients with fixed
airflow limitation
COPD
ASTHMA
Number
Age
Males/Females
NS/ExS/S
Atopy
FEV1
27
67 + 1.7
19/10
2/23/4
3/29
56 + 3
19
64 + 1.9
12/7
14/5/0
16/19
56 + 2
Reversibility
4.7 + 0.9
8.7 + 2.4*
Fabbri LM et al Am J Respir Crit Care Med 2003;167 418-424
Fixed airflow limitation in Asthma and COPD
FEV1 changes after oral corticosteroids
History
of Asthma
History
of smoking
History
of Asthma
History
of smoking
400
14
200
**
% predicted
ml
300
12
**
10
8
6
4
100
2
0
0
Fabbri LM et al Am J Respir Crit Care Med 2003;167 418-424
Fixed airflow limitation in Asthma and COPD
Airway Responsiveness to methacholine
History
of Asthma
History
of smoking
Methacholine PC20FEV1
(mg/ml)
10
1
0,1
Fabbri LM et al Am J Respir Crit Care Med 2003;167 418-424
Fixed airflow limitation in Asthma and COPD
Residual Volume
L
3,0
History
of Asthma
*
History
of smoking
150
History
of Asthma
*
History
of smoking
125
2,5
2,0
100
1,5
Fabbri LM et al Am J Respir Crit Care Med 2003;167 418-424
Fixed airflow limitation in Asthma and COPD
Carbon monoxide diffusion capacity (Kco)
***
120
History
of Asthma
1,5
History
of smoking
110
***
History
History
of Asthma of smoking
100
90
80
70
1,0
60
50
40
0,5
30
Fabbri LM et al Am J Respir Crit Care Med 2003;167 418-424
HIGH RESOLUTION COMPUTERIZED TOMOGRAPHY
(HRCT) SCAN OF THE LUNGS IS DIFFERENT IN PATIENTS
WITH FIXED AIRFLOW LIMITATION DUE TO
SMOKING OR TO ASTHMA
Patients with fixed airflow limitation due to asthma
maintain distinct radiological and functional
characteristics from patients with a history of smoking,
even when they develop fixed airflow limitation,
suggesting that fixed airflow limitation
does not define a unique disease entity.
Fabbri LM et al Am J Respir Crit Care Med 2003;167 418-424
Pathogenesis of COPD
INFLAMMATION
Small airway disease
Airway inflammation
Airway remodeling
Parenchymal destruction
Loss of alveolar attachments
Decrease of elastic recoil
AIRFLOW LIMITATION
Fixed airflow limitation in asthma and COPD
SPUTUM
120
*
110
***
100
90
History of
Asthma
80
History
of smoking
70
60
50
40
30
20
10
0
Macrophages
Neutrophils
Eosinophils
Lymphocytes
Fabbri LM et al Am J Respir Crit Care Med 2003;167 418-424
Fixed airflow limitation in Asthma and COPD
Exhaled Nitric Oxide
History
of smoking
50
(ppb)
Exhaled NO
60
History
of Asthma
***
40
30
20
10
0
Fabbri LM et al Am J Respir Crit Care Med 2003;167 418-424
20
CD4+/ CD8+
16
p < 0.05
12
8
4
0
History of
Asthma
History of
Smoking
Fabbri LM et al Am J Respir Crit Care Med 2003;167 418-424
p < 0.01
Eosinophils / mm2
200
160
120
80
40
0
History of
Asthma
History of
Smoking
Fabbri LM et al Am J Respir Crit Care Med 2003;167 418-424
Differences between asthma and COPD
ASTHMA
Sensitizing agent
COPD
Noxious agent
Asthmatic airway
inflammation
CD4+ T-lymphocytes, Th2
COPD airway inflammation
CD8+ T-lymphocytes, Tc1
Marcrophages
Eosinophils
Neutrophils
Completely
reversible
Airflow limitation
Completely
irreversible
Th1 and Th2 balance
W. Busse and R. Lemanske. Immunology of asthma NEJM 2001: 344:350
Chemokines-cytokines expression in T cells infiltrating
the central airways of asthmatics vs COPD patients
L
ASTHMA
ASTHMA
L
e
L
CXCR3/IFN-g
CCR4/IL-4
L
L
e
CCR4/IL-4
e
e
CXCR3/IFN-g
Panina Bordignon, Papi A et al J Clin Invest 2001; 107:1357
500
CXCR3+ cells/mm2
400
p = 0.02
300
200
100
0
COPD Smokers Non Smokers
Saetta et al, Am J Respir Crit Care Med 2002; 165: 1404-1409
CXCR3+ are Tc1 cells
Double staining CXCR3/CD8 and
CXCR3/INFg
CXCR3+ cells co-express CD8 and INFg
Saetta et al, Am J Respir Crit Care Med 2002; 165: 1404-1409
Pathogenesis of COPD
Cigarette smoke
or air pollutant
?
Alveolar macrophage
CD8+ T-cell
CXCR3
Inflammatory cytokines
(IL-8, LTB4)
Neutrophil
CXCL-10
Alveolar wall destruction
EMPHYSEMA
Proteases
Mucus hypersecretion
CHRONIC BRONCHITIS
Modified from Barnes, 1998
Smoking and airway inflammation in
patients with mild asthma
In addition to the eosinophilic airway
inflammation observed in patients with
asthma, smoking induces neutrophilic
airway inflammation
A relationship is apparent between smoking
history, airway inflammation, and lung
function in smoking asthmatics
Chalmers GW et al. Chest 2001; 120:1917
Cigarette Smoking Impairs the Therapeutic
Response to Oral Corticosteroids in Chronic
Asthma
We conclude that active smoking
impairs the efficacy of short-term oral
corticosteroid treatment in chronic
asthma
Chaudhuri R al. Am J Respir Cr Care Med (Dec 1)2003);168: 1308.
ASMA
Allergeni
BPCO
Fumo di sigaretta
Infiammazione bronchiale
Linfociti T CD4+
Eosinofili
Infiammazione bronchiale
Linfociti T CD8+
Macrofagi, neutrofili
COMPLETAMENTE
REVERSIBILE
RIDUZIONE DEL FLUSSO NON COMPLETAMENTE
REVERSIBILE
AEREO ESPIRATORIO
Asma bronchiale
• Definizione ed eziopatogenesi
• Epidemiologia e fattori di rischio
• Diagnosi
• Classificazione
•Trattamento
Epidemiologia
dell’asma
Negli ultimi 20 anni la prevalenza di asma è
aumentata considerevolmente in molti paesi,
soprattutto nei bambini
Variazione della
prevalenza dei
sintomi asmatici
nel mondo
International Study of
Asthma and Allergies in
Children (ISAAC)
Differente prevalenza di asmarinocongiuntivite ed eczema
atopico nel mondo
500000 bambini tra 13-14 anni
155 centri, 56 nazioni
Lancet 1998;351:1225
Aumento della prevalenza di asma
in bambini/adolescenti
{ 1966
1989
Svezia
{ 1979
1991
Giappone
{ 1982
1992
Scozia
{ 1982
1992
UK
{ 1989
1994
USA
{ 1982
1992
Nuova Zelanda
{ 1975
1989
Australia
{ 1982
1992
Finlandia
(Haahtela et al)
(Aberg et al)
(Nakagomi et al)
(Rona et al)
(Omran et al)
(NHIS)
(Shaw et al)
(Peat et al)
0
5
10
15
20
Prevalenza (%)
25
30
35
Fattori di rischio di asma
Fattori individuali
Fattori ambientali
Predisposizione
genetica
Atopia
Iperresponsività delle
vie aeree
Sesso
Razza/etnia
Allergeni
Infezioni delle vie respiratorie
Inquinamento atmosferico
Sensibilizzanti professionali
Fumo di tabacco
Fattori socio-economici
Dimensioni del nucleo familiare
Additivi alimentari e farmaci
Obesità
Infezioni parassitarie
ASMA = MALATTIA GENETICA COMPLESSA
Iperreattività
bronchiale
Sintomi
VEMS
?
?
FENOTIPO
IgE totali
=
GENOTIPO
?
IgE specifiche
Eosinofili
?
?
Allergeni
+
Infezioni
AMBIENTE
?
Inquinanti
atmosferici
Sforzo fisico
Genetica
E’ stata dimostrata una correlazione tra i
cromosomi 5q, 6p, 11q, 13q, 16q e 20p e l’asmaatopia.
Beghe B. Clin Exp Allergy. 2003 Aug;33(8):1111-7.
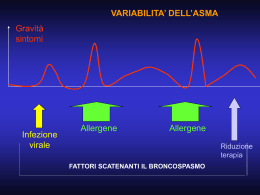
Fattori in grado di indurre
riacutizzazioni asmatiche
Infezioni delle vie respiratorie
Allergeni
Inquinanti atmosferici interni (fumo, ecc..)
ed esterni (urbani, industriali, ecc..)
Esercizio fisico
Fattori meteorologici
Farmaci
Alimenti
Riacutizzazioni asmatiche e virus
respiratori
• Le infezioni virali sono causa frequente di riacutizzazioni
asmatiche
• I soggetti asmatici sono più suscettibili all’infezione da
rinovirus
• E’ dimostrato un sinergismo tra infezioni virali ed
esposizione ad allergeni nell’indurre le riacutizzazioni e
nel determinare la gravità delle riacutizzazioni
Papi et al. FASEB J. 2002 Dec;16(14):1934-6. Epub 2002 Oct 04.
Fattori di rischio che portano
all’insorgenza di asma: allergeni
Allergeni domestici
Sono quelli liberati da:
acari
animali a pelo (gatto, cane, coniglio ecc..)
scarafaggi
miceti
Allergeni degli ambienti esterni
Sono quelli liberati da:
piante erbacee (graminacee, urticacee, composite, ecc..)
ed arboree (oleacee, betulacee, ecc..)
miceti
Allergeni professionali
Erwin EA et al.J Allergy Clin Immunol. 2005 Jan;115(1):74-9.
Asma bronchiale
• Definizione ed eziopatogenesi
• Epidemiologia e fattori di rischio
• Diagnosi
• Classificazione
• Trattamento
E’ Asma?
Episodi ricorrenti di respiro sibilante
Tosse notturna
Tosse o respiro sibilante in seguito a sforzo
Tosse,respiro sibilante o senso di costrizione
toracica dopo esposizione ad allergeni o inquinanti
aerei
Le malattie da raffreddamento “vanno al petto” o
richiedono più di 10 giorni per la guarigione
Diagnosi di asma
Anamnesi ed insieme dei sintomi
Esame obiettivo
Prove di funzionalità respiratoria
Spirometria
Test di reversibilità
Test di provocazione bronchiale aspecifico
Indagini per identificare i fattori di rischio
Altre indagini
Anamnesi
•Le è mai capitato di avere mancanza di fiato dopo uno sforzo
intenso?
• Le è mai capitato di svegliarsi per la presenza di respiro sibilante?
• Le è mai capitato di svegliarsi per un attacco di tosse?
• Le è mai capitato di avere un episodio di mancanza di respiro
durante il giorno a riposo?
Esame obiettivo
•Negativo
•Sibili telespiratori
•Broncospasmo serrato
Prove di Funzionalità Respiratorie
( SPIROMETRIA )
• Il sospetto diagnostico di asma impone la valutazione di
VEMS,CVF,VEMS/CVF
prima
e
dopo
inalazione
di
broncodilatatore a breve durata d’azione ( Bye e coll. 1992; Li
e O’ Connel,1996 )
• L’ostruzione è indicata da riduzione rispetto al valore di
riferimento di :
• VEMS
• VEMS/CVF
• La REVERSIBILITA’ è significativa se VEMS>12% e a 200ml
dopo B2 agonista a breve durata d’ azione( ATS,1991 )
Diagnosi di asma:
Prove di funzionalità respiratoria
• Test di reversibilità (incremento > 12% rispetto al teorico e
variazione > 200 ml**). Da considerare anche in soggetti con
VEMS % pred nei limiti della norma, in particolare in età
giovanile
•Test con metacolina o test da sforzo
*Rint: Airway resistance misurate con la interrupter technique
**Criteri ERS 1993
CURVA FLUSSO - VOLUME
Una curva flusso-volume
normale presenta un
rapido picco di flusso
espiratorio con un
graduale declino a zero.
FEV1e FVC >80% del
predetto
FEV1/FVC > 70% del
predetto
Curva flusso-volume di tipo ostruttivo
• Morfologia tipica della curva
con concavità verso l’alto
• FEV1/FVC < 70% del predetto
• FEV1 ( VEMS ):
•Lieve
> 80%
•Moderata > 50% < 80%
•Severa > 30 < 50%
•Molto severa < 30%
Curve Spirometriche (VEMS)
Tipiche
Volume
VEMS
Soggetto Normale
Soggetto asmatico (dopo broncodilatatore)
Soggetto asmatico (prima del broncodilatatore)
1
2
3
4
Tempo (sec)
5
Nota: Ciascuna curva di VEMS rappresenta il valore più alto tra tre misurazioni consecutive
Prove di Funzionalità Respiratorie
( SPIROMETRIA )
• UN QUADRO OSTRUTTIVO REVERSIBILE E/O UN SINGOLO
PARAMETRO CLINICO O FUNZIONALE E’ INSUFFICIENTE
PER PORRE DIAGNOSI
• E’ NECESSARIO CHE SIANO PRESENTI SINTOMI DI ASMA
ALL’ANAMNESI
• E CHE VENGANO ESCLUSE ALTRE DIAGNOSI
Quando eseguirla?
• al momento della prima valutazione
• dopo un periodo di trattamento per
documentare il raggiungimento della
“normalità” di funzione respiratoria
• almeno ogni anno per valutare la stabilità
della funzione respiratoria
DIAGNOSI DIFFERENZIALE
NELL’ ASMA
Neonati e Bambini
• Malattie vie aeree
superiori
• Ostruzione vie aeree
centrali
• Ostruzione delle
piccole vie
Adulti
• BPCO
• Scompenso cardiaco
• Ostruzione meccanica
delle vie aeree
• Embolia polmonare
• Disfunzione laringea
INDAGINI SUPPLEMENTARI
• Variazioni circadiane del PEF (variabilità
> 20%)
• Radiografia del torace
• Test allergologici
• Valutazione ORL
• Presenza eventuale di reflusso
gastroesofageo
Un indice semplice di variazione del
PEF
Highest PEF (670)
PEF (L/min)
800
700
600
500
Morning PEF
Evening PEF
Lowest morning PEF (570)
400
300
0
7
14
Days
Minimum morning PEF ( % recent best): 570/670 = 85%
(From Reddel, H.K. et al. 1995)
Sintomi: tosse, sibili, dispnea,
intolleranza allo sforzo
Sospetto clinico di Asma
Spirometria
Test di broncostimolazione
no
Sindrome ostruttiva?
sì
Diagnosi alternative
all’Asma
no
Iperreattività
bronchiale?
sì
Test di reversibilità
Trattamento ex
adiuvantibus 4-6
settimane
Ostruzione reversibile?
no
no, dopo almeno 2 tentativi
sì
Diagnosi alternative
all’Asma
Diagnosi di Asma
Diagnosi di asma
Indagini per identificare i fattori di
rischio
•
•
•
•
•
•
Valutazione anamnestica allergologica approfondita.
Skin prick test come indagine di primo livello
utilizzando estratti allergenici standardizzati.
Il dosaggio delle IgE specifiche sieriche è un esame di
secondo livello.
Valutazione della presenza di rinite o rinosinusite.
Valutazione della presenza di reflusso gastro-esofageo.
Valutazione sulla presenza di intolleranza ad aspirina,
conservanti alimentari e rischi professionali
ALTRE INDAGINI PER LA DIAGNOSI E IL
MONITORAGGIO
Markers
Commenti
Spirometria completa
Diffusione polmonare
Differenza Asma-BPCO
Espettorato
spontaneo o
indotto
Eosinofili
Altre cellule inf.
Contributo alla diagnosi
Contributo alla
caratterizzazione fenotipica
Contributo al monitoraggio
Aria esalata
NO
Contributo alla diagnosi
(specialmente nel bambino)
Contributo al monitoraggio
Eosinofili
Contributo alla diagnosi
Contributo al monitoraggio
Funzione
polmonare
Sangue periferico
Smith et al.Curr Opin Allergy Clin Immunol. 2005 Feb;5(1):49-56.
Wenzel S. Clin Exp Allergy. 2003 Dec;33(12):1622-8.
Asma bronchiale
• Definizione ed eziopatogenesi
• Epidemiologia e fattori di rischio
• Diagnosi
• Classificazione
• Trattamento
Classificazione di Gravità
CLASSIFICAZIONE DI GRAVITA’
Caratteristiche cliniche in assenza di terapia
Sintomi
STEP 4
Grave
Persistente
STEP 3
Moderato
Persistente
Sintomi notturni
Continui
Attività fisica
limitata
Frequenti
Quotidiani
Attacchi che limitano
L’attività
1 volta
Alla settimana
STEP 2
Lieve
Persistente
> 1 volta/settimana
ma < 1 volta / giorno
STEP 1
Intermittente
< 1 volta/settimana
Asintomatico e con
normale PEF tra gli
attacchi
FEV1 o PEF
60% predetto
> 2 volte al mese
Variabilità > 30%
60 - 80% predetto
Variabilità > 30%
80% predetto
Variabilità 20 - 30%
2 volte al mese
80% predetto
Variabilita < 20%
La presenza di almeno uno dei criteri di gravità è sufficiente per classificare un paziente
in un determinato livello di gravità
Classificazione di gravità
CLASSIFY SEVERITY
Clinical Features during Treatment
Symptoms
Nighttime Symptoms
FEV 1 o PEF
STEP 4
Severe
Persistent
Continuous
Limited physical Frequent
activity
≤60% predicted
Variability >30%
STEP 3
Moderate
Persistent
Daily
>1 time week
Use 2-agonist daily
Attacks limit activity
60-80% predicted
Variability >30%
STEP 2
Mild
Persistent
≥1 time a week
but <1 time a day
>2times a months
≥80% predicted
Variability 20-30%
≤2 times a month
≥80% predicted
Variability <20%
<1 time a week
STEP 1
Intermittent Asymptomatic and
normal PEF between
attacks
One of the features of severity is sufficient to place a patient in that category
Treatment
Six-part Asthma Management Program
Control of Asthma
Minimal (ideally no) chronic symptoms
Minimal (infrequent) exacerbations
No emergency visits
Minimal (ideally no) “as needed” use of β2-agonist
No limitations on activities, including exercise
PEF circadian variation of less than 20 percent
(Near) normal PEF
Minimal (or no) adverse effects from medicine
Management of asthma:
2004 update the GINA guidelines
Mild
Avoidance of risk factors, immunotherapy
Intermittent Short-acting beta-2 agonists as needed
Mild
Low-dose inhaled steroids
Persistent
Moderate
Persisten
t
Combination of long-acting
beta2 agonists with inhaled
steroids, and/or LTRA,
theophylline
Severe
Persistent
Systemic
steroids
Patients currently achieving control
Only 5% of patients
achieve asthma control
Not well controlled
Well controlled
Rabe et al. Eur Respir J 2000
Six-part Asthma Management Program
Control of Asthma
Minimal (ideally no) chronic symptoms
Minimal (infrequent) exacerbations
No emergency visits
Minimal (ideally no) “as needed” use of β2-agonist
No limitations on activities, including exercise
PEF circadian variation of less than 20 percent
(Near) normal PEF
Minimal (or no) adverse effects from medicine
Time course of asthma control
No night
symptoms
100
No rescue
2-agonists
% improvement
amPEF
Exercise/BHR
Exacerbations
0
Days
Weeks
Months
Years
Woolcock, ERS 2000
Six-part Asthma Management Program
Control of Asthma
Minimal (ideally no) chronic symptoms
particularly nocturnal asthma
PEF circadian variation of less than 20 percent
(Near) normal PEF
Minimal (ideally no) “as needed” use of β2-agonist
No limitations on activities, including exercise
Minimal (infrequent) exacerbations, hospitalization
Minimal (or no) adverse effects from medicine
Two alternative views on maintaining
asthma control
Flat “mountain top” maintained by regular treatment
“Undulating terrain” characterized by peaks and valleys
requiring flexible dosing of treatment
Treatment change
Treatment change
Treatment change
Asma bronchiale
• Definizione ed eziopatogenesi
• Epidemiologia e fattori di rischio
• Diagnosi
• Classificazione
•Trattamento
Management of asthma:
2004 update the GINA guidelines
Mild
Avoidance of risk factors, immunotherapy
Intermittent Short-acting beta-2 agonists as needed
Mild
Low-dose inhaled steroids
Persistent
Moderate
Persisten
t
Combination of long-acting
beta2 agonists with inhaled
steroids, and/or LTRA,
theophylline
Severe
Persistent
Systemic
steroids
Programma in sei parti
per il trattamento dell’asma
1. Educare il paziente alla collaborazione al trattamento
2.
3.
4.
5.
6.
dell’asma
Valutare e controllare il più possibile la gravità dell’asma
tramite registrazione dei sintomi e misure della funzionalità
respiratoria
Evitare l’esposizione a fattori scatenanti
Elaborare piani di trattamento farmacologico per la gestione
cronica nei bambini e negli adulti.
Elaborare piani individuali per la gestione delle
riacutizzazioni
Fornire assistenza di follow-up regolare
Programma in sei parti per il trattamento dell’asma
Parte 1:Obiettivi del trattamento a lungo
termine
Raggiungere e mantenere il controllo dei sintomi
Prevenire gli episodi asmatici e le riacutizzazioni
Mantenere la funzionalità respiratoria il più
possibile a livelli normali
Mantenere i normali livelli di attività, incluse le
attività fisiche
Evitare gli effetti collaterali del trattamento
farmacologico dell’asma
Prevenire lo sviluppo di una limitazione irreversibile
al flusso aereo
Prevenire la mortalità per asma
Programma in sei parti per il
trattamento
dell’asma
.
Il trattamento più efficace consiste nel
prevenire l’infiammazione delle vie aeree
eliminando i fattori causali
L’asma
può
essere
controllata
efficacemente nella maggior parte dei
pazienti, anche se non può essere guarita
I fattori principali che contribuiscono alla
mortalità e morbilità per asma sono la
sottodiagnosi e il trattamento inadeguato
Programma in sei parti per il trattamento dell’asma
Parte 2: Valutazione e monitoraggio della
gravità dell’asma mediante segnalazione dei
sintomi e misure della funzionalità respiratoria
Segnalazione dei sintomi
Spirometria per la valutazione iniziale. Picco di flusso
espiratorio per le valutazioni seguenti:
Valutazione della gravità
Valutazione della risposta al trattamento
Monitoraggio domiciliare del PEF
Uso di farmaci sintomatici
Sintomi notturni
Limitazione alle attività
Importante per i pazienti con scarsa percezione dei sintomi
Riportare in un diario le misurazioni quotidiane
Valuta la gravità e predice i peggioramenti
Guida l’uso di un sistema a zone per l’autogestione dell’asma
Emogasanalisi arteriosa per riacutizzazioni gravi
Programma in sei parti per il trattamento dell’asma
Parte 3: Evitare l’esposizione ai
fattori di rischio
Ridurre l’esposizione agli allergeni degli
ambienti interni
Evitare il fumo di tabacco
Evitare le emissioni degli autoveicoli
Identificare gli irritanti presenti sul luogo
di lavoro
Analizzare il ruolo delle infezioni nello
sviluppo dell’asma, specialmente in
bambini e lattanti
Programma in sei parti per il trattamento dell’asma
Parte 4: Trattamento
farmacologico
Farmaci per il controllo dell’asma:
Glucocorticosteroidi inalatori
ß-agonisti a lunga durata d’azione
Antagonisti recettoriali dei leucotrieni
Glucocorticosteroidi orali
Metilxantine a lento rilascio
Cromoni
Terapia Farmacologica
Farmaci per il sollievo dei sintomi:
ß2-agonisti inalatori a rapida azione
Glucocorticosteroidi sistemici
Anticolinergici
Metilxantine ad azione rapida
Management of asthma:
2004 update the GINA guidelines
Mild
Avoidance of risk factors, immunotherapy
Intermittent Short-acting beta-2 agonists as needed
Mild
Low-dose inhaled steroids
Persistent
Moderate
Persisten
t
Combination of long-acting
beta2 agonists with inhaled
steroids, and/or LTRA,
theophylline
Severe
Persistent
Systemic
steroids
Farmaci antiasmatici
raccomandati
Step 1: Adulti
Gravità
Step 1:
Intermittente
Farmaci
quotidiani per il
controllo
• Nessuno
Altre opzioni
• Nessuno
Farmaci per il sollievo dei sintomi: ß2- agonisti a rapida azione q.o, in
uso occasionale.
Farmaci antiasmatici
raccomandati
Step 2: Adulti
Gravità
Farmaci quotidiani
per il controllo
Altre opzioni (in ordine
di efficacia globale)
Step 2:
Lieve
Persistente
•Glucocorticosteroi • Antileucotrieni
di inalatori (< 500
• Cromoni
μg BDP o
equivalenti), anche
in singola dose
giornaliera
Farmaci per il sollievo dei sintomi: ß2- agonisti a rapida azione q.o, in
uso occasionale.
Farmaci antiasmatici
raccomandati
Step 3: Adulti
Gravità
Farmaci quotidiani per il
controllo
Altre opzioni (in ordine di efficacia
globale)
Step 3:
Moderato
persistente
• Glucocorticosteroidi
inalatori (200 – 1000 μg
BDP o equivalenti)
più β2- agonisti inalatori
a lunga durata d’azione
• Glucocorticosteroidi inalatori (500 –
1000 μg BDP o equivalenti) più
antileucotrieni, or
• Glucocorticosteroidi inalatori (500 –
1000 μg BDP o equivalenti) più teofillina
a lento rilascio, o
• Glucocorticosteroidi inalatori a dosi più
alte (> 1000 μg BDP o equivalenti)
Farmaci per il sollievo dei sintomi: ß2- agonisti a rapida azione q.o, in
uso occasionale.
• Treatment with montelukast 10 mg + budesonide 800
mg
–
–
Was comparable to doubling the budesonide dose
to 1600 mg
Had a faster onset of action than doubling the budesonide dose to 1600 mg
• Both treatments were well tolerated, with a
significantly (P<0.05) lower incidence of respiratory
adverse events with montelukast + budesonide 800 mg
compared with budesonide 1600 mg
Clinical Observation of Montelukast as a Partner Agent for
Complementary Therapy
Montelukast + Budesonide vs higher-dose budesonide
Investigation of Montelukast
as a Partner Agent
for Complementary Therapy
• Bjermer L, Bisgaard H, Bousquet J, Fabbri LM, Greening A,
Haahtela T, Holgate ST, Picado C, Leff JA.
•
•
Montelukast or salmeterol combined with an inhaled steroid in adult asthma:
design and rationale of a randomized, double-blind comparative study (the
IMPACT Investigation of Montelukast as a Partner Agent for
Complementary Therapy-trial).
Respir Med. 2000 Jun;94(6):612-21.
IMPACT
L’aggiunta di montelukast in pazienti i cui sintomi non sono bene
tollerati dal fluticasone inalatorio, potrebbe fornire un controllo clinico
equivalente al salmeterolo
GOAL study:
Aiming for TOTAL OR WELL CONTROLLED
ASTHMA
GOAL was designed to test prospectively whether sustained asthma control
assessed using a composite measure derived from GINA / NIH guidelines
Flat “mountain top” maintained by regular treatment
“Undulating terrain” characterized by peaks and valleys
requiring flexible dosing of treatment
Farmaci antiasmatici
raccomandati
Step 4: Adulti
Gravità
Farmaci quotidiani per il controllo
Altre opzioni
Step 4
Grave
persistente
• Glucocorticosteroidi inalatori
( > 1000 μg BDP o equivalenti) più
β2- agonisti a lunga durata d’azione
• più uno o più dei seguenti, se
necessario:
- Antileucotrieni
- Teofillina a lento rilascio
- Glucocorticosteroidi orali (solo
dopo aver ottimizzato tutto il resto)
• Valutare possibili
fattori aggravanti o
che possono rendere
la malattia non
controllata (aderenza
al trattamento, fattori
psico-sociali,
esposizione ad
allergeni, RGE, rinosinusite, sensibilità ad
ASA, etc)
Farmaci per il sollievo dei sintomi: ß2- agonisti a rapida azione q.o, in uso
occasionale.
Classificazione di Gravità dell’asma
rispetto alla terapia di fondo in atto e
indicazioni per i successivi adattamenti
Livello attuale della
terapia di fondo
STEP 1
STEP 2
STEP 3
STEP 4
nessuna
Corticosteroidi in.
Corticosteroidi in.
Corticosteroidi in.
+ β2-agonisti lunga
durata
+ β2-agonisti lunga
durata
+ altri farmaci
Moderato
persistente
Grave
persistente
Livello attuale dei
sintomi e della
funzione
Lieve
persistente
STEP 1
Intermittente
Intermittente
STEP 2
Lieve Persistente
Lieve
persistente
Moderato
persistente
STEP 3
Moderato Persistente
Moderato
persistente
Grave
persistente
STEP 4
Grave Persistente
Grave
persistente
Grave
persistente
Valutare
step-up
Valutare
step-up
Valutare
step-up
Valutare
step-down
Grave
persistente
Grave
persistente
Grave
persistente
Grave
persistente
Grave
persistente
Grave
persistente
Step-up e step-down
L’assenza di controllo della malattia a qualsiasi livello deve
determinare un incremento della terapia di base, secondo le variazioni
previste all’interno e tra le classi di gravità
L’ottenuto controllo dell’asma per lungo tempo (3 mesi) può
permettere una riduzione del livello di terapia, secondo le variazioni
previste all’interno e tra le classi di gravità (D)
Nei pazienti con asma lieve persistente e moderato, la terapia con
corticosteroidi inalatori o con la combinazione fissa CSI+LABA può
essere incrementata per brevi periodi sulla base dei sintomi e della
funzione respiratoria, ottenendo una riduzione delle riacutizzazioni
gravi e permettendo di mantenere bassa la dose di corticosteroidi
inalatori per uso regolare (B)
INDICAZIONI ALL’IMMUNO TERAPIA NELL’ASMA
L’ITS può essere indicata nei pazienti con asma allergica,
da lieve a moderata, specialmente quando l’asma è associata
a rinite, in accordo con le indicazioni già definite.
Lo scopo è quello di ridurre i sintomi ed il consumo di farmaci,
nonché di interferire con la storia naturale della malattia.
L’immunoterapia ed il trattamento farmacologico non sono
mutuamente esclusivi.
L’immunoterapia non deve essere somministrata a pazienti
con asma severa persistente o non adeguatamente
controllata dalla terapia.
FUTURE TERAPIE DELL’ASMA
nuovi corticosteroidi inalatori
• monosomministrazione giornaliera (mometasone)
• attivazione “locale” (ciclesonide)
possibili minor effetti collaterali a lungo termine
• anticorpi monoclonali umanizzati anti-IgE
• efficaci nell’asma e nella rinite allergica
• indicati nell’asma grave (riduzione delle riacutizzazioni
• inibitori della PD4 (roflumilast, cilomilast)
• effetto broncodilatatore ed antinfiammatorio
• efficaci come CSI a bassa dose
• indicati in particolari fenotipi (ad es. nei pazienti
senza eosinofilia)
Programma in sei parti per il trattamento dell’asma
Parte 5: Trattamento delle riacutizzazioni
gravi dell’asma: necessità di ricovero
ospedaliero
Pazienti a rischio di morte per asma
o con asma”quasi-fatale”
Asma grave:
•Pregresso episodio di rischio di morte (ventilazione
meccanica, acidosi respiratoria, ricovero in terapia
intensiva)”.
•Ricovero ospedaliero o visita in pronto soccorso
per asma nel corso dell’anno precedente
•Terapia con tre o più farmaci antiasmatici
•Utilizzo eccessivo di ß2 agonisti
•Difficoltà a mantenere il controllo dell’asma
Trattamento delle riacutizzazioni
gravi dell’asma: necessità di ricovero
ospedaliero
Caratteristiche comportamentali e psicosociali
dei pazienti a rischio:
1.
2.
3.
4.
5.
Scarsa aderenza alla terapia
Patologie psichiatriche
Abuso di alcoolici o droghe
Obesità
Gravi problematiche sociali o familiari
Trattamento a domicilio
Asma Acuto
Valutazione iniziale
Anamnesi, esame obiettivo (eloquio, FC, FR), PEF
Trattamento iniziale
2 agonisti a breve durata d’azione (fino a 3 somministrazioni/30 min.)
Corticosteroidi sistemici
Risposta buona
Risposta incompleta
o scarsa
Asma severo o
a rischio di morte
Terapia domiciliare
(controllo a breve)
Invio in Ospedale
Trattamento in Pronto Soccorso
Asma Acuto
Valutazione iniziale
Anamnesi, esame obiettivo, EGA, PEF o VEMS
Trattamento iniziale
Broncodilatatori ; cortisonici sistemici, O 2 se necessario
Buona risposta
Osservazione
per almeno 1 ora
Se stabile,
dimissione con
consiglio di
controllo
specialistico
entro 20gg
Risposta incompleta/cattiva
Insufficienza respiratoria
Consulenza specialistica pneumologica
Buona risposta
Cattiva risposta
Dimissione
Ricovero
Valutazione
funzionale
Ricovero in
Pneumologia UTIR o
Unità di Terapia Intensiva
Safety of Long-Acting Beta2-Agonists
Fernando D. Martinez, M.D.
Arizona Respiratory Center
The University of Arizona
FDA/GSK, Package Insert for ADVAIR, approved March 3, 2006
FDA/GSK, Package Insert for ADVAIR, approved March 3, 2006
Controversies About Safety of
Regular Use of Short-Acting Beta2-Agonists
“The epidemics of asthma deaths in the UK and New
Zealand appear to be related to adverse effects of
these drugs on airway function and airway
hyperresponsiveness”
Sears, JACI 2002; 110:S322
“frequent use of short-acting beta-agonists has been
associated with increased risk of death and neardeath from asthma…the increased use of shortacting beta-agonists in these situations is
symptomatic of poor asthma control, which is the
underlying cause of the untoward outcome”
Nelson, JACI 2006; 117:3
Serevent UK Nationwide
Surveillance Study
16 wk, 2:1 salmeterol:salbutamol randomization ratio,
double-blind trial in parallel groups
Inclusion criteria included age >12 yrs and “a clinical
requirement for regular bronchodilator treatment”
16,787 randomized to salmeterol, 8,393 to salbutamol
Among patients with moderate and severe asthma, 72%
and 83%, respectively, were taking inhaled corticosteroids
concomitantly
Castle et al, BMJ, 1993:306:1034
Serevent UK Nationwide
Surveillance Study: Results
12 asthma-deaths in salmeterol group, 2 in salbutamol
group (2.3 vs. 0.8 /1000 patient-yrs: RR=3.0, p=0.10)
14 asthma-deaths were in patients with severe disease.
For 10/14 patients, their asthma could “possibly have been
more appropriately treated by earlier or higher doses of
glucocorticosteroids”
However, allocation to therapy being randomized, this
explanation could not explain the excess deaths in the
salmeterol group
Castle et al, BMJ, 1993:306:1034
SMART
Salmeterol Multicenter Asthma Research Trial
Salmeterol MDI 42mcg BID + Usual Care
• No inhaled longacting beta2-agonist
(n=13,176)
R
• > 12 years of age
28 week treatment period
Phone contact every 4 weeks
Placebo MDI BID + Usual Care
(n=13,179)
Clinic Visit
28 week supply of study
medication provided
Nelson et al. Chest 2006; 129:15
Baseline Characteristics
Salmeterol
(n=13,176)
Placebo
(n=13,179)
Age, mean
39.2
39.1
Sex, n (%)
Female
Male
8334 (64)
4703 (36)
8337 (64)
4686 (36)
Ethnic Origin, n (%)
Caucasian
African American
Hispanic
Asian
Other
9281 (71)
2366 (18)
996 (8)
173 (1)
230 (2)
9361 (72)
2319 (18)
999 (8)
149 (1)
224 (2)
84.0
83.8
Peak Expiratory Flow (% Predicted)
Nelson et al. Chest 2006; 129:15
Asthma Medications at Baseline
Salmeterol
Placebo
n=13,176
n=13,179
12,715 (97)
12,660 (96)
461 (3)
519 (4)
12,059 (92)
12,043 (91)
Inhaled corticosteroids
6127 (47)
6138 (47)
Methylxanthines
1766 (13)
1767 (13)
Leukotriene modifiers
1437 (11)
1402 (11)
Concurrent Medications, n (%)
Subjects using asthma medications
at Baseline
Subjects with no asthma medications
at Baseline
Inhaled or oral beta2-agonists
(excluding inhaled LABAs)
Nelson et al. Chest 2006; 129:15
SMART Results
All Patients and Ethnic Subgroups
1° Endpoint
RR (95% CI)
SAL n
PLA n
Respiratory
Death or Life
Threatening
Experience
1.40 (0.91, 2.14)
1.05 (0.62, 1.76)
4.10 (1.54, 10.90)
50
29
20
36
28
5
2° Endpoints
Respiratory
Death
2.16 (1.06, 4.41)
2.29 (0.94, 5.56)
3.88 (0.83, 18.26)
24
16
8
11
7
2
Asthma
Death or Life
Threatening
Experience
1.71 (1.01, 2.89)
1.08 (0.55, 2.14)
4.92 (1.68,14.45)
37
17
19
22
16
4
Asthma Death
4.37 (1.25, 15.34)
5.82 (0.70, 48.37)
7.26 (0.89, 58.94)
13
6
7
3
1
1
.031.062.125.25 .5
1
2
4
8
16 32 64 128
Total
Caucasian
African American
N=13176
N=9281
N=2366
N=13179
N=9361
N=2319
SMART Results
All Patients and by ICS Use at Baseline
1° Endpoint
RR (95% CI)
SAL n
PLA n
Respiratory
Death or Life
Threatening
Experience
1.40 (0.91, 2.14)
1.21 (0.66, 2.23)
1.60 (0.87, 2.93)
50
23
27
36
19
17
2° Endpoints
Respiratory
Death
2.16 (1.06, 4.41)
2.01 (0.69, 5.86)
2.28 (0.88, 5.94)
24
10
14
11
5
6
Asthma
Death or Life
Threatening
Experience
1.71 (1.01, 2.89)
1.24 (0.60, 2.58)
2.39 (1.10, 5.22)
37
16
21
22
13
9
Asthma Death
4.37 (1.25, 15.34)
1.35 (0.30, 6.04)
13
4
9
3
3
0
.031.062 .125 .25 .5
1
2
4
8
16 32 64 128
Total
ICS
Non-ICS
N=13176
N=6127
N=7049
N=13179
N=6138
N=7041
Increased Contractile Responses in ASM of
Mice Overexpressing the β2 Adrenoceptor
*p=0.02, ** p<0.001
McGraw et al, J Clin Invest 2003;112:619
Asma bronchiale
• Definizione ed eziopatogenesi
• Epidemiologia e fattori di rischio
• Diagnosi
• Classificazione
•Trattamento
Università degli Studi di Modena e Reggio Emilia
Clinica di Malattie dell’Apparato Respiratorio
Direttore Prof. L. M. Fabbri
Seminari interni del primo trimestre
Corso Integrato di Malattie dall’Apparato Respiratorio e
Chirurgia Toracica
Anno Accademico 2005-2006
ASMA BRONCHIALE
Scaricare