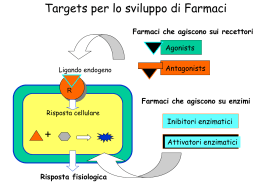
ALTERAZIONI NELLA FUNZIONE DI RECETTORI 1. Difetti di FUNZIONE su base genetica: Geni mutati codificano per recettori che trasducono il segnale anche in assenza/basse concentrazioni di ligandi Geni mutati codificano per proteine citoplasmatiche che fanno parte dei sistemi di trasduzione del segnale con guadagno di funzione (gain-of-function) di funzione Geni mutati codificanti per proteine ad attività di regolazione negativa di componenti della trasduzione del segnale hanno una ridotta attività inibitoria (loss-of-function) 2. Difetti di FUNZIONE su base acquisita: Fattori esogeni (tossine batteriche, sostanze tossiche) o endogeni (ormoni, molecole biologicamente attive, risposte dell’ospite a danni di diversa natura) alterano la trasduzione del segnale da parte di recettori modificando la funzione di componenti della trasduzione del segnale 1° messaggero (STIMOLO) Recettore Trasduttore (Enzima o Proteina adattatrice) 2° messaggero Trasduttore (Enzima o Proteina adattatrice) 3° messaggero BERSAGLIO RISPOSTA BIOLOGICA La trasduzione del segnale non è necessariamente lineare, ma più spesso “divergente” o a “rete” La trasduzione del segnale comporta il più delle volte una modificazione post-traduzionale di proteine. le più frequenti sono: •Fosforilazione •Ubiquitinazione •Acetilazione •Poli(ADP)ribosilazione •Proteolisi Proteine possono anche essere modificate da processi di ossidazione o nitrosilazione Una modificazione covalente di una proteina può modificare la sua funzione in diversi modi. Due frequenti sono: 1) una modificazione conformazionale, che nel caso di un enzima ne determina accesso al substrato; 2) la generazione di sito che viene riconosciuto da domini specifici di altre proteine le ain Tratta da Marks et al. “Cellular Signal Processes”, Garland Science VI SONO 4 MODALITA’ PRINCIPALI DI REGOLAZIONE DI INTERAZIONI PROTEINA -PROTEINA 1. Il sito di riconoscimento è una corta sequenza aminoacidica: SH3 WW Pro-x-x-Pro Pro-Pro-x-Tyr 2. Il sito di riconoscimento è una corta sequenza aminoacidica contenente una modificazione covalente: SH2, PTB fosfoTyr 14-3-3 fosfoSer 3. Il sito di riconoscimento è un componente della membrana plasmatica: C1 C2 PH, PX diacilglicerolo fosfatidilserina, acido fosfatidico fosfoinositidi fosforilati in posizione 3 4. Il sito di riconoscimento è un dominio uguale a quello di interazione: Death domain (DD) CARD PYD DD CARD PYD CLASSI DI MESSAGGERI PRIMARI I. MOLECOLE BIOLOGICAMENTE ATTIVE ED IN GRADO DI INTERAGIRE CON DIVERSI BERSAGLI CELLULARI A DISTANZA O NELLA SEDE DI PRODUZIONE. II. MOLECOLE ADESIVE IMPLICATE NELL’INTERAZIONE CELLULA-CELLULA E CELLULA-PROTEINE DELLA MATRICE EXTRACELLULARE (ECM). III. PICCOLE MOLECOLE A BREVE EMIVITA IN GRADO DI ATTRAVERSARE LA MEMBRANA PLASMATICA (ROIs, NO E RNIs, GLUCOSIO, OSSIGENO) IV. STIMOLI MECCANICI La trasduzione del segnale ha spesso come ultimo bersaglio la regolazione della trascrizione genica. Recettori cellulari per agonisti di diversa natura possono agire secondo due modalità Tratta da Marks et al. “Cellular Signal Processes”, Garland Science Receptor Protein Tyrosine Phosphatases Tratta da Marks et al. “Cellular Signal Processes”, Garland Science Fattore di crescita (GF) P P Residuo di tirosina P P P SH2 P P P SH2 ENZIMI: •PLCg •Tirosin chinasi citoplasmatiche (Src) •Fosfatidil inositolo 3-chinasi (mediante adattatore p85) •Tirosin fosfatasi (SHP1/2) “ADATTATORI”: •Grb2 •Shc •Nck •IRS Tratta da Marks et al. “Cellular Signal Processes”, Garland Science Tratta da Marks et al. “Cellular Signal Processes”, Garland Science Regolazione delle small GTP-binding proteins Guanine nucleotide Exchange Factor GTPase Activating Protein Guanine nucleotide Dissociation Inhibitor 1. Ras viene attivato da proteine fosforilate in tirosina FAK-P IRS-P LAT-P INTEGRINE FATTORI DI CRESCITA 7TMRs RECETTORI IMMUNI SH2 YP Grb2 SH3 Sos1 GEF Ras Raf MEK1, MEK2 ERK1, ERK2 Elk-1, Ets1, Sap1a, c-Myc, Tal, MAP kinase kinase kinase (MAPKKK); Ser/Thr MAP kinase kinase (MAPKK); Ser/Thr e Tyr MAP kinase (MAPK); Ser/Thr TRANSCRIPTION FACTORS
Scaricare