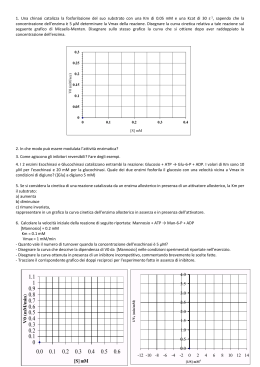
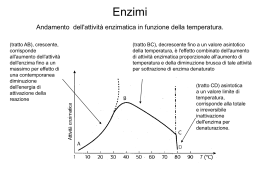
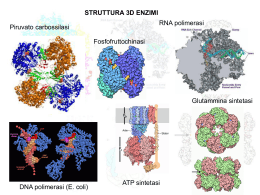
ENZIMI Catalizzatori prodotti da cellule viventi ma capaci di agire indipendentemente da esse Determinano tutti i processi di degradazione, sintesi, trasformazione e conservazione dell’energia nella formazione ed evoluzione della materia vivente. Sono PROTEINE spesso associate ad un metallo o molecola organica CATALISI ⇓ legata ai gruppi R degli amminoacidi la cui natura e disposizione residua individua una tasca detta SITO ATTIVO. E’ fondamentale la conformazione nativa della proteina per la sua funzione catalitica. DENATURAZIONE ⇒ MODIFICA STRUTTURA NATIVA ⇒ DISATTIVAZIONE DELL’ENZIMA Complementarità geometrica e fisica tra un E ed un substrato dipendente da forze non covalenti CATALISI OMOGENEA CATALISI ETEROGENEA sub. e cat. nella stessa fase sub. e cat. in fasi diverse Incremento di velocità 108-1020 volte con eventuale fondamentale intervento di componenti non proteiche (ioni Me o coenzimi). Struttura tridimenzionale dell’E fondamentale per la conoscenza dello stato di transizione e quindi del meccanismo di reazione. SITO ATTIVO = PARTE DELL’ENZIMA IN CONTATTO CON IL SUBSTRATO (zona piccola in confronto alle dimensioni dell’enzima). Modificazioni sito attivo scomparsa attività enzimatica. Struttura primaria e strutture superiori determinate dalla sintesi proteica = predestinazione di una proteina a funzionare da enzima. PM enzimi = da 12000 a 106 Molecola su cui opera l’enzima = substrato DIMENSIONE ENZIMA » DIMENSIONE SUBSTRATO Apoenzima(denaturato con cal.) + cofattore o gruppo prostetico (stabile al riscaldamento) ⇓ Enzima completo (oleoenzima) Enzimi richiedono cofattori per funzionare che possono essere ioni inorganici (Fe, Mg, Mn, Zn, Mo etc.) o molecole organiche (coenzimi) che possono essere: legati debolmente alla proteina legati saldamente alla proteina (gruppo prostetico) ATP ⇒ metabolita coezimatico + comune (cosubstrato modificato nella reazione e dissociato) NAD+ e NADP+ ⇒ coenzimi nucleotidici piridinici associati a deidrogenasi che catalizzano il trasferimento di un H- da un substrato al nucleotide portandolo nella forma ridotta con rilascio di H+ Coenzima A ⇒ coenzima derivato dall’acido pantotenico è coinvolto nel trasferimento di gruppi acilici CH3COAltri coenzimi sono: Biotina, Acido Lipoico, vitamine A, D, E e K. Enzimi identificati da 4 numeri: 1. Appartenenti a una delle classi relative alla reazione catalizzata 2. Appartenenza ad una sottoclasse 3. Appartenenza ad una sottosottoclasse 4. Posizione progressiva nella sottosottoclasse Esempio ATP + glucosio = ADP + glucosio-6-fosfato Catalizzatore esochinasi (nome comune) o ATP-glucofosfotransferasi (catalizza il trasferimento del P da ATP a glucosio). Numero dell’enzima 2.7.1.1. 2. classe delle transferasi 7. sottoclasse fosfotransferasi 1. sottosottoclasse fosfotransferasi con OH come gruppo accettore 1.glucosio come accettore del gruppo fosforico. Enzima Chirale riesce a distinguere tra gruppi della molecola stericamente non equivalenti. Risulta perciò altamente specifico e distingue due diversi stereoisomeri o nella reazione con un centro Pro-chirale genera uno solo dei possibili isomeri (geometrici o ottici) SPECIFICITA’ DEGLI EMZIMI Un enzima può avere diversi gradi di specificità: Specificità che tiene conto del legame (specificità di legame, Bassa specificità) Specificità che tiene conto di una parte della molecola (specificità di gruppo) Specificità che richiede le due parti della molecola ed il legame che le unisce (specificità assoluta). Es. A-B + H2O = AOH + BH •la natura di A e B non è importante •A o B devono essere determinate •A e B devono essere del tipo appropriato. Maltasi: catalizza l’idrolisi del maltosio ma essa può operare sugli a-glucosidi cioè sul glucosio legato con legame a-glucosidico ad un altro zucchero qualsiasi (specificità di gruppo). Meccanismo reazione enzimatica Catalisi per abbassamento Ea per stabilizzazione chimica del complesso attivato e/o + corretto orientamento geometrico per la formazione del complesso attivato E con S forma ES ad energia + bassa in un equilibrio non alterato, riuscendo a discriminare tra parecchi substrati (specificità) in competizione per il S.A. nel quale ci sono gruppi funzionali che: •Reagiscono temporaneamente con S •Predispongono S a formare P I gruppi catalitici di E interagendo con S lo preparano (attivano) alla reazione abbassando Ea. Tra substrato-enzima si forma il complesso ES la cui energia di legame serve per: Compensare la riduzione dell’entropia (avvicinamento e orientamento substrato) desolvatare il substrato indurre binding produttivo o adattamento indotto Dall’energia del legame E-S dipendono la catalisi e la specificità. DIVERSI TIPI DI CATALISI Catalisi acido base specifica se dovuta a H+ o OH- o generale se dovuta a gruppi accettori o donatori di protoni (sulle catene laterali degli a.a. e più comune al pH 7 della cellula) Catalisi covalente mediante formazione di un complesso attivato stabile per la formazione di legami covalenti tra E ed S. Meccanismo catalisi enzimatica Andamento cinetico Il sito attivo Cinetica Enzimatica La velocità iniziale di una reazione aumenta quasi linearmente all'aumentare della concentrazione di substrato. Vo La velocità è direttamente proporzionale alla concentrazione del substrato e la reazione è di primo ordine V = k [S] [S] Cinetica Enzimatica La proporzionalità fra V e [S] progressivamente diminuisce. Vmax V La velocità iniziale diventa indipendente dalla [substrato] e la reazione è di ordine zero rispetto al substrato. [S] La costante di Michaelis (KM) kM kM affinità kM kM kM kM kM Effetti della concentrazione dell’enzima Vmax è direttamente proporzionale alla [E] Km è indipendente dalla [E] e dalla [S] Unità Internazionale la quantità di enzima che catalizza la formazione di una micromole di prodotto in un minuto kcat o numero di turnover il numero di molecole di substrato convertite in prodotto nell'unità di tempo da una molecola di enzima quando è saturata con il substrato. E+S k1 k-1 kcat = k2 kcat ES k2 E+P Vmax = kcat [ET] kcat kcat kcat kcat kcat efficienza catalitica Enzima catalasi kcat 40 000 000 anidrasi carbonica 1 000 000 acetilcolinesterasi 14 000 lattato deidrogenasi chimotripsina 1 000 100 DNA polimerasi 15 lisozima 0,5 1 1 KM 1 V Vmax Vmax [S] Che cosa influenza la velocità della reazione? Pepsina Chimotripsina pH Velocità di reazione TEMPERATURA Velocità di reazione Tripsina pH Andamento variabile con uno o più massimi di attività a diversi pH. A pH estremi: Temperatura, °C •si può alterare irreversibilmente la stabilità dell’enzima La velocità aumenta all’aumentare di T, ma nella •si può modificare la ionizzazione di S influenzando il legame EScatalisi enzimatica un aumentoladi T può portare admodificandone una variazione di conformazione con perdita •si può modificare ionizzazione dell’E l’affinità per S •si può modificare la ionizzazione la ionizzazione delsolito complesso conseguente dell’attività catalitica. Di si ha ES un max di attività tra 40°C e Gli effetti 260°C e 3 influenzano la KM il 4completa la Vmax. a 90-95 °C. e la denaturazione Influenza della temperatura Lo studio attività/temperatura permette di calcolare dall’equazione di Arrenius K=A e-Ea/RT dalla cui linearizzazione si possono calcolare: Ea (molto + basso nelle reazioni enzimaticamente catalizzate) Q10= coefficiente termico ovvero fattore di cui aumenta la velocità quando T aumenta di 10°C. Reazioni non catalizzate Q10= 2 Reazioni catalizzate 1<Q10< 2 Influenza del pH Andamento variabile con uno o più massimi di attività a diversi pH. A pH estremi: •si può alterare irreversibilmente la stabilità dell’enzima •si può modificare la ionizzazione di S influenzando il legame ES •si può modificare la ionizzazione dell’E modificandone l’affinità per S •si può modificare la ionizzazione la ionizzazione del complesso ES Gli effetti 2 e 3 influenzano la KM il 4 la Vmax. REAZIONI CON PIU’ SUBSTRATI Reazioni sequenziali = reazioni con + substrati tutti presenti affinchè si abbia la liberazione di prodotti Reazioni a ping-pong = prodotto liberato prima che tutti i substrati siano stati legati. S1 per primo si lega ad E che subisce una modificazione per sostituzione liberando il primo prodotto: poi l’enzima modificato si lega al secondo substrato S2 formando il secondo prodotto e liberando l’E nella forma originaria. SISTEMI MULTIENZIMATICI Reagiscono in una serie consecutiva di reazioni in cui P diventa S della reazione successiva (azione concertata da 2 a 20 E di reazioni in sequenza). Sistemi multienzimatici in fase solubile (glicolisi) Sistemi multienzimatici fisicamente associati con ridotti problemi di diffusione (ac. grasso sintetasi) Sistemi associati a membrane o ribosomi (complessi della catena respiratoria) Inibitori enzimatici Irreversibili Reversibili INIBIZIONE ENZIMATICA Inibitori (I) =diminuiscono le velocità di reazione L’inibitore può legarsi all’enzima mediante legami: Fisici (inibizione reversibile) con l’allontanamento di I si ripristina l’attività di E Chimici (inibizione irreversibile) la formazione di legami covalenti impedisce il semplice allontanamento dell’I. INIBIZIONE REVERSIBILE Inibizione competitiva = I compete con S per il sito attivo di E Si può ridurre aumentando la [S]. Cambia KM non cambia Vmax Inibizione non competitiva = I si lega ad E in un sito diverso dal sito attivo. Si abbassa la Vmax ma non si modifica la KM Inibizione incompetitiva = I si lega solo al complesso ES. E + S ES E+P; ES+I ESI Si modificano entrambe le costanti cinetiche. Inibizione Competitiva Inibizione competitiva per formazione di legami col sito attivo mutuamente escludenti Un inibitore competitivo ridurrà l'affinità enzima substrato, cioè aumenterà il valore di Km. Ad alte concentrazioni di substrato la reazione non viene rallentata e Vmax è sempre la stessa. Inibizione non-competitiva Inibizione competitiva per cambiamento di conformazione mutuamente escludenti Inibizione incompetitiva Il substrato non viene più convertito in prodotto La KM rimane invariata La Vmax diminuisce I Gli inibitori irreversibili si combinano o distruggono un gruppo funzionale dell’enzima essenziale per l’attività catalitica. Es. Inibitori suicidi o inattivatori basati sul meccanismo che portano avanti le prime tappe della reazione enzimatica normalmente, poi invece di essere convertiti nel prodotto di reazione diventando composti molto reattivi che si legano irreversibilmente all’enzima. Inibizione da prodotto = prodotto che compete con il S al sito attivo formando EP. ATTIVITA’ ENZIMATICA = misura della variazione di concentrazione di reagente o prodotto nel tempo. Misurata in unità di attività (UA) come la quantità di E utile per trasformare una micromole di S in P al minuto (a pH e [S] ottimali). Attività specifica =unità di enzima per mg di proteina (maggiore quanto maggiore è la purezza dell’enzima). Attività molecolare =unità per micromole di E alla [S] ottimale, cioè il numero di molecole di substrato trasformate per minuto per molecola di enzima Unità di misura in katal = quantità di E che trasforma una mole di S al secondo (si usano i sottomultipli come microkatal o nanokatal). Per l’attività specifica katal/kg di proteina. DOSAGGIO ATTIVITA’ ENZIMATICA Attività enzimatica dipendente da : T, pH, con. substrato, conc. cofattori. Le misure di attività vanno fatte in condizioni definite e controllate. Si sceglie una conc. di substrato saturante ([S] >10KM) dopo aver calcolato dalla Michaelis-Menten i valori di KM e Vmax. La misura della velocità iniziale Vo a pH e T ottimali dipende solo dalla [E]. Si aggiungono gli eventuali cofattori indispensabili per la catalisi. La commissione internazionale ha suggerito di usare la T=25°C e nei paesi tropicali 37°C. I metodi analitici più usati per il dosaggio misurano l’assorbanza del S o preferibilmente P nel tempo. Accanto ai dosaggi ottici esistono metodi fluorimetrici, manometrici, polarografici o radioattivi per dosare l’attività enzimatica. L’attività specifica è più utile di quella totale se si desiderano seguire le fasi di purificazione dell’E da una matrice reale. specificità substrati reazioni complementarietà strutturale mutuo riconoscimento modulazione dell’attività quantità di proteina enzimatica regolazione REGOLAZIONE E CONTROLLO DELL’ATTIVITA’ ENZIMATICA Enzimi regolatori sono capaci di modulare la attività catalitica in risposta di certi segnali. Nei metabolismi possono lavorare insieme in modo sequenziale, ma almeno uno determina la velocità complessiva catalizzando la reazione più lenta (enzima regolatore). In molti sistemi multienzimatici il I enzima di ogni sequenza è un enzima regolatore. Regolazione: 1.Allosterica (azione mediante altra forma assunta per il legame reversibile con un metabolita regolatore detto modulatore). 2.Modificazione da legame covalente (gruppi chimici modificanti AMP, P, gruppi metili legati covalentemente all’E) Queste due classi di enzimi sono proteine a struttura quaternaria che spesso non ha sulla stessa subunità sito attivo e sito regolatore. Quando il substrato si comporta da modulatore l’enzima è detto omotropico se si tratta di molecola diversa eterotropico. Gli E regolatori non seguono il modello di Michaelis e Menten con andamento a sigmoide invece che iperbolico della curva Vo –[S] dovuto a interazioni cooperative tra le subunità dell’E. Regolazione della glicogeno fosforilasi mediante modificazioni covalenti MECCANISMI DI INDUZIONE E REPRESSIONE Regolazione della produzione concentrazione di E Meccanismi di sintesi proteica rispetto alla produzione di E nelle diverse condizioni metaboliche: 1. Enzimi costitutivi= prodotti a v costante (C costante) indipendentemente dallo stato metabolico dell’organismo permanentemente presenti nella cellula 2. Enzimi inducibili = prodotti in c.n. in piccolissime quantità, ma con produzione aumentata in risposta a speciali sostanze (es. bgalattosidasi per E. coli) La repressione può essere indotta da particolari sostanze che fanno scomparire dal corredo enzimatico alcuni enzimi coinvolti nella sintesi dell’E in questione Interessano i processi di sintesi proteica e coinvolgono fenomeni a livello genetico e sono esempi di risparmio energetico . ZIMOGENI= PRECURSORI INATTIVI DI MOLTI ENZIMI La loro attivazione avviene con scissione proteolitica di una parte di essi (es.chimotripsina e tripsina) ISOENZIMI= FORME MULTIPLE DI ENZIMI CHE DIFFERISCONO IN COMPOSIZIONE DI a.a. Catalizzano la stessa reazione con diversa cinetica (Km e Vmax) come la lattico deidrogenasi (5 isoenzimi) ENZIMI NEL TERRENO Sono prevalentemente liberi ed extracellulari e possono rimanere stabili ed attivi per migliaia di anni. Nel suolo esiste attività catalitica inorganica ed enzimatica, ma quest’ultima è molto più efficiente e eliminabile con trattamenti termici energici (110-150 °C per 15-30 h per una distruzione totale) Due grandi categorie 1. E cellule proliferanti 2. E accumulati (liberi o immobilizzati) Per distinguere tra gli accumulati e i proliferanti può usare un agente sterilizzante (toluene o ossido di etilene o radiazioni UV) che estinguono l’attività microbica, ma non modificano quella degli esoenzimi. Nel suolo 4 classi di E: •Ossidoreduttasi •Idrolasi •Liasi •Transferasi La prime due sono predominanti Polisaccaridasi e proteinasi (idrolasi) demoliscono macromolecole come carboidrati e proteine e sono essenziali per i cicli biologici di C e N. Fosfatasi e solfatasi (idrolasi extracellulari) producono P e S nutrienti per le piante. Altre idrolasi demoliscono fitofarmaci e xenobiotici. Deidrogenasi (ossidoreduttasi intracellulari) danno informazioni sull’attività biologica delle popolazioni microbiche. E del suolo usati come indicatori di fertilità Nel suolo c’è una correlazione tra sostanze umiche e attività enzimatiche ( attività esterasica prop. al contenuto di S.O.) Le attività enzimatiche decrescono nel profilo del terreno più rapidamente della S.O. L’attività degli enzimi nel terreno riguarda alcune delle più importanti trasformazioni nel ciclo di C, N, P, S. Il terreno ad es. contiene ureasi (da animali attraverso il ciclo dell’urea), che condiziona la fertilizzazione ureasica. Le attività enzimatiche nel suolo possono essere considerate come indici di fertilità.Ogni tipo di terreno può essere caratterizzato per il suo patrimonio in attività enzimatica, che si mostra efficiente anche quando le condizioni ambientali sono proibitive per i microorganismi e, in casi limite, può aiutare la ripresa vegetativa per la piante e l’avvio delle attività microbiche col ripristino delle condizioni favorevoli. ENZIMI IMMOBILIZZATI Nel terreno esistono attività enzimatiche extracellulari associate a costituenti colloidali organici (humus) ed inorganici (argille e ossidi) del suolo. Gli E vengono trasformati da catalizzatori omogenei in eterogenei. L’immobilizzazione di un enzima comporta una diminuzione dei gradi di libertà rispetto ed E libero. Tuttavia in vari settori farmaceutici ed industriali gli E immobilizzati risultano efficienti catalizzatori specifici eterogenei. E immobilizzato: •Può essere riusato •Può essere usato in processi continui •Può presentare minor sensibilità ad agenti disattivanti •Può essere preparato per usi particolari Effetti dell’immobilizzazione Svantaggi -Cambi di conformazione che possono rendere il sito attivo meno accessibile -Riduzione della concentrazione effettiva dell’enzima -Effetti microambientali di diversità di intorno del sito attivo rispetto alla soluzione E immobilizzato ha una più alta Km, diversa specificità di substrato, diverso optimum di pH e T. Vantaggi Maggiore resistenza termica Maggiore resistenza proteolitica, agli inibitori ed ai Me pesanti Possibilità di riutilizzo + volte con separazione ed allontanamento dei prodotti di reazione. Le conoscenze sugli E immobilizzati ha consentito applicazioni tecnologiche e preparazione di modelli simulando sistemi reali in piante, terreno e acque per interpretare osservazioni sperimentali e migliorare le conoscenze di base. E di sistemi multienzimatici, specie se associati a membrane cellulari possono essere considerati esempi di enzimi immobilizzati che operano su sistemi viventi. INTERAZIONI TRA E DEL SUOLO E RESIDUI FITOFARMACI Dipendono da · · · · Natura e dose del composto Tipo di enzima Tipo di terreno Condizioni ambientali Si possono avere tre situazioni: •1. Attività enz. aumenta dopo il trattamento (prodotto usato da alcune classi di microorg.) •2. Attività enz. inalterata (terreno biologicamente morto può conservare attività enz.) •3. Attività enz. ridotta o annullata dal trattamento (conseguenze agronomiche serie) Le tre situazioni possono verificarsi contemporaneamente per le diverse attività enzimatiche. Anche operando solo su alcuni enzimi un erbicida può alterare l’equilibrio del corredo enzimatico del suolo con riflessi più o meno pronunciati su tutto l’ecosistema.
Scaricare