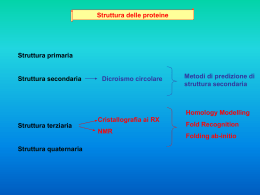
CORSO DI LAUREA SPECIALISTICA IN BIOTECNOLOGIE DEL FARMACO AA 2010-11 Adriana Maggi LEZIONE 9 Ingegneria cellulare II Applicazioni dell’ingegneria cellulare. Analisi struttura funzione delle proteine eucariote RICERCA DI BASE APPLICAZIONI INDUSTRIALI Riconoscimento della funzione di una proteina (oncogeni, geni oncosoppressori) Studio della regolazione dell’espressione genica. Analisi di mutazioni di elementi cis e trans Screening di molecole farmacologicamente attive (HTS) Produzione di biofarmaci Biological reporter: molecules acting as surrogate, measurable, indicators of a given molecular event I geni reporter GENE VANTAGGI SVANTAGGI B-Galattosidasi (Batterica) Ben caratterizzata, stabile, rilevazione automatizzabile Presenza di attività endogena in cellule di mammifero, enzima tetramerico (risposta non lineare) Luciferasi (Lucciola) Alta attività specifica, mancanza di attività endogena (basso background) Richiede l’aggiunta di cofattore, O2, ATP. Fosfatasi alcalina (Umana) Proteina di secrezione, saggio colorimetrico molto sensibile. Elevata attività endogena in alcuni tipi cellulari. fluorescent proteins (GFP, varianti RFP, BFP) Monomerico, non richiede substrato, assente nei mammiferi, varianti con diversa l di fluorescenza. Bassa sensibilità per mancanza di amplificazione (non è una reazione enzimatica) fluorescent proteins La green fluorescent protein è una proteina naturale (prodotta dalla medusa Aequorea victoria) di piccole dimensioni (238 aa 26,9 kd) che se eccitata da una radiazione nel campo dell’ultravioletto (l 395 nm), ma anche del visibile (l 475 nm, colore blu) emette una radiazione di colore verde (505 nm) Osamu Shimomura Premio Nobel 2008 Fluoroforo di GFP è un tripepide Ser-deidroTyr-Gly che è ciclizzato: p-idrossibenzilidene-imidazolidone Nella struttura tridimensionale della GFP alcuni residui basici fanno ponti a idrogeno con atomi di ossigeno (His148 con Tyr66 e Gln94 o Arg96 con l’ imidazolidone.) stabilizzando il fluoroforo L’emissione di luce avviene tramite un meccanismo sequenziale di un processo autocatalitico in assenza di cofattori. La reazione inizia con una rapida ciclizzazione tra la Ser65 e la Gly67 per formare un intermediato (imidazolin-5-one) seguita da una reazione di ossidazione della Tyr66. La reazione è termosensibile, ma una volta prodotta la GFP è molto stabile. La proteina è stata cristallizzata e la sua struttura determinata. La GFP funziona in forma dimerica la struttura cilindrica è sostenuta da foglietti beta, le dimensioni del cilindro sono 30 Å di larghezza e 40 Å di lunghezza , segmenti ad alfa elica chiudono I cilindri da ambedue le parti e costituiscono lo scheletro per la formazione del fluoroforo che si trova al centro dei cilindri. Questa particolare struttura con fogietti beta esterni e alfa eliche interne forma una nuova classe di proteine denominata beta-can. Si tratta di una struttura molto stabile e difficilmente degradabile. La conoscenza della struttura ha permesso di generare una serie di mutanti, il primo dei quali è stata una muazione puntiforme (S65T) descritta da Roger Tsien nel 1995 che migliora le caratteristiche dello spettro di emissione (509 nm) con una fluorescenza più sostenuta e più stabile nel tempo e lo spostamento del picco di eccitazione a 488 nm. Negli anni a seguire, il gruppo di Tsien ha sviluppato una vastissima gamma di proteine fluorescenti (YFP, EBFP, EBFP2, citrine, Venus, ecc) Roger Tsien, premio Nobel 2008 Imaging dell’espressione genica attraverso i sistemi reporter. Le proteine fluorescenti (GFP e BFP). Citosol BFP Golgi GFP Luciferasi Le luciferasi sono una classe di enzimi ossidativi che agendo su un substrato specifico causano la produzione ( luciferasi di lucciola, e suoi derivati ricombinanti, Luc 2, ecc) ' (lucem ferre). luciferina + ATP → luciferil adenilato + PPi luciferil adenylato + O2 → ossiluciferina + AMP + fotoni Utilizzo di proteine bioluminescenti o fluorescenti per studi di funzione geniche, di correlazioni-struttura-funzione, studi di regolazione di espressione genica Lo studio della regolazione dell’espressione genica. I sistemi reporter X Elementi di regolazione trans Y Promotore Prodotto genico facilmente Z Gene reporter Elementi di regolazione cis quantizzabile Effetto di mutazioni specifiche sulla attività trascrizionale del recettore degli estrogeni ER activity (fold over basal) 4 3 NH2- A AF-1 DBD NH2- A AF-1 DBD D AF-2 F -COOH :wt :1-399 -COOH :182-599 F -COOH :S122-A DBD D AF-2 F DBD D AF-2 NH2- A AF-1 NH2- A AF-1 DBD D AF-2 F -COOH :C241/244-A NH2- A AF-1 DBD D AF-2 F -COOH :G525-R NH2- A AF-1 DBD D AF-2 F -COOH :L543/544-A 2 1 0 * ** ** ** Un esempio storico. L’analisi del promotore del gene tk del virus Herpes Simplex -100 GC -80 CCAAT -60 GC -40 -20 TATA +1 + + + + - Generazione di mutanti + + --+-+- Trascrizione in oociti di Xenopus laevis Analisi di Northern Studio di funzione genica: l’esempio della identificazione della funzione di Nip-2 e protimosina 16 h 24h bnip-2 expression associates to cell death 48h 20 c nip 0.5 nip 1.5 nip 2.5 nip2 mRNA Cell death (dead cells/dish)x 10 2 7 6 5 4 3 2 1 0 15 10 5 0 • Nip-2 pro-apoptotic activity is blocked by overexpression of Bcl-2 • mutants of nip-2 in the Bcl-2 binding domani fail to cause apoptosis Meda et al. 2001 0 1 4 16 24 48 Hours after Locke TRANSFEZIONE DI bnip2/PROT-A cDNA IN MCF-7 CELLS BNIP2 %survival apoptosi 100 BNIP2 CTRL 50 25 0 % proliferation proliferazione CTRL 75 CTRL BNIP2 200 150 100 50 0 CTRL BNIP2 STUDI DI STRUTTURAFUNZIONE Greene et al. EMBO reports 8, 6, 563–568 (2007) Structure of TFMPV-E2/ER ligandbinding domain. (A) The structure of one monomer of ER is shown as a ribbon diagram, with the bound GRIP1 coactivator peptide coloured red. The compound is shown in a stick representation, with carbon atoms coloured green, oxygen atoms coloured red and fluorine atoms coloured pink. (B) A stereo view of part of the ligand-binding pocket bound to oestradiol (top panels; Protein Data Bank code 1ERE), or TFMPV-E2 (bottom panels). The ligands are coloured green and are shown in a stick representation. (C) TFMPV-E2 is shown in a 2F o–F c electron density map, contoured to 1.5 . ER , oestrogen receptor ; GRIP, glutamate receptor interacting protein; TFMPV-E2, trifluoromethyl-substituted phenylvinyl oestradiol compound Greene et al. EMBO reports 8, 6, 563–568 (2007) Applicazioni dell’ingegneria cellulare. Analisi struttura funzione delle proteine eucariote RICERCA DI BASE APPLICAZIONI INDUSTRIALI Riconoscimento della funzione di una proteina (oncogeni, geni oncosoppressori) Studio della regolazione dell’espressione genica. Analisi di mutazioni di elementi cis e trans Screening di molecole farmacologicamente attive (HTS) Produzione di biofarmaci Screening di molecole farmacologicamente attive. ER cDNA LUC Potenziali ligandi ER ER LUC LUC Units ERE CTR E2 CTR High-throughput Screening (1) La possibilità di automatizzare la detezione del reporter consente uno screening ad “alto flusso”. Library di molecole Saggio biologico automatizzabile Piattaforma Robotizzata Elaborazione digitale dei dati High-throughput Screening (2) 1990. 20 ricercatori 1.5 milioni di molecole/anno Oggi. 4 ricercatori 2.5 milioni di molecole/anno I più moderni saggi di screening consentono la determinazione della POTENZA e della SPECIFICITA’ della sostanza testata. Applicazioni dell’ingegneria cellulare. Analisi struttura funzione delle proteine eucariote RICERCA DI BASE APPLICAZIONI INDUSTRIALI Riconoscimento della funzione di una proteina (oncogeni, geni oncosoppressori) Studio della regolazione dell’espressione genica. Analisi di mutazioni di elementi cis e trans Screening di molecole farmacologicamente attive (HTS) Produzione di biofarmaci Produzione di biofarmaci La produzione delle proteine terapeutiche in microorganismi non è sempre possibile soprattutto per le modificazioni post-traduzionali L’utilizzo di cellule animali consente di ottenere prodotti proteici strutturalmente più simili al fisiologico, ma pone serie difficoltà tecniche e costi più elevati. IMPIANTO DI FERMENTAZIONE PER LA PRODUZIONE DI PROTEINE TERAPEUTICHE Difficoltà nella produzione di biofarmaci Istituzione di Master cell banks caratterizzate in dettaglio per stabilità genetica, tempi di crescita, contaminazioni, numero di copie del vettore, livello di espressione del transgene. Preparazione di Manufacturers cell banks sottoposte ad ulteriore caratterizzazione prima e dopo il caricamente nell’impianto pilota Controllo su larga scala della stabilità nelle condizioni di fermentazione, con la preparazione di Extended cell banks. Controllo delle condizioni di produzione Recupero e produzione Caratterizzazione del prodotto CONTROLLO QUALITA’ Controllo di qualità di proteine terapeutiche Caratterizzazione della proteina Determinazione dello stato di purezza Saggio biologico SDS PAGE/Western Saggio immunologico HPLC SDS PAGE Western Presenza di proteine seriche Isoelectrofocusing Presenza di proteine cellulari HPLC Presenza pirogeni Mappa peptidica Presenza di DNA cellulare Sequenziamento N-terminale Spettrometria di massa Composizione in carboidrati Composizione in acido sialico TPA ricombinante Il primo farmaco ricombinante prodotto in cellule di mammifero Cellule CHO (Chinese Hamster Ovary) Pregressa conoscenza nella produzione di vaccini Assenza di attività tossica per l’uomo Stabile integrazione di geni eterologhi Crescita in sospensione o monostrato Modificazioni post-traduzionali corrette Alcuni esempi di proteine terapeutiche in commercio TPA Insulina Interferone alfa hGH IL-2 G-CSF FSH Interferone beta Eritropoietina Glucocerebrosidasi Fattore VII E.Coli, CHO E.Coli E.Coli E.Coli E.Coli E.Coli CHO CHO CHO CHO BHK (Baby Hamster Kidney cells)
Scaricare