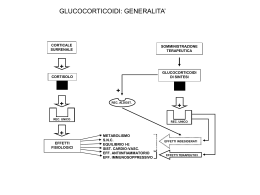
LA TERAPIA IMMUNOSOPPRESSIVA Dalla terapia empirica alla terapia biologica • La nostra comprensione dei meccanismi che regolano la funzione immunitaria è abbastanza sofisticata, ma la comprensione dei fattori che scatenano e sostengono la maggior parte delle malattie infiammatorie reumatiche è rimasta a lungo rudimentale. • I trigger immunologici delle malattie reumatiche ed i meccanismi funzionalmente rilevanti dei farmaci immunosoppressori erano poco caratterizzati e così la terapia ha avuto un’evoluzione empirica piuttosto che in modo mirato, basato su un’ipotesi patogenetica Una migliore comprensione della patogenesi delle malattie autoimmuni insieme ad un notevole avanzamento biotecnologico ha migliorato la nostra capacità di usare agenti biologici per colpire selettivamente elementi patogenetici appropriati della risposta immune senza causare una immunosoppressione generalizzata B cell T cell Macrophage Synoviocyte Cytokines Increased cytokine production (IL-1, IL-6) Increased adhesion molecules Increased production of MMP Increased inflammation Cell migration Tissue remodeling Cytokines involved are: GM-CSF, IFN-, IL-1β, IL-6, IL-8, IL-10, IL-12, IL-15, IL-2, IL-17, TGF-β, TNF. GM-CSF = granulocyte-macrophage colony-stimulating factor. Cytokine Network Macrophage IL-15 GM-CSF M-CSF TNF- Fibroblast IL-10 IL-1Ra FGF IL-8 IL-6 GM-CSF IL-1 TNF- Adhesion molecule expression IL-1 TNF- HLA-DR Complement Metalloproteinases Firestein GS. In: Rheumatology. 2nd ed. 1998:5.13.1-5.13.24. Metalloproteinases Prostaglandins Complement Reclutamento dei linfociti T nella cute psoriasica IL-8 RANTES MIP-3 CTACK IP-10 MCP-1 MDC IL-1 TARC TNF- Attivazione cellule endoteliali E-selettina TARC MIP-3 CTACK MCPs ICAM-1 VCAM-1 Fractalkine CCR4 CCR6 CCR10 CL A 1. Rotolamento e adesione iniziale LFA-1 (CD18/CD11a) 4b1 CX3CR1 2. Attivazione integrine e adesione stabile 3. Migrazione transendoteliale Vaso dermico Stimolo Biologia del TNF- TNF- di membrana 26kDa nucleo TNF- solubile TACE sTNF-R1 TNF-R1 (p55) 17kDa monomero trimero nucleo 3’-AU-mRNA TACE dimero (ADAM17) Trasferimento del ligando TNF- trimero TNF-R2 sTNF-R2 TACE (p75) Farmaci immunosoppressori convenzionali Glucocorticoidi Agenti alchilanti Antimetaboliti Inibitori della calcineurina Antimalarici Sulfasalazina GLUCOCORTICOIDI • Gli effetti dei glucocorticoidi (GCS) sono mediati dal legame ai recettori citoplasmatici dei GCS nelle cellule bersaglio • I recettori per i GCS, che sono espressi in quasi tutti i tipi di cellule umane, ivi compresi linfociti, moniciti e polinucleati, sono membri di una superfamiglia di recettori per altri ormoni steroidei, come gli estrogeni e la vitamina D • I GCS si legano ai recettori glucocorticoidi (GR) del citosol, che sono associati a due molecole di heat shock protein 90 (Hsp90) GLUCOCORTICOIDI • Il complesso GCS-GR trasloca nel nucleo e si lega ai glucocorticoid response elements (GRE ed nGRE) nelle sequenze promoter dei geni bersaglio, dando come risultato un’aumentata (GER) o dimunuita (nGRE) trascrizione • I GR attivati inoltre interagiscono con altri fattori di trascrizione • I GCS dimunuiscono l’attività del nuclear factor kB attraverso l’aumentata trascrizione del suo inibitore, IkB • I GCS inoltre regolano eventi post-trascrizionali, di sintesi proteica e di secrezione GLUCOCORTICOIDI • I GSC sopprimono l’infiammazione attraverso la riduzione dell’essudato infiammatorio, la riduzione della produzione di mediatori infiammatori, la riduzione del reclutamento di cellule infiammatorie nel sito di infiammazione e la ridotta attivazione delle cellule infiammatorie. In generali i GCS sopprimono in maggior misura l’imunità cellulare rispetto a quella umorale • INIBIZIONE DELLA SINTESI DI PROSTAGLANDINE attraverso la stimoalzione di lipocortina-1, che inibisce la sintesi di eicosanoidi GLUCOCORTICOIDI • I GCS inibiscono la trascrizione di TNF-, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-8, IFN-, GMCSF. Non ne riducono solo la sintesi, ma riducono indirettamente la loro azione contrastando gli effetti dei fattori di attivazione trascrizionale, come AP-1 • I GCS inibiscono l’espressione delle molecole di adesione, come ICAM-1 ed ELAM-1, sia direttamente che attraverso l’inibizione di citokine come TNF- ed IL-1 • I GCS inducono la sintesi di ACE ed endopeptidasi che degradano la bradikinina: diminuiscono la permeabilità vascolare; inibiscono l’isoenzima inducibile NO-sintasi GLUCOCORTICOIDI neutrofili numero, traffico, funzione relativamente inalterata macrofagimonociti eosinofili numero, traffico, fagocitosi ed effetto battericida, inibizione della presentazione dell’Ag, release citokine, release eicosan numero, traffico, produzione di citokine, proliferazione e attivazione compromessa, scarso effetto su sintesi Ig numero, apoptosi basofili numero, rilascio di mediatori linfociti GLUCOCORTICOIDI • Buon assorbimento orale, intramuscolare, intrasinoviale, cutaneo. La somministrazione con il cibo ritarda il picco di concentrazione, ma non influisce sulla biodisponibilità • Eliminazione prevalentemente epatica: idrossilazione, coniugazione, escrezione con le urine • La differenza di emivita plasmatica fra i diversi GCS è minima • E’ notevole invece la differenza tra la potenza e la durata degli effetti biologici GLUCOCORTICOIDI • I GCS si possono dividere, in base alla durata dell’efftto biologico in: • SHORT-ACTING (8-12 ore): cortisolo e cortisone • INTERMEDIATE-ACTING (12-36 ore): prednisone, prednisolone e methylprednisolone • LONG-ACTING (36-72 ore): desametasone GLUCOCORTICOIDI farmaco Idrocortisone Potenza GC Potenza MC Dose equiv. mg 1 1 20 Cortisone 0.8 0.8 25 Prednisone 4 0.8 5 Prednisolone 4 0.8 5 Mprednisolone 5 0.5 4 Desametasone 25-30 0 0.7 GLUCOCORTICOIDI • I GCS sono indicati nel trattamento della maggior parte delle malattie autommunireumatologiche. • Nell’artrite reumatoide (ed altre artriti infiamatorie) la dose di GCS da utilizzare è generalmente bassa ( 10 mg/die Pd equivalente) • In caso di LES, Vasculiti sistemiche, Polimiosite (ma non nella Sclerosi sistemica o nella sindrome di Sjogren non complicata da vsaculite) la dose iniziale è in genere = 1 mg/Kg/die GLUCOCORTICOIDI • Un problema maggiore, ormai dal punto di vista storico, è costituito dall’uso prolungato di dosi elevate di GCS. Attualmente si cerca di ovviare a questo problema: – Associando allo steroide un farmaco immunosoppressore, quando se ne preveda l’uso prolungato (> 10 mg/die per > 60 giorni) – Iniziando il tapering dello steroide dopo 2-4 settimane di terapia e cercando di arrivare ad una dose equivalente di 15 mg die entro 2-3 mesi . GLUCOCORTICOIDI • Il trattamento con dosi elevate e pulsate di GCS è utilizzato , in genere in combinazione con altri immunosoppressori, per trattare serie complicanze del LES (nefrite, interessamento SNC), o delle vasculiti • I dati che ne suggeriscono l’efficacia derivano largamente da studi non controlati • I vantaggi sono costituiti dalla assenza di soppressione dell’asse ipotalamo-ipofisi-surrene e di sviluppo di osteoporosi GLUCOCORTICOIDI • La terapia pulsata che prevede la somministrazione di 1 g di Methylprednisolone per 3 giorni consecutivi determina una risposta clinica che dura 4-12 settimane (esistono schemi che utilizzano dosi inferiori) • Questo schema è generalmente sicuro se il farmaco viene infuso lentamente (1-2 ore). Complicanze possibili: serie aritmie, , flushing, aumento PA, cefalea, iperglicemia GLUCOCORTICOIDI • La somministrazione intramuscolare di un GC long-acting (Mpd acetato) determina una bassa concentrazione di GC circolante per alcune settimane e rappresenta una modalità alternativa di trattamento dei flares di malattie infiammatorie rispetto alla somministrazione orale seguita da tapering graduale • Questo tipo di terapia può essere utilizzato anche negli attacchi acuti di gotta, in alternativa all’indometacina GLUCOCORTICOIDI • La somministrazione di GCS a durata d’azione intermedia a giorni alterni sembra efficace nel ridurre alcuni effetti colaterali, come il ritardo di crescita nei bambini, la minor inibizione dell’asse HPA, la riduzione delle manifestazioni cushingoidi. Tuittavia non previene l’osteoporosi. • Il trattamento a giorni alterni va riservato alle fasi di stabilità di malattia • Nella maggioranza dei pazienti tuttavia la somministrazione quotidiana di GCS è più efficace GLUCOCORTICOIDI • La somministrazione di GCS intraarticolare e nei tessuti molli è piuttosto utilizzata dai reumatologi, in particolare nel trattamento delle forme oligoarticolari GLUCOCORTICOIDI • Una copertura supplementare con GCS deve essere considerata in ogni paziente che abbia ricevuto un trattamento steroideo di durata > di alcune settimane nel corso dell’anno precedente in caso di chirurgia o situazione di malattia severa • La secrezione fisiologica di cortisolo in corso di chirurgia maggiore è approssimativamente par a 75-150 mg/die • La dose di idrocortisone comunemente somministrata è di 100 mg con l’induzione anestetica seguita da 100 mg ogni 6 hr per 72 hr GLUCOCORTICOIDI • I glucocorticoidi orali a bassa dose (<10mg Pd o equivalente) o l’iniezione locale sono molto efficaci e rapidi nel controllo dei sintomi nell’ AR. Molti pazienti sono funzionalmente dipendenti dai GC e li continuano a lungo termine • Recenti evidenze suggeriscono che basse dosi di GC riducono la velocità di progressione del danno radiologico e quindi sembrano avere un potenziale azione di fondo GLUCORTICOIDI • Effetti collaterali della terapia con GCS • IMMUNOLOGICI: – Aumentata suscettibilità alle infezioni, ridotta risposta infiammatoria, ridotta ipersensibilità ritardata, linfopenia • MUSCOLOSCHELETRICI – Osteoporosi complicata da fratture, necrosi avascolare, miopatia • GASTROINTESTINALI – Ulcera peptica in combinazione con FANS, pancreatite GLUCORTICOIDI • CARDIOVASCOLARI – ipertensione., ritenzione di liquidi, ATS accelerata • DERMATOLOGICI – Acne, irsutismo, strie rubre, fragilità cutanea, ecchimosi • NEUROPSICHIATRICI – Alterazioni dell’umore, labilità emotiva, euforia, insonnia, depressione, psicosi • OFTALMOLOGICI – Cataratta, glaucoma GLUCORTICOIDI • ENDOCRINO-METABOLICHE – Intolleranza al glucosio, diabete mellito, coma diabetico, aumento di peso, iperlipoproteinemia, redistribuzione del grasso – bilancio azotato negativo, soppressione della crescita, atrofia muscolare, danneggiata capacità di guarigione delle ferite – ritenzione di Na ed acqua, aumentata eliminazione di potassio, alcalosi ipokaliemica – impotenza, irregolarità mestruali, soppressione dell’asse ipotalamo-ipofisi-surrene, insufficienza corticosurrenalica acuta (crisi addisoniane) GLUCORTICOIDI • I pazienti che assumono Prednisone alla dose 5 mg/die hanno un aumentato rischio di osteoporosi e devono essere sottoposti a MOC regolarmente • I pazienti trattati con GC devono assumere 1500 mg di Ca/die + 400-800 U di vit D: • Considerare terapia estrogenica nelle donne e bisfosfonati CICLOFOSFAMIDE • E’un agente alchilante del DNA: determinando un cross-linking del DNA ne altera la sintesi e provoca la morte cellulare • La ciclofosfamide è inattiva: il principale metabolita attivo è la mostarda fosforamide • La ciclofosfamide ha un effetto marcato non solo sulle cellule in rapida replicazione, ma su tutto il il ciclo cellulare e determina un’alterazione della maggior parte delle risposteimmuni cellulari ed umorali • Determina dei linfociti T e B, della proliferazione linfocitaria, della sintesi di Ig, soppressione della ipersensibilità ritardata per nuovi antigeni CICLOFOSFAMIDE • La somministrazione orale od ev della ciclofosfamide comporta concentrazioni plasmatiche simili • La ciclofosfamide è rapidamente metabolizzata a livello epatico (attraverso il citocromo P-450) e l’emivita dei metaboliti attivi è di 2-8 ore • La ciclofosfamide è eliminata prevalententemente nelle urine, per la maggior parte come metaboliti inattivi: tuttavia il 10-20% è eliminato come molecola inalterata ed alcuni metaboliti attivi sono presenti nelle urine • La malattia epatica non influenza la citotossicità della ciclofosfamide • In caso di IRC la dose viene ridotta in base all’entità del danno renale e viene regolata in base a tossicità ed efficacia CICLOFOSFAMIDE • EFFETTI AVVERSI • EMATOLOGICI – Mielosoppressione reversibile: frequente la leucopenia: modesta piastrinopenia. L’uso a lungo termine aumenta l’effetto mielosoppressore. Attenzione ad allopurinolo che aumenta l’emivita di ciclofosfamide e la frequenza della leucopenia • INFETTIVI – Le infezioni sono una comune e potenzialmente seria complicanza del trattamento con ciclofosfamide: sono più frequenti con il trattamento orale rispetto a quello ev pulsato CICLOFOSFAMIDE • UROLOGICI – Tossicità vescicale: cistite emorragica e cancro vescicale correlati alla via di somministrazione, dose cumulativa durata di terapia. Dovuta principalmente al metabolita Acroleina, che viene legato dal Mesna (utile solo in caso di somministrazione ev di ciclofosfamide). Rischio di cancro, calcolato su casistiche di pazienti trattati per os, aumentato di 31 volte. Il tumore si è sviluppato da 7 mesi a 15 anni dopo l’inizio di terapia. I fumatori hanno sono più a rischio sia per la cistite che per il cancro CICLOFOSFAMIDE • ONCOLOGICI – Aumenta il rischio di neoplasie (diverse da ca vescica) di 2-4 volte: più comuni npl cutanee, orofaringee, mieloproliferative. Il rischio aumenta con la dose cumulativa (forse < frequenti con trattamento ev) • RIPRODUTTIVI – Tossicità gonadica: insufficienza ovarica, il cui rischio aumenta con l’età della paziente e con la dose cumulativa. Azospermia frequente nei pazienti trattati con ciclofosfamide per neoplasie: poche informazioni nei pazienti trattati per malattie autoimmuni CICLOFOSFAMIDE • POLMONARI – La tossicità polmonare si presenta in < dell’1% dei pazienti trattati. Una forma precoce di polmonite, che si verifica dopo 1-6 mesi di trattamento risponde lla sospensione del trattamento ed alla somministrazione di steroidi. Una forma più insidiosa e tardiva da in genere luogo a fibrosi polmonare, dopo 1-13 anni di terapia per os • MISCELLANEA – Teratogenicità, alopecia, cardiotossicità (rara), inappropriata secrezione ADH, ipersensibilità CICLOFOSFAMIDE • INDICAZIONI CLINICHE – – – – – – – – Vasculiti sistemiche Nefrite lupica Interessamento SNC in LES Manifestazioni severe del LES Alveolite interstiziale in sclerosi sistemica Vasculite reumatoide Sindrome di Good-Pasture Vasculiti isolate del SNC CICLOFOSFAMIDE • DOSI E VIA DI SOMMINISTRAZIONE – Per os: 2 mg/Kg/die. 3-5 mg/Kg/die per 2-3 giorni in pazienti con manifestazioni severe di malattia. Riduzione della dose del 25-50% se IRC. La dose viene aumentata di 25 mg ad intervalli di 1-2 settimane se la malattia è attiva: aggiustare la dose per evitare GB < 3000/mm3 – EV: 0.5-1 g/m2 ogni 4 settimane (in 30-60’). Dose ridotta del 30% se filtrato glomerulare < 1/3 del normale. Aumentare la dose del 25% se GB al nadir > 4000/mm3. Diminuire la dose del 25% se GB al nadir >1500. Utilizzo di Mesna e di antiemetici AZATIOPRINA • E’ un analogo purinico ed è un anti-metabolita ciclospecifico. Azatioprina è rapidamente convertita a 6mercaptopurina, di cui è il profarmaco • E’ un farmaco molto utilizzato come immunosoppressore sia nei trapianti che nelle malattie autoimmuni • L’esatto meccanismo immunosoppressore dei metaboliti attivi tiopurinici non è noto. L’inibizione della sintesi ex-novo delle purine è importante nella riduzione della proliferazione cellulare, mentre l’incorporazione dei nucleotidi tioguanidici nel DNA determinerebbe la citotossictà AZATIOPRINA • • • • • Riduce il numero dei linfociti circolanti soppprime la proliferazione linfocitari Inibisce la produzione di Ig Inibisce la proliferazione dei monociti Sopprime l’attività delle cellule naturalkiller • Inibisce l’immunità cellulo-mediata ed umorale AZATIOPRINA • Azatioprina è utilizzata nel trattamento di diverse malattie autoimmuni: – LES: come terapia di mantenimento nella nefrite lupica (dopo induzione di remissione con ciclofosfamide): come farmaco steroid-sparing – Vasculiti sistemiche: in genere come farmaco di mantenimento – Miositi – Malattia di Behcet • Dosaggio: all’inizio 50 mg/die: aumento della dose a 2-2.5 mg/Kg/die dopo 1-2 settimane (oppure aumento di 25 mg ogni 1-2 settimane) AZATIOPRINA • Il metabolismo di azatioprina è complesso ed avviene principalmente attraverso gli enzimi xantino-ossidasi e thiopurinametil-transferasi (TPMT): l’inibizione di xantino-ossidasi (ad es. con allopurinolo) o una bassa attività di TPMT (genetica) determina l’accumulo di metaboliti tossici e quindi una > tossicità. • In caso di ridotta funzionalità renale raccomandata una modesta riduzione della dose • E’ presente un metabolismo placentare del farmaco AZATIOPRINA • Una delle più importanti e talvolta fatali interazioni farmacologiche è rappresentata dall’interazione tra allopurinolo ed azatioprina, attraverso l’inibizione dell’inattivazione di 6-MP mediata della xantino-ossidasi. • In caso di necessità di utilizzo combinato dei due farmaci è consigliata una riduzione del 70% circa della dose di azatioprina ed un attento monitoraggio dell’emocromo • Uso combinato di azatioprina e sulfasalazina mielotossicità AZATIOPRINA • EFFETTI AVVERSI – Mielosoppressione: poco comune mielosoppressione severa che in genere è causata da scarsa o assente attività di TPMT (genetica). L’esordio è acuto ma ritardato (in media dopo 4-10 settimane dall’inizio della terapia) – Gastrointestinali: nausea, vomito e diarrea. Lieve aumento delle transaminasi nel 5-10% dei pazienti: raramente severa colestasi, malatti veno-occlusiva epatica, iperplasia nodulare epatica AZATIOPRINA • EFFETTI AVVERSI – Neoplasie: i dati al riguardo sono discordanti. Alcuni studi segnalano un rischio aumentato in particolare di malattie linfoproliferative – Ipersensibilità: sindromi acute caratterizzate da shock, febbre, rash, pancreatite, insufficienza renale ed epatite: sono molto rare e precoci (dopo circa 2 settimane di terapia) – Infezioni: meno frequenti rispetto a quanto si verifica in corso di terapia con agenti alchilanti LEFLUNOMIDE (ARAVA) • Inibisce la sintesi de novo dei nuclerotidi pirimidinici (nella fase G1 tardiva della replicazione cellulare) = azione anti-proliferativa delle cellule mononucleate in fase di replicazione attiva • Nei linfociti attivati è indispensabile il ricorso alla sintesi de novo di purine e pirimidine • Leflunomide (LEF) è un farmaco immunomodulante di tipo citostatico e non citotossico LEFLUNOMIDE • Inibizione dell’espressione dei recettori cellulari di membrana per IL-2 • Inibizione del fattore di trascrizione nucleare NF-B, indotto da TNF- • Inibisce la proliferazione delle cellule B mediante riduzione della chinasi 2-ciclina dipendente • Inibizione dell’induzione di ciclo-ossigenasinei PMN attivati ed inibizione produzione di radicali liberi nei mononucleati del sangue periferico LEFLUNOMIDE • Dosaggio: 20 mg/die in singola dose (se non tollerato 10 mg/die) • Tossicità Teratogenicità Epatotossicità • Effetti collaterali diarrea, alopecia, rash, cefalea rischio teorico di immunosoppressione infezioni LEFLUNOMIDE • Valutazione basale crasi ematica funzionalità epatica (lunga emivita di LEF, ricircolo enteroepatico: ostruzione dele vie biliari, malattie epatiche, epatite virale immunodeficienza severa sono controindicazioni al trattamento funzionalità renale gravindex (nelle donne fertili che non usino mezzi contraccettivi adeguati) LEFLUNOMIDE • Monitoraggio: come per MTX • Se persistente di AST o ALT (>2-3 volte) sospendere il farmaco ed eseguire wash-out con colestiramina: ev. biopsia epatica • Wash-out con colestiramina prima di tentare il concepimento LEFLUNOMIDE • Trials clinici controllati randomizzati hanno stabilito che LEF costituisce un’alternativa alla monoterapia con MTX, specie per i pazienti che non tollerano MTX o che non hanno avuto una buona risposta ad MTX • La riduzione dell’attività di malattia e della progressione radiologica è equivalente a quella ottenuta con dosi moderate di MTX • LEF può essere utilizzata in combinazione con MTX in assenza di risposta clinica completa con dosi piene di MTX MICOFENOLATO • Il Micofenolato Mofetile è ampiamente utilizzato nel trapianto d’organi, ma trova attualmente alcune importanti indicazioni nella terapia delle malattie autoimmuni • E’ un profarmaco inattivo, idrolizzato in acido micofenolico • L’acido micofenolico inibisce la inosinomonofosfato deidrogenasi, enzima cruciale per la sintesi de novo delle purine MICOFENOLATO • I linfociti sono criticamente dipendenti dalla sintesi de novo delle purine e sono così un target relativamente selettivo del farmaco: ciò rende conto della capacità del faramco di inibire reversibilmente la proliferazione di linfociti T e B, senza mielotossicità • Il Micofenolato la sintesi di DNA, la proliferazione dei linfociti, la produzione di Ig MICOFENOLATO • Il micofenolato è rapidamente e completamente assorbito e de-esterificato ad acido micofenolico che è altamente legato alle proteine plasmatiche (98%) • L’emivita è di circa 16 ore • Sia le malattie renali che quelle epatiche hanno effetti minori sulla distribuzione dell’acido micofenolico ed un aggiustamento della dose in genere non è necessario MICOFENOLATO • La malattia autoimmune per la quale è più frequentemente utilizzato il micofenolato è il LES, in particolare – Nefrite lupica: il micofenolato appare sovrapponibile ad azatioprina nella terapia di mantenimento. Studi in corso ne dimostrerebbero la pari efficacia rispetto a ciclofosfamide nella induzione di remissione della nefrite – LES refrattario ad altre terapie immunosoppressive (manifestazioni cutanee ed ematologiche) – Arterite di Takayasu MICOFENOLATO • EFFETTI AVVERSI – Gastrointestinali • • • • Diarrea Nausea, vomito Addominalgie Aumentati livelli di enzimi epatici – Ematologici • Linfocitopenia – Neoplastici • Riporati alcuni casi di neoplasie cutanee e non METHOTREXATE • E’ un potente analogo dell’acido folico che inibisce competitivamente la diidrofolato reduttasi (antimetabolita) • Meccanismi d’azione: Inibizione della timidilato sintetasi inibizione prod. Ig Inibizione adenosino deaminasiaccumulo adenosinainibizione aderenza e chemiotassi dei PMN ed inibizione funzionalità di linfociti e monociti Inibizione proliferazione endoteliale e neoangiogenesi Riduzione produzione leucotrieni da parte di PMN Inibizione di attività di IL-1 (possibile legame competitivo con catena b di IL-1) METHOTREXATE • Dosaggio:7.5 – 20 mg/sett. OS o IM • Tossicità: Potenzialmente teratogeno fibrosi epatica , cirrosi (rare); aumento transaminasi mielosoppressione (rara) infiltrati o fibrosi polmonare (rara, ma severa) linfomi (rari, relazione non chiara) • Effetti collaterali Nausea, vomito, diarrea, stomatite (ridotti dalla somministrazione di ac. Folinico) alopecia (rara) Dispnea Linfoadenomegalia METHOTREXATE • Valutazione basale crasi ematica funzionalità epatica (sierologia per HBV ed HCV nei pazienti a rischio) funzionalità renale (80% del farmaco eliminato dal tubulo prossimale renale) radiografia del torace gravindex (nelle donne fertili che non usino mezzi contraccettivi adeguati) METHOTREXATE • Monitoraggio emocromo, creatininemia e transaminasi mensilmente per i primi 6 mesi, indi ogni 1-2 mesi. Se AST/ALT (< 2 volte) ripetere test entro 2-4 settimane Se AST/ALT (>2<3 volte) controllo ogni 2-4 settimane e riduzione della dose Se AST/ALT (>3 volte) in modo persistente sospendere il farmaco : ev. biopsia METHOTREXATE • Methotrexate farmaco di riferimento nella terapia dell’artrite reumatoide, ma usato anche: – – – – Artrite psoriasica Sindrome di FELTY Adult-Onset-Still-disease Vasculiti sistemiche (ANCA-associate, Takayasu, Horton) – Polimialgia reumatica (steroid-sparing agent) – Sclerosi sistemica METHOTREXATE • Studi clinici randomizzati hanno stabilito l’efficacia di MTX nella AR, in particolare nei pazienti con malattia severa • Studi longitudinali e trials randomizzati dimostrano che MTX ritarda la progressione delle erosioni radiologiche • Studi osservazionali indicano che > 50% dei paz. che assumono MTX continuano il farmaco oltre i 3 anni di terapia • A causa del favorevole profilo efficacia/tossicità, basso costo ed elevata tollerabilità MTX è considerato il farmaco di riferimento CICLOSPORINA • Polipeptide ciclico di 11 aa di origine fungina, altamente idrofobo. Eliminazione principalmente per via biliare. Assorbimento orale nettamente aumentato (+30-50%) con microemulsione preconcentrata (NEORAL) • Concentrazione plasmatica da farmaci che inibiscono citocromo P450 (eritromicina, ketoconazolo, estradiolo, Ca++antagonisti, alcool) • Il complesso ciclosporina-ciclofillina lega la calcineurina citoplasmatica inibendone l’attività blocco dei geni che codificano per IL-2, LI-2R ed inibizione funzionale dei linfociti T. Incrementa la sintesi di TGFb CICLOSPORINA • Dosaggio: 2.5 –4 mg/Kg /die in due dosi ogni 12 ore • Tossicità: Insufficienza renale: meccanismo non chiaro: di trombossano ed endotelina, prostaglandine Ipertensione arteriosa: compare in circa il 20% dei pazienti trattati per malattia autoimmune Controindicata se: insuff. renale, ipertensione arteriosa non controllata, immunodeficienza, marcate alterazioni funzionalità epatica. Attenzione alle condizioni preneoplastiche (es. sindromi mielodisplastiche, paraproteinemia) CICLOSPORINA • EFFETTI AVVERSI – – – – – Ipertricosi Ipertrofia gengivale Tremori-cefalea Sintomatologia dispeptica (lieve) Neoplasie: nei pazienti trattati con ciclosporina per trapianto aumentato rischio di eoplasie della pelle e di linfomi: non sufficienti i dati nei pazienti trattati per malattie autoimmuni CICLOSPORINA • INTERAZIONI CON FARMACI – Aumentano la concentrazione di ciclosporina • • • • Eritromicina Antifungini azolici (fluconazolo, itraconazolo, keto.) Diltiazem, verapamil, amlodipina Amiodarone, allopurinolo, danazolo – Diminuiscono la concentrazione di ciclosporina • Induttori degli enzimi epatici (rifampicina, fenitoina, barbiturici – Aumentano la tossicità renale di ciclosporina • Aminoglicosidi, chinolonici,amfotericina B, FANS, ACE inibitori CICLOSPORINA • Valutazione basale: – Emocromo – Creatininemia, uricemia – Funzionalità epatica – Pressione arteriosa La compromissione della funzione renale, pari al 20% circa, è quasi completamente reversibile con la sospensione del farmaco • Monitoraggio: creatininemia ogni 2 sett. Sino a dose stabile,poi ogni mese. Controllo di emocromo, funz, epatica, potassiemia CICLOSPORINA • In studi controllati la Ciclosporina A è risultata efficace, a breve termine, come monoterapia di fondo nell’artrite reumatoide • E’ efficace in terapia di combinazione con MTX ed OH clorochina • E’ efficace nel rallentare la progressione radiologica CICLOSPORINA • La ciclosporina viene utilizzata – Psoriasi – Artrite psoriasica – LES (manifestazioni cutanee,ematologiche e renale -s. nefrosica-, steroid sparing agent: non stidu controllati) – Polimiosite – M. di Behcet (manifetsazioni oculari9 – Pioderma gangrenoso – Vasculiti ANCA associate IDROSSICLOROCHINA • Antimalarico di sintesi • Assorbimento orale elevato, elevata affinità tissutale (in particolare per i tessuti ricchi di melanina). Metabolizzata dal fegato. Lunga emivita (40 gg) • Meccaniscmo d’azione: – Inibizione sintesi DNA – Accumulo endosomiale e pH vacuolare – Inibizione attività di PMN e monociti IDROSSICLOROCHINA • Dosaggio : 4-6 mg/Kg/die da assumere ai pasti • Tossicità:Danno maculare (correlata ed età ed a dosaggio. > con Clorochina) • Effetti collaterali: – Depositi corneali (aloni colorati) – Cicloplegia (dose-dipendente) – Rash maculopapulari nel 3-10% dei casi: richiedono la sospensione del farmaco – Leucopenia e piastrinopenia (rari) – Miopatia vacuolare (astenia-riduzione dei riflessi) IDROSSICLOROCHINA • Valutazione basale: nessuna salvo che il paz. Abbia > 40 anni o abbia una patologia oculare • Non indicato alcun monitoraggio, salvo comparsa di sintomi EFFICACIA • Numerosi studi ne hanno dimostrato il beneficio sintomatico, specie in pazienti con malattia lieve all’esordio. Da sola non rallenta la progressione radiologica. IDROSSICLOROCHINA • Le indicazioni cliniche della idrossiclorochina sono: – LES (malattia lieve, con interessamento cutaneo ed articolare) – LED ed SCLE (lupus eritematoso cutaneo subacuto) – Sindrome di Sjogren ( in particolare interessamento articolare) – Connettiviti indifferenziate – Artrite reumatoide SULFASALAZINA • Molecola di sintesi: sulfapiridina + ac.5aminosalicilico • Ridotto assorbimento intestinale (<30%), circolo enteroepatico ed escrezione biliare • Meccanismo d’azione: – – – – Metabolismo di prostaglandine Metabolismo folati e purine Metabolismo di citochine ed immunoregolazione Neoangiogenesi SULFASALAZINA • Dosaggio:1000 mg 2 –3 volte al giorno • Tossicità: Mielosoppressione (leucopenia) • Effetti collaterali: – Nausea, vomito, dispepsia (20% dei pz) – Cefalea, vertigine, s. depressiva, febbricola – Stomatite, rash, fotosensibilità, dermatiti esfoliative – Alterazioni di citonecrosi e colestasi epatica (rari e di modesta entità) • Controindicazione: deficit di G6PDH SULFASALAZINA • Monitoraggio: emocromo ogni 2-4 sett. Per i primi 3 mesi, quindi ogni 3 mesi EFFICACIA • E’ efficace sui ed è in grado di ritardare la progressione radiologica INDICAZIONI • Artrite reumatoide, spondiloartriti sieronegative, malattie infiammatorie intestinali TERAPIE DI COMBINAZIONE • Il trattamento convenzionale con un singolo DMARD spesso non consente di ottenere un adeguato controllo dei sintomi e/o di prevenire la progressione di malattia: da qui l’uso combinato di più DMARDs • Esistono controversie sul tipo di combinazioni e sul tipo di approccio sequenziale – step-up o step-down • Spesso vi è un aumento di tossicità senza chiara dimostrazione di un effetto sinergico dei farmaci TERAPIE DI COMBINAZIONE • CsA + MTX > efficace ma più tossica di MTX • MTX+ HCQ + SSZ > efficace di MTX e di HCQ+SSZ senza aumento di tossicità • MTX+ HCQ + SSZ > efficace di MTX+SSz e di MTX+HCQ • SSZ+GC+MTX > efficace di SSZ (step-down) • MTX + LEF o MTX + anti-TNF efficaci dove insoddisfacente risposta a MTX Farmaci modificatori della risposta biologica Anti-TNF- Infliximab Adalimumab Etanercept I farmaci elencati sono ampiamente utilizzati nella pratica clinica reumatologica e sono il paradigma della nuova strategia immunosoppressiva Approcci terapeutici attraverso agenti biologici • Reclutamento delle cellule infiammatorie – Molecole di adesione, chemochine, complemento • Funzione delle cellule T – Ag di superficie delle cellule T (anti-CD4 mAb) – Molecole costimolatorie (CTLA4Ig-anti-CD40 mAb – Terapie Ag specifiche (tolleranza orale) • Citochine – – – – Antagonisti Il-1 (IL-1RA) Anti –TNF citochine pro-infiammatorie Anti-IL6 mAb Il-10 (citochina anti-infiammatoria) Inhibition of Cytokines Normal Interaction Neutralization of Cytokines Inflammatory cytokine Monoclonal antibody Cytokine receptor Soluble receptor Inflammatory signal No signal Receptor Blockade Monoclonal antibody Receptor antagonist No signal Activation of Anti-inflammatory Pathways Anti-inflammatory cytokine Suppression of inflammatory cytokines Adapted with permission from Choy EHS, Panayi GS. N Engl J Med. 2001;344:907–916. Copyright © 2001 Massachusetts Medical Society. All rights reserved. Generations of TNF- Antibodies 4th Fully Human 3rd Humanized 2nd Chimeric 1st Murine No Mouse Protein Adalimumab Adalimumab (D2E7) 5–10% Mouse Protein (D2E7) CDP-571 25% Mouse Protein 100% Mouse Protein Infliximab CDP-870 S S S S Etanercept CH3 S S S S SS SS CH2 Fc Region of Human IgG1 Immunex/Amgen 2002 Extracellular Domain of Human p75 TNF Receptor • Binds soluble and membrane TNF- and TNF-b (lymphotoxin) • Moderate- to high-binding affinity to TNF- • Half-life of 4-5 days • Inject sc every 3-4 days • Standard dose only • With MTX or monotherapy (monotherapy only in EU) Infliximab Mouse (binding site for TNF) Human (IgG1) Centocor, Inc. 2002 • Chimeric A2 (cA2) IgG1 monoclonal antibody • Binds to TNF with high affinity and specificity • Half-life of 8-9.5 days • Administered IV every 8 weeks • Must be used with MTX Adalimumab (D2E7) Characteristics: Fully Human Monoclonal Antibody Preclinical findings: • High affinity (Kd = 6.1 x 10-10 pM) and selectivity for TNF- • Potent neutralization of TNF- (IC50 = 200 pM) • Long half-life (14 days) • Soluble and membranebound TNF are biologically active. Adalimumab (D2E7) is able to bind to and neutralize both EFFETTI PATOFISIOLOGICI DEL TNF NELL’ ARTRITE REUMATOIDE • Stimola la sintesi di altre citokine proinfiammatorie • Induce le cellule endoteliali ad esprimere molecole di adesione che attirano i leucociti nelle articolazioni coinvolte • Stimola la produzione di metalloproteinasi da parte dei macrofagi sinoviali, fibroblasti, osteoclasti e condrociti • Sopprime la sintesi dei proteoglicani della cartilagine RUOLO DEL TNF NELL’ARTRITE REUMATOIDE • TNF è una potente citochina che influenza tutti gli aspetti dell’AR • TNF è principalmente prodotto da monociti e macrofagi • Il blocco di TNF comporta la riduzione dei livelli di altre citochine proinfiammatorie, IL-1, IL-6, IL-8, GM-CSF • TNF è il maggior contributo alle alterazioni patologiche-degenerative dell’AR International Consensus Statement on the Use of TNF anatgonists in RA • “Gli antagonisti del TNF sono raccomandati per il trattamento dell’artrite reumatoide dopo un adeguato tentativo con un altro DMARD efficace, di cui il più comunemente usato è il methotrexate” International Consensus Statement on the Use of TNF antagonists in RA • Gli antagonisti del TNF possono essere aggiunti al trattamento presistente o, quando appropriato, possono sostituire i DMARDs precedentemente usati o altri agenti biologici • Gli antagonisti del TNF sono efficaci in pazienti MTX-naive • Quando gli altri DMARDs sono relativamente controindicati, gli antagonisti del TNF possono essere presi in considerazione come primo DMARD International Consensus Statement on the Use of TNF antagonists in RA • Quando utilizzati in dosi e ad intervalli di somministrazione adeguati, gli antagonisti del TNF dovrebbero portare ad un miglioramento significativo e documentabile entro 12 settimane • Gli antagonisti del TNF rallentano la progressione radiologica nell’AR: sino a quando le implicazione di tale rallentamento saranno chiare, le modificazioni radiologiche di per se non dovrebbero determinare una decisione clinica WARNINGS • Gli antagonisti del TNF non dovrebbero essere iniziati o dovrebbero essere sospesi • Per serie infezioni • In presenza di disordini demielinizzanti • In pazienti con insufficienza cardiaca severa (NYHA III-IV) • In pazienti con pancitopenia • Tutti i pazienti devono essere valutati per TBC latente Precautionary Statements • La sicurezza del blocco di TNF non è nota nelle seguenti situazioni: • Linfoma o altre neoplasie • Infezioni croniche (compresi HBV, HCV, HIV) • Durante gravidanza ed allattamento • In caso di interventi chirurgici maggiori • Quando si usano vaccini viventi attenuati I farmaci anti-TNF disponibili in clinica • ETANERCEPT (Enbrel ): proteina ricombinante di fusione tra FC e recettore solubile p75 di TNF- • INFLIXIMAB (Remicade ): anticorpo monoclonale chimerico (uomo-topo) anti TNF- • ADALIMUMAB (Humira ): anticorpo monoclonale completamente umanizzato anti TNF- I farmaci anti-TNF disponibili in clinica • ENBREL : 25 mg sottocute 2 volte alla settimana • REMICADE: 3-5 mg /Kg in infusione venosa (2 ore) ogni 4-8 settimane (dopo una fase iniziale che prevede 3 somministrazioni a 0-2°-6° settimana) • HUMIRA: 40 mg sottocute ogni 2 settimane • Un rapido invio allo specialista reumatologo è consigliato in caso di sospetto clinico di Artrite Reumatoide, che può essere supportato dalla presenza di uno di questi segni-sintomi • >= 3 articolazioni tumefatte • Coinvolgimento di MCF/MTF – squeeze test positivo • Rigidità mattutina >= 30 minuti
Scaricare