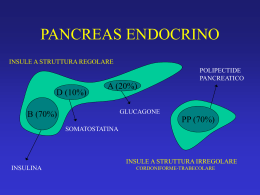
Riunione Scientifica Giornate Anatomo-Patologiche Gallaratesi 2-3 aprile 2009 I tumori neuroendocrini gastroenteropancreatici C. Capella Anatomia Patologica Università degli Studi dell’Insubria “I Tumori endocrini del duodeno e del piccolo intestino” Tabella 1. Cellule del sistema endocrino diffuso del tratto GEP umano: tipi, produzione ormonale e distribuzione. Tipo cellulare Ormone prodotto Pancreas Stomaco CF Intestino An Tenue Ap D Dg I Crasso C R P/D1 Grelina s + s + s s EC Serotonina s + + + + + + + + D Somatostatina + + + + + + + s + L GLI/PYY s + + + + + A Glucagone + PP PP + B Insulina + X Sconosciuto + ECL Istamina + G Gastrina CCK CCK + + s S Secretina + + GIP GIP + + s M Motilina + + s N Neurotensina s + + fn fn + + CF: corpo-fondo; An: antro; D:duodeno; Dg: digiuno; I: ileo; Ap: appendice cecale; C: colon; R: retto; +: presenti; s: presenti in numero scarso; fn: presenti nel feto e nel neonato; EC: enterocromaffine; GLI: immunoreagenti glucagone-simili (glicentina, glucagone-37, glucagone-29); PYY: peptide PP-simile con tirosina-amide N-terminale; PP: polipeptide pancreatico; ECL: enterocromaffino-simile; CCK: colecistochinina; GIP: polipeptide gastro-inibitore. Tabella modificata, dalla ref. 9. Tabella 2. Principali categorie di tumori GEP (WHO 2000) Tumori endocrini ben differenziati Tumore (carcinoide) Carcinoma (carcinoide maligno) Carcinoma endocrino scarsamente differenziato (a piccole cellule) Tumori misti esocrini-endocrini Lesioni pseudotumorali Per una diagnosi più dettagliata è necessario ricorrere all’uso di anticorpi specifici diretti contro i vari ormoni gastrointestinali per identificare il citotipo funzionale tumorale prevalente Tabella 3. Tumori endocrini GEP: tipo cellulare prevalente, sede e sindromi cliniche associate. Tipo di tumore Ben differenziato Tipo cellulare prevalente Pa B + ipoglicemia A + Glucagonoma PP + D + + + + + EC + + + + + CF An p/i/g Tenue Dg Ap I Sindrome clinica Crasso C R somatostatinoma + + + + + + + + + “carcinoide” “carcinoide atipica” L Scarsamente differenziato Intestino D ECL* G Stomaco + + + + + + + + + + Zollinger-Ellison + + + + + - Pa: pancreas; CF: corpo-fondo; An: antro; D: duodemo; Dg: digiuno; I: ileo; Ap: appendice cecale; C: colon; R: retto; +: tumori presenti; EC: enterocromaffini; ECL: enterocromaffino-simile; -: non definita; p/i/g: cellule piccole/intermedie/grandi. Tabella modificata dalla ref. 41; *: le cellule P/D1 producenti grelina sono state riscontrate nel 75% dei tumori (42) Tab.6. Classificazione clinico-patologica dei tumori endocrini del duodeno e del digiuno prossimale Tumore endocrino ben differenziato A) A comportamento benigno: confinato alla mucosa-sottomucosa, non angioinvasivo, di dimensioni <1 cm, non funzionante a) Tumore producente gastrina (duodeno prossimale) b) Tumore producente serotonina c) Paraganglioma gangliocitico, di qualsiasi dimensione (regione ampollare) B) A comportamento incerto: confinato alla mucosa-sottomucosa, di dimensioni >1 cm e/o angioinvasivo a) Tumore producente somatostatina, con o senza malattia di Von Recklinghausen (regione ampollare) b) Tumore producente gastrina, funzionante (gastrinoma) o non funzionante, sporadico o associato a MEN-1 c) Tumore producente serotonina, non funzionante Carcinoma endocrino ben differenziato A basso grado di malignità, esteso oltre la sottomucosa o con metastasi a) Carcinoma producente gastrina funzionante (gastrinoma), sporadico o associato a MEN-1 b) Carcinoma producente somatostatina (regione ampollare) con o senza malattia di Von Recklinghausen c) Carcinoma producente serotonina, non funzionante o funzionante (di qualsiasi estensione o dimensione), con sindrome da carcinoide d) Paraganglioma gangliocitico maligno Carcinoma endocrino scarsamente differenziato Carcinoma ad alto grado di malignità (a cellule piccole/ intermedie o a grandi cellule) (regione ampollare) Tumori endocrini del duodeno Epidemiologia - Nelle serie più recenti rappresentano fino al 22% dei TE-GI - Prevalgono leggermente nei M (M/F = 1,5:1) - Le decadi più colpite sono la V e la VI - I TE a cellule G rappresentano il gruppo maggiore (62%), seguiti dai TE a cellule D (21%), dai paragangliomi gangliocitici (9%), dai TE non definiti (5,6%), dai TE a cellule a PP e dai CESD Localizzazione I porzione: 49% II porzione: 46% III porzione: 2,2% IV porzione: 2,2% TE a.c.a gastrina non funzionanti: nella I^ porzione TE a.c.a gastrina funzionanti (ZES): nella I, II e III porzione TE a.c.a somatostatina e paragangliomi g.: in sede periampollare Aspetti clinici S. da infiltrazione locale (t. non funzionanti): ittero, pancreatite, emorragie, ostruzione S. endocrini (t. funzionanti): ZES (gastrinomi) ZES - compare nel 15%-23% dei TE duodenali - i gastrinomi si localizzano più frequentemente nel duodeno che nel pancreas - i TE associati a ZES compaiono in età più giovane e hanno una maggior incidenza di metastasi linfonodali rispetto a TE a cellule G non funzionanti Aspetti macroscopici - In prevalenza polipoidi, sottomucosi, < 1 cm - Più raramente infiltrativi e > 1 cm - Nel 13% dei casi multipli (nella ZES- MEN1) - Diametro medio: 0,8 cm (t. a gastrina), 2,3 cm (t. a somatostatina), 1,7 cm paragangliomi g., 2,5 cm PDEC TE a cellule a gastrina - sottomucosi, architettura trabecolare-giriforme - prevalentemente immunoreattivi per la gastrina - altre immunoreattività: alfa-hGC, somatostatina, 5HT, PP, CDX2 - esprimono SSR2A - l’attività proliferativa (Ki67) è < 2% per i t. non funzionanti e in genere tra il 2% e il 10% per i t. funzionanti - gastrinomi associati a MEN-1 presentano un’iperplasia delle cellule G nella mucosa duodenale . TE a cellule somatostatina - frequentemente infiltrano la tonaca muscolare e oltre - hanno una componente tubulo-ghiandolare prevalente - mostrano corpi psammomatosi (58% dei casi) - sono immunoreattivi per la SST - altre immunoreattività: gastrina, calcitonina, ACTH - indice proliferativa (Ki67): in genere > 2% . Paragangliomi gangliocitici hanno un aspetto infiltrativo sono formati da 3 tipi cellulari: 1) c. fusate 2) c. epiteliali 3) c. gangliari (differenziazione trifasica) le c. epiteliali sono IR per la cromogranina, il PP, la SST le c. fusate sono S-100 IR le c. gangliari sono IR per marcatori neuronali . CK Carcinomi endocrini scarsamente differenziati sono tumori della ampolla di Vater infiltrano profondamente hanno struttura solida, con ampie aree di necrosi la metà sono associati ad adenomi le cellule sono piccole, intermedie o grandi e indifferenziate vi è immunoreattività per la sinaptofisina, più raramente per la cromogranina sono: AE1/AE3, CK7+ CK20+/- TTF1RbKi67: 63% (medio) (Nassar et al. 2005) . SYN CK Suscettibilità genetica MEN-1 25-33% dei gastrinomi si associano a MEN-1 e quasi tutti sono localizzati nel duodeno i casi ZES-MEN1 presentano LOH al locus del gene MEN1 o mutazioni puntiformi del gene MEN-1 Neurofibromatosi di tipo 1 i p. con neurofibromatosi di tipo 1 (NF1) hanno un rischio significativo di sviluppo di un TE a somatostatina periampollare alcuni pazienti con NF1 hanno anche un feocromocitoma; altri hanno GIST intestinali multipli Multiple endocrine neoplasia type 1-associated duodenal somatostatin- and gastrin-producing microtumours Multiple endocrine neoplasia type 1-associated duodenal somatostatin- and gastrin-producing microtumours ,2 mm in diameter. (Anlauf et al. 2006) Loss of heterozygosity (LOH) analysis of chromosome 11q13 (red) and centromere 11 (C11; green) in duodenal microtumours (adjacent sections). (A, B) Somatostatin-immunoreactive microtumour within the Brunner's glands revealing LOH for both chromosomal regions. (C-D) Gastrin-producing microtumour in close association with the mucosa showing LOH for 11q13 but not for C11. (E-F) gastrin-producing microtumour within the submucosa revealing no LOH for either allele. (Anlauf et al. 2006) Prognosi TE a gastrina I gastrinomi associati a ZES hanno una prognosi meno favorevole dei TE a gastrina non funzionanti, mostrando un’alta incidenza di metastasi linfonodali: 60-80% vs 0. Questo indica che i tumori non funzionanti hanno quasi sempre un comportamento biologico benigno. Metastasi epatiche sono riscontrate nel 5-10% dei casi con ZES (Anlauf et al. 2006) La sv. a 10 a dei gastrinomi è del 60-84%. TE a cellule a somatostatina sono spesso maligni hanno frequentemente un diametro > 2 cm ed invadono la parete duodenale, il pancreas e i LN regionali la sv. sembra essere minore rispetto a quella dei t.a.c. gastrina Paragangliomi gangliocitici sono in gran prevalenza benigni Carcinomi endocrini scarsamente differenziati mostrano segni istologici di alta malignità le metastasi sono presenti nella maggior parte dei casi (LN: 77%; fegato, cervello; Nassar et al. 2005) il 64% dei pazienti muoiono nel giro di 4-30 mesi, sopravvivenza media: 14,5 mesi (Nassar et al. 2005) Tumori endocrini del piccolo intestino Tab. 7 - Tumori endocrini del digiuno distale e dell’ileo _________________________________________________________________________________ Tumore endocrino ben differenziato A) A comportamento benigno: non funzionante, confinato alla mucosa-sottomucosa, di dimensioni <1 cm a) Tumore producente serotonina b) Tumore producente enteroglucagone B) A comportamento incerto: non funzionante, confinato alla mucosa-sottomucosa, di dimensioni >1 cm angioinvasivo a) Tumore producente serotonina b) Tumore producente enteroglucagone Carcinoma endocrino ben differenziato A basso grado di malignità, con invasione profonda (muscolare propria o oltre) o con metastasi a) Carcinoma producente serotonina, con o senza sindrome da carcinoide b) Carcinoma producente enteroglucagone Carcinoma endocrino scarsamente differenziato Carcinoma ad alto grado di malignità (a cellule piccole/ intermedie o a grandi cellule) (colon e retto) _________________________________________________________________________________ Epidemiologia Hanno un’incidenza di 0,28-0,89 per 100.000 Rappresentano il 23-28% dei TE gastrointestinali Tendono ad aumentare (1998-2002) in proporzione rispetto a quelli dell’appendice e agli adenocarcinomi del piccolo intestino (Modlin et al. 2007) Sono egualmente distribuiti nei sessi La VI e la VII decade sono quelle più colpite Modlin 2007 Small intestinal neoplasia incidence, 1973-2002. Over the 30-yr study period, the number and percentage of SI-NETs, adenocarcinomas, and lymphomas have all increased. Proportionately, NETs have increased to the greatest extent Eziologia Sconosciuta Riportati casi associati a iperplasia delle cellule endocrine nella mucosa adiacente al tumore (Moyana et al. 1992) 15% dei TE dell’ileo son associati a t. non endocrini, principalmente ad adenocarcinomi del colon (Modlin, Sandor 1997) Sede La maggior parte sono localizzati nell’ileo terminale e nel 30% dei casi sono multipli T. Endocrini digiuno-ileali Aspetti clinici I p. con TE digiuno-ileali accusano più frequentemente dolori addominali crampiformi (da ostruzione intermittente) L’ecografia, la TAC spirale con contrasto, l’endoscopia con capsula e l’octreoscan sono ampiamente usati per localizzare il t. primitivo e le eventuali metastasi La sindrome da carcinoide è presente nel 5-7% dei p. con carcinomi endocrini ben differenziati (carcinoidi maligni) a cellule EC dell’ileo ed è sempre associata alla presenza di metastasi epatiche Aspetti macroscopici La dimensione dei TE digiuno-ileali è < 1 cm nel 13% e > 2 cm nel 47% dei casi E’ frequente l’infiltrazione della t. muscolare e del peritoneo L’interessamento del mesentere provoca una reazione desmoplastica e un inginocchiamento intestinale con ostruzione Aspetti microscopici I TE a cellule EC producenti 5HT come costituiti da nidi tondeggianti di cellule, che formano spesso palizzate periferiche Le cellule tumorali sono intensamente argentofile e reattive per la cromogranina A, la serotonina (5HT), il CDX2, la sostanza P e altre tachichinine come la neurokinine A e B e il neuropeptide K Hanno un indice Ki67 medio < 0,2% e un indice apoptico medio < 0.01% Producono fattori di crescita come il TGF-alfa, il PDGF, l’aFGF, l’HGF, il TGF-β1 e il CTGF Le arterie e le vene localizzate in vicinanza del tumore hanno una parete ispessita e il lume vascolare è ristretto e occluso Grimelius SSTR2A Site Stomach n 3 WHO classification Tumor Sex Age (years) Size (cm) B UB Type F/M Mea n Rang e Mean Range 2 1 Type 1 3/0 71 64–78 1.5 0.5–2 0/3 0/3 Type 3 1/2 41 26–56 2.4 2–2.8 3/3 0/3 G-cell 1/3 54.5 46–63 0.7 0.5–1 0/4 3/4* 1 D-cell 3/0 46 38–54 1.5 0.5–2.5 1/3 0/3 1 GP 0/2 57.5 36–79 3 2–4 1/2 0/2 12 EC-cell 5/7 56 40–72 2.4 0.9–3 12/12 12/12 EC-cell 2/3 71 23–96 1.7 1–2.5 0/5 5/5 2 EC-cell 1/1 48 46–50 4.6 3–8 2/2 2/2 2/2 1 1 L-cell 2/5 52 34–70 2.5 0.1–5 1/8 0/8 0/1 1 1 L/EC-cell 0/2 56 42–70 1.2 0.2–2 1/2 0/2 1 Undefined 2/1 52 38–72 0.2 0.1–0.3 1/2 0/3 EC-cell 0/1 45 0/1 0/1 Insulinoma 4/4 59 33–85 1.3 1–1.7 0/8 0/8 Gastrinoma 2/0 55.5 40–71 2 2–2 2/2 2/2* A-cell 3/2 58 25–66 1.6 1.2–2.1 0/5 0/5 2 PP-cell 1/1 57.5 28–59 4.9 1.8–8 2/3 1/3 1 A/D-cell 1/0 37 1/1 0/1 1 EC-cell 2/1 62.3 1/3 2/3 VIPoma 0/1 72 5.5 0/1 0/1 Undefined 0/1 57 3.5 1/1 0/1 3 Duodenum 3 4 4 3 1 2 1 Ileum 12 Appendix 5 Right colon 2 Rectum 8 6 2 1 Pancreas 8 1 5 2 3 1 8 2 5 2 5 3 1 1 3 1 1 Total 72 C 2 1 1 Metastases 2 6 50–75 2.5 2–3 CDX2 Primary 27/72 (37.5%) La Rosa et al. (2004) Metastases 0/3 0/1 6/6 0/1 8/14 Ileal EC-cell (serotonin-producing cell) tumor shows a diffuse and intense nuclear CDX2 immunoreactivity (A). The lymph-node (B) and liver (C) and metastases coming from this tumor show the same pattern of CDX2 expression (original magnification, ×200) Suscettibilità genetica I TE digiuno-ileali, contrariamente a quelli gastrici e duodenali si associano solo raramente a MEN1 Alterazioni genetiche I TE ileali mostrano frequentemente perdite dell’intero cromosoma 18 o del suo braccio lungo o piccole delezioni in 18q. Prognosi La mortalità per TE digiuno-ileale è del 21% contro il 6% dei TE gastrici e il 4% di quelli duodenali La sopravvivenza a 5 a dei pazienti con TE digiunoileale è di circa il 60% e a 10 a di circa il 43% Le metastasi sono generalmente ai LN regionali e al fegato, raramente (0,5%) sono extraddominali La sopravvivenza è negativamente correlata con le metastasi a distanza e la s. da carcinoide
Scaricare