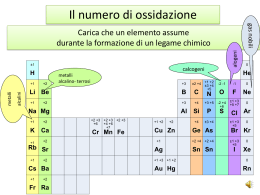
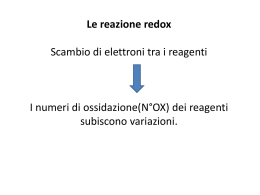
Reazioni redox •combustioni •corrosioni •fotosintesi •metabolismo alimentare •preparazione dei metalli •...................................... cosa hanno in comune? lo scambio di elettroni Ossidazione • originariamente: • oggi: reazione di un elemento con l'ossigeno perdita di elettroni 2 Mg + O2 → 2 MgO Il metallo solido, magnesio, reagisce con l'ossigeno gassoso dando ossido di magnesio solido, formato da ioni Mg2+ e O2L'atomo di magnesio si ossida. Perde 2 elettroni. Riduzione • originariamente: • oggi: preparazione di un metallo dall'ossido acquisto di elettroni 2 Fe2O3 + 3 C → 4 Fe + 3 CO2 Gli ioni Fe3+, presenti in Fe2O3, si trasformano in atomi neutri di ferro elementare L'atomo di ferro si riduce. Acquista 3 elettroni. Bilancio delle cariche • Tutti gli elettroni persi in un'ossidazione devono essere acquistati in una riduzione • Una reazione redox comprende sempre una ossidazione e una riduzione 2 NaBr + Cl2 → 2NaCl + Br2 Il bromo si trasforma da ione Br - (con 1 e- in più) a molecole neutre Br2. Perde un elettrone e si ossida. Il cloro passa da molecola neutra Cl2 a ioni Cl -. Acquista e- e si riduce. NUMERI DI OSSIDAZIONE Il numero di ossidazione (N.O.) è una misura dello stato di ossidazione d’un elemento. Il N.O. viene assegnato seguendo regole semplici con le quali si assegnano formalmente gli elettroni di un legame all’atomo più elettronegativo (meno metallico) La somma dei N.O in un composto neutro è uguale a zero. Il N.O. di uno ione monoatomico è uguale alla carica dello ione. La somma dei N.O. degli atomi in uno ione poliatomico è uguale alla carica dello ione. Ogni atomo allo stato elementare ha sempre N.O. eguale a zero. Il N.O. di F è sempre –1 . Il N.O. di O è sempre –2 tranne che nei perossidi ( O22 -, N.O = -1 ) , nei superossidi (O2- , N.O.= -1/2) e nel F2O ( N.O.= +2 ). Il N.O. dell’ H è sempre eguale a +1 tranne che negli idruri metallici ( N.O.= -1 ) OSSIDAZIONE : processo in cui il N.O. di un elemento aumenta RIDUZIONE : processo in cui il N.O. di un elemento diminuisce Regola fondamentale La somma dei n.o. di tutti gli atomi nella formula deve essere uguale alla carica dello ione (o a zero se la formula è neutra) Regole pratiche • • • • • tutti gli elementi hanno n.o. = 0 negli ioni monoatomici il n.o. è la carica dello ione il n.o. di H è +1 (tranne quando è legato a un metallo) il n.o. di F è sempre -1 il n.o. di O è -2 (eccezioni: composti con F e con legami O-O) Esempi di n. di ossidazione • • • • • • • H2O NaCl (Na+ Cl -) H2S Al2S3 (Al3+ S2-) SO2 SO42H2O2 H +1 Na +1 H +1 Al +3 S +4 S +6 H +1 O -2 Cl -1 S -2 S -2 O -2 O -2 O -1 Esempi di n. di ossidazione • • • • • • • H2SO4 H +1 S +6 O -2 KMnO4 K +1 Mn +7 O -2 MnO4Mn +7 O -2 Fe2O3 Fe +3 O -2 FeO Fe +2 O -2 H2, O2, N2, Na, K, Mg, Fe, S, P4 tutti 0 Cr2O72Cr +6 O -2 Esempi di n. di ossidazione • • • • • • • CH4 CO2 C2H6 C2H6O CO C2H4O2 C6H6 C-4 C +4 C-3 C-2 C +2 C 0 C-1 H +1 O -2 H +1 H +1 H +1 H +1 O -2 O -2 O -2 REAZIONI DI OSSIDO-RIDUZIONE Nelle reazioni Redox uno o più elementi si ossidano (aumenta N.O.) e uno o più elementi si riducono (diminuisce N.O.). L’ossidazione avviene mediante perdita di elettroni La riduzione avviene mediante acquisto di elettroni 2 Na + Cl2 2 NaCl 0Il sodio si0è ossidato +1 -1 Il cloro si è ridotto Una reazione Redox può essere sempre scomposta idealmente in due semi-reazioni una di ossidazione ed una di riduzione 2 H2 O 2 H2 + O2 +1 -2 L’idrogeno si è0ridotto 0 L’ossigeno si è ossidato Na Na+ + e- Cl2 + 2 e- 2 Na + Cl2 (x 2) 2 Cl- 2 NaCl Terminologia redox Un ossidante si riduce acquista elettroni ha n.o. alto diminuisce il n.o. 2 Mg riducente Un riducente si ossida cede elettroni ha n.o. basso aumenta il n.o. + O2 → ossidante 2 MgO Bilanciare Cu(s) + Ag+(aq) → Cu2+(aq) + Ag(s) 1 Cu a sx, 1 Cu a dx; 1 Ag a sx, 1 Ag a dx è già bilanciata? NO! Carica tot. +1 a sx, +2 a dx Raddoppiamo gli Ag+ a sx (e gli Ag a dx) Cu(s) + 2 Ag+(aq) → Cu2+(aq) + 2 Ag(s) Bilanciare 1. 2. 3. 4. Identificare ossidante e riducente Trovare n. elettroni acquistati e ceduti Uguagliare elettroni acquistati e ceduti Aggiustare i coefficienti per uguagliare: • • n. di atomi di ciascun elemento carica totale 2 NaI(aq) + 2 H2SO4(aq) + MnO2(s) Na2SO4(aq) + MnSO4(aq) + 2 H2O + I2(g) 2 I- + 4 H+ + MnO2 Mn2+ + 2 H2O + I2 Br2 (CCl4) + 2 KI (aq) 22 KBr KBr (aq) (aq) ++ II22 (CCl4) (CCl4) Br2 (CCl4) + 2 I- (aq) 22 Br Br-- (aq) (aq) ++ II22 (CCl4) (CCl4) Bilanciamento delle reazioni Redox MnO4- + H+ + Br- Mn2+ + BrO3- + H2O Si scompone la reazione in un due semi-reazioni : Br- BrO3- + 6 e- bil elett Ossidazione Br- BrO3- + 6 e- + 6 H+ bil cariche (1) Br- + 3 H2O Riduzione (2) BrO3- + 6 e- + 6 H+ MnO4- + 5 eMn2+ MnO4- + 5 e- + 8 H+ Mn2+ MnO4- + 5 e- + 8 H+ Mn2+ + 4 H2O bil masse bil elett bil cariche bil masse Il numero di elettroni persi nella semi-reazione di ossidazione deve eguagliare il numero di elettroni acquistati nella semi-reazione di riduzione moltiplicando l’eq (1) per 5 e l’eq (2) per 6. Sommando e semplificando si ottiene : (3) 5 Br- + 15 H2O 5 BrO3- + 30 e- + 30 H+ 6 MnO4- + 30 e- + 48 H+ 6 Mn2+ + 24 H2O 6 MnO4- + 18 H+ + 5 Br6 Mn2+ + 5 BrO3- + 9 H2O
Scaricare