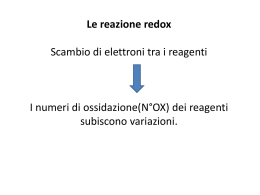
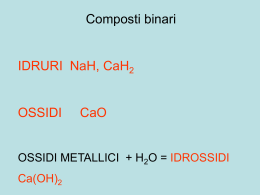
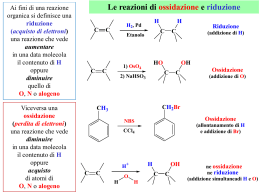
Il numero di ossidazione gas nobili ±1 calcogeni H alcalini metalli +1 alogeni Carica che un elemento assume durante la formazione di un legame chimico +2 metalli alcalino- terrosi He +1 +2 ±3 +4 +5 +3 ±2 +4 Li Be B C +1 +3 +4 +3 +5 -2 +4 +6 Al Si P S +4 ±3 +4 +2 Na Mg +1 +2 K Ca +1 +2 Rb Sr +1 +2 Cs Ba +1 +2 Fr Ra +2 +3 +2 +3 +2 +3 +6 +4 +6 +7 Cr Mn Fe +1 +2 +2 Cu Zn 0 N -2 -1 -1 0 O F Ne ±1 +3 +5 +7 0 Cl Ar ±1 +3 +5 0 Ge As Br Kr +1 +2 +4 +2 +4 ±1 +3 +5 0 Ag Sn Sn I Xe +1 +3 +1 +2 0 Au Hg Rn Spostandoci a destra … il C ad esempio 4e- C +4 -2 2O CO2 4x1e- C -4 4H +1 CH4 -2 CO 2e- C +2 O elementi dei gruppi VA, VIA, VIIA 3e- N -3 3H NH3 +1 2x1e- 2Na+1 Na2O O-2 1e- H+1 Cl-1 E’ anche possibile però che… 2x3 e- 2N+3 2x1e- 2Cl+1 3O-2 2x5 e- O-2 2N+5 5O-2 2x3e- 2Cl+3 3O-2 2x5e- 2Cl+5 5O-2 2x7e- 2Cl+7 7O-2 Scriviamo la formula chimica di una sostanza … +7 -2 Cl2 O7 La regola viene detta della X Alcune regole che è bene ricordare … •Gli atomi delle sostanze elementari hanno sempre numero di ossidazione zero; •Il numero di ossidazione dell’ossigeno è sempre -2 (tranne nei perossidi in cui vale -1); •Il numero di ossidazione dell’idrogeno è sempre +1 ad eccetto degli idruri; •In una molecola o unità formula la somma dei numeri di ossidazione di tutti gli atomi presenti deve essere uguale a zero; se si tratta di uno ione deve coincidere con la carica dello ione.
Scaricare