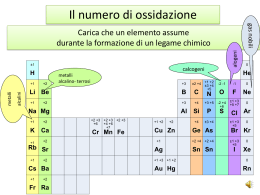
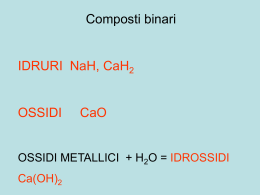
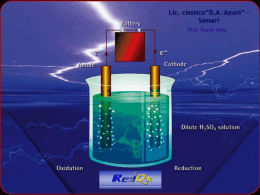
Le reazione redox Scambio di elettroni tra i reagenti I numeri di ossidazione(N°OX) dei reagenti subiscono variazioni. Ossidazione: perdita di elettroni dapartedi un reagente. (il NOX aumenta) Riduzione: guadagno di elettroni da parte di un reagente. (NOX diminuisce) Agente Ossidante: sostanza cheaccetta gli elettroni. Agente Riducente: sostanza checede gli elettroni. Le reazioni di ossidoriduzione sono quelle reazioni in cui si ha uno scambio di elettroni tra due specie chimiche; una specie subisce una reazione di ossidazione, l'altra subisce una reazione di riduzione. Reazione di ossidazione La reazione di ossidazione è una reazione in cui una specie chimica, atomo o ione perde elettroni. Il suo numero di ossidazione aumenta. Fe → Fe2+ + 2 e(NB e- è il simbolo dell'elettrone che ha carica negativa) Reazione di riduzione La reazione di riduzione è una reazione in cui una specie chimica, atomo o ione acquista elettroni. Il suo numero di ossidazione diminuisce. 2H+ + 2 e- → H2 Se in una reazione chimica un elemento si ossida perdendo elettroni, dovrà esistere un altro elemento che, acquistando gli elettroni, si riduce. Pertando le reazioni di ossidazione e di riduzione devono avvenire contemporaneamente. Si parla quindi di reazioni di ossidoriduzione o di reazioni redox. Come si riconoscono le reazioni di ossidoriduzione Un modo semplice per riconoscere le reazioni redox è quello di osservare se vi è variazione del numero di ossidazione di due differenti elementi. Infatti, se vi è variazione del numero di ossidazione, la reazione è di ossidoriduzione. Consideriamo la reazione tra ioduro di potassio e bromo: 2 KI + Br2 → 2 KBr + I2 Seguendo le regole per attribuire il numero di ossidazione, si ha che: lo iodio I in KI ha numero di ossidazione -1, mentre in I2 ha numero di ossidazione 0. -1 → 0 Il numero di ossidazione di I passa da -1 a 0, il suo numero di ossidazione aumenta. KI quindi si ossida ed è una sostanza riducente. Il bromo in Br2 ha numero di ossidazione 0, mentre in KBr ha numero di ossidazione -1. 0 → -1 Il numero di ossidazione di Br passa da 0 a -1, il suo numero di ossidazione diminuisce. Br2 quindi si riduce ed è una sostanza ossidante. In questa reazione vi è variazione del numero di ossidazione di due differenti elementi, si tratta quindi di una reazione redox.
Scaricare