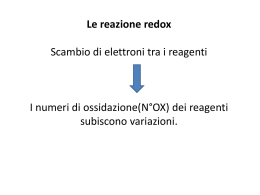
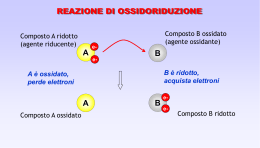
TITOLAZIONI DI OSSIDO-RIDUZIONE REAZIONE DI OSSIDORIDUZIONE (REDOX) Rezioni chimiche in cui avviene un trasferimento di elettroni da una specie chimica ad un’altra. Comportano variazione del numero di ossidazione degli atomi partecipanti alla stessa REAZIONE DI OSSIDORIDUZIONE (REDOX) Numero di ossidazione: differenza tra il numero degli elettroni di valenza che l’atomo possiede allo stato libero ed il numero degli elttroni di valenza assegnati formalmente all’atomo legato 1) OSSIGENO = -2 2) IDROGENO = +1 3) METALLI ALCALINI (Li, Na, K)= +1 4) METALLI ALCALINO TERROSI (Be, Mg, Ca..) = +2 5) FLUORO = -1 REAZIONE DI OSSIDORIDUZIONE (REDOX) Numero di ossidazione: la somma algebrica dei numeri di ossidazione dei vari atomi componenti in una molecola deve essere uguale a zero ed in uno ione deve essere uguale alla sua carica CO2 = SO3 = Fe2O3= SO4-2 = MnO4- = C vale +4 S vale +6 Fe vale +3 S vale +6 Mn vale +7 REAZIONE DI OSSIDORIDUZIONE (REDOX) Ossidazione:processo in cui un atomo cede elettroni con conseguente aumento del suo numero di ossidazione Riduzione: il processo in cui un atomo acquista elettroni con conseguente diminuzione del suo numero di ossidazione REAZIONE DI OSSIDORIDUZIONE (REDOX) Agente ossidante: ogni specie chimica capace di acquistare elettroni Oss + ne- = Rid Si tratta quindi di un accettore di elettroni che tende pertanto a ridursi con diminuzione del proprio numero di ossidazione Agente riducente: ogni specie chimica capace di cedere elettroni Rid = Oss + neSi tratta quindi di un donatore di elettroni che tende pertanto a ossidarsi con aumento del proprio numero di ossidazione REAZIONE DI OSSIDORIDUZIONE (REDOX) Ossidazione e riduzione sono processi interdipendenti e non si può avere un’ossidazione senza una contemnporanea riduzione. La forma ossidata e la forma ridotta di una sostanza costituiscono una semicoppia coniugata ossidoriduttiva ed una reazione redox può essere considerata come la combinazione di due semicoppie REAZIONE DI OSSIDORIDUZIONE (REDOX) Ox1 + ne- = Rid1 Rid2 = Ox2 + neOx1 + Rid2 = Rid1 + Ox2 BILANCIAMENTO DELLE EQUAZIONI REDOX METODO DELLE SEMIREAZIONI Le due semireazioni vengono bilanciate separatamente e poi sommate per ottenere l'equazione ionica netta bilanciata. Per il bilanciamento bisogna: a) bilanciare gli elettroni (in modo tale da conservare degli elettroni scambiati) b) bilanciare le cariche (in modo tale da conservare la carica elettrica di ambo i mebri della semireazione aggiungendo cariche positive come ioni H3O+ o cariche negative come ioni OH- a seconda dell’ambiente in cui la reazione avviene) d) bilanciare le masse (aggiunta di molecole di H2O) BILANCIAMENTO DELLE EQUAZIONI REDOX I- + Mno4- = I2 + Mn+2 +7 0 Riduzione +7 a +2 Ossidazione -1 a 0 Rid. MnO4- + 5e = Mn+2 6 cariche negative 2 cariche positive Tenendo conto che la reazione avviene in ambiente acido bisogna aggiungere a primo membro tante cariche positive come ioni H3O+ da eguagliare il numero di cariche positive a secondo membro -6 + 8 = +2 BILANCIAMENTO DELLE EQUAZIONI REDOX I- + Mno4- = I2 + Mn+2 +7 0 Riduzione +7 a +2 Ossidazione -1 a 0 Rid. MnO4- + 5e + 8H3O+ = Mn+2 Ora bilancio di massa. Se l’equazione è ben bilanciata come carica torna un numero intero di molecole di H2O. Per fare questo si contano tutti gli idrogeni a primo membro (24) li si sottraggono ad eventuali idrogeni presenti a secondo membro (0), tutti gli ossigeni a primo membro (12), li si sottraggono ad eventuali ossigeni a secondo membro. Il risultato di tali sottrazioni deve portare ad un numero di idrogeni doppio rispetto agli ossigeni. In questo caso 24 idrogeni, 12 ossigeni = 12 H2O da bilanciare a secondo membro BILANCIAMENTO DELLE EQUAZIONI REDOX I- + Mno4- = I2 + Mn+2 +7 0 Riduzione +7 a +2 Ossidazione -1 a 0 Rid. MnO4- + 5e + 8H3O+ = Mn+2 + 12 H2O Verificare il bilancio dell’intera semireazione. Mn = 1 a primo membro, 1 a secondo membro. H = 24 a primo membro, 24 a secondo membro. O = 12 a primo membro, 12 a secondo membro BILANCIAMENTO DELLE EQUAZIONI REDOX I- + Mno4- = I2 + Mn+2 +7 0 Riduzione +7 a +2 Ossidazione -1 a 0 Ox. 2I- = I2 + 2e Quando i coeffecienti stechiometrici delle due specie ossidata e ridotta sono diversi fare subito bilancio di massa BILANCIAMENTO DELLE EQUAZIONI REDOX I- + Mno4- = I2 + Mn+2 +7 0 Riduzione +7 a +2 Ossidazione -1 a 0 Ox. 2I- = I2 + 2e 2 cariche negative 2 cariche negative Non necessita di bilancio di carica né di massa BILANCIAMENTO DELLE EQUAZIONI REDOX I- + Mno4- = I2 + Mn+2 +7 0 Riduzione +7 a +2 Ossidazione -1 a 0 Rid. MnO4- + 5e + 8H3O+ = Mn+2 + 12 H2O Ox. 2I- = I2 + 2e X 10/2 X 10/5 Si calcola il m.c.m (10) e si moltiplica ciascuna semireazione per un coefficiente pari a m.c.m/numero di elettroni che compare nella semireazione BILANCIAMENTO DELLE EQUAZIONI REDOX I- + Mno4- = I2 + Mn+2 +7 0 Riduzione +7 a +2 Ossidazione -1 a 0 Rid. 2MnO4- + 10e + 16H3O+ = Si sommano le semireazioni e si semplifica il numero degli elettroni (se fatta bene il numero degli elettroni è lo stesso nei due membri) e si verifica un’ultima volta la massa 2Mn+2 + 24 H2O Ox. 10I- = 5I2 + 10e 2MnO4- + 10e + 16H3O+ + 10I- = 2Mn+2 + 24H2O + 5I2 + 10e IL POTENZIALE DI OSSIDORIDUZIONE Ad ogni semicoppia redox è associato un potenziale di ossidoriduzione espresso dall’equazione di Nerst E = E0 + RT/nF x ln[Ox]/[Rid] R = costante dei gas, T = temperatura in °K, n = numero di elettroni scambiati dalla semicoppia, F = costante di Faraday E = E0 + 0.059/n x log[Ox]/[Rid] IL POTENZIALE DI OSSIDORIDUZIONE E = E0 + 0.059/n x log[Ox]/[Rid] E0 è una costante caratteristica di ogni semicoppia detta potenziale standard (o normale, o potenziale ad attività unitaria) Se [Ox] e [Rid] hanno attività (conentrazione) pari a 1 il loro rapporto = 1 e si annulla il log per cui E = E0 a 25 °C, 1 atm, e concentrazioni = 1M Assegnando alla semicoppia 2H+ +2e- = H2 per convenzione il valore 0, è possibile calcolare per accoppiamento con questa semicoppia gli E0 di tutte le semicoppie redox POTENZIALI STANDARD DI OSSIDORIDUZIONE La specie ossidata della semicoppia a potenziale maggiore ossida la specie ridotta della semicoppia a potenziale minore POTENZIALI STANDARD DI OSSIDORIDUZIONE POTENZIALI STANDARD DI OSSIDORIDUZIONE X IL POTENZIALE DI OSSIDORIDUZIONE Sia data la reazione I2 + Cl- =. Sulla base dei valori di potenziale standard la stessa potra avvenire spontaneamente? I2/I- E0 = 0.535 V Cl2/Cl- E0 = 1.36 V La reazione non avviene IL POTENZIALE DI OSSIDORIDUZIONE Sia data la reazione O2 + Fe+2 =. Sulla base dei valori di potenziale standard la stessa potra avvenire spontaneamente? O2/H2O E0 = 1.229 V Fe+3/Fe+2 E0 = 0.77 V La reazione avviene IL POTENZIALE DI OSSIDORIDUZIONE Perché una reazione redox possa essere sfruttata in analisi quantitativa deve avvenire che i potenziali dei reagenti siano tali da assicurare la completezza della reazione IL POTENZIALE DI OSSIDORIDUZIONE 1) L’ossidante ha un E0 superiore di parecchi decimi di volt a quello del riducente: la reazione procede sponteneamente fino a completamento 2) I due E0 sono simili: in tal caso le due sostanze reagiscono finchè, all’equilibrio, saranno rpesenti in miscela i due reagenti ed i prodotti della reazione che risulta pertanto incompleta 3) Il riducente ha un E0 nettamente superiore a quello dell’ossidante: le due sostanze non reagiscono IL POTENZIALE DI OSSIDORIDUZIONE Quali sono i fattori che possono influenzare una reazione redox? 1) Concentrazione dei reagenti 2Fe+3 + 2I- = 2Fe+2 + I2 E0 Fe+3/Fe+2 = 0.77, E0 I2/I- = 0.535 Un eccesso di Fe+3 contribuisce alla completezza della reazione IL POTENZIALE DI OSSIDORIDUZIONE Quali sono i fattori che possono influenzare una reazione redox? 2) pH: concentrazione di ioni H3O+ compare nell’equazione della semicoppia ed influisce sul valore di E calcolato con l’eq. di Nerst MnO4- + 8H+ + 5e = Mn+2 + 4H2O E = E0 +0.059/n log[MnO4-][H+]8/[Mn+2] Il permangato risulta tanto più ossidante quanto più l’mabiente è acido IL POTENZIALE DI OSSIDORIDUZIONE H3AsO4 + 2H+ + 2e = HAsO2 + 2H2O E0 = 0.559 V I2 + 2e = 2IE0 = 0.535 V Solo il potenziale dell’arseniato dipende dal pH (alla seconda potenza). In mezzi molto acidi l’arseniato ossida lo ioduro a iodio. In soluzione alcaline lo iodio ossida l’arsenito IL POTENZIALE DI OSSIDORIDUZIONE Quali sono i fattori che possono influenzare una reazione redox? 3) Velocità di reazione: se una reazione redox si svolge completamente nelk senso desiderato ma con una bassa velocità non può essere usata in analisi quantitativa. Effetto della temperatura e dei catalizzatori TITOLAZIONI REDOX Durante una reazione redox la grandezza fisica che varia è il potenziale di ossidoriduzione. Pertanto sarà possibile seguire l’andamento di una titolazione redox calcolando il valore di E nelle varie fasi della titolazione e costruire in tal modo una curva di titolazione ponendo in ordinata i valori di E ed in ascissa il volume in ml di titolante TITOLAZIONI REDOX Ox1 + ne = Rid1 Ox2 + ne = Rid2 E1 = E10 + 0.059/n log[Ox1]/[Rid1] E2 = E20 + 0.059/n log[Ox2]/[Rid2] Se E1 > E2 Ox1 + Rid2 = Rid1 + Ox2 La reazione procede verso destra fino al punto di equivalenza in cui sarà E1 = E2 TITOLAZIONI REDOX E0 + 0.059/n log [Ox1]/[Rid1] = E0 + 0.059/n log [Ox2]/[Rid2] E10 – E20 = 0.059/n log ([Ox2][Rid1]/[Rid2][Ox1]) E10 – E20 = 0.059/n logKeq Log Keq = n(E10 – E20)/0.059 TITOLAZIONI REDOX Titolazione di 100 mL di FeSO4 0.1 N con Ce(SO4)2 0.1 N Ce+4 + Fe+2 = Ce+3 + Fe+3 Ce+4 + e = Ce+3 E0 = 1.45 V Fe+2 = Fe+3 + e E0 = 0.77 V LogKeq = 1.45 – 0.77/0.059 = 11.52 Keq = 3.3 x 1011 Reazione quantitativa CALCOLO DELLA CURVA DI TITOLAZIONE 1) Inizio titolazione – punto di equivalenza Si applica l’equazione di Nerst alla specie da titolare (Fe) EFe = EFe0 + 0.059log[Fe+3]/[Fe+2] 2) Al punto di equivalenza si ha [Ce+3] = [Fe+3]; [Ce+4] = [Fe+2] ovvero ECe = ECe0 + 0.059log[Ce+4]/[Ce+3] = EFe = EFe0 + 0.059log[Fe+3]/[Fe+2] CALCOLO DELLA CURVA DI TITOLAZIONE 2E = ECe0 + EFe0 + 0.059log[Ce+4] [Fe+3]/[Ce+3] [Fe+2] 2E = ECe0 + EFe0 Potenziale al punto equivalente E = ECe0 + EFe0 /2 CALCOLO DELLA CURVA DI TITOLAZIONE In generale al punto equivalente per un sistema aOx1 + bRid2 = bOx2 + aRid1 Il valore di E si calcola dalla seguente espressione Eeq = 0 bE 1 + 0 aE 2 / a+b CALCOLO DELLA CURVA DI TITOLAZIONE 3) Dopo in punto di equivalenza Si applica l’equazione di Nerst alla specie da titolare (Ce) ECe = ECe0 + 0.059log[Ce+4]/[Ce+3] CURVA DI TITOLAZIONE INDICATORI DI OSSIDORIDUZIONE Sostanze organiche che possono esistere in una forma ossidata ed una ridotta aventi colori diversi Indox + ne = Indrid Eind = EInd0 x 0.059/nlog[Indox]/[Indrid] Intervallo di viraggio EInd = EInd0 ± 0.059/n Tanto maggiore è il numero n di elettroni coinvolti nella semireazione tanto più netta è la variazione di colore INDICATORI DI OSSIDORIDUZIONE Indox + ne = Indrid Al punto equivalente Eind = EInd0 Potenziale di transizione L’indicatore viene scelto in modo da avere un potenziale di transizione il più possibile simile al potenziale del punto di equivalenza della titolazione CALCOLO DEL POTENZIALE DI UNA REAZIONE REDOX Ox1 + Rid2 = Rid1 + Ox2 E= + E - E Dove E+ è pari al potenziale della semicoppia Ox1/Rid1, E- è pari al potenziale della semicoppia Rid2/Ox2 METODI OSSIDIMETRICI A) PERMANGANOMETRIA B) TITOLAZIONI CON SALI DI CROMO (VI) ESAVALENTE C) CERIMETRIA D) IODIMETRIA E) IODOMETRIA F) BROMOMETRIA G) BROMATOMETRIA H) TITOLAZIONI CON IODIO (V) PERMANGANOMETRIA Determinazione mediante soluzioni di KMnO4 Ambiente acido MnO4- + 8H+ + 5e = Mn+2 + 4H2O (E0 = 1.51 V) Ambiente neutro o debolmente basico MnO4- + 4H+ + 3e = MnO2 + 2H2O (E0 = 1.695 V) Ambiente neutro in presenza di Ba+2 MnO4- + e = MnO4- (E0 = 0.564 V) PERMANGANOMETRIA KMnO4 Ambiente acido PE = PM/5 158.04/5 = 31.608 Ambiente neutro o debolmente basico PE = PM/3 158.04/5 = 52.68 Ambiente neutro in presenza di Ba+2 PE = PM/1 158.04/1 = 158.04 PERMANGANOMETRIA KMnO4 Ambiente acido (per acido solforico) (2MnO4- + 10Cl- + 16H+ = 2Mn+2 + 5Cl2 + 8H2O) PERMANGANOMETRIA KMnO4 a) Colore intenso delle soluzioni e difficoltà di lettura della buretta b) Instabilità delle soluzioni PERMANGANOMETRIA La soluzione di KMnO4 viene controllata nel titolo usando ossalato di sodio come sostanza madre 2MnO4- + 5H2C2O4 + 6H+ = 2 Mn+2 +10CO2 + 8H2O PERMANGANOMETRIA Dosaggio dell’acqua ossigenata FU 2MnO4- + 5H2O2 + 6H+ = 2 Mn+2 +5O2 + 8H2O L’ossigeno passa da -1 a 0 il PE dell’acqua ossigenata è pertanto uguale alla metà del PM La concentrazione dell'acqua ossigenata viene espressa solitamente in "volumi": ad esempio le soluzioni diluite usate come disinfettante portano la dicitura "10 volumi" oppure "12 volumi"; esistono in commercio anche soluzioni molto più concentrate, ad esempio a 130 volumi. La concentrazione in volumi di una soluzione di acqua ossigenata è il rapporto tra il volume di ossigeno gassoso, misurato nelle condizioni normali (t = 0 °C, P = 1 atm), che si sviluppa per decomposizione completa dell'acqua ossigenata contenuta in un dato volume di soluzione ed il volume della soluzione medesima. Se, ad esempio, una soluzione di acqua ossigenata ha un titolo pari a 10 volumi questo significa che dalla decomposizione completa dell'acqua ossigenata contenuta in 1 litro di soluzione derivano 10 litri di ossigeno gassoso, volume di gas misurato a t = 0 °C e P = 1 atm. La definizione fa riferimento alla reazione di decomposizione dell'acqua ossigenata: 2H2O2 = 2H2O + O2 68 g 22.4 l 2H2O2 = 2H2O + O2 68 g 22.4 l Calcolare la concentrazione in volumi di una soluzione di acqua ossigenata 1.5 M In un 1 litro di soluzione sono disciolte 1.5 mol di acqua ossigenata pari a 51 g. Mediante la proporzione 68 : 22.4 = 51 : x Si ricava che x = 16.8 l. Per cui la decomposizione completa dell’acqua ossigenata contenuta in 1 l di soluzione genera 16.8 l di ossigeno gassoso. Il rapporto tra il volume di ossigeno e ilvolume di soluzione è pari a 16.8/1 per cui la concentrazione di acqua ossigenata corrisponde a 16.8 volumi 2H2O2 = 2H2O + O2 68 g 22.4 l Calcolare la concentrazione in volumi di una soluzione di acqua ossigenata 39% p/v In 100 ml di soluzione sono disciolti 39 g di acqua ossigenata per cui in 1 l della stessa soluzione saranno disciolti 390 g. Similmente a prima dalla proporzione 68 : 22.4 = 390 : x Si ricava che x = 128 l. Per cui la decomposizione completa dell’acqua ossigenata contenuta in 1 l di soluzione genera 128 l di ossigeno gassoso. Il rapporto tra il volume di ossigeno e ilvolume di soluzione è pari a 128/1 per cui la concentrazione di acqua ossigenata corrisponde a 128 volumi 2H2O2 = 2H2O + O2 68 g 22.4 l Calcolare la concentrazione in volumi di una soluzione di acqua ossigenata 2.5 N PE = PM/2 PE = 34/2 = 17 In 1 l di soluzione 2.5 N sono contenuti 2.5 equivalenti di acqua ossigenata pari a 2.5x17 = 42.5 g. Applicando la proporzione 68 : 22.4 = 42.5 : x Si ricava che x = 14 l. La concentrazione pertanto è 14 volumi TITOLAZIONI CON SALI DI CROMO (VI) K2Cr2O7 Cr2O7-2 + 14H+ + 6e = 2 Cr+3 + 7H2O Cr+6 = Cr+3 PE = PM/6 TITOLAZIONI CON SALI DI CROMO (VI) K2Cr2O7 a) b) c) d) E’ una sostanza madre Soluzioni chimicamente stabili nel tempo Non ha stati di ossidazione intermedi Non ossida ioni Cl- e quindi può essere usato in presenza di HCl (determinazione di sali ferrosi nei minerali che in generali vengono per l’appunto disciolti per aggiunta di HCl) e) Seppure colorate sono sufficientemente trasparenti da agevolare la letteura della buretta TITOLAZIONI CON SALI DI CROMO (VI) K2Cr2O7 CERIMETRIA Alternativa alla permanganometria in quanto il potenziale di semicoppia è pressochè analogo Ce+4 + e = Ce+3 PE = PM CERIMETRIA a) E’ possibile usare sostanze madri per preparare soluzioni ceriche a titolo noto come ad esempio il nitrato ammonico cerico (NH4)2[Ce(NO3)6] b) Altri sali di cerio (IV) come il solfato non sono sostanze madri e vanno standardizzati con sostanze madri come As2O3 c) Non ha stati di ossidazione intermedi d) Chimicamente stabili nel tempo e) Il Ce+4 non ossida gli ioni Clf) Le soluzioni sono trasparenti CERIMETRIA a) Il potenziale dipende dal pH e dalla formazione di complessi b) I sali di cerio (IV) sono costosi CERIMETRIA Come indicatore si usa in genere la ferroina CERIMETRIA Determinazione del menadione “Un campione pesato sciolto in acido acetico glaciale si tratta con polvere di Zn e HCl…” A) Perché acido acetico glaciale: la sostanza non è solubile in acqua B) Perchè Zn/HCl: si sviluppa H2 che serve a ridurre quantitativamente il menadione alla sua forma idrochinonica CERIMETRIA Determinazione del menadione O OH O OH CERIMETRIA Determinazione del menadione “…Si titola con ammonio e cerio nitrato 0.1N” O OH + Ce+4 OH + Ce+3 + 2H+ O PE = PM/2 = 86.1 CERIMETRIA Determinazione del paracetamolo “Un campione pesato si scioglie in acido solforico diluito e si bolle a ricadere per 1h…” A) Perché? L’ambiente acido serve ad idrolizzare il gruppo acetamido NHCOCH3 NH2 OH OH CERIMETRIA Determinazione del paracetamolo “…Si titola con ammonio e cerio solfato 0.1 in presenza di ferroina” NH2 NH + 2 Ce+4 OH + 2 Ce+3 + 2H+ O PE = PM/2 = 75.6 IODIMETRIA E IODOMETRIA I2 + 2e = 2I- E0 = 0.535 V 1) Titolazioni dirette o IODIMETRICHE: viene utilizzato come agente ossidante una soluzione a titolo noto di iodio con la quale si titolano sostanze riducenti. Dato il valore del potenziale lo iodio è un ossidante blando adatto a titolare riducenti energici il cui potenziale standard sia di molto inferiore a quello della semicoppia iodio/ioduro IODIMETRIA E IODOMETRIA I2 + 2e = 2I- E0 = 0.535 V 2) Titolazioni indirette o IODOMETRICHE: un eccesso di KI viene fatto reagire con ossidanti energici. Dalla reazione si sviluppa iodio che viene poi retrotitolato con una soluzione di tiosolfato sodico (Na2S2O3) a titolo noto secondo la reazione 2S2O3-2 + I2 = 2I- + S4O6-2 (tetrationato) IODIMETRIA I2 è una molecola apolare che non è solubile in acqua. Inoltre ha una spiccata volatilità pur essendo solido. La preparazione della soluzione di I2 avviene pesando all’istante lo I2 in bilancia analitica e scigliendolo ina soluzione contenente KI I2 + I- = I3- IODIMETRIA La soluzione va poi conservata in recipienti di vetro ambrato in quanto la luce catalizza la decomposizione di I2 in HI. Da evitare il contatto con materiali diversi dal vetro come la gomma IODIMETRIA La soluzione di I2 viene standardizzata con anidride arseniosa (As2O3) previamente essiccata a 110 °C As2O3 + 2OH- = 2AsO2- + H2O (solubilizzazione - metarsenito) Si neutralizza l’eccesso di alcali con HCl e si aggiunge NaHCO3 per evitare che si instauri l’equilibrio AsO2- + I2 + 2H2O = H2AsO4- + 2I- + 2H+ AsO2- + I2 + 2HCO3- = H2AsO4- + 2I- + 2CO2 PE (As2O3) = PM/4 = 197.82/4 = 49.455 IODIMETRIA La soluzione di I2 non è stabile a pH alcalini! I2 + 2OH- = I- + IO- + H2O (a freddo) 3I2 + 6OH- = 5I- + IO3- + 3H2O (a caldo) REAZIONI DI DISPROPORZIONE IO- = ipoiodito IO3- = iodato IODIMETRIA Come indicatore si usa la salda d’amido IODIMETRIA IODOMETRIA La soluzione di Na2S2O3 si prepara sciogliendo il sale in acqua esente da CO2 La presenza di CO2 nel mezzo di reazione abbasserebbe il pH della soluzione con conseguente decomposizione del tiosolfato S2O3-2 + 2H+ = H2SO3 + S IODOMETRIA La soluzione di Na2S2O3 si standardizza per via indiretta mediante una soluzione a titolo di KIO3 (sostanza madre) alla quale si aggiunge un eccesso noto di KI retrotitolando con la soluzione di tiosolfato lo I2 che si libera dalla reazione in presenza di salda d’amido di cui si seguirà la decolorazione (gialla) IO3- + 5I- + 6H+ = 3I2 + 3H2O IODOMETRIA IO3- + 5I- + 6H+ = 3I2 + 3H2O Spesso alla salda d’amido si preferisce usare un solvente organico non miscibile in acqua (CH2Cl2, CHCl3, CCl4) e più “pesante” della stessa acqua. Questo scioglierà selettivamente lo iodio che impartirà alla soluzione organica un colore rosavioletto IODOMETRIA IO3- + 5I- + 6H+ = 3I2 + 3H2O Nella standardizzazione con KIO3 ogni molecola di iodato equivale a 6 atomi di iodio quindi PE (KIO3) = PM/6 214.02/6 = 35.67 IODOMETRIA Le titolazioni iodometriche non vanno effettuate a pH alcalini S2O3-2 + 4I2 + 10OH- = 2SO4-2 + 8I- + 5H2O Parimenti non vanno effettuate a pH molto bassi H2S2O3 = H2SO3 + S H2SO3 + I2 +H2O = 2I- +SO4-2 + 4H+ (2 equivalenti di iodio per mole di acido solforoso) IODOMETRIA Le soluzioni di I- a pH molto bassi si ossidano all’aria O2 + 4I- + 4H+ = 2I2 + 2H2O IODIMETRIA: APPLICAZIONI Dosaggio dell’H2O (metodo di Karl-Fischer) Reattivo di K.F.: I2/SO2/Piridina (C5H5N) [eccesso] in metanolo anidro H2O + I2 + SO2 + 3C5H5N = 2C5H5N.HI + C5H5N.SO3 PE (H2O) = PM/2 IODIMETRIA: APPLICAZIONI Dosaggio dell’acido ascorbico Acido deidroascorbico PE = PM/2 = 88.06 IODOMETRIA: APPLICAZIONI Dosaggio del cloro attivo negli ipocloriti Soluzioni di ipoclorito in ambiente acido libera Cl2 (cloro attivo) il quale esercita una forte azione ossidante ClO- + Cl- + 2H+ = Cl2 + H2O (i prodotti commerciali a base di ipoclorito vengono prodotti per elettrolisi di soluzioni di cloruro per cui normalmente contengono Cl- in eccesso) IODOMETRIA: APPLICAZIONI Cl2 + 2I- = I2 + 2Cl(sommando con la reazione precedente) ClO- + 2I- + 2H+ = Cl- + I2 + H2O Lo iodio viene poi retrotitolato con tiosolfato PE (Cl2) = PM IODOMETRIA: APPLICAZIONI Cloramina T CH3C6H4SO2NClNa + 2I- + 2H+ = CH3C6H4SO2NH2 + I2 + Na+ Cl- PE = PM/2 = 140.9 BROMOMETRIA Titolazioni che impiegano un eccesso noto di bromo (Br2). Il bromo non reagito viene fatto reagire con KI in modo da liberare una quantità equivalente di I2 che verrà poi titolato con tiosolfato BROMOMETRIA BROMOMETRIA Generazione del Br2 in situ Bromato di potassio + bromuro di potassio BrO3- + 5Br- + 6H+ = 3Br2 + 3H2O BROMOMETRIA: APPLICAZIONI (eccesso) Br2 + 2I- = I2 + 2BrPE (tribromofenolo) = PM/6 94.11/6 = 15.68 BROMOMETRIA: APPLICAZIONI Il colore del tribromofenolo potrebbe interferire con la titolazione. Per questo nella determinazione si aggiunge un solvente organico clorurato in genere CH2Cl2 che “isola” il composto permettendo di evidenziare il colore della salda d’amido nella fase acquosa BROMOMETRIA: APPLICAZIONI Determinazione dell’isoniazide
Scaricare