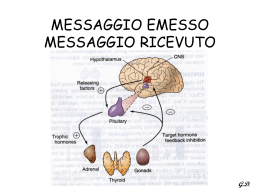
SURRENE Dott.ssa Donatella Pastore DOVE SI TROVA Il surrene è un organo pari, di forma piramidale (4-6g), situato sulla superficie antero-mediale del polo superiore di ciascun rene. L'apporto ematico è assicurato da numerose piccole arterie che originano dall'arteria frenica inferiore, dall'aorta e dalle arterie renali. Sono situate sui poli renali superiori, vascolarizzate da tre arterie surrenali (superiore, inferiore e media) ramificazioni dell’aorta. L’azione delle surrenali è controllata dal sistema nervoso vegetativo simpatico e parasimpatico, sono fra loro autonome e lavorano in maniera indipendente. Sezionando le ghiandole surrenali possiamo notare la presenza di due formazioni cellulari distinte: la midollare e la corticale, poste rispettivamente nella zona centrale e periferica della ghiandola I surreni sono due ghiandole endocrine, ciascuna composta da due distinte aree concentriche, la corticale e la midollare, che differiscono tra loro dal punto di vista embriologico e anatomo-funzionale. La prima è di origine mesodermica, la seconda è di derivazione neuroectodermica. L’area Midollare produce adrenalina e noradrenalina sotto l’influenza di situazioni di paura o stress, con effetti sulla muscolatura liscia dei vasi sanguigni che si contrae vasocostringendoli; sulla muscolatura scheletrica ha effetti inversi, poiché dilata i vasi sanguigni che la irrorano. La situazione che ne deriva consente l’immediata funzionalità di distretti anatomici potenzialmente implicati in situazioni di pericolo. Sotto l’effetto dell’adrenalina viene altresì incrementata la frequenza cardiaca, la pressione sanguigna, e la concentrazione plasmatica di zuccheri circolanti, rilasciati dai depositi epatici. Nella Corticale del surrene sono secreti gli ormoni corticoidi divisi in tre categorie distinte: i mineralcorticoidi con funzione di stimolo nella ritenzione di cloruro di sodio e acqua ed escrezione di potassio, i glucocorticoidi che regolano la glucogenesi epatica, e gli ormoni sessuali (androgeni) che interagiscono con il testosterone e progesterone per lo sviluppo dei caratteri sessuali secondari. Controlla importanti funzioni vitali, quali la risposta adattativa allo stress, l’equilibrio elettrolitico, la pressione arteriosa, lo sviluppo puberale. Tra i glucocorticoidi più importanti citiamo il cortisolo fondamentale nel metabolismo dei carboidrati e nei processi di adattamento allo stress, ma anche potente antinfiammatorio con azione antiimmunitaria. Nell’organismo stimola la conversione in glucosio delle proteine ed il conseguente stoccaggio sotto forma di glicogeno. Per tali ragioni è un cattivo alleato nella pratica sportiva, soprattutto di sport finalizzati all’incremento delle masse muscolari, vista la sua azione catabolica. La riduzione della quota proteica indotta determina astenia e un inevitabile calo della prestazione fisica. Tra i mineralcorticoidi, l’aldosterone è di primaria importanza nell’omeostasi dei liquidi extracellulari. SURRENE CORTICALE (più esterna) MIDOLLARE (più interna) Secerne corticosteroidi Secerne catecolamine Zona glomerulare (più esterna) (mineralcorticoidi) Regolata dal sistema renina-Angiotensina Zona fascicolata (glucocorticoidi) Zona reticolare (androgeni) Regolate dall’ACTH SURRENI Costituiti da: • ZONA CORTICALE 90% (derivazione mesodermica) • ZONA MIDOLLARE 10% (derivazione neuroectodermica) 10% 110 70% 0 20% 90% 10% Compartimenti funzionali della corteccia surrenale ZONA glomerulare PRINCIPALE ORMONE SECRETO FATTORI DI CONTROLLO aldosterone sistema reninaangiotensina DHEA:(deidroepiandrosterone) fascicolata cortisolo ACTH ACTH:corticotropina reticolare DHEA ACTH CORTICOSURRENE Il corticosurrene produce 3 principali gruppi di ormoni: Glucocorticoidi Androgeni Mineralcorticoidi Feedback lungo IPOTALAMO + CRH (corticotropin-releasing hormone) - Feedback corto IPOFISI ACTH (corticotropina) + - SURRENE CORTISOLO L’azione più importante dell’ACTH consiste nella stimolazione delle cellule delle zone fascicolata e reticolare del corticosurrene con conseguente produzione di cortisolo e degli androgeni. L’ipersecrezione di ACTH e degli altri peptidi ad azione melanotropa derivanti dalla POMC(alpha e beta MSH, beta-LPH), provoca iperpigmentazione, come si osserva nella malattia di Addison Esone 1 Esone 2 GENE Introne 1 Introne 2 Trascrizione mRNA Regione Tradotta Traduzione e Rimozione del Segnale POMC proopiomelanocortina Clivaggio Post-Traduzionale N-POMC 1-76 J-PEPTIDE B-LPH ACTH 1-39 Processo Parziale (30%) Stati Patologici N-POMC 1-48 g-MSH g-LPH b-END ASSE IPOTALAMO-IPOFISI-SURRENE Il CRH stimola la secrezione di ACTH in maniera pulsatile: il ritmo circadiano determina un picco nella secrezione mattutina e progressivamente declina durante la giornata. Numerosi stress determinano un aumento della secrezione di ACTH: stress fisici (traumi, ipossia, ipoglicemia acuta, interventi chirurgici), emotivi (dolore, depressione) . ASSE IPOTALAMO-IPOFISI-SURRENE •L’ACTH è secreto episodicamente dall’ipofisi e ha un’emivita in circolo di circa 20 minuti. • Il numero dei picchi, più che la loro ampiezza, è il fattore determinante la quantità giornaliera di cortisolo prodotto. • Pattern di secrezione legato al ritmo sonno veglia. ASSE IPOTALAMO-IPOFISI-SURRENE L’ACTH stimola la sintesi degli steroidi della corteccia surrenalica legandosi al suo recettore ed attivando una adenilciclasi con produzione di AMPc (effetto rapido) e inducendo l’espressione dei geni che codificano gli enzimi coinvolti nella steroidogenesi (effetto lento). Il fattore che limita la biosintesi steroidea è il trasporto del colesterolo alla membrana mitocondriale regolato dalla proteina StAR (Steroidogenic Acute Regulatory protein) La conseguenza principale è l’aumento dell’attività dell’enzima P450scc che converte il colesterolo a pregnenolone, innescando la cascata steroidogenica Il tipo di ormone prodotto dalle cellule corticosurrenali dipende dall’attività enzimatica presente all’interno delle stesse. Molte attività enzimatiche del corticosurrene sono in comune con le gonadi. • A P-450scc : 20-22 idrossilasi : 20-22 desmolasi •C :3beta idrossisteroidodeidrogenasi • B P-450 c 17 : 17 a idrossilasi • H P-450 c 17 : 17-20 Desmolasi • D P-450 c 21 : 21 a idrossilasi • E P450 c11 : 11 beta idrossilasi • F P450 c11 : 18 idrossilasi • G P450 c11 : 18 aldeidesintetasi •I : 3b-idrossisteroidosulfotranferasi TRASPORTO PLASMATICO I corticosteroidi circolano nel sangue sia liberi che legati a proteine ma solo l’ormone libero è biologicamente attivo. Questo legame con le proteine determina un’emivita più lunga dello steroide, prevenendone il catabolismo da parte degli enzimi epatici. Il cortisolo è presente in forma libera nel sangue solo per il 3-10%, il 90% è legato alla transcortina o Corticosteroid Binding Globulin (CBG) e una piccola quota è legata all’albumina Gli androgeni circolano prevalentemente legati all’albumina. Il testosterone e l’estradiolo si legano per il 60% alla Sex-Hormone-Binding Globulin (SHBG) solo l’12% è in forma libera MECCANISMO D’AZIONE Gli ormoni steroidei diffondono passivamente attraverso le membrane cellulari dei tessuti bersaglio legandosi a specifici recettori intracellulari (superfamiglia dei recettori nucleari) Il complesso ormone-recettore migra a livello nucleare dove regola l’espressione di geni specifici Il complesso ormone-recettore può legarsi direttamente al DNA o tramite fattori di trascrizione Gli ormoni steroidei possono legarsi anche a recettori non specifici (es. il cortisolo ha anche una debole attività mineralcorticoide) CORTICOSURRENE: ORMONI STEROIDEI Glucocorticoidi → promuovono la formazione del glucosio dalle proteine, favoriscono la deposizione dei grassi, incrementano il flusso ematico renale, riducono i processi infiammatori, esercitano un’azione antiinsulinica diretta. Mineralcorticoidi → favoriscono l’assorbimento del sodio e l’eliminazione del potassio a livello dei tubuli renali, con riassorbimento di acqua. Androgeni → concorrono alla mascolinizzazione ed all’anabolismo proteico, interferiscono sulla crescita dei peli corporei, modificano le masse muscolari. I glucocorticoidi sono una classe di ormoni steroidei che, nell'uomo, sono prodotti in particolare nella zona fascicolata della corticale del surrene. Il più importante glucorticoide umano è il cortisolo. Nella farmacopea moderna esistono numerosi glucorticoidi sintetici, p.es. il prednisone. I glucorticoidi agiscono sul metabolismo dei carboidrati e riducono le risposte infiammatorie e immunitarie. I medicinali a base di glicorticoidi trovano impiego soprattutto per contrastare infiammazioni, allergie e reazioni di rigetto nei trapianti d'organo. Tra i numerosi effetti collaterali negativi si annoverano soprattutto aumento della glicemia, diabete mellito tipo 2, riduzione nella fissazione del calcio e la conseguente osteoporosi, impotenza, calo della libido, ipoandrogenismo, depressione, perdita di massa cutanea e muscolare, ipertensione, sindrome di Cushing, ipocorticosurrenalismo. La ricerca scientifica sta sviluppando molecole sintetiche di glucocorticoidi che, pur mantenendo il loro effetto antinfiammatorio, aumentano il meno possibile il catabolismo e in generale gli effetti collaterali. Azione dei Glucocorticoidi • Inotropismo, gittata cardiaca • ↑ Sensibilità dei Tessuti Periferici alle Catecolamine • ↑ Resistenza alla Fatica Muscolare • Liberano grandi riserve di energia attraverso la gluconeogenesi, la lipolisi e la proteolisi • Iperglicemia • Azione Catabolica a livello di tutti i tessuti muscolari tranne il miocardio ed il diaframma • Iperinsulinemia Azione dei Glucocorticoidi • Azione antinfiammatoria: Stabilizzazione delle membrane lisosomiali (inibizione della sintesi delle prostaglandine e dei leucotrieni), ↓ della permeabiltià vascolare, ↓ attività chemiotattica. •Azione immunosoppressiva: ↓ dei Linfociti circolanti, dei monociti e degli eosinofili, inibizione della produzione delle citochine •Azione Cardiaca: Effetto inotropo positivo, ↑ gittata cardiaca e la sensibilità dei vasi alle catecolamine. Nei pz con deficit di Cortisolo in caso di stress può insorgere Shock Azione dei Glucocorticoidi • Azione Renale: ↑ del filtrato glomerulare, del flusso renale e della clearance dell’acqua libera. •Attività mineralcorticoide si esplica con un’aumentata escrezione di potassio e ioni idrogeno, un’aumentata ritenzione di sodio. •Azione sulla crescita: dosi elevate di glucocorticoidi inibiscono la crescita lineare, la maturazione dell’osso per l’azione sui nuclei di ossificazione a livello epifisario e riducono la secrezione del GH. •Nel differenziamento accelerano il processo di maturazione del Fegato e dell’apparato intestinale ed stimolano la produzione del Surfactante polmonare. Azione dei Glucocorticoidi • Azione sul Metabolismo del Calcio e dell’osso: Bilancio negativo del calcio riducono l’assorbimento intestinale e aumentano l’escrezione renale. Aumento compensatorio della secrezione del PTH. •Un moderato aumento dei glucocorticoidi genera euforia e un miglioramento della sensazione di benessere; un incremento consistente provoca irritazione e labilità emotiva, difficoltà di concentrazione e memoria. Nell’ipocorticosurrenalismo si ha astenia, facile irritabilità, depressione, introversione, diminuzione dell’appetito e aumentata sensibilità gustativa e olfattiva •L’eccesso di glucocorticoidi inibisce l’attività dei fibroblasti con perdita di collagene e di tessuto connettivo sottocutaneo • La clearance osmolare è il volume di plasma liberato da tutti i soluti osmoticamente attivi nell'unità di tempo. La clearance dell'acqua libera è la differenza tra l'ammontare di acqua escreta con le urine nell'unità di tempo (o flusso urinario) e la clearance osmolare. Questa misura indica quindi se si sta producendo un volume urinario maggiore del volume di plasma depurato oppure il contrario, cioè se si sta perdendo acqua o se c'è ritenzione idrica. Cortisolo: ↑ Neoglucogenesi ↑ Lipolisi ↓ Glicogenosintesi ↓ Captaz. glucosio (muscolo) ↓ Sintesi proteica ↑ Catabolismo proteico ↑ Rilascio acidi grassi liberi ORMONI PRODOTTI DALLE GHIANDOLE SURRENALI le ghiandole surrenali sono strutture a forma di piramide, appoggiate al polo superiore dei reni. Ormone CORTISOLO Funzione Controlla il metabolismo degli zuccheri, dei grassi e delle Mattino proteine e regola la pressione del sangue. Viene prodotto in quantità maggiore al mattino rispetto alla sera. Per prepararsi 5-25 μg/dl all'esame è consigliabile sospendere l'attività fisica intensa 24 ore prima del test ed essere a digiuno da almeno 8 ore. E' Sera bene anche segnalare al laboratorio d'analisi l'eventuale I valori si riducono del assunzione di farmaci a base di cortisone nei 6 mesi 50% precedenti l'esame. Regola l'equilibrio dei sali minerali nell'organismo. Nelle 2 settimane che precedono l'esame, si devono evitare farmaci ALDOSTERONE diuretici e a base di propanololo e non si deve mangiare liquirizia. Adulto 3-16 nanogrammi/100ml di sangue Gravidanza 18-100 nanogrammi/100ml di sangue Il Cortisolo è implicato in molte funzioni essenziali dell’organismo, come il metabolismo e l’utilizzo delle proteine, dei carboidrati e dei grassi, la risposta dell’organismo allo stress fisico o psichico, il controllo dell’infiammazione e di livelli adeguati di zucchero nel sangue. Il cortisolo aiuta a mantenere una pressione del sangue appropriata, e una normale attività nervosa e cerebrale. Anche il DHEA svolge un ruolo nel metabolismo proteico, glicidico e lipidico, e partecipa al mantenimento di un corretto livello glicemico. Contribuisce alla regolazione del peso corporeo, della pressione arteriosa e della funzione immunitaria. È utilizzato dall’organismo come precursore aspecifico dei vari ormoni steroidei, dagli androgeni agli ormoni femminili. Il DHEA rappresenta un contro-regolatore dell’azione del cortisolo e ne modula gli effetti perversi indotti da un’eccessiva secrezione. Fisiopatologia e clinica corticosurrenale • Insufficienza corticosurrenale • Sindromi da iperfunzione surrenale Insufficienza corticosurrenale Inadeguata secrezione di ormoni della corteccia surrenale, in particolare di cortisolo, come conseguenza della distruzione di più del 90% della corticale del surrene (iposurrenalismo primario) o di un deficit della secrezione ipofisaria di ACTH (iposurrenalismo secondario*) o della secrezione ipotalamica di CRH (iposurrenalismo terziario) *spesso secondario a terapia prolungata con corticosteroidi in malattie infiammatorie, allergiche, autoimmuni…… Insufficienza corticosurrerale cronica primitiva o Morbo di Addison: etiologia • Adrenalite autoimmune • Tubercolosi • Altre 1% • • • • • • • • 80% 19% Istoplasmosi, blastomicosi, sarcoidosi Emocromatosi, amiloidosi Malattie opportunistiche associate all’AIDS Adrenomielodistrofia Carcinomi metastatici Deficit congenito familiare dei glucocorticoidi Resistenza isolata ai glucocorticoidi Iatrogene: ketoconazolo, mitotate, aminoglutemide, metirapone Morbo di Addison La forma più frequente è quella autoimmune (80-90% dei casi) caratterizzata da un’infiltrazione di linfociti T citotossici, che porta all’atrofia bilaterale della corticale dei surreni. Sono stati individuati anticorpi circolanti contro la 21-idrossilasi ( raramente 17α-idrossilasi). Talvolta si associa ad altre malattie autoimmuni: • PAS di tipo 1 (m.di Addison, ipoparatiroidismo, candidosi mucocutanea) • PAS di tipo 2 (m. di Addison, tiroidite di Hashimoto, DM1) PAS: Sindromi Polighiandolari Autoimmuni M. Di Addison: patogenesi Distruzione o atrofia primaria del corticosurrene → ↓ corticosteroidi (cortisolo) → inefficace controregolazione ipotalamo-ipofisaria→ ↑ secrezione di CRH e dei peptidi derivanti dalla pro-opiomelanocortina ACTH e MSH (responsabile della melanodermia). All’ipocortisolismo si associa ipoaldosteronismo. BASSI valori di CORTISOLEMIA e ELEVATI valori di ACTH M. Di Addison: quadro clinico • • • • • • • • • • • • Astenia e adinamia intensa Stato depressivo e apatia Anoressia Disturbi gastrointestinali (vomito, diarrea, dolori crampiformi) Dimagramento Disordini elettrolitici (iperpotassiemie, iposodiemia) Disidratazione Ipotensione arteriosa (vertigini in ortostatismo e lipotimie) Desiderio di cibi salati Ipoglicemia Iperazotemia (da riduzione del filtrato glomerulare) Melanodermia (iperpigmentazione) M. Di Addison: diagnosi • Dosaggio cortisolo libero urinario 24 ore (ridotto) • Dosaggio ACTH (utile per differenziare l’ipocorticosurrenalismo primario da quello secondario e terziario – aumentato nel primo caso) • PRA attività reninica plasmatica (elevata, per diminuita produzione di aldosterone) • Elettroliti plasmatici (iperkaliemia, iposodiemia) • Dosaggio Ab anti-surrene • Test del metopirone, dell’insulina o del CRH Indagini dinamiche: Si basano sui meccanismi di feedback che regolano l’asse IIS. Si distinguono in indagini di stimolo e di soppressione dell’asse. Esse permettono di valutare l’integrità e la funzione dell’asse e di stabilirne la capacità funzionale residua e di risposta allo stress. La risposta all’inibizione e allo stimolo permette la diagnosi di iper- o ipofunzione surrenale e nel secondo caso di determinarne l’origine primaria o secondaria. Un mancato incremento dei valori di ACTH indicano una insufficienza surrenale secondaria Quadro ematologico dell’insufficienza surrenale primaria: Iposodiemia Iperpotassiemia Anemia Eosinofilia Linfocitosi Ipoglicemia Nel morbo di Addison si assiste all'aumento dell'escrezione di Na e alla diminuzione dell'escrezione di K, specialmente nelle urine, che sono isotoniche, ma anche nel sudore, nella saliva e nel tratto GI. Ne risultano basse concentrazioni ematiche di Na e Cl e un'alta concentrazione sierica di K. L'incapacità di concentrare le urine, associata alle modificazioni dell'equilibrio elettrolitico, determina la comparsa di grave disidratazione, ipertonicità plasmatica, acidosi, riduzione del volume circolante, ipotensione e collasso circolatorio. Il deficit di cortisolo contribuisce all'ipotensione e causa alterazioni del metabolismo dei carboidrati, dei grassi e delle proteine, nonché un notevole aumento della sensibilità all'insulina. In assenza di cortisolo, vengono sintetizzate quantità insufficienti di carboidrati a partire dalle proteine; ne risultano ipoglicemia e diminuzione del glicogeno epatico. A esse consegue astenia, dovuta in parte al deficit della funzione neuromuscolare. A causa della ridotta secrezione surrenalica diminuisce la resistenza alle infezioni, ai traumi e ad altri stress. L'astenia del muscolo cardiaco e la disidratazione determinano una riduzione della gittata cardiaca e può comparire insufficienza circolatoria. La riduzione dei livelli ematici di cortisolo comporta un aumento della produzione di ACTH ipofisario e un aumento dei livelli ematici di b-lipotropina, la quale ha attività melanocito-stimolante e produce l'iperpigmentazione della cute e delle mucose caratteristica del morbo di Addison. Esami di laboratorio Le alterazioni dei livelli sierici degli elettroliti, comprendenti la riduzione del Na (< 130 mEq/l), l'aumento del K (> 5 mEq/l), la riduzione del HCO3 (da 15 a 20 mEq/l) e l'aumento dell'azoto ureico, associati a un quadro clinico caratteristico, suggeriscono la presenza del morbo di Addison . I livelli plasmatici di renina e ACTH sono aumentati. Quando l'insufficienza corticosurrenalica è provocata da un'inadeguata produzione di ACTH da parte della ghiandola ipofisaria, i livelli degli elettroliti sono generalmente nella norma. Iter diagnostico negli ipocorticosurrenalismi Sospetto clinico, Iposodiemia, iperpotassemia, Cortisolemia bassa o ai limiti Test rapido ACTH Cortisolemia <20g/dl INSUFFICIENZA SURRENALE Cortisolemia >20g/dl ESCLUSIONE MALATTIA Cortisolemia >20g/dl Ma clinica sospetta Test metapirone o Insulina o CRH ACTH plasmatico normale ACTH >50 pg/ml INSUFFICIENZA PRIMARIA ACTH <50 pg/ml INSUFFICIENZA SECONDARIA alterati Quadro clinico: La maggior parte delle manifestazioni cliniche della malattia di Addison, quali astenia, debolezza muscolare, anoressia,nausea, vomito, ipotensione e ipoglicemia, consegue alla carenza degli effetti metabolici dei glicocorticoidi. Alcuni sintomi sono invece dovutial deficit di ormoni mineraloattivi (disidratazione, ipotensione, iponatriemia, iperkaliemia, acidosi) o di androgeni (perdita di peli). M. Di Addison: terapia Terapia sostitutiva: somministrazione di dosi adeguate di idrocortisone o cortisone acetato; a volte utile l’associazione con farmaci ad azione mineraloattiva (fluoroidrocortisone) Sindromi da iperfunzione surrenale La SINDROME di CUSHING è una condizione di iperfunzione cortico-surrenale caratterizzata da una prevalente iperincrezione di cortisolo. ECCESSO DI GLUCOCORTICOIDI Sindrome di Cushing • ACTH-dipendente • Morbo di Cushing 68% (ipersecrezione ipofisaria di ACTH) • Sindrome da ACTH ectopico ( es. carcinoma a chicco d’avena del polmone) 12% • ACTH-indipendente (ipersecrezione di Cortisolo) • • • • Adenoma surrenalico 10% Carcinoma surrenalico 8% Iperplasia surrenalica micronodulare 1% Iperplasia surrenalica macronodulare < 1% Sindrome di Cushing: quadro clinico • • • • • • • • • • Obesità centripeta Pletora facciale (facies lunare) Ridotta crescita lineare (nel bambino) Oligo-menorrea Irsutismo Ipertensione Ridotta tolleranza glicidica Impotenza Osteopenia con fratture Debolezza muscolare miopatia 94% 84% 80% 76% 73% 72% 67% 67% 59% 58% Sindrome di Cushing: quadro clinico • Strie rubre • Edema periferico 56% • Acne, cute grassa • Facilità alle ecchimosi • Disturbi psichici • Polidipsia-poliuria • Insufficienza cardiaco-congestizia • Calcoli renali • Cefalea • Melanodermia (s.da ACTH ectopico) 57% 53% 53% 48% 34% 22% 16% 14% 6% Gli arti sono di ridotto spessore per ipotrofia muscolare dovuta all’aumentato catabolismo proteico provocato dall’ ipercortisolemia. Sindrome di Cushing: diagnosi • Dosaggio del cortisolo libero urinario delle 24 ore • Dosaggio cortisolo plasmatico (ritmo circadiano 8-16-23) • Dosaggio ACTH plasmatico • Test di inibizione con alte dosi di desametasone (test di Liddle) per la diagnosi differenziale tra Morbo di Cushing e S. dell’ACTH ectopico Nella sindrome di Cushing in cui manca la controregolazione del Feedback neg, il test non provoca la diminuzione dell’ACTH e del Cortisolo, permettendo la diagnosi di ipercortisolismo. Sindrome di Cushing: terapia Chirurgica : • asportazione adenoma ipofisario ACTHsecernente • asportazione adenoma surrenalico monolaterale cortisolo-secernente • Surrenectomia bilaterale in caso di iperplasia nodulare bilaterale (seguita da terapia cortisonica sostitutiva) ATTIVITÀ FISICA E CORTISOLO La sua secrezione è correlata alla durata e all'intensità dell'esercizio fisico, tanto più questi fattori aumentano e tanto maggiore sarà la quantità di cortisolo secreta. Da notare l'incremento dell'ACTH già nel periodo pre-gara, causato dallo stress psicologico da competizione. Dopo l’incremento nel sangue i valori della concentrazione del cortisolo ritornano a valori di base rapidamente in caso di esercizi di breve durata, mentre possono ritornare ai livelli basali molto più lentamente in caso di esercizi prolungati di endurance Numersi studi hanno dimostrato che sia esercizi di potenza quanto esercizi aerobici della durata di almeno 20 min e di intensità di almeno Il 60% del VO2max, possono stimolare la produzione di cortisolo. Anche esercizi di minore intensità ma di maggiore durata, 90 min, o di elevata intensità e di brevissima durata, 1 min, possono essere associati ad un incremento della Cortisolemia. A parità di carico di lavoro, gli esercizi anaerobici inducono Incrementi del cortisolo maggiori degli esercizi aerobici. Una riduzione della risposta del cortisolo si ha nei soggetti molto allenati. I glucocorticoidi stimolano il catabolismo proteico, accelerando la degradazione delle miofibrille muscolari (effetti più evidenti nelle fibre resistenti o di tipo II, presenti in elevata percentuale nelle masse muscolari degli arti inferiori) incrementano l'attività della glicogeno sintetasi (accumulo di glicogeno) stimolano la sensazione di fame favoriscono il deposito di grasso nella regione addominale Per mantenere sotto controllo i livelli di cortisolo è bene consumare pasti piccoli in termini calorici, ma frequenti (5 o più al giorno). Si consiglia inoltre di iniziare la giornata con una colazione abbondate e di privilegiare l'assunzione di carboidrati complessi come l'avena, i cereali senza zucchero, le farine integrali ed i loro derivati. L’organismo di un atleta, continuamente sottoposto a stress psicofisici dovuti ad allenamenti ai limiti delle sue possibilità fisiologiche, inizia a manifestare i primi segni di quelli che potremmo definire gli effetti collaterali dello sport: sintomi da sbilanciamento ormonale dovuti ad aumento di un ormone, il cortisolo, accompagnati dall’aumento degli ormai famosi, radicali liberi. Lo stress generato dallo sforzo, produce uno stimolo a livello dell’ipotalamo (organo situato nel cervello) inducendolo a secernere CRH (Corticotropin Releasing Hormone), un peptide di 41 aminoacidi, che attraverso una via preferenziale intracranica raggiunge l’adenoipofisi (ghiandola centrale di controllo per molte altre a livello periferico), stimolandola a produrre ACTH (AdenoCorticotropic-Hormone), un peptide di 39 aminoacidi che, passato in circolo, raggiunge le ghiandole surrenali stimolandole, attraverso un legame a specifici recettori di membrana, a secernere ormoni glucocorticoidi (cortisolo) e mineralcorticoiodi (aldosterone ). Maggiore sarà lo stress, psichico o fisico, maggiore sarà quindi la produzione di questi due ormoni, con le relative conseguenze. Nell’arco della giornata il livello di ACTH e di glucocorticoidi nel sangue presenta delle variazioni, dette circadiane, in quanto presentano un ciclo che si ripete nell’arco della giornata. I momenti di secrezione massima sembrano essere quelli tra le ultime ore di sonno e le prime di veglia, mentre la minore si raggiunge verso la mezzanotte o le prime ore del nuovo giorno (una-due di notte). Rilevando una scomparsa di questo ritmo, nel dosaggio ematico di questi ormoni, abbiamo già un chiaro segno di elevato stress. Tornando all’attività sportiva, dal momento in cui comincia a diventare intensa, si verifica quindi: un aumento nella produzione di corticosteroidi (in particolare cortisolo ed aldosterone); un aumento della produzione delle catecolamine (i mediatori biologici del sistema adrenergico: adrenalina e noradrenalina); una importante produzione di radicali liberi Vediamo ora più in dettaglio le funzioni di questi ormoni che così spesso vengono chiamati in causa in relazione all’attività sportiva. Il cortisolo, è un ormone con diverse funzioni ma che, fondamentalmente, presiede alla regolazione del metabolismo dei carboidrati. E’ possibile mettere in evidenza molti dei suoi effetti osservando quello che succede quando si verifica un eccesso di tale ormone in circolo. Gli effetti da eccessiva produzione di cortisolo sono: · sul metabolismo glucidico 1. viene stimolata la degradazione del glicogeno (glicogenolisi) con una liberazione in circolo di zuccheri semplici; 2. viene favorita la sintesi di zuccheri a partire da aminoacidi (i mattoni delle proteine) attraverso la gluconeogenesi; 3. in seguito a questi eventi (1. e 2.) si ha un effetto iperglicemizzante, con iperinsulinemia reattiva. La distruzione di proteine per la produzione di aminoacidi utili per la sintesi di zuccheri provoca una degradazione proteica, soprattutto muscolare, nota anche come “auto-cannibalismo” sul metabolismo lipidico: 1. viene favorita la sintesi di tessuto adiposo, direttamente o indirettamente attraverso il rialzo insulinemico. · sul metabolismo proteico: 1. si verifica una riduzione della sintesi proteica (soprattutto a livello del muscolo scheletrico) con simultaneo aumento della proteolisi determinando un bilancio negativo dell’Azoto, la proteolisi utile, come abbiamo visto, per la gluconeogenesi; 2. a parte il tessuto epatico, che reagisce con un incremento della sintesi proteica, i vari tessuti ed in particolare il tessuto muscolare striato, l’adiposo, l’osseo, il linfoide ed il connettivale vanno incontro a catabolismo proteico (autodistruzione) sul metabolismo degli acidi nucleici: 1. fatta eccezione per il fegato, viene inibita la sintesi di DNA e RNA e viene stimolato il catabolismo in quasi tutti i tessuti dell’organismo; · sul sistema immunitario: * 1. ne riduce l’efficacia; · sulla reazione infiammatoria : 1. si nota una riduzione della intensità della vasodilatazione e 2. ritardi del processo riparativo; · sul sistema cardiocircolatorio: 1. aumento della gittata sistolica 2. aumento del tono muscolare periferico e quindi 3. ipertensione * Sul sistema immunitario i glucocorticoidi hanno una potente azione antinfiammatoria, riducendo l’attività dei linfociti ed inibendone la proliferazione. Questo avviene principalmente, ma non solo, inibendo le cicloossigenasi che producono prostaglandine e tromboxani proinfiammatori. Inoltre, inibendo la produzione di numerosi mediatori dell’infiammazione, inibiscono la funzione anche di macrofagi ed eosinofili e riducono la permeabilità vascolare; infine, stabilizzano le membrane di basofili e mastociti, riducendo la liberazione d’istamina. A livelli elevati i glucocorticoidi hanno attività francamente immunosoppressiva, inducendo l’apoptosi dei linfociti, e questo giustifica il loro utilizzo come parte dei protocolli immunosoppressivi. sui tessuti connettivali ed epiteliali: 1. si osserva una riduzione della crescita dei fibroblasti e 2. una riduzione della sintesi di collagene con conseguente assottigliamento della matrice ossea, assottigliamento cutaneo e rallentamento del processo riparativo; · sul tessuto osseo: 1. si assiste ad un peggioramento del metabolismo osseo, aggravato da un cattivo assorbimento del calcio a livello intestinale; · sulla funzionalità renale: 1. si verificano interferenze con effetti metabolici negativi sul riassorbimento dell’acqua, del sodio e del potassio; sul sistema ormonale: 1. viene inibita la secrezione di GH (l’ormai famoso ormone della crescita) e 2. viene alterata la funzionalità tiroidea · sul tono dell’umore: 1. momenti di grande benessere, talora euforia 2. alternati a fenomeni di depressione Nello sportivo le cause che concorrono ad un aumento del cortisolo, sono: · sonno insufficiente, · riposo insufficiente, · recupero insufficiente, · attività extra sport troppo stressanti, · allenamenti in concomitanza di malessere psicofisico · alimentazione inadeguata. Questo ormone viene ancora biologicamente prodotto, seguendo esattamente le stesse modalità fisiologiche che si realizzavano negli uomini primitivi nel momento in cui venivano minacciati da qualche animale o pericolo. Controlla, infatti, il tipico meccanismo di difesa “attacca o fuggi”. Superata una certa soglia, sport e salute non vanno poi così d’accordo, il fisico ha bisogno di accorgimenti ben specifici (dieta, tempi di recupero, integrazione eccetera) per sopperire a carichi di lavoro esagerati. I sintomi da aumentati corticosteroidi nello sportivo sono: · aumentata vulnerabilità alle malattie da raffreddamento, · aumento della pressione sanguigna, · aumento delle pulsazioni del cuore al mattino,prima di scendere dal letto, · aumento del periodo necessario al recupero, · riduzione del peso corporeo ed in particolare della massa magra, · riduzione della forza e della performance in generale, · disturbi del sonno-insonnia , · cambiamenti ormonali (per esempio aumento del cortisolo e diminuzione del testosterone), · diminuzione dell’appetito, · diminuzione della fiducia in se stessi, · riduzione del desiderio e dell’entusiasmo per l’allenamento, · stanchezza cronica, · aumentata depressione, ansia, irritabilità. Per ridurre la produzione di cortisolo, senza ricorrere a farmaci o integratori: · aumentare il recupero post allenamento, · aumentare la durata e la qualità del sonno, · migliorare l’alimentazione - anche in termini di scelta di cibi più facilmente digeribili, · controllare il trend delle proprie prestazioni, · alleggerire periodicamente il carico di lavoro, Sintesi dei mineralcorticoidi (steroidi derivati dal colesterolo) Zona glomerulare ALDOSTERONE •Più importante mineralcorticoide •Circola per il 60-65% legato a proteine non specifiche (15-20% con la CBG e il 40% con l’albumina) •Emivita ematica breve (15-20 min) •Sito d’azione principale tubulo contorto distale e la porzione corticale del dotto collettore, dove stimola il riassorbimento di Na e l'escrezione di K. •La sua azione si effettua attraverso l’aumento della sintesi dei canali del Na e della pompa Na+-K+ATPasi L'Aldosterone Ormone steroideo prodotto dalla corteccia surrenale. È il più importante regolatore del volume dei liquidi extracellulari e del metabolismo del sodio e del potassio. Queste azioni sono ottenute attraverso un’azione diretta sul rene; in particolare l’aldosterone agisce sulla parte distale del nefrone, dove determina una diminuzione dell’escrezione di sodio e di acqua e un aumento dell’escrezione di potassio e di ioni idrogeno. La produzione di aldosterone è controllata da tre meccanismi: il sistema renina-angiotensina-aldosterone , la concentrazione di potassio e l’azione dell’ACTH. Il sistema renina-angiotensina-aldosterone regolando la produzione di aldosterone costituisce il più importante fattore di controllo del volume plasmatico; infatti mantiene costante il volume sanguigno determinando ritenzione di sodio e acqua da parte del rene, quando c’è diminuzione di volume plasmatico (per esempio, disidratazione, emorragie), e riducendo la ritenzione renale di sodio e acqua quando il volume sanguigno aumenta. Il potassio regola direttamente la secrezione di aldosterone: un eccesso di potassio nel sangue induce un aumento della produzione di aldosterone. L’ACTH ha un’azione di stimolo della produzione di aldosterone, ma di importanza minore. L’aldosterone è dosabile nel sangue mediante metodi radioimmunologici; il suo dosaggio basale, e dopo test di stimolo (infusione di sodio, ortostatismo, diuretici), è fondamentale per la diagnosi di patologie causate da eccesso o carenza La renina viene prodotta in risposta al calo della pressione della arteriola renale, del sodio e del volume plasmatico. La renina viene inibita da aumento della pressione arteriosa e da una dieta a elevato contenuto di sodio. SISTEMA RENINA -ANGIOTENSINA La secrezione dell'aldosterone è regolata dal sistema reninaangiotensina e in misura minore dall'ACTH. La renina, un enzima proteolitico, si trova depositata nelle cellule iuxtaglomerulari del rene. La secrezione di renina è indotta dalla riduzione del volume e del flusso ematico nelle arteriole renali afferenti. La renina causa la trasformazione epatica dell'angiotensinogeno (una a2-globulina) in angiotensina I, un polipeptide a 10 aminoacidi, che viene a sua volta convertita in angiotensina II, ( enzima ACE), un polipeptide a 8 aminoacidi. L'angiotensina II provoca la secrezione di aldosterone e, in misura molto minore, di cortisolo e deossicorticosterone. La ritenzione di Na e acqua derivante dall'aumento della secrezione di aldosterone fa aumentare la volemia e riduce la secrezione di renina. Sistema renina-angiostensina aldosterone (app. iuxtaglom.) Renina ACE (tessuti:polmone) ↓ ↓ Angiotensinogeno → Angiotensina I → Angiotensina II* (fegato) + Surrene (z. glomerulare) Secrez. Aldosterone ↓ *↑P.A. ↑Vol. Plasm. ↑Vasocostriz. ↑ Na+ ↓ K+ ↓− Renina IPERTENSIONI ENDOCRINE Con il termine di ipertensione arteriosa endocrina si intende un aumento della pressione arteriosa (diastolica >=85e sistolica >= 140 mmHg) dovuto a cause ormonali. Le ipertensioni endocrine si dividono in PRIMARIE: alterazioni degli ormoni che regolano primariamente la pressione arteriosa SECONDARIE: endocrinopatie che possono comportare un aumento della pressione arteriosa In base alle ultime linee guida dell'Organizzazione Mondiale della Sanità si parla di: sistolica (mmHg) diastolica (mmHg) Pressione ottimale <120 <80 Pressione normale <130 <85 Pressione normale alta 130-139 Ipertensione lieve 140-159 Ipertensione moderata 160-179 85-89 90-99 100-109 Ipertensione grave >180 >110 Ipertensione sistolica isolata >140 <90 L'ipertensione endocrina da eccesso di ormoni mineralcorticoidi è dovuta a iperaldosteronismo primario (da ipersecrezione del corticosurrene), iperaldosteronismo sopprimibile con glucocorticoidi, iperaldosteronismo secondario (da elevati livelli di renina), eccesso degli altri ormoni mineraloattivi. Iperaldosteronismo • Primitivo (S. di Conn)(ipersecrezione di aldosterone, livelli ematici di renina soppressi, ipersodiemia, ipopotassiemia (o ipokaliemia) e clinicamente da ipertensione arteriosa) • Secondario( è caratterizzato da ipopotassiemia, elevati livelli sierici di aldosterone e di PRA e clinicamente da ipertensione o normotensione, provocata da cause extrasurrenali) • PRA: attività reninica plasmatica • Capacità della renina di produrre angiotensina I dall’angiotensinogeno. • E’ un’indagine di primo livello nella diagnosi di iperaldosteronismo per differenziare la forma primaria da quella secondaria. Iperaldosteronismo primitivo (Sindrome di Conn) L'iperaldosteronismo primitivo è dovuto a un adenoma, di solito monolaterale, delle cellule della zona glomerulare della corteccia surrenale o più raramente, a un carcinoma o a iperplasia surrenalica. Gli adenomi sono estremamente rari nei bambini, ma la sindrome entra talvolta a far parte del quadro del carcinoma surrenalico o dell'iperplasia surrenalica dell'infanzia. Il quadro clinico è inoltre mimato da quello dell'iperplasia surrenalica congenita da deficit di 11b-idrossilasi. Nei bambini, l'ipokaliemia e l'iperaldosteronismo della sindrome di Bartter si distinguono dalla sindrome di Conn grazie all'assenza di ipertensione. Sintomi e segni L'ipersecrezione di aldosterone può produrre ipernatriemia, ipercloridria, ipervolemia e alcalosi ipokaliemica, che si manifestano con fenomeni episodici di astenia, parestesie, paralisi transitorie e tetania. Sono comuni l'ipertensione diastolica e una nefropatia ipokaliemica con poliuria e polidipsia. L'escrezione di aldosterone in presenza di un alto apporto di Na (> 10 g/die) è solitamente > 200 mg/die se è presente un tumore. La restrizione di Na causa ritenzione di K. Occasionalmente si osservano disturbi della personalità, iperglicemia e glicosuria. In molti casi la sola manifestazione clinica è un'ipertensione da lieve a moderata. Diagnosi Un test utile consiste nel somministrare spironolattone, da 200 a 400 mg/die, poiché esso fa regredire le manifestazioni cliniche della malattia, compresa l'ipertensione, entro 5-8 sett. (Questa regressione si verifica raramente nei pazienti con ipertensione non dovuta all'aumento dell'aldosterone.) Il dosaggio della renina plasmatica è utile per la diagnosi e si effettua solitamente misurando il livello plasmatico della renina al mattino, con il paziente in posizione supina, somministrando 80 mg di furosemide PO e ripetendo quindi la determinazione dopo che il paziente ha mantenuto la stazione eretta per 3 ore. I soggetti normali mostrano un sensibile aumento della renina in stazione eretta, mentre nei pazienti con iperaldosteronismo ciò non accade. Circa il 20% dei pazienti con ipertensione essenziale, che non ha necessariamente un iperaldosteronismo, ha una renina bassa che non risponde alla stazione eretta. Possono essere utili i dosaggi dell'aldosterone plasmatico, eseguiti su sangue periferico o dopo cateterizzazione delle vene surrenaliche. La diagnosi dipende quindi dalla dimostrazione dell'elevata secrezione di aldosterone nelle urine o nel sangue, dell'espansione dello spazio extracellulare dimostrata dal mancato aumento della renina plasmatica in posizione eretta e dalle alterazioni del K notate sopra. La TC dimostra spesso in questi casi la presenza di un piccolo adenoma. La RMN non aumenta la capacità diagnostica. Terapia Una volta stabilita la diagnosi di iperaldosteronismo primitivo, entrambe le ghiandole surrenali devono essere esplorate alla ricerca di possibili adenomi multipli Iperaldosteronismo Con questo termine si designa una condizione caratterizzata da un'eccessiva produzione di aldosterone. La conseguenza più temibile di questa malattia è l'ipertensione, dal momento che il rene trattiene notevoli quantità di sodio con conseguente aumento dei liquidi circolanti (più sangue → maggiore ostacolo alla circolazione → ipertensione → danni cardiovascolari). Eccessivi livelli di aldosterone si accompagno anche ad ipopotassemia, con conseguente comparsa di gradi crescenti di debolezza muscolare fino alla paralisi e sofferenze cardiache. L'iperaldosteronismo può essere causato da un adenoma o da un'iperplasia bilaterale della zona corticale del surrene. Nel primo caso l'intervento chirurgico può essere risolutivo, mentre nel secondo si procederà con l'assunzione di farmaci specifici (antialdosteronici). L'iperaldosteronismo può essere anche secondario all'assunzione di alcuni farmaci (diuretici), alla stenosi di un'arteria renale e ad altre condizioni di reninismo (aumento della liberazione di renina primario o secondario), alla gravidanza o ad un'alterata ripartizione dei fluidi nel compartimento extracellulare, come in presenza di edemi ed in corso di cirrosi epatica o sindrome nefrosica. In tutti questi casi si registra una diminuzione della volemia che rappresenta uno stimolo per il sistema renina-angiotensina e la conseguente produzione di aldosterone, i cui livelli plasmatici salgono fino ad assumere connotati patologici. Fisiopatologia iperaldosteronismo primitivo (S.di conn) ↑ aldosterone → ↑ rit Na+ → ↑ perdita k+ ↓ ↓ renina ↓ ↓ angio II Iperaldosteronismo primitivo (S. di Conn) • Aumentata ed inappropriata produzione di aldosterone → ritenzione Na, ipertensione arteriosa, bassa renina plasmatica, ipok • Epidemiologia - 2 % degli ipertesi - F/M: 2 - 2,5/1 (adenoma; iperplasia M=F) -Età: tutte (prev. 3a - 4a decade) Fisiopatologia dell’iperaldosteronismo Iperplasia o Adenoma del surrene aldosterone sodio potassio renina Angiotensina II Iperaldosteronismo primitivo (S. di Conn) • Anatomia patologica • Adenoma corticosurrenale (50%) • Carcinoma surrenale(molto raro) • Iperplasia bilaterale (nodulare o diffusa) (50%) • Idiopatica • Sensibile ai glucocorticoidi (ACTH“iperdipendente”) • Iperplasia monolaterale (molto rara) Iperaldosteronismo primitivo (S. di Conn): quadro clinico • Ipertensione arteriosa (da lieve a grave, prevalentemente diastolica) • Ipopotassiemia • Alcalosi, tetania (rara) • Poliuria, polidipsia (insensibilità ADH) • Aritmie cardiache (ipertensione art., ipoK) • Cefalea • Edemi generalmente assenti Iperaldosteronismo primitivo: dati di laboratorio • • • • Aldosterone plasmatico aumentato Ipokaliemia PRA soppressa Evidenza per adenoma • Livelli di aldosterone non modificabili con: • Test posturali (3 ore stazione eretta) • Carico di sale • Somministrazione di captopril • Studi morfofunzionali • TAC/RMN • Scintigrafia surrenalica con iodocolesterolo • Cateterismo vene surrenaliche Iperaldosteronismo primitivo: cenni di terapia • Adenoma • Surrenectomia monolaterale • Controllo ipertensione • 90% a breve termine • 70% a lungo termine • Iperplasia bilaterale • Surrenectomia bilaterale (rara) • Terapia medica • Spironolattone (antagonista dell'aldosterone), canrenoato di K, amiloride (diuretico che favorisce l'eliminazione del Na e riduce quella del K a livello del tubulo renale) • Altri farmaci anti-ipertensivi: Ca antagonisti Iperaldosteronismi secondari • Con ipertensione arteriosa (↑ produzione di renina) • Ipertensione nefrovascolare • Ipertensione maligna • Reninoma • Senza ipertensione arteriosa (↑ volume plasmatico (edemi)/↓ K+) • Scompenso circolatorio • S.nefrosica • Cirrosi epatica • Tubulopatie renali • Diarrea, vomito • Abuso di diuretici, lassativi IPERALDOSTERONISMO SECONDARIO E’ una condizione caratterizzata da - ipok, -elevato aldosterone, -elevata PRA, - ipertensione provocata da cause extrasurrenali. INDAGINI Potassiemia (bassa) Aldosterone plasmatico (alto) PRA (alta) (differenzia i primari dai secondari) IPERTENSIONI ENDOCRINE SECONDARIE Numerose endocrinopatie comportano un aumento della pressione arteriosa come fattore secondario della sintomatologia indotta dalla malattia. Caratteristica comune di queste forme è la regressione dell’ipertensione con il trattamento della malattia di base. 1)Sindrome di Cushing: si ha ipertensione arteriosa a causa di elevati livelli di cortisolo. Il Cortisolo stimola la produzione di renina e angiotensinogeno, aumenta la sensibilità del cuore e dei vasi alle catecolamine e inibisce il loro metabolismo potenziandone l’effetto vasocostrittore. Il cortisolo è in grado di legarsi al recettore per i mineralcorticoidi e promuovere il riassorbimento del sodio 2) Tumori secernenti estrogeni e androgeni nei pazienti con tumori secernenti estrogeni o androgeni si riscontra ipertensione e ipoK. Gli steroidi sessuali aumentano la sintesi di renina e angiotensinogeno. 3) Terapia estrogenica. Aumentata sintesi epatica dell’angiotensinogeno e di recettori per l’angiotensina II. Ciò causa aumento dell’aldosterone e quindi ipertensione. 4) Diabete mellito e obesità. L’iperinsulinismo determina l’aumento del riassorbimento renale del sodio Iperaldosteronismo secondario L'iperaldosteronismo secondario, un aumento della produzione di aldosterone da parte della corteccia surrenale causato da stimoli originati al di fuori dei surreni, somiglia a quello primitivo ed è correlato all'ipertensione. L'iperaldosteronismo secondario che si verifica in coincidenza con la fase accelerata dell'ipertensione viene considerato una conseguenza dell'ipersecrezione di renina. Iperaldosteronismo si osserva anche nell'ipertensione dovuta alla patologia ostruttiva delle arterie renali (p. es., ateromi, stenosi). Esso è conseguenza della riduzione del flusso ematico nel rene interessato. L'ipovolemia, specialmente durante la terapia diuretica, stimola il sistema reninaangiotensina portando all'ipersecrezione di aldosterone. Nello scompenso cardiaco i tassi di secrezione possono essere normali, ma il flusso ematico al fegato e il metabolismo epatico dell'aldosterone sono ridotti, per cui i livelli circolanti dell'ormone sono elevati. IPERTENSIONE +IPOKALIEMIA PRA Alta (ipertensioni secondarie)0860299163 bassa0860299163 Ipertensione nefrovascolare Ipertensione maligna (reninomi) Terapia estrogenica Nefropatia con perdita di sali aldosterone basso Altri ipermineralcorticismi Sindrome di Liddle Liquirizia alto Iperaldosteronismo primario Fisiopatologia e clinica della midollare surrenalica La midollare è la parte centrale delle ghiandole surrenali. È una struttura altamente specializzata del sistema nervoso simpatico. Di origine neuroectodermica, fa parte del sistema simpatocromaffine e sintetizza catecolamine: adrenalina (80%), noradrenalina e, in piccola quantità, dopamina. Le Catecolam(m)ine sono composti chimici derivanti dall'amminoacido tirosina. Le catecolamine sono idrosolubili e sono legate per il 50% alle proteine del plasma, cosicché circolano nel sangue. Le catecolamine più importanti sono l'adrenalina (epinefrina), la noradrenalina (norepinefrina) e la dopamina. Le catecolamine come ormoni sono rilasciate dalle ghiandole surrenali in situazioni di stress come stress psicologico o cali di glicemia. Le catecolamine sono composti organici diidrossilati caratterizzati da un anello fenolico di tipo catecolico(diidrossibenzene). I membri più importanti di questa famiglia sono: ADRENALINA, NORADRENALINA, DOPAMINA. La sintesi delle catecolamine avviene attraverso una serie di reazioni enzimatiche che utilizzano come substrato iniziale l'aminoacido aromatico L-TIROSINA e tale formazione ha luogo nelle cellule cromaffini della midollare surrenale e dei neuroni simpatici. La tirosina, il capostipite delle catecolammine. La noradrenalinac L' adrenalina La dopamina Sintesi dell’adrenalina Sintesi delle catecolamine Immagazzinamento catecolamine vescicolare e rilascio di Spegnimento del segnale catecolaminergico • Le MAO e le COMT sono i principali sistemi enzimatici responsabili del catabolismo delle catecolamine • La maggior parte delle catecolamine secrete e’ ricatturata dal terminale sinaptico • Cocaina e antidepressivi triciclici modulano l’attivita’ dei trasportatori per le catecolamine Biosintesi delle catecolamine Metabolismo delle catecolamine SINTESI La sintesi dell'adrenalina avviene nella midollare surrenale ed è la stessa della noradrenalina, con un passaggio in più, catalizzato dall'enzima feniletanolammina-N-metiltransferasi, che converte la noradrenalina in adrenalina. L'adrenalina viene sintetizzata nelle cellule cromaffini, presenti nella zona midollare delle ghiandole surrenali. La sintesi comincia con il trasporto attivo nella cellula dell'amminoacido L-Tirosina. Il primo passaggio, operato dalla tirosina idrossilasi, consiste nell'ossidazione in posizione 3' della tirosina, formando l'amminoacido catecolico L-DOPA (DiidrOssiF(PH)enilAlanina) ed è la tappa limitante la velocità di tutta la sintesi (l'enzima è auto controllato da un sistema a feedback negativo da parte delle catecolamine sintetizzate nonché da siti di fosforilazione controllati dalle proteine chinasi). Il secondo passaggio consiste nella decarbossilazione della L-DOPA a dopamina ed è operato dalla decarbossilasi degli L-amminoacidi aromatici, chiamata in passato dopa-decarbossilasi. La dopamina prodotta viene trasportata in vescicole di deposito, all'interno delle quali l'enzima dopamina β-idrossilasi inserisce un gruppo ossidrilico in configurazione assoluta R sull'atomo di carbonio β rispetto al gruppo amminico, ottenendo così la noradrenalina. Infine la feniletanolamina-N-metiltransferasi attacca un gruppo metilico sull'azoto amminico, arrivando ad ottenere adrenalina, che viene conservata nelle vescicole SECREZIONE L'adrenalina viene secreta dalle cellule cromaffini della midollare del surrene in seguito alla stimolazione da parte del sistema nervoso simpatico. L'innervazione simpatica è l'unica che raggiunge la midollare del surrene, che può essere considerata come un ganglio simpatico modificato. Il neurone pre-gangliare secerne acetilcolina. Le cellule cromaffini sono ricche di recettori colinergici nicotinici, la cui attivazione e il conseguente ingresso di sodio provocano depolarizzazione della membrana cellulare. In risposta al potenziale d'azione così generato le cellule secernono adrenalina nel circolo sanguigno. Il rilascio di adrenalina è stimolato da forti emozioni, in particolare la paura, e in generale in quelle situazioni dove sia prevedibile la necessità di una fuga, un combattimento o comunque un'aumentata attività fisica. Le catecolamine vengono accumulate in GRANULI, che contengono proteine idrosolubili, dette cromogranine, che le fanno aderire all’ATP. Le catecolamine vengono secrete in risposta all’esercizio fisico agli interventi chirurgici, all’ipoglicemia, all’infarto miocardico e più in generale a qualunque stimolo anossico. FUNZIONE In generale l'adrenalina, facendo parte delle vie riflesse del sistema simpatico, è coinvolta nella reazione "combatti o fuggi" (fight or flight). A livello sistemico i suoi effetti comprendono: rilassamento gastrointestinale, dilatazione dei bronchi, aumento della frequenza cardiaca e del volume sistolico (e di conseguenza della gittata cardiaca), deviazione del flusso sanguigno verso i muscoli, il fegato il miocardio e il cervello e aumento della glicemia. A livello locale gli effetti dell'adrenalina possono essere molto diversi o anche opposti a seconda del tipo di recettore espresso dalle cellule di uno specifico tessuto. I recettori adrenergici si dividono in due tipologie, α (alfa) e β (beta), ciascuna con vari sottotipi, dai quali dipende la risposta del tessuto. Alcuni recettori sono poco sensibili all'adrenalina e più sensibili alla noradrenalina, e rispondono quindi direttamente al sistema nervoso simpatico. Altri recettori sono molto sensibili all'adrenalina e poco alla noradrenalina: •Recettori α1: localizzati al livello delle arteriole causano contrazione della muscolatura liscia e quindi vasocostrizione. L'aumento di resistenza e quindi di pressione sanguigna locale che ne consegue riduce il flusso sanguigno verso la periferia, consentendo una migliore irrorazione degli organi indispensabili. Recettori α2: hanno un effetto opposto rispetto agli α1, in quanto provocano rilassamento della muscolatura. Si trovano sul tratto gastrointestinale. Infatti la digestione viene messa in secondo piano durante una reazione simpatica. Questi recettori si trovano anche sul pancreas, dove provocano una riduzione della secrezione. In questo modo viene ridotta la concentrazione di insulina nel sangue, e quindi aumentata la concentrazione di glucosio, al fine di renderlo immediatamente disponibile per il lavoro muscolare. Recettori β1: si trovano principalmente sulle cellule del miocardio. La presenza di adrenalina provoca un aumento della permeabilità al calcio della membrana delle cellule cardiache, con conseguente aumento di frequenza e intensità della contrazione. A livello renale stimolano la secrezione di renina, con conseguente ritenzione idrica e aumento della volemia e quindi della pressione. •Recettori β2: hanno effetto inibitorio sulla muscolatura liscia. A livello bronchiale provocano dilatazione, consentendo un maggior ingresso di ossigeno e una fuoriuscita più veloce di anidride carbonica. A livello delle arterie coronarie, delle arterie che irrorano il muscolo scheletrico e dell'arteria epatica causano vasodilatazione. Il maggior afflusso di sangue al miocardio consente l'aumento della gittata cardiaca (vedi sopra), ai muscoli consente un metabolismo più veloce e quindi un minor affaticamento, al fegato consente una maggior produzione di glucosio. •Recettori β3: localizzati nel tessuto adiposo, la loro attivazione provoca la liberazione dei trigliceridi, che possono quindi essere consumati per produrre energia, quindi lipolisi. Gli effetti dell'adrenalina sono sempre legati alla previsione di un'intensa attività fisica, compatibile con una fuga o un combattimento, ma anche con l'attività sportiva e con lavori faticosi. METABOLISMO Noradrenalina, adrenalina e dopamina vengono degradate da due diversi sistemi enzimatici: le catecol-O-metiltrasferasi (COMT) localizzate prevalentemente al livello postsinaptico e negli epatociti, e dalle monoaminossidasi (MAO) localizzate all'interno della cellula addossate ai mitocondri. Le MAO a loro volta si dividono in due sottoclassi o isoforme A e B. L'isoforma A è adibita alla deamminazione ossidativa della noradrenalina, dell'adrenalina e della serotonina, mentre l'isoforma B metabolizza soprattutto la dopamina. Le COMT invece metilano uno dei due ossidrili catecolici e porta alla formazione di metaboliti, i quali vengono poi deaminati nel fegato dalle MAO. La noradrenalina dopo essere stata rilasciata nella sinapsi può legarsi ai recettori adrenergici dell'effettore e dare una reazione, oppure può essere allontanata per diffusione e mediante flusso ematico, oppure può essere ricaptata dalle varicosità (processo di re-uptake) e una volta ritornata nel terminale assonico viene rimpacchettata per essere utilizzata un'altra volta al sopraggiungere di una nuova depolarizzazione di membrana. 2 meccanismi: 1) Ricaptazione a livello dell’assone (captazione tipo 1) Le c. possono essere riaccumulate in granuli e poi secrete nuovamente o metabolizzate dalle monoamminoossidasi (MAO) (inibita dalla cocaina e dagli antidepressivi). Tipica della noradrenalina. 2) Secondo meccanismo extraneuronale (rene e fegato). Captazione di tipo 2. Degradazione delle c. attraverso la catecol-O- metiltransferasi (COMPT) con formazione di metadrenalina e metanefrine. Tipica dell’adrenalina. Entrambe le vie metaboliche portano alla formazione dell’acido vanilmandelico. La porzione midollare del surrene produce due ormoni importanti, l'adrenalina e la noradrenalina, raggruppabili sotto il termine unico "catecolamine". La regione midollare si sviluppa dallo stesso tessuto embrionale dei neuroni simpatici ed è considerata una struttura neuroendocrina. La sua funzione, infatti, è controllata dal sistema nervoso centrale, che per comunicare con essa, non si affida ad ormoni ma ad impulsi nervosi. Questo meccanismo di controllo permette la fulminea liberazione di catecolamine al momento del bisogno, ad esempio quando ci si trova dinanzi ad un pericolo improvviso, da fronteggiare nel più breve tempo possibile. Dopo essere state liberate nel sangue, le catecolamine surrenali preparano il corpo allo sforzo richiesto: aumentano la pressione arteriosa, dilatano i bronchi, accelerano la frequenza cardiaca, stimolano la degradazione del glicogeno, aumentano la glicemia, accelerano gli atti respiratori ed inibiscono la peristalsi intestinale. Quali effetti esplicano l'adrenalina e la noradrenalina? a) Stimolano l'attività del cuore, aumentando la forza di contrazione del muscolo cardiaco; b) aumentano il tasso glicemico del sangue, facilitando così l'assorbimento degli zuccheri da parte dei tessuti; c) stimolano la coagulazione del sangue; d) diminuiscono la fatica muscolare, per cui consentono un'attività fisica più intensa e prolungata; e) svolgono un'azione vasocostrittrice, permettendo in tal modo al sangue di affluire in maggior quantità in una parte dell'organismo in cui vi sia impellente necessità del suo apporto. Quale effetto generale produce la secrezione di adrenalina? Di preparare l'organismo a reagire, per esempio, in risposta a un pericolo imminente o a un fattore stressante. ADRENALINA E NORADRENALINA SONO DUE ORMONI SECRETI DALLOSTRATO MIDOLLARE DEL SURRENE E DA ALCUNE TERMINAZIONI NERVOSE (noradrenalina). Questi due ormoni intervengono nella reazione adrenergica chiamata "FIGHT OR FLIGHT", ovvero combatti o scappa. Com'è intuibile dal suo nome, tale reazione ha lo scopo di preparare l'organismo ad uno sforzo psicofisico importante in tempi brevissimi: facilitando l'utilizzo dei substrati energetici muscolari rimuovendo i cataboliti (aumenta il flusso renale) aumentando l'apporto energetico agli organi vitali facilitando la ricostruzione delle riserve energetiche Funzioni ADRENALINA: aumenta la gittata cardiaca aumenta la pressione arteriosa sistolica diminuisce la pressione arteriosa diastolica aumenta il flusso ematico muscolare aumenta il flusso ematico renale e cutaneo aumentata glicogenolisi e lipolisi vasocostrizione vasodilatazione nei distretti epatico e muscolare aumento del metabolismo dilatazione bronchiolare aumento della vigilanza Durante un esercizio muscolare statico la secrezione di adrenalina prevale sulla secrezione di noradrenalina. Funzioni NORADRENALINA: aumenta la gittata cardiaca aumenta le resistenze periferiche totali aumenta la pressione arteriosa aumenta il flusso coronarico La noradrenalina viene invece secreta in risposta a stimoli di intensità elevata e la sua secrezione è proporzionale all'intensità dell'esercizio. Intorno al 7075% del VO2max si registra un picco nella secrezione di noradrenalina. Fattori che stimolano la secrezione delle catecolamine Ansia Freddo Dolore Traumi Sforzi fisici Ipotensione Paura Ipercapnia Piacere intenso Fame ATTIVAZIONE ADRENERGICA L'aumento della secrezione di catecolamine prepara il corpo ad un elevato stress psicofisico: aumentando la broncodilatazione aumentando il numero di atti respiratori (tachipnea) aumentando la glicogenolisi aumentando la gluconeogenesi aumentando la lipolisi inibendo la glicogeno sintesi diminuendo l'insulina aumentando la secrezione di glucagone aumentando la glicolisi LA REAZIONE ADRENERGICA IN RISPOSTA ALL'ESERCIZIO FISICO è INOLTRE INFLUENZATA DA: DURATA DELL'ESERCIZIO (aumenta con la durata dell'esercizio) ALLENAMENTO (diminuisce con l'allenamento) DIGIUNO (aumenta negli stati di digiuno in risposta all'ipoglicemia ) TEMPERATURA (aumenta con il diminuire della temperatura) Le catecolamine aumentano la pressione arteriosa attraverso: •L’incremento della gittata cardiaca e delle resistenze periferiche per vasocostrizione arteriolare. •Lo stimolo sulla liberazione di renina e quindi di Angiotensina II Cenni di Embriologia Il tessuto cromaffine della midollare surrenalica e dei gangli del sistema nervoso simpatico ha un’origine comune, dalla cresta neurale. I precursori del sistema simpatico, i simpatogoni, originano dalla cresta neurale migrano ventralmente differenziandosi nei neuroblasti paravertebrali e preaortici. Da queste cellule originano quelle gangliari e i feocromoblasti. La midollare del surrene origina dai feocromoblasti, migrano dai gangli simpatici nella corticale surrenale formando degli agglomerati cellulari da cui origina la midollare surrenale. Il flusso ematico a livello della midollare surrenalica deriva dall’arteria frenica inferiore, derivante dall’aorta, dall’arteria renale e dal sistema portale corticomidollare che origina dalla zona reticolare della corteccia surrenale. BIOSINTESI DELLE CATECOLAMINE NH2 Tirosina (alpha metilparatirosina) OH CO2H Tirosina idrossilasi (cAMP protein kinase, Glucocorticoid) Sistema APUD (amine precursor uptake and decarboxylation) Diidrossifenilalanina (DOPA) Decarbossilasi aminoacida L-aromatica Dopamina OH Dopamina b-idrossilasi OH NH2 OH Norepinefrina Feniletanolamina N-metiltransferasi (PNMT) Epinefrina OH OH H N OH CH3 Le Catecolamine vengono accumulate in granuli e secrete in risposta a: •Stress •Esercizio fisico •Interventi chirurgici •Ipoglicemia •Infarto miocardico acuto •Emorragie La rimozione delle catecolamine avviene principalmente attraverso il meccanismo di captazione delle stesse nel terminale presinaptico chiamato uptake-I. Le catecolamine possono anche essere rimosse dal tessuto extraneuronale uptake-2, specialmente dal fegato e dal rene, dove sono metabolizzate. Le catecolamine vengono metabolizzate dalla CatecolO-metiltransferasi (COMT), che converte la NE in normetanefrina e la epinefrina in metanefrina e dalla monoammino ossidasi (MAO) che converte la metanefrina e normetanefrina in acido vanilmandelico e la NE e E in acido 3,4 diidrossi mandelico. Le catecolamine sono immagazzinate in granuli secretori attivamente da una pompa H++ ATP e proteine trasportatrici quali la vesicular monoamine transporters (VMATs) Metaiodiobenzilguanidina (MIBG) I131 o I123 è importato dalla VMATs nei granuli secretori della midollare surrenalica Ruolo fondamentale dei recettori adrenergici a livello periferico I recettori alpha hanno un effetto eccitatorio con l’eccezione del tratto GI, dove producono effetti inibitori. I recettori beta producono effetti inibitori eccezione fatta del cuore, dove hanno uno stimolo eccitatorio. I recettori adrenergici vengono distinti in alpha (1 e 2) e beta (1,2,3). I recettori alpha1 e 2 sono distinti in 7 sottotipi in base alle differenze nella distribuzione tissutale. I recettori alpha 1: azione vasocostrittrice I recettori alpha 2: azione duplice -causano vasocostrizione e quindi ipertensione – azione antiipertensiva I recettori beta 1: aumento della contrattilità cardiaca e della lipolisi I recettori beta 2: rilasciamento della muscolatura liscia, ma stimoland anche la produzione di noradrenalina provocano ipertensione. I recettori beta 3: lipolisi (tessuto adiposo) Recettori b3 adrenergici aumentano la termogenesi a livello del tessuto adiposo bruno ed aumentano la lipolisi Qualsiasi tumore che produce, immagazzina e secerne catecolamine e innesca la patologia caratterizzata da un eccessivo rilascio di catecolamine può essere considerato un feocromocitoma ed essere trattato come tale indipendentemente dalla sua localizzazione Il Feocromocitoma è un tumore delle cellule cromaffini caratterizzato da ipertensione arteriosa, da aumento delle catecolamine sieriche e urinarie e da alterazioni del metabolismo glicidico. E’ molto raro ed è un tumore benigno nel 90% dei casi e maligno nel 10 % dei casi. Nel 10 % dei casi è familiare e associato a sindromi politumoral Familiari quali la sindrome MEN 2 ( mutazione del gene RET sul cromosoma 10) Feocromocitoma •La più importante malattia della midollare surrenale è il Feocromocitoma. • Nella ghiandola surrenale si ha 85%- 90% dei tumori • Le localizzazione extra surrenale può essere trovata in organi che originano dalla cresta neurale –Corpo carotideo, chemorecettori aortici, gangli simpatici, organo di Zuckerkandl- e sono detti paraganglioma, chemodectoma. • Incidenza del 0.8 x 100000 per anno •La frequenza è uguale in entrambi i sessi, sono più frequenti tra i 30 e i 50 anni. •Il 10% dei casi sono bilaterali nella forma sporadica . •Il 50% dei casi sono bilaterali e generalmente intrasurrenalici nella forma familiare . Forma familiari di Feocromocitoma I Neoplasia Endocrina Multipla tipo 2a (Sindrome di Hippel): • Mutazione del protoncogene RET Chr 10 •Carcinoma midollare della tiroide, Iperparatiroidismo Neoplasia Endocrina Multipla tipo 2b: • Mutazione del protoncogene RET Chr 10 • Carcinoma midollare della tiroide, neuromi della mucosa, ganglioneuroma intestinale, megacolon, habitus Marfanoide Feocromo e S. neuroectodermiche Neurofibromatosi (malattia di von Recklinghasen) tipo 1: • Mutazione del gene tumore-soppressore NF1 Chr 17 • Neurofibromatosi periferica Emangioblastoma Cerebelloretinale (sindrome di von Hippel-Lindau) tipo 2: • Mutazione erronea che interessa il gene tumore soppressore VHL Chr 3p25-26 • Angioma retinico; emangioblastoma del cervelletto e del midollo spinale; carcinoma renale a cellule chiare; cisti pancreatiche, renali, epididimali e endolinfatiche Manifestazioni Cliniche • Ipertensione parossistica o sostenuta. Usualmente l’ipertensione è labile. Sintomatologia associata a cefalea, sudorazione profusa, palpitazioni con o senza tachicardia, ansia, un senso di rovina, pallore cutaneo, nausea e dolore addominale. • L’associazione di cefalea, sudorazione e palpitazioni (triade del feocromocitoma) permette la diagnosi con una specificità del 93.8% ed una sensibilità del 90.9% • L’ipertensione è sostenuta in circa metà dei paziente, circa un terzo dei pazienti può avere crisi parossistiche e meno di un quinto può avere pressione normale • Altri sintomi includono ipotensione ortostatica, iperglicemia, ipermetabolismo, perdita di peso e persino cambiamenti psichici • L’iperglicemia è generalmente modesta riscontra durante gli episodi ipertensivi. e si • Il feocromocitoma può precipitare un infarto del miocardio; un prolungato eccesso di catecolamine può portare ad una miocardiopatia (ipertrofia cardiaca) • Il feocromocitoma può anche secernere la calcitonina, il peptide vasoattivo intestinale e la ACTH Diagnosi differenziale • Crisi ansiose, attacchi di panico, tireotossicosi, sospensione repentina della terapia con clonidina, uso di anfetamine, cocaina, ipoglicemia, angina pectoris o infarto del miocardio, tumori del cervello, emorragia subaracnoidea, decondizionamento cardiovascolare, tossiemia della gravidanza, neuroblastoma (bambini). • Tra i farmaci ricordiamo gli inibitori della monoamminossidasi come la Selegilina e le benzodiazepine tricicliche come la Clozapine Sono indagini di primo livello la determinazione delle catecolamine e dei loro metaboliti nelle urine e la determinazione delle metanefrine plasmatiche. Diagnosi • Test urinari: si misura il dosaggio della metanefrina e dell’acido vanilmandelico. Catecolamine Metanefrine Acido vanilmandelico Valori Normali: Catecolamine totali Epinefrina 24 ore <100 g/ 24 ore < 20 g/ 0.3-0.9 mg/24 ore < 9 mg/24 ore plasma: Normetanefrina 18-112 pg/mL Metanefrina 12-61 pg/mL < 300g/24 ore Norepinefrina < 80g/24 ore < 500g/24 ore • Raccogliere le urine in un acido forte 20 mL 6N HCL o 25 mL di 50% acido acetico Prelievo ematico • Il paziente deve essere supino a digiuno e l’ago dovrebbe essere inserito in vena per almeno 20’ prima del prelievo. • I valori normali sono per la norepinefrina < 500 pg/mL e per l’epinefrina < 100 pg/mL; valori superiori a 1500 pg/mL per la norepinefrina e a 300 pg/ml per l’epinefrina sono diagnostici per il Feocromocitoma • La determinazione dei valori normetanefrina e metanefrina è risultata utile, ma pochi laboratori fanno questo dosaggio • La cromogranina A è un eccellente marker per il controllo nel tempo di un paziente con un pregresso tumore neurendocrino. Test farmacologici (test inibitori) • Test alla Fentolamina antagonista a-adrenergico: Permette la diagnosi di feocromocitoma quando riduce la pressione sistolica di 35 mm HG e quella diastolica di 25 mm Hg dopo la somministrazione di 1 o 5 mg del farmaco. La pressione va misurata ogni 30’’-60’’ per 10’. •Test alla Clonidina agonista a2 adrenergico a livello centrale: Si misurano le concentrazioni ematiche delle catecolamine prima e tre ore dopo la somministrazione di clonidina (0.3 mg/70kg). Le catecolamine di persone non affette dal feocromocitoma diminuiscono; mentre quelle con il feocromocitoma o non hanno variazioni o i valori delle catecolamine aumentano. • Test di stimolo con Istamina, Glucagone, tiramina e Metoclopramide (aumento di tre volte i valori di base nei soggetti con feocromocitoma 12 mmol/L-2000 pg/mL) Localizzazione • Tomografia Computerizzata. Epinefrina urinaria maggiore al 15% delle catecolamine totali la localizzazione è surrenalica • La risonanza magnetica permette di distinguere il feocromocitoma da altre masse surrenaliche. MRI T2 pesata ha un intensità tre volte superiore rispetto al fegato, MRI T1 pesata ha un intensità uguale a quella epatica • La scintigrafia con metaiodiobenzilguanidina I-131 permette di rilevare l’ottanta-novantacinque per cento dei feocromocitomi. Questa metodica può anche visualizzare neuroblastomi e tumori del sistema APUD. Octreotide-scan (111In-DTPA) e tomografia ad emissione di positroni 6 (18F) fluorodopamina Trattamento • Il trattamento di scelta è chirurgico • Importante è la preparazione all’intervento per evitare crisi ipertensive. Esistono diversi protocolli clinici • La preparazione inizia sette giorni prima dell’intervento con la somministrazione della fenossibenzamina a-bloccante non specifico . Il dosaggio iniziale è di 10 mg due volte al giorno che può essere aumentato di 0.5-1.0 mg/kg al giorno in due tre dosi giornaliere. • Prazosina alla dose di 2-5 mg due volte al giorno; Labetololo alla dose di 200-600 mg; Metirosina 250 mg ogni sei ore con incrementi giornalieri di 250-500 mg fino ad un massimo di 4 g al giorno; Nifedipina 10 mg è usata per controllare le punte pressorie. Trattamento • Durante l’intervento chirurgico la fentolamina, la nicardipina o la nifedipina dovrebbero essere somministrati per prevenire le crisi ipertensive • Se è presente tachicardia o aritmia indotta dalle catecolamine Propanololo può essere usato per endovena a 0.1-1 mg • Il paziente subito dopo l’intervento ha bisogno dell’infusione di liquidi per recuperare il volume ematico • Frequenti sono le crisi ipotensive che occorrono durante l’intervento o subito dopo l’intervento chirurgico. In questa circostanza si preferisce l’infusione di liquidi ma quando il paziente è stato sottoposto ad una massiva terapia alfa bloccante si può ipotizzare l’utilizzo di agenti pressori Ormone Risposta all'esercizio Rapporti speciali Probabile significato Catecolamine Aumento Maggiore incremento con esercizio intenso noradrenalina > adrenalina, minore incremento dopo allenamento Aumento del glicoso ematico, regolazione del sistema cardiovascolare Ormone della crescita (GH) Aumento Maggiore incremento nel soggetto fisicamente deficiente, declino più rapido nel soggetto fisicamente valido Incerto, probabilmente ritardata liberazione di FFA ACTH - Cortisolo TSH - Tiroxina Maggiore incremento con esercizio intenso; minore incremento con Aumento della gliconeogenesi nel Aumento esercizio submassimale dopo fegato (rene) allenamento Incremento del turnover della tiroxina Aumento con esercizio prolungato di Incerto, può esaltare il metabolismo dei con l'allenamento, senza evidenti effetti alta intensità FFA tossici LH - FSH Nessuna variazione Decremento con allenamento rigoroso Amenorrea Testosterone Estradiolo Progesterone Aumento -Incremento durante la fase luteinica dei ciclo ? Insulina Diminuzione Minore decremento dopo allenamento Diminuito stimolo alla utilizzazione del glicoso ematico Glucagone Aumento Minore incremento dopo allenamento Aumento del glicoso ematico tramite glicogenolisi e gliconeogenesi Renina -Angiotensina Aldosterone Aumento Stesso incremento dopo allenamento, nel ratto ADH Aumento -- PTH - Calcitonina Nessuna variazione -- Eritropoietina -- -- Aumento Prostaglandine Possibile aumento Endorfine Aumento Possono aumentare in risposta a contrazioni isometriche sostenute - può essere necessario uno stress ischemico Maggiore incremento dopo allenamento ? Ritenzione di sodio per mantenere il volume plasmatico Ritenzione di acqua per mantenere il volume plasmatico Necessari per assicurare un adeguato sviluppo osseo Potrebbe essere importante per incrementare l'eritropoiesi Forse vasodilatatatori locali Regolazione di altri ormoni L'adrenalina e la noradrenalina sono entrambe coinvolte nella produzione energetica. Le catecolamine aumentano il ritmo cardiaco e la pressione ematica, stimolano la disgregazione dei grassi (lipolisi), aumentano la disgregazione del glicogeno muscolare ed epatico e inibiscono il rilascio di insulina da parte del pancreas. Sia l'adrenalina che la noradrenalina aumentano durante l'attività fisica aerobica anche se in quantità diverse a seconda dell'intensità dell'attività fisica.
Scaricare