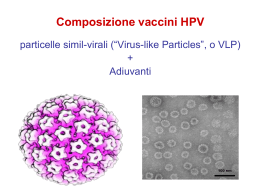
La campagna vaccinale HPV nazionale ed in Emilia Romagna: luci ed ombre Rimini 24 marzo 2011 Maria Grazia Pascucci Servizio Sanità Pubblica Assessorato Politiche per la salute Risposta immune all’infezione da HPV • L’esposizione naturale ad infezioni virali produce una risposta immunologica di tipo anticorpale e cellulo-mediata, tuttavia: – L’HPV non produce viremia, resta localizzato a livello epiteliale e mucosale – I tipi HPV oncogeni stimolano fattori cellulari che inibiscono la risposta immune locale Risposta immune all’infezione da HPV • Pertanto, infezioni pregresse da HPV oncogeni non necessariamente inducono immunità verso infezioni successive: – Il livello di protezione conferito dall’infezione naturale è variabile – Sono possibili le reinfezioni o nuove infezioni – All’aumentare dell’età diminuisce la risposta immunitaria pertanto aumenta l’incidenza delle infezioni persistenti I vaccini contro l’HPV I vaccini sono costituiti dalle proteine virali capsidiche dell'HPV-L1 e, in misura minore, L2, (Virus-Like Particles, VLPs) ottenute mediante tecniche di ingegneria genetica (DNA ricombinante): in pratica capsidi senza DNA, strutturalmente ed antigenicamente identiche ai virioni naturali, tali da evocare una efficace risposta neutralizzante tipospecifica. Composizione del vaccino anti-HPV 16-18 Schema di HPV virus-like particles (VLPs) • Assomiglia ad una particella virale • Non infettante, per assenza di DNA Autoassemblaggio dei pentameri in VLPs Pentamero: 5L1 + 1L2 VACCINI contro HPV Gardasil® • Merk • Vaccino quadrivalente (16,18,6,11) • Ciclo vaccinale:tre dosi 0, 2, 6 mesi via i.m. • Prodotto su Saccharomyces cerevisiae • Adiuvante: alluminio • Conservazione a 2-8°C, protezione dalla luce, validità 3 anni Cervarix ® • Glaxo SmithKline • Vaccino bivalente (16, 18) • Ciclo vaccinale:tre dosi 0, 1, 6 mesi via i.m. • Prodotto in cellule di insetto con vettore Baculovirus • Adiuvante: AS04 (Al(OH)3+ MPL ®(monofosforil-lipide A) • Conservazione a 28°C,protezione dalla luce, validità 3 anni Valutazione dell’efficacia dei vaccini Endpoints virologici • infezioni incidenti/transienti • infezioni persistenti Endpoints clinici • lesioni di basso grado (CIN 1) • lesioni di alto grado (CIN 2/3, AIS) Endpoints immunologici • misurazione delle immunoglobuline G Sulla base dell’età dei soggetti coinvolti negli studi, il programma di valutazione del vaccino è stato diviso in due parti: • Studi di efficacia clinica in donne a partire dai 16 anni; • Studi di immunogenicità in donne a partire dai 16 anni e in maschi e femmine di 9-15 anni. Immunogenicità dei vaccini • • • • Sieroconversione in >99% Titoli 10-50 volte più alti di quelli indotti dall’infezione naturale Picco 1 mese dopo la terza somministrazione, seguito da lieve riduzione del titolo, e plateau 18-24 mesi dopo Plateau mantenuto per almeno 8,5 anni (vaccino bivalente) Gardasil, elevato tasso di sieropositività a HPV 6,11,16,18 8.787 donne di età compresa tra 16 e 26 anni vaccinate con Gardasil Sieropositività % (IC 95%) GMT mMV/mL (IC 95%) HPV 6 99,8 (99,6-99,9) 543 (526-560) HPV 11 99,7 (99,5-99,9) 762 (735-789) HPV 16 99,8 (99,5-99,9) 2.294 (2.185-2.408) HPV 18 99,5 (99,1-99,7) 462 (444-480) Sieropositività e GMT misurati entro 1 mese dopo la 3° dose Misurata con competitive Luminex Immunoassay (cLia), tecnica basata sulla neutralizzazione di singoli epitopi per ciascun tipo di HPV (ogni test impiega tipi diversi di anticorpi monoclonali) Joura EA et al, Vaccine 2008; 26:1-8 Cervarix® mantiene livelli anticorpali elevati e sostenuti fino a 7.3 anni Sieropositività ≥ 98% in ogni momento 10,000 livelli degli anticorpi ≥13- volte + alti dei livelli indoti dall'infezione naturale HPV 16 EU/ml 1,000 100 10 1 0 7 12 18 25–32 33–38 39–44 45–50 51–56 57–62 63–68 69– –74 75– –76 77– –82 83– –88 82-83 mesi Seropositività ≥ 98% in ogni momento HPV 18 EU/ml 10,000 livelli degli anticorpi ≥11- volte + alti dei livelli indoti dall'infezione naturale 1,000 100 10 1 0 7 12 18 25–32 33–38 39–44 45–50 51–56 57–62 63–68 69-74 75-76 77– –82 83– –88 Mese Adapted from De Carvalho, N et al. 25th International Papillomavirus Conference (Abstract P-29.15), 2009. Correlazione livelli anticorpali serici e CVS Women 15-55Y; Mo 24 Anti-HPV-16 2.5 15-25 years R=0.9031 26-45 years R= 0.7280 46-55 years R=0.8753 2 15-25 years R = 0.9114 26-45 years R = 0.8235 2.5 1.5 1 46-55 years R = 0.9328 2 1.5 0.5 0 1 0.5 -0.5 -1 -0.5 Anti-HPV-18 3 Log ratio (anti-HPV-18/total 18/total IgG) in CVS Log ratio (anti-HPV-16/total 16/total IgG) in CVS (ELISA) 0 0.5 1 1.5 2 Log ratio (anti-HPV-16/total IgG) in serum 2.5 0 0 0.5 1 1.5 2 2.5 Log ratio (anti-HPV-18/total IgG) in serum Livelli Ab serici + elevati Livelli Ab + elevati nel sito di infezione – dove c’è maggiore necessità Schwarz et al. 2008 3 Efficacia clinica La valutazione dell’efficacia clinica si basa sulla quantificazione della riduzione dell’incidenza dell’infezione persistente da HPV e sulla riduzione dell’incidenza delle lesioni precancerose da genotipi di HPV contenuti nel vaccino. Vaccino bivalente efficacia verso CIN2 e CIN3+ da HPV-16/18 Coorte TVC naïve analisi primaria∗ Efficacia Vaccinale (96.1%CI) Endpoint Gruppo Vaccino N 5449 n Controlli 5436 63 Vaccino 5449 0 CIN3+ HPV-16/18 5436 LL UL p-value 98.4 90.4 100 < 0.0001 100 64.7 100 < 0.0001 1 CIN2+ HPV-16/18 Controlli % 13 ∗ Corrisponde all’analisi “grezza” senza esclusione delle eventuali lesioni attribuibili ai ceppi HPV16 e 18. Paavonen J et al. Lancet 2009 EFFICACIA DEL VACCINO HPV QUADRIVALENTE (analisi combinata su 4 studi N = >20.000) 100 95% 100% 100% 99% 93% 70% 54% 47% 50 42% 36% 0 PPE population CIN/AIS CIN 1 Fonte: EMEA, RCP Gardasil, 2006 MITT-3 population CIN 2 CIN3/AIS EGL • 98-100% di efficacia verso CIN2/3 causati dai sierotipi contenuti nei vaccini nelle ragazze senza evidenza di precedenti infezioni • Non hanno azione terapeutica • Ambedue i vaccini sviluppano anticorpi con titoli molto più elevati rispetto all’infezione naturale • Il livello minimo protettivo di anticorpi non è conosciuto • Il vaccino quadrivalente mostra un calo degli anticorpi misurabili verso HPV 18 ma non vi è evidenza che questo comporti la perdita della protezione Estensione della fascia di età interessata • Pubblicati studi, sia immunologici che di efficacia clinica, sull’estensione della fascia di età nella quale i vaccini sono efficaci: fino a 45 anni il tetravalente e fino a 55 anni il bivalente. February 4, 2011 Human papillomavirus vaccine (HPV) (Minimum age: 9 years) • Quadrivalent HPV vaccine (HPV4) or bivalent HPV vaccine (HPV2) is recommended for the prevention of cervical precancers and cancers in females. • HPV4 is recommended for prevention of cervical precancers, cancers, and genital warts in females. • HPV4 may be administered in a 3-dose series to males aged 9 through 26 years to reduce their likelihood of genital warts. Cross protezione • Riconosciuta la cross protezione cioè la capacità dei vaccini di proteggere in parte anche da sierotipi non contenuti nei vaccini stessi; in particolare tale capacità è stata dimostrata per Gardasil verso il sierotipo 31 (correlato al 16) ma non verso il 45 ( correlato al 18); per Cervarix è stata dimostrata per 31,33 e 45 anche se con significatività differenti. Cross-protezione verso singolo ceppo oncogeno (popolazione TVC-naïve) Analisi Finale [Lancet 2009]1 HPV types HPV312,3 HPV332,3 Gruppo N n Vaccino 5449 0 Controllo 5436 20 Vaccino 5449 5 Controllo 5436 18 Vaccino 5449 0 HPV452,3 Controllo 5436 5 HPV HR, esclusi HPV16 e182,3 Vaccino 5449 21 Controllo 5436 67 5449 22 Efficacia % 96.1% CI p- value 100.0 (78.3; 100.0) <0.0001 72.3 (19.1; 92.5) 0.0065 100.0 (-19.5; 100.0) 68.8 (47.1; 82.4) Vaccino Tutti HPV 77.7 Soggetti DNA negativi al baseline per il corrispondente ceppo HPV oncogeno (63.5; 87.0) 5436 98 Controllo HR2,3 0.0310 <0.0001 <0.0001 Analisi al Follow Up 48M N n Efficacia% 95% IC 5466 3 89.4 5452 28 (65.5; 97.9) 5466 5 82.3 5452 28 (53.4; 94.7) 5466 0 5452 8 100.0 (41.7; 100.0) 0.0039 5466 45 5452 102 56.2 (37.2; 69.9) <0.0001 5466 46 5452 151 69.8 (57.8; 78.8) <0.0001 pvalue <0.0001 <0.0001 1 Skinner et al.oral presentation IPC2009 Sweden 2 [Paavonen J; 26th IPvC Montreal 3-8 luglio 2010] per i dati di EV rispetto ai ceppi HPV 16 e 18 3 [Romanowski B; 26th IPvC Montreal 3-8 luglio 2010] per i dati di Xprotezione dati di sicurezza CERVARIX Coorte TVC Vaccino N = 9319 outcomes di sicurezza Control N = 9325 n % n % 701 8 699 8 11 <1 6 <1 condition cliniche significative 2960 32 3025 32 malattie croniche di nuova insorgenza 251 3 268 3 malattie autoimmuni di nuova insorgenza 78 <1 77 <1 morti 9 <1 8 <1 Eventi Avversi Seri (SAE) SAE legate al Vaccino nessun decesso era associabile al vaccino, in ogni gruppo Paavonen J et al. Lancet 2009 dati di sicurezza: esiti in gravidanza coorte TVC CERVARIX Vaccino N = 1804 esiti in gravidanza* Controlli N = 1802 n % n % gravidanze ongoing 204 11 212 12 neonati normali 1124 62 1136 63 anomalie congenite 12 <1 9 <1 condizioni cliniche rilevanti (del feto) 9 <1 10 <1 aborto spontaneo 164 9 156 9 interruzione di gravidanza 185 10 194 11 Paavonen J et al. Lancet 2009 Gardasil: sicurezza confermata dagli organismi internazionali “… Sulla base delle informazioni disponibili il CDC e l'FDA hanno concluso che Gardasil è sicuro ed efficace nella prevenzione delle patologie causate dai 4 tipi vaccinali… … Con riferimento agli eventi avversi gravi rilevati attraverso il sistema VAERS - Vaccine Adverse Event Reporting System - è stato confermato che: - non esiste un rapporto causale tra gli eventi avversi gravi registrati e la vaccinazione con Gardasil - in particolare, la vaccinazione con Gardasil non aumenta il rischio di Sindrome di Guillain-Barrè nei vaccinati rispetto alla popolazione generale…” “Sicurezza dei vaccini contro il papillomavirus umano … I dati post commercializzazione degli USA riguardanti un vaccino HPV (Gardasil) sono stati rassicuranti; il profilo di sicurezza è stato simile a quello trovato nei trial clinici pre-marketing. Nessuna evidenza di eventi avversi gravi, precedentemente non individuati è stata causalmente correlata al vaccino…” Comunicato CDC 22 ottobre 2008; WHO GAVCS 2009 Sorveglianza post-marketing • Negli Stati Uniti da giugno 2006 a gennaio 2010 sono state somministrate 28 milioni di dosi ; ci sono state 15.829 segnalazioni di eventi avversi delle quali la grande maggioranza ( 92%) non gravi. • In Gran Bretagna sono state somministrate da Aprile 2008 3,5 milioni di dosi e 3446 sono le segnalazioni di reazioni avverse per la grande maggioranza non gravi. • In ambedue i Paesi, oltre a registrare le segnalazioni spontanee di reazioni avverse, vengono monitorate alcune patologie di particolare interesse (Sindrome di Guillain Barrè, Encefalite, altre patologie neurologiche e autoimmuni ) e non si è rilevato alcun aumento della frequenza nella popolazione vaccinata rispetto all’atteso. • In Emilia-Romagna dall’inizio della campagna vaccinale sono state somministrate circa 130.000 dosi e vi sono state 325 segnalazioni di reazioni avverse di cui 14 definite gravi (astenia, dolori muscolari e articolari, reazioni allergiche, trombocitopenia idiopatica, crisi convulsiva) Reazioni avverse segnalate in EmiliaRomagna anni 2006-2008 Tipovac N Esa PCV7 MPR DTPa MenC HPV dT Influ Var DTPa,IPV IPV EpB ped dTpa Hib DT 238 183 156 148 94 53 37 8 4 4 3 3 3 2 2 Dosi 2006- TassoX10 2008 000 351889 341980 306481 103098 209509 38795 88264 60612 2218 28052 2584 25747 3348 29219 4766 6,8 5,4 5,1 14,4 4,5 13,7 4,2 1,3 18,0 1,4 11,6 1,2 9,0 0,7 4,2 Strategie di vaccinazione nel mondo OMS: privilegiare le pre-adolescenti USA, Agosto 2006: raccomandato per bambine tra 9 e 12 anni, recupero fino a 26 anni EU: raccomandato per bambine e ragazze in Austria, Francia, Germania. Strategia di vaccinazione in Italia • Parere Consiglio Superiore Sanità, 11/01/07: gratuito per le bambine nel 12°anno di vita, invito a considerare il recupero a 18 o 25 anni • DeterminazioneAIFA del 28/02/2007 per Gardasil: fascia H-RR, gratuito per le bambine nel 12° anno di vita (a 11 anni compiuti) L’impiego di Gardasil deve essere stabilito in accordo alle raccomandazioni ufficiali • Documento portato all’attenzione della Conferenza Stato-Regioni e approvato il 20/12/2007: dal 2008 coorte 12°anno di vita (nate 1997) In discussione la disponibilità della vaccinazione presso ambulatori vaccinali AUsl per ragazze e donne da 12 a 26 anni • Determinazione AIFA del 29/10/2007 per Cervarix Data di inizio campagna vaccinale Ricognizione delle decisioni regionali sulla campagna vaccinale HPV 16- 18 2008 2007 P. Trento; Liguria; Toscana Veneto;Emilia-Romagna; Molise; Calabria; Sicilia** Campania Lazio Lombardia; P. Bolzano; Basilicata* Friuli-Venezia Giulia; Umbria; Abruzzo; Puglia Marche Valle d’Aosta Sardegna Piemonte Coorti con offerta attiva e gratuita al 31-12-2009 1 coorte (12°anno) 4 coorti (12-15-18-25°anno) 2 coorti (12 - 15/16/17°anno) Regioni Coorti Piemonte, Valle D’Aosta 12° e 16° Liguria 12° e 16° dal 2010 Toscana 12° e 16° dal 2009 Friuli Venezia Giulia 12° e 15° Marche 12° e 17° non appena disponibile vaccino Recupero delle nate nel 1996 e altre coorti con offerta gratuita su richiesta Gratuita attiva (6) Gratuita su richiesta (9) Non previsto il recupero (6) Altre coorti con offerta gratuita su richiesta Coorti Toscana 13° - 14 - 15° Marche 13° -17° Il diritto alla gratuità è mantenuto anche se la vaccinazione non è stata effettuata nell’anno previsto? Informazione non pervenuta (4) Diritto alla gratuità mantenuto (15) Diritto alla gratuità non mantenuto (2) Regioni Diritto fino a Valle D’Aosta, Toscana 16 anni Veneto, Sicilia 25 anni FVG 18 anni Marche 26 anni Coorti con pagamento agevolato 13-25° anno (9) Basilicata: classi intermedie * 13-17° anno (3) 14-25°anno (2) * Calabria: ASP Reggio Calabria * * * Dati desunti dalla precedente ricognizione 17-25° anno (2) 18-26°anno (1) 16-17° anno (1) Nessuna coorte (4) Strategia di vaccinazione in EmiliaRomagna • Delibera regionale del 25-02-2008 n. 236: “Recepimento dell’intesa Stato, Regioni e Province autonome del 20 dicembre 2007 e approvazione del programma regionale di vaccinazione anti-HPV” • Delibera regionale del 13-12-2010 n.1928: “ Modificazione del programma regionale di vaccinazione anti-HPV ” Programma regionale vaccinazione anti-HPV in Emilia-Romagna • offerta gratuita del vaccino, con invito a tutte le adolescenti nel dodicesimo anno di vita (nell’anno 2008 la coorte delle nate nel 1997, cioè 16.611 ragazze) • vaccinazione delle ragazze fino ai 25 anni di età, su richiesta dei genitori e con prezzo “agevolato” (prezzo di acquisto del vaccino da parte della Regione più costo per la prestazione, come da tariffario regionale). • la vaccinazione, inoltre, viene eseguita gratuitamente, su presentazione spontanea e richiesta dei genitori, a tutte le adolescenti che hanno compiuto 11 anni nel corso del 2007 (coorte delle nate nel 1996) Coperture vaccinali HPV, al 30 giugno 2010, distinte per AUsl, Regione Emilia-Romagna. Dati al 30 giugno 2010 Coorte 1998 Coorte 1997 Copertura vaccinale HPV (3 dosi) nella coorte di nascita 1998. Dati al 30 giugno 2010 100 Copertura vaccinale HPV (3 dosi) ne lla coorte di nascita 1997. Dati al 30 giugno 2010 100 83,5 80 93,1 71,8 80 52,4 60 40 57,2 60 40 26,4 20 20 0 0 Piacenza Parma Reggio Modena Bologna Imola Ferrara Ravenna Forli' Emilia Cesena Rimini Regione EmiliaRomagna Piacenza Parma Reggio Modena Bologna Imola FerraraRavenna Forli' Cesena Rimini Regione Emilia EmiliaRomagna DISTRETTI DISTRETTI MIN Valtaro e Valceno (Parma) 6,1% MIN Porretta Terme (Bologna) 54,3% MAX Pianura Ovest (Bologna) 88,9% MAX Imola (Imola) 93,1% Area Nord Area Centro Area Romagna Media regionale Coperture vaccinali HPV coorte di nascita 1997, Regione Emilia-Romagna. Confronto dati al 30 giugno 2009, al 31 dicembre 2009 e al 30 giugno 2010 Dati al 30 giugno 2009 Dati al 31 dicembre 2009 Dati al 30 giugno 2010 % vaccinati con almeno 1 dose % vaccinati con almeno 2 dosi % vaccinati 3 con dosi % vaccinati con almeno 1 dose % vaccinati con almeno 2 dosi % vaccinati 3 con dosi % vaccinati con almeno 1 dose % vaccinati con almeno 2 dosi % vaccinati 3 con dosi Piacenza 80,9 79,5 75,6 86,2 81,3 78,7 84,8 83,7 81,6 Parma 68,1 64,5 43,2 66,7 64,5 59,0 67,6 65,7 61,4 Reggio Emilia 75,6 73,4 67,1 75,5 74,3 71,0 78,5 76,6 74,2 Modena 73,9 72,5 56,4 76,1 75,0 71,1 78,0 77,2 74,4 Bologna 68,2 67,0 60,6 67,1 66,4 61,8 70,8 70,3 67,2 Imola 93,7 92,8 90,1 94,3 93,7 91,4 95,7 94,9 93,1 Ferrara 76,4 74,5 54,0 79,6 78,9 74,2 86,1 85,6 82,6 Ravenna 77,3 74,0 46,4 78,2 77,7 67,3 80,0 79,7 77,2 Forlì 78,2 76,2 49,7 79,3 78,5 72,5 81,5 81,0 77,1 Cesena 65,5 64,6 55,0 66,4 65,6 62,8 66,6 66,0 63,6 Rimini 58,3 55,9 44,4 60,2 58,7 54,5 61,1 59,6 57,2 Regione 72,6 70,7 57,4 73,5 72,2 67,6 75,7 74,7 71,8 Azienda USL Coperture vaccinali HPV coorte di nascita 1998, Regione Emilia-Romagna. Confronto dati al 31 dicembre 2009 e al 30 giugno 2010 Dati al 31 dicembre 2009 Dati al 30 giugno 2010 % vaccinati con almeno 1 dose 76,2 % vaccinati con almeno 2 dosi 74,8 % vaccinati 3 con dosi 26,3 % vaccinati con almeno 1 dose 76,0 % vaccinati con almeno 2 dosi 75,2 % vaccinati 3 con dosi 71,8 Parma 46,1 39,6 11,5 64,3 61,9 39,6 Reggio Emilia 63,2 57,2 24,8 79,3 76,9 59,2 Modena 61,9 56,3 25,4 77,3 75,6 54,6 Bologna 60,8 58,7 21,0 66,6 64,9 58,2 Imola 87,2 83,9 22,9 87,4 85,0 83,5 Ferrara 34,1 28,3 11,4 64,7 56,6 32,2 Ravenna 30,2 26,2 5,7 73,9 64,0 26,4 Forlì 56,8 52,5 19,7 80,9 79,9 52,4 Cesena 59,7 53,0 21,6 65,4 65,1 56,6 Rimini 56,1 50,8 29,2 59,1 57,4 50,7 Regione 56,8 52,2 20,4 71,6 68,7 52,4 Azienda USL Piacenza Coperture vaccinali HPV nelle coorti di nascita 1990-95, Regione Emilia-Romagna. Confronto dati al 31 dicembre 2009 e al 30 giugno 2010 Dati al 31 dicembre 2009 Coorte Dati al 30 giugno 2010 % vaccinate % vaccinate % vaccinate % vaccinate % vaccinate % vaccinate con almeno con almeno con almeno con almeno con 3 dosi con 3 dosi 1 dose 2 dosi 1 dose 2 dosi Coorte di nascita 1995 8,7% 8,1% 5,9% 11,8% 11,1% 8,4% Coorte di nascita 1994 8,1% 7,5% 5,6% 10,6% 10,1% 7,9% Coorte di nascita 1993 8,3% 7,8% 5,6% 9,6% 9,1% 7,8% Coorte di nascita 1992 6,0% 5,6% 4,4% 6,8% 6,5% 5,5% Coorte di nascita 1991 3,8% 3,5% 3,0% 3,9% 3,7% 3,4% Coorte di nascita 1990 1,4% 1,3% 1,1% 1,5% 1,4% 1,4% Coorti di nascita 1990-95 6,0% 5,6% 4,3% 7,3% 6,9% 5,7% E nel resto d’Italia? Coperture vaccinali per la prima e terza dose di HPV al 31 dicembre 2009. Coorte di nascita 1997 81% 80% 60% Copertura nazionale 3 dosi 52% 40% 19% 20% Nord * dati al 30 giugno 2009 Centro Sud Sicilia Sardegna Puglia Molise Calabria Basilicata Abruzzo Umbria Toscana Marche* Lazio Veneto Val d'Aosta Piemonte PA Trento PA Bolzano Lombardia* Liguria FVG Emilia-Romagna 0% Coorte 1997: dati di copertura per 3 dosi di vaccino HPV aggiornati al 30/06/2010, per Regione * Regione Campania: dati aggiornati al 31/12/2009 Recupero coorte di nascita 1996 (14 Regioni) Coperture vaccinali al 31 dicembre 2009 Copertura nazionale 1 dose 50% 3 dosi 42% offerta attiva Nord Centro Sud Coperture vaccinali per la prima e terza dose di HPV al 31 dicembre 2009. Coorte di nascita 1998. Copertura nazionale 1 dose 37% 3 dosi 13% Nord Centro Sud Coperture vaccinali per la prima e terza dose HPV per le altre coorti di nascita Range Terza dose Media nazionale (%) Range 11,3 2,3-84,1 6,9 1,3-76,4 1994 15,5 1,9-89,4 8,8 1,1-81,8 1993 21,0 1,7-78,1 13,4 0,8-79,9 1992 5,7 1,2-86,6 3,8 0,8-81,6 1991 4,5 0,8-86,6 3,4 0,4-76,7 1990 n.a 0,6-n.a. 3,6 0,3-78,1 1989-1983 0,8 0,2-52,7 0,5 0,2-31,6 1982 1,7 0,1-58,3 1,5 0,1-53,2 Prima dose Media nazionale (%) 1995 Studio PreGio Indagine CAP (Conoscenze, Attitudine, Pratica) Fattibilità dell’offerta della vaccinazione HPV in donne di 18-26 anni. Studio PreGio ASL Avezzano-Sulmona 64 (51) Bologna 69 (74) Firenze 42 (45) Imola 81 (79) Ivrea 57 (53) Napoli Pescara Denature specime n Vaccinate con almeno una dose n (%) Teramo Torino Viterbo Total Capture and detect hybrids 45 (30) 51 (50) Luminescen 63 (61)ce 45 (57) 63 (64) 580 (56) Le fonti d’informazione su Pap-test, HPV e vaccino Vaccino vissuto atteso Pap-test HPV Amici/parenti 60% 27% 20% 4% Riviste/quotidiani/TV 11% 23% 28% 5% Ginecologo 31% 13% 8% 55% Medico di famiglia 12% 8% 8% 49% 3% 3% 3% 16% Servizio vaccinale ASL - - - 12% Farmacista - - - 1% Internet 2% 5% 4% 5% Non so, non ricordo 1% 2% 2% - Consultorio familiare La quasi totalità delle intervistate richiede informazioni di qualità veicolate da professionisti sanitari Aspetti critici • • • • • • • profilo di sicurezza a lungo termine durata dell’efficacia necessità di un richiamo pressione selettiva uso in gravidanza impatto sulle politiche di screening falsa sicurezza verso altre infezioni sessualmente trasmesse • implicazioni sociali e comunicative rispetto alla prevenzione di una malattia a trasmissione sessuale rivolta alle bambine • Impegno organizzativo Possibili punti di forza • In certe regioni si registra una maggiore copertura da parte del vaccino rispetto allo screening con migliore penetrazione in quelle fasce di popolazione che gli screening, per differenti motivi, non riescono a raggiungere • La vaccinazione HPV dovrebbe rappresentare un’occasione per mantenere alta l’attenzione sugli screening, ma anche per affrontare e diffondere i temi di una sessualità responsabile. Sembra infatti molto calata l’attenzione verso le malattie sessualmente trasmissibili sia da parte dei mezzi di comunicazione e delle istituzioni, sia da parte dei cittadini che non sembrano più avere paura di queste malattie, come dimostrato dall’aumento della proporzione dei casi di infezione da HIV attribuibili a trasmissione sessuale. Rosolia - Tassi di incidenza per 100.000 Emilia-Romagna e Italia e copertura vaccinale regionale al 24°mese. Periodo 1987 - 2009 100 140 120 100 80 95 90 60 40 20 0 85 1987 1988 1989 1990 1991 1992 1993 1994 1995 1996 1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007 2008 2009 * Emilia-Romagna * Dato italiano provvisorio Italia copertura vaccinale ER 80 Anagrafe vaccinale informatizzata • E’ di fondamentale importanza potere disporre di anagrafi vaccinali informatizzate il più complete possibili. Un’anagrafe informatizzata di tutte le ragazze vaccinate permetterà l’incrocio con i registri dei programmi di screening per valutazioni di efficacia. Inoltre è importante al momento dello screening conoscere lo stato vaccinale della donna visto che esiste una differente prevalenza di patologia tra chi è vaccinato e chi non ha ricevuto il vaccino. • È quindi importante che vengano comunicati ai dipartimenti di Sanità Pubblica i dati quanto più possibili completi anche delle donne che vengono vaccinate privatamente negli ambulatori dei professionisti. Emilia-Romagna I manifesti, l’opuscolo, i depliant informativi I depliant sulla vaccinazione HPV nelle diverse lingue, Emilia-Romagna
Scaricare