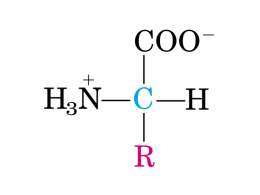
AMMINOACIDI E PROTIDI Prof. Paolo Polidori Università di Camerino AMMINOACIDI Le proteine sono polimeri lineari di amminoacidi; ogni amminoacido è legato al successivo tramite un legame peptidico. Gli amminoacidi derivano il loro nome dal fatto di possedere un gruppo amminico e un acido nella medesima molecola. In teoria, sono possibili moltissimi amminoacidi: in pratica, quelli che sono incorporati nelle proteine sono soltanto 20. I venti amminoacidi che formano le proteine sono tutti -amminoacidi: l’atomo di carbonio è quello cui sono legati sia il gruppo carbossilico che il gruppo amminico. STRUTTURA PRIMARIA PROTEINE Si intende la definizione della sequenza degli amminoacidi di una catena polipeptidica. Legandosi fra loro, gli amminoacidi formano sequenze lineari, come lineare è il DNA che le codifica. Le strutture primarie possibili sono numerose: si possono infatti avere 20 diverse possibilità (quanti sono gli amminoacidi) per la prima posizione. A ciascuna di queste 20 ne corrispondono 20 per la seconda posizione, e così via. Quindi il numero totale delle possibilità è 20n, (20 = numero amminoacidi, n = numero lunghezza catena). Struttura Secondaria Proteine Dipende da quella primaria: alcuni amminoacidi promuovono certe strutture secondarie e ne destabilizzano altre. Tra le strutture secondarie più note si può citare l’-elica. La struttura terziaria descrive il ripiegamento nello spazio delle catene polipeptidiche. La struttura quaternaria interessa le molecole proteiche composte da più sub-unità, come l’emoglobina. DIGESTIONE DELLE PROTEINE Le proteine alimentari hanno un valore in quanto da loro si possono ottenere amminoacidi liberi che vengono poi utilizzati per i bisogni dell’organismo. I problemi connessi alla digestione sono quindi quelli di idrolizzare i legami peptidici; il legame peptidico è forte e non si idrolizza facilmente. Alcuni enzimi del tubo gastroenterico, chiamati endopeptidasi, scindono le grosse molecole proteiche in frammenti più piccoli, sui quali è possibile l’azione di altri enzimi (esopeptidasi) che producono amminoacidi singoli e piccoli peptidi (2-3 amminoacidi). DENATURAZIONE PROTEINE I legami chimici che determinano le strutture superiori alla primaria sono deboli, possono essere scissi dalla temperatura (cottura alimenti) e da variazioni di pH (nello stomaco, aggiunta di limone, ecc.). Questo processo si chiama Denaturazione e la proteina che lo subisce cambia la propria conformazione e perde le sue proprietà biologiche caratteristiche La cottura può non soltanto denaturare le proteine, ma anche alterare alcuni aminoacidi. ENZIMI DIGESTIVI L’intestino digerisce e assorbe ogni giorno una notevole quantità di proteine, alcune di provenienza alimentare, altre secrete nel tratto gastroenterico. La digestione delle proteine si avvale di 2 tipi di enzimi: le endopeptidasi e le esopeptidasi. Tale digestione avviene nello stomaco e nel tenue e i prodotti finali sono amminoacidi, di e tripeptidi. Nello stomaco, la secrezione acida denatura le proteine esponendole all’attacco della pepsina, che le scinde in frammenti più o meno grandi. Le endopeptidasi pancreatiche (tripsina, chimotripsina ed elastasi) scindono ulteriormente i frammenti proteici. La secrezione di enzimi proteolitici da parte del pancreas è controllata dalla presenza di proteine nel canale gastroenterico: per questo è molto importante la precedente idrolisi parziale operata nello stomaco dalla pepsina. ASSORBIMENTO AMMINOACIDI I prodotti finali della digestione proteica sono assorbiti dalla mucosa enterica. E’ probabile che più della metà degli amminoacidi venga assorbita in forma di e tripeptidica. Gli amminoacidi assorbiti lasciano le cellule della mucosa e sono trasportati al fegato tramite la vena porta. Gli amminoacidi sono parzialmente metabolizzati negli enterociti, ove sono attive alcune transaminasi. GLI ENZIMI Gli enzimi sono proteine, ma spesso la componente proteica non è l’unica necessaria per l’attività: molti enzimi richiedono infatti la presenza di cofattori non proteici. Il termine enzima deriva dal greco, significa “nel lievito”, fu coniato quando si scoprì che estratti di lievito erano capaci di fermentare lo zucchero anche se le cellule erano morte. In sostanza, gli enzimi sono catalizzatori prodotti dalle stesse cellule viventi che li utilizzano, e possono catalizzare le reazioni in entrambi i sensi, reagenti-prodotti o viceversa. CLASSIFICAZIONE ENZIMI Gli enzimi sono ripartiti in sei classi: 1. Ossidoriduttasi: catalizzano reazioni di ossidoriduzione 2. Trasferasi: catalizzano il trasferimento di gruppi. 3. Idrolasi: catalizzano reazioni di idrolisi. 4. Liasi: catalizzano reazioni di addizione a un doppio legame. 5. Mutasi o Isomerasi: catalizzano reazioni di isomerizzazione. 6. Ligasi o Sintetasi: formano un legame con l’intervento di cofattori. AMMINOACIDI ESSENZIALI Dal punto di vista nutrizionale, gli amminoacidi possono essere divisi in essenziali e non essenziali. La presenza nell’alimentazione di tutti gli amminoacidi essenziali in quantità adeguata è un requisito fondamentale per assicurare il mantenimento della massa corporea e la crescita degli infanti. In caso di deficienza, il bilancio di azoto diventa negativo e si ha una perdita netta di proteine. Amminoacidi Essenziali e Non Essenziali Essenziali Non Essenziali Precursori di essenziali Istidina Alanina Glutammina Isoleucina Aspartato Metionina Leucina Asparagina Glutammato Lisina Glutammato Serina, Colina Metionina Serina Glutammato Fenilalanina Treonina Triptofano Valina Fenilalanina DIGERIBILITA’ PROTEINE Non tutte le proteine sono egualmente digeribili, quindi la quantità di amminoacidi assorbita dall’organismo non corrisponde alla quantità di amminoacidi assunti con l’alimentazione. La digeribilità è legata a numerosi fattori; le proteine della carne, delle uova, del pesce e del latte sono digerite per il 94-97% e la loro digeribilità è posta come 100 quando si paragonano proteine di origine diversa. VALORE BIOLOGICO PROTEINA Implica studi sul bilancio di azoto, indica il rapporto tra proteina depositata/proteina assorbita, dipende essenzialmente dal tipo di amminoacidi. Esiste anche un punteggio NPU (net protein utilization), misura l’utilizzazione totale della proteina (proteina depositata/proteina ingerita). AMMINOACIDO LIMITANTE: Quello contenuto in percentuale più bassa rispetto alle esigenze. Composizione in amminoacidi essenziali di una proteina ideale di riferimento Sorgente Lisina proteica Solforati Treonina Triptofano Punteggio Ideale 5.5 3.5 4.0 1.0 100 Latte in polvere 8.0 2.9 3.7 1.3 83 solforati Cereali 2.4 3.8 3.0 1.1 44 lisina Legumi 7.2 2.4 4.2 1.4 68 solforati chimico (ammin. limitante) CONCLUSIONI Il ruolo fondamentale degli amminoacidi è quello di prendere parte alla costruzione delle proteine. Il difetto, anche di un solo amminoacido, porta ad un rallentamento e ad un arresto della biosintesi proteica. Il fabbisogno di amminoacidi essenziali deve essere soddisfatto; il fabbisogno complessivo di amminoacidi varia molto in relazione alla disponibilità di altri nutrienti, quali ad esempio i glicidi.
Scaricare