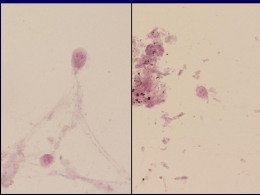
238 Attualità Recenti Prog Med 2011; 102: 238-245 La capsula endoscopica nella malattia di Crohn Carlo Maria Girelli Riassunto. La malattia di Crohn è in continuo aumento nei Paesi occidentali e, ancora oggi, viene diagnosticata tardivamente. La localizzazione di malattia nel piccolo intestino interessa circa il 30% dei pazienti ed è la sede che comporta le maggiori difficoltà diagnostiche. L’impressionante miglioramento tecnologico nella diagnostica endoscopica e radiologica del piccolo intestino occorso nell’ultimo decennio consente oggi di diagnosticare meglio che in passato questa condizione. In particolare, la capsula endoscopica è uno strumento altamente sensibile per il riscontro di lesioni infiammatorie della mucosa, ma deve essere impiegato con cautela per la possibilità di ritenzione e l’aspecificità dei reperti endoscopici. In questa revisione della letteratura sono stati criticamente valutati i principali vantaggi e svantaggi della metodica nei vari contesti clinici relativi alla malattia di Crohn e precisamente: nella malattia di Crohn già diagnosticata, sospetta, operata, e nella malattia infiammatoria intestinale non classificabile; in un tentativo di indirizzare il clinico verso un impiego appropriato nei diversi scenari associati alla malattia infiammatoria intestinale. The incidence of Crohn’s disease is steadily growing in western countries and the diagnosis is still delayed from symptoms onset by several years. Up to one third of patients have exclusive disease location in the small bowel, the tract less accessible to conventional diagnostic visualization. In the last decade, astonishing improvements in radiologic and endoscopic imaging allowed to better diagnose small bowel Crohn’s disease. In particular, capsule endoscopy is a high sensitive tool in diagnosing subtle inflammatory lesions of the mucosa, but retention risk and low specificity limit its use in this setting. The present review provides a critical evaluation of the published studies addressed to the diagnostic role of small bowel capsule endoscopy in established, suspect, operated Crohn’s disease and unclassified inflammatory bowel disease: in an attempt to help the clinician to utilize capsule endoscopy properly in the different clinical scenarios associated to inflammatory bowel disease. Parole chiave. Capsula endoscopica, malattia di Crohn, malattia infiammatoria intestinale, piccolo intestino. Key words. Capsule endoscopy, Crohn’s disease, inflammatory bowel disease, small bowel. Introduzione si, ispessimento parietale intestinale, nodularità ed ulcere della mucosa) ed istologici. Diversamente dalla rettocolite ulcerosa (altra malattia infiammatoria cronica intestinale), nella MC ogni tratto del tubo gastroenterico può essere coinvolto, anche se l’interessamento del tratto compreso tra ileo terminale e colon destro è presente sino al 70% dei casi, mentre nel 25-35% dei casi si reperta l’esclusivo interessamento dell’intestino tenue2. Poiché il dolore addominale e la diarrea cronici sono i sintomi più comunemente riportati all’esordio, la diagnosi differenziale con la sindrome dell’intestino irritabile può essere ardua e – dal momento che quest’ultima condizione, almeno 50-100 volte più frequente della MC, viene diagnosticata con criteri clinici in assenza di sintomi di allarme3 – non sorprende che la MC sia diagnosticata tardivamente, con una latenza diagnostica considerevole, senza sostanziali modifiche nel corso degli ultimi tre decenni. Il dato più recente, estrapolato dalla coorte canadese di Manitoba, indica infatti che la diagnosi di MC viene posta dopo un periodo mediano di 11 anni (range 3-43 anni) dall’esordio sintomatologico4. La malattia di Crohn (MC) è una delle malattie infiammatorie croniche intestinali la cui incidenza è in continuo aumento nei Paesi occidentali. In Italia non esistono dati epidemiologici recenti, ma si stima che circa 25.000-30.000 soggetti adulti ne siano affetti1. La malattia è definibile come un’infiammazione transmurale dell’intestino, con aspetti anatomo-patologici caratteristici (infiltrato focale con aggregati linfoidi, distorsione delle cripte, ascessi criptici, deplezione mucipara, ulcere e fissurazioni, granuloma), la cui diagnosi, in assenza di un marcatore diagnostico di certezza, si fonda su una costellazione di reperti clinici (dolore addominale, diarrea, ematochezia, calo ponderale, massa addominale, insufficiente crescita nei bambini, fistole perianali, tags anali, febbre, manifestazioni extra-intestinali immuno-mediate, risposta alla terapia, recidiva alla sospensione del trattamento), biochimici (negatività delle ricerche microbiologiche, elevazione degli indici di flogosi, trombocitosi, leucocitosi, anticorpi anti-Saccaromyces Cerevisiae), radiologici/endoscopici (stenosi, fistole, asces- Summary. Capsule endoscopy appropriateness in Crohn’s disease. UOC Medicina ad Indirizzo Gastroenterologico, AO Ospedale di Circolo di Busto Arsizio, Presidio di Busto Arsizio. Pervenuto il 18 novembre 2010. C.M. Girelli: La capsula endoscopica nella malattia di Crohn Senza dubbio, l’aspecificità e l’eterogeneità dei sintomi, unitamente alla difficoltà di approccio diagnostico all’intestino tenue, inaccessibile all’endoscopia convenzionale e, sino a pochi anni orsono, indagabile indirettamente solo per mezzo di metodiche radiologiche convenzionali (pasto baritato, clisma del tenue) e tomografiche (ultrasonografia di superficie, tomografia assiale computerizzata) sono implicati nel ritardo diagnostico. Nell’ultimo decennio abbiamo assistito ad un rapido progresso tecnologico nella diagnostica d’immagine dell’intestino tenue, sia endoscopica, con l’avvento della capsula endoscopica e dell’enteroscopia assistita da device, sia radiologica, con la messa a punto di metodiche come la enterografia mediante tomografia computerizzata (ETC), l’enterografia mediante risonanza magnetica (ERM), e l’ultrasonografia con mezzo di contrasto orale ed endovenoso a microbolle. Queste metodiche endoscopiche e radiologiche non competono tra loro, essendo in gran parte indagini complementari, consentendo le prime una miglior definizione delle lesioni mucosali e, per quanto concerne l’enteroscopia assistita da device, il campionamento istologico; le seconde, la possibilità di valutare l’estensione della malattia e le sue complicanze transmurali (fistole/ascessi) ed ostruttive. Sebbene considerate sicure, queste nuove metodiche sono tuttavia costose, operatore-dipendenti, ancora insufficientemente verificate negli studi clinici e scarsamente diffuse sul territorio e, remora non meno importante, non sono esenti da possibili complicanze anche gravi. La capsula endoscopica per il piccolo intestino (CEPI), commercializzata in Italia dal 2001, rappresenta il progresso più rilevante nella diagnostica dell’intestino tenue ed è attualmente raccomandata come terzo esame nell’approccio alle emorragie digestive oscure: dopo un’esofago-gastroduodenoscopia ed una colonscopia negativa5. La CEPI, essendo indolore, di semplice esecuzione e ben accettata dai pazienti, appare particolarmente adatta a diagnosticare le lesioni iniziali della MC ed essendo stata ampiamente pubblicizzata dai mezzi di comunicazione di massa, non di rado viene richiesta dai pazienti affetti da malattia infiammatoria intestinale nota o sospetta, per una valutazione diagnostica del piccolo intestino, anche se la metodica è stata maggiormente testata e validata nel contesto clinico dell’emorragia digestiva oscura. Pertanto, lo scopo della presente revisione della letteratura è quello di delineare l’attuale collocazione della CEPI nella diagnostica della MC dell’intestino tenue nei differenti contesti clinici in cui è stata valutata e, precisamente, nella MC nota, nella MC sospetta, nella MC operata e nella malattia infiammatoria intestinale non classificabile, precedentemente denominata colite indeterminata. La capsula endoscopica nella malattia di Crohn nota Due meta-analisi6,7 hanno mostrato una resa diagnostica maggiore della CEPI rispetto a metodiche radiologiche come il pasto baritato (PB), ETC, ed endoscopiche come l’ileocolonscopia (IC) e la enteroscopia push. In particolare, due studi8,9 hanno enfatizzato l’abilità della CEPI di identificare lesioni prossimali (duodeno-digiunali) inattese, migliorando la stadiazione di malattia. Tuttavia va rilevato che in tutti gli studi considerati in queste meta-analisi, i pazienti erano stati sottoposti a studi radiologici precedentemente alla CEPI per escludere dall’arruolamento quelli con stenosi significative, onde minimizzare il rischio di ritenzione. La frequenza di ritenzione della CEPI, la complicanza più comune della metodica, è di gran lunga più elevata nella MC nota rispetto all’indicazione dell’emorragia oscura, essendo riportata sino al 13%10. Inoltre, non è noto se il riscontro di un numero maggiore di lesioni riscontrate nel tratto più prossimale del piccolo intestino abbia un impatto sul trattamento e sull’outcome di questi pazienti. Pertanto, l’utilizzo della CEPI nei pazienti con MC nota dovrebbe essere limitato a quelli che necessitano una rivalutazione strumentale di malattia, che hanno controindicazioni ad una ERM, che sono stati già sottoposti ad un carico elevato di radiazioni ionizzanti nella loro anamnesi ed in cui, per il rischio di ritenzione, l’intervento chirurgico potrebbe essere un’opzione terapeutica. Questi pazienti potrebbero esser sottoposti, prima della CEPI, a valutazione della pervietà intestinale mediante capsula patency, una capsula ingerita dal paziente che, in caso di ostruzione, si autodissolve. L’enunciato delle linee-guida dell’Organizzazione Mondiale di Endoscopia Digestiva e dell’Organizzazione Europea per Crohn e Colite (OMED-ECCO) stabilisce che il ruolo della CEPI nei pazienti con MC nota dovrebbe focalizzarsi sui soggetti con sintomi non spiegati (qualora altri accertamenti radiologici siano stati inconclusivi) se l’acquisizione di nuovi elementi possano modificare il trattamento11. La capsula endoscopica nella malattia di Crohn sospetta Per le motivazioni di cui si è detto, non stupisce che questo contesto clinico sia stato quello maggiormente indagato dai ricercatori. L’interpretazione dei risultati degli studi non è agevole, principalmente per due motivi; (a) la eterogeneità dei criteri d’inclusione dei pazienti e (b) l’arbitrarietà della definizione di positività del reperto endoscopico. Il punto (a) si riferisce alla mancanza di criteri standardizzati per definire la MC sospetta. Nei vari studi pubblicati i pazienti dovevano avere diarrea cronica e dolore addominale, datanti da un tempo talvolta imprecisato e più o meno associati ad indici di sospetto come calo ponderale, anemia, positività del sangue occulto fecale, sideropenia, elevazione della proteina C reattiva, febbre, manifestazioni extra-intestinali di malattia, in aggiunta alla negatività della colonscopia e a quella di almeno un accertamento radiologico del piccolo intestino. 23 240 Recenti Progressi in Medicina, 102 (6), giugno 2011 Gli studi più recenti12,13 hanno cercato di uniformare i criteri di sospetta MC utilizzando variabili cliniche, biochimiche e radiologiche concordate da un gruppo di esperti in occasione della 5° Conferenza Internazionale di Capsula Endoscopica (ICCE, figura 1)14, criteri che, anche se mai formalmente testati e validati, hanno il pregio di costituire una base comune su cui poter disegnare studi futuri, paragonabili tra loro. A questo proposito, uno studio multicentrico tedesco denominato CEDAP-Plus (Capsule Endoscopy in Diarrhea and Abdominal Pain e almeno un sintomo e/o segno indicativo di malattia organica compreso tra calo ponderale superiore al 10% del peso usuale, anemia sideropenica inspiegata, aumento di almeno uno degli indici infiammatori considerati, cioè proteina C reattiva, velocità di eritrosedimentazione, leucocitosi, trombocitosi)15 ha prospetticamente valutato 50 pazienti con dolore addominale e/o diarrea cronici, con endoscopia del tratto digestivo inferiore e superiore ed almeno una diagnostica d’immagine radiologica sul piccolo intestino considerati negativi o inconcludenti per malattia organica gastrointestinale. Lo studio ha mostrato che la presenza di almeno un indice infiammatorio alterato comportava un rischio relativo significativamente elevato (3,2; 95% IC: 1-10) per il riscontro di malattia infiammatoria ileale all’indagine con CEPI confermando, almeno indirettamente, che i criteri ICCE rappresentano un buon inizio per la selezione dei pazienti con sospetto diagnostico di MC da sottoporre a CEPI. Il punto (b) riguarda l’arbitrarietà del reperto endoscopico con cui i ricercatori hanno definito positivo, negativo o dubbio per MC un esito di CEPI. I criteri usualmente adottati nei vari studi definivano come molto suggestivi per MC più di 3 ulcere distinte, compatibili con MC; 1-3 ulcere e modificazioni infiammatorie aspecifiche: afte, erosioni, denudazione focale dei villi, congestione, edema, eritema (figura 2). Sospetta malattia di Crohn del piccolo intestino 1 item della colonna A e almeno un item delle altre colonne Colonna A Sintomi GI Colonna B Sintomi extra GI Dolore addominale cronico Febbre Diarrea cronica Pyoderma Colonna C Laboratorio Anemia sideropenica Artrite/artralgia Calo ponderale Uveite Crescita insufficiente Malattia perianale Colonna D Radiologia Ecografia intestinale VES/PCR Pasto baritato Leucocitosi ETC/ERM ASCA/pANCA Colangite sclerosante Figura 1. Criteri ICCE per sospetta malattia di Crohn del piccolo intestino. GI, gastrointestinali; PCR, proteina C reattiva; ASCA, anticorpi anti Saccaromyces Cerevisiae; pANCA, anticorpi anti neutrofili pattern peri-nucleare; ETC, enterografia mediante tomografia computerizzata; EMR, enterografia mediante risonanza magnetica14. A B C D Figura 2. Lesioni infiammatorie del piccolo intestino evidenziate dalla capsula endoscopica. A. Erosioni denudazione focale dei villi; diagnosi finale: malattia di Crohn. B. Erosioni aftoidi; diagnosi finale: tubercolosi. C. Ulcera (freccia); diagnosi finale: malattia di Crohn. D. Ampia ulcera stenosi; diagnosi finale: enterite cronica multifocale ulcero-stenosante (CMUSE). C.M. Girelli: La capsula endoscopica nella malattia di Crohn L’aspecificità di tali reperti aumenta soprattutto in relazione all’utilizzo di farmaci anti-infiammatori non steroidei (FANS) da parte dei pazienti nelle settimane precedenti la valutazione con CEPI (tabella 1). Gli studi futuri, per ovviare a tale inconveniente, dovranno essere disegnati escludendo i pazienti che ammettono uso di FANS, utilizzando scale endoscopiche semi-quantitative validate, disegnate ad hoc per la CEPI, quali il punteggio di Lewis ed il CECDAI16,17. Tabella 1. Condizioni associate a lesioni infiammatorie della mucosa del piccolo intestino. • Volontari sani • Malattie – Malattia di Crohn – Tubercolosi – Malattia di Behcet – Vasculiti – Farmaci (ASA, FANS, sali di potassio, etc) – Malattia celiaca complicata – CMUSE – CNSU – Neoplasie maligne ASA, Acido Acetilsalicilico; FANS, Farmaci Antinfiammatori Non Steroidei; CMUSE, Criptogenyc Multifocal Ulcero-Stenosing Enteritis; CNSU, Chronic Non Specific Ulcer rapporto non specificato tra i due sottogruppi, rendendo poco agevole la interpretazione dei risultati nel sottogruppo di pazienti con MC sospetta. In questi studi, la frequenza di ritenzione della CEPI appariva inferiore al 5%, solo di poco aumentata rispetto ai pazienti con l’indicazione con emorragia oscura, probabilmente perché i pazienti inclusi erano già stati sottoposti ad una diagnostica radiologica in grado di escludere la presenza di grossolane ostruzioni intestinali. Per quanto riguarda la collocazione della CEPI nel work up diagnostico della sospetta MC, sono stati pubblicati due algoritmi diagnostici; il primo, del gruppo americano della Mayo Scottsdale, prevede l’utilizzo immediato della CEPI dopo una IC negativa in assenza di sintomi ostruttivi o previo capsula patency in presenza di sospetta occlusione (figura 3 alla pagina seguente)20; il secondo, proposto dal gruppo inglese di Sheffield, contempla l’utilizzo della CEPI come terzo esame dopo una IC negativa o incompleta ed almeno una metodica radiologica inconcludente o negativa (figura 4)21. Per quanto riguarda l’analisi costo/beneficio dell’approccio diagnostico con CEPI nel sospetto MC del piccolo intestino, sono stati pubblicati due studi con disegno e metodologia differenti. Nel primo, gli autori hanno effettuato una simulazione col metodo Montecarlo per confrontare il rapporto costo/beneficio di un approccio con CEPI o con PB come secondo test dopo una IC negativa per MC. I risultati di questo studio hanno mostrato un eguale rapporto costo/beneficio per le due metodiche, suggerendo pertanto l’impiego della CEPI come secondo test per la sua provata, superiore accuratezza diagnostica22. Importanti limitazioni di questo studio consistevano (a) nella mancata considerazione della probabilità pre-test di malattia, (b) nella assunzione di valori di sensibilità (0,96) e specificità (0,87) della CEPI eccessivamente elevati, (c) nella mancata considerazione dei costi indotti da una falsa diagnosi di malattia di Crohn; (d) nella mancata considerazione che gli studi inseriti nel modello avevano incluso pazienti che avevano già effettuato, nella stragrande maggioranza, un PB inconcludente. Il secondo studio utilizzava un modello di Markov per l’analisi costo/beneficio dell’utilizzo della CEPI come secondo test dopo una IC negativa. Tenendo conto di queste limitazioni, una metaanalisi7 ha mostrato una resa diagnostica della CEPI superiore a PB, ETC ed IC nel contesto degli studi che confrontavano la CEPI con altre metodiche d’immagine per il piccolo intestino, non solo in pazienti con MC nota, ma anche in soggetti con MC sospetta. L’accuratezza diagnostica della CEPI, in termini di sensibilità, specificità, predittività positiva e negativa, è stata valutata in 3 studi non controllati, di cui solo uno prospettico18, due dei quali hanno in buona parte, retrospettivamente, utilizzato i criteri ICCE (tabella 2). Complessivamente, se si eccettua lo studio di Tukey12 che ha incluso un 25% di pazienti che avevano ammesso l’uso di FANS precedentemente alla CEPI, abbassando in tal modo la specificità del test, le caratteristiche della CEPI appaiono soddisfacenti. In particolare, la migliore caratteristica della CEPI nella sospetta MC sembra essere l’elevata predittività negativa, la capacità cioè di escludere la presenza di malattia. Un ulteriore studio di Tabella 2. Accuratezza della capsula endoscopica nella sospetta malattia di Crohn confronto tra CEPI ed IC ed del piccolo intestino. altre metodiche radiologiN F up Sn Sp VPP VPN LR+ LRche (PB, ETC) in cui la dia- Studio (mesi) gnosi finale di MC è stata assegnata da una commis- Girelli18 27 21 0,3 0,84 0,87 0,0 5,8 0,08 sione di esperti alla fine del12 102 12 0,85 0,73 0,31 0,7 3,1 0,2 lo studio, ha confermato la Tukey bassa specificità della CE- Figueiredo13 78 28 0,3 0,80 0,77 0,4 4,7 0,08 PI19; tuttavia lo studio inN: numero pazienti; F up: follow up; Sn: sensibilità; Sp: specificità; VPP: predittività positiva; VNP: predittività cludeva pazienti con MC sia nota che sospetta, con un negativa; LR: likelihood ratio. 241 242 Recenti Progressi in Medicina, 102 (6), giugno 2011 zo test è in grado di identificare lesioni mucosali compatibili con MC in soggetti con radiologia inconclusiva o negativa; 3) la diagnosi di MC non dovrebbe fondarsi solo su immagini identificate alla CEPI; 4) una CEPI negativa ha un’elevata predittività negativa per MC. Sospetta MC del piccolo intestino Ileocolonscopia positiva Ileocolonscopia negativa o fallita Non ostruzione Ostruzione possibile La capsula endoscopica nella malattia di Crohn non classificabile Nella malattia infiammatoria intestinale all’esordio, la sovrapposizione di Patency elementi diagnostici caratteristici sia per MC sia per Non ostruzione Ostruzione rettocolite ulcerosa (RCU) non consente una diagnostica differenziale tra queste Capsula endoscopica ETC (ERM) due condizioni nel 4-10% dei casi nelle casistiche relative ad una popolazione adulta e sino al 30% nelle casistiche pediatriche. Tale condizione, M di Crohn precedentemente denomiconfermata nata colite indeterminata, è attualmente definita malattia infiammatoria intestinale non classificabile (IBDU), riservando il termine “colite indeterminata” a quella conTrattare dizione in cui l’anatomo-patologo non è in grado di dirimere tra MC e RCU sul Figura 3. Inserimento della capsula endoscopica nell’algoritmo diagnostico della sospetta malattia campione operatorio di proc20 di Crohn (proposta americana). tocolectomia. L’IBDU deve MC, malattia di Crohn; ETC, enterografia con tomografia computerizzata; ERM, enterografia essere distinta da almeno 3 con risonanza magnetica. condizioni che possono trarre in inganno il clinico e; precisamente: 1) l’interessamento dell’ileo terminale in corso di RCU con valQuesto studio, che ha tenuto in considerazione nel vola ileo-ciecale beante (la cosiddetta backwash modello le considerazioni precedentemente sottoliileitis); 2) il risparmio della mucosa rettale nella neate, ha mostrato che l’utilizzo della CEPI come RCU sottoposta a terapia topica; 3) l’interessaterzo test (dopo IC ed almeno una metodica radiomento isolato del cieco in corso di RCU (la cosidlogica inconcludente) aveva un rapporto costo/bedetta cecal patch). Dopo 8 anni di follow up, circa neficio eccessivamente alto, anche in condizioni di l’80% dei pazienti con IBDU sarà correttamente elevata probabilità pre-test di MC23; forse l’unica diagnosticato come MC o RCU. Con l’eccezione delpecca di questo studio è quella di aver adottato pala back-wash ileitis, la presenza di lesioni infiamrametri di sensibilità e specificità della CEPI dematorie mucosali nel piccolo intestino è prerogatisunti dal già citato studio di Solem19 che includeva va peculiare della MC e, pertanto, l’impiego della pazienti con MC sia nota sia sospetta in proporzioCEPI appare attraente nel processo diagnostico-difni non specificate, introducendo un bias di selezioferenziale, in particolare per le forme severe e poco ne. In conclusione, nella MC sospetta, l’utilizzo delresponsive alla terapia medica per le quali è consila CEPI dovrebbe essere cauto, in sintonia con derato un intervento di proctocolectomia restaural’enunciato OMED-ECCO11 che stabilisce: 1) l’IC e tiva con confezionamento di pouch ileale (IPAA), la ETC (o altra metodica d’immagine radiologica considerato attualmente il gold standard della chicross-sectional equivalente) dovrebbero sempre rurgia elettiva per la RCU refrattaria. precedere l’utilizzo della CEPI; 2) la CEPI come ter- C.M. Girelli: La capsula endoscopica nella malattia di Crohn Sospetta MC del piccolo intestino Ileocolonoscopia ± pasto baritato Sì MC confermata No Trattare renza significativa di pouchite o di nuove lesioni Crohn-like nei soggetti con una CEPI pre-operatoria positiva per lesioni infiammatorie digiuno-ileali al follow up mediano di un anno28. Pertanto si conclude, in accordo con lo statement OMED-ECCO11, che nei pazienti con IBDU la CEPI può esser utile nell’identificare pazienti con lesioni compatibili con MC, ma una CEPI negativa non esclude lo sviluppo futuro di MC. Rimane il sospetto di MC del piccolo intestino Dolore addominale sintomo dominante? La capsula endoscopica nella malattia di Crohn operata Circa l’80% dei pazienti con MC ileo-colica saranno operati di resezione intestiETC (ERM) ± Patency Capsula endoscopica nale per una complicanza o per fallimento della terapia No medica nel corso della storia della loro malattia e, di questi, il 20-30% avranno una Evidenza di stenosi recidiva clinica entro un anno dall’intervento chirurgico. Circa la metà dei soggetti che ha recidivato, nei successivi 10 anni subirà un secondo intervento resettivo. Considerare DAE e/o chirurgia L’ileocolonscopia è quindi raccomandata nel follow up post-operatorio in tutti i paFigura 4. Inserimento della capsula endoscopica nell’algoritmo diagnostico della sospetta malattia zienti con sospetto clinico di 21 di Crohn (proposta inglese) . recidiva. Tre studi hanno vaCriteri ICCE soddisfatti. lutato se la CEPI può comMC, malattia di Crohn; ETC, enterografia con tomografia computerizzata; ERM, enterografia con ripetere con l’IC, considerata il sonanza magnetica; DAE, enteroscopia assistita da device. gold standard per la valutazione post-operatoria. Nel primo studio, su 32 pazienti, la CEPI ha mostrato una sensibilità ed una specifiInfatti, il fallimento postoperatorio della pouch cità del 76% e 91% rispettivamente e nel 50% dei è stato stimato nel 3-5% dei pazienti correttamensoggetti è stato evidenziato un interessamento proste diagnosticati come RCU e nel 50-60% nei pasimale di malattia, ovviamente non indagabile dalzienti con pre-esistente MC. Sfortunatamente, solo l’IC29. Nel secondo studio, Biancone e collaboratori pochi studi hanno valutato il potenziale beneficio derivante dall’impiego diagnostico della CEPI in hanno mostrato una sensibilità ed una specificità del 93% e 67% rispettivamente e lesioni aggiuntive prosquesto contesto. Ad una casistica pediatrica di 7 pasimali sono state identificate nel 76% dei 22 soggetzienti in cui la CEPI ha correttamente diagnosticati studiati30. Infine, uno studio spagnolo ha mostrato 3 pazienti come MC24, si aggiungono 3 studi relativi agli adulti, tutti con meno di 31 pazienti, in to la recidiva in 15 pazienti su 24 mediante CEPI e cui la diagnosi di MC è stata definita dalla presensolo in 6/24 con IC con riscontro aggiuntivo di lesioza di almeno tre ulcere nel piccolo intestino. In queni prossimali nel 54%31; in quest’ultimo studio, non sti studi la presenza di reperti alla CEPI compatisorprendentemente, i pazienti hanno preferito sotbili con MC aveva una frequenza variabile tra il 16 toporsi alla CEPI piuttosto che alla IC. In conclusioe il 23%25-27. Tuttavia, uno studio retrospettivo più ne, questi studi hanno mostrato un’elevata sicurezza ed un’ accettabile accuratezza della CEPI nella recente, relativo a 68 soggetti sottoposti a CEPI privalutazione della recidiva post-operatoria della MC. ma di IPAA per IBDU, non ha mostrato una diffeSì No 243 244 Recenti Progressi in Medicina, 102 (6), giugno 2011 Le linee-guida OMED-ECCO per tale sottogruppo di pazienti suggerisce che: 1) la CEPI dovrebbe esser considerata solo in caso di fallimento o controindicazione della IC; 2) la CEPI identifica lesioni prossimali del tenue non identificabili dall’IC, ma il significato clinico di tale riscontro è al momento incerto11. Conclusioni Sebbene la CEPI abbia certamente rappresentato un importante passo avanti per il miglioramento della nostra comprensione della MC del piccolo intestino, il suo ruolo diagnostico nella pratica clinica quotidiana appare confinato a contesti clinici particolari e la sua efficacia diagnostica complessiva appare meno chiara rispetto alla sua indicazione principale: l’emorragia digestiva oscura. Nella MC già diagnosticata, sono pochi i pazienti che potrebbero giovarsi di quest’indagine diagnostica nella pratica clinica quotidiana. Al contrario, nella MC sospetta, definita in accordo coi criteri ICCE, l’elevata predittività negativa della CEPI potrebbe escludere una MC con buona probabilità, tenendo presente che l’aspecificità dei reperti endoscopici ne riduce la predittività positiva. Nella malattia intestinale infiammatoria non classificata il ruolo della CEPI è in larga parte sconosciuto e dovrà essere indagato con studi di non semplice effettuazione per la rarità della condizione e la necessità di un lungo follow up. Infine, nel sospetto di recidiva postoperatoria, la CEPI può avere un ruolo diagnostico nei pazienti che rifiutano la colonscopia o in cui la colonscopia è incompleta. Bibliografia 1. Trallori G, Palli D, Saieva C, et al. A populationbased study of inflammatory bowel disease in Florence over 15 years (1978-92). Scand J Gastroenterol 1996; 31: 892-99. 2. Farmer RG, Hawk WA, Turnbull RB Jr. Clinical patterns in Crohn’s disease: a statistical study of 615 cases. Gastroenterology 1975; 68: 627-35. 3. AGA Technical Review on Irritable Bowel Syndrome. Gastroenterology 2002; 123: 2108-31. 4. Burgmann T, Clara I, Graff L, et al. The Manitoba Inflammatory Bowel Disease Cohort Study: prolonged symptoms before diagnosis – how much is irritable bowel syndrome? Clin Gastroenterol Hepatol 2006; 4: 614-20. 5. Raju GS, Gerson L, Das A, Lewis B. American Gastroenterological Association (AGA) Institute medical position statement on obscure gastrointestinal bleeding. Gastroenterology 2007; 133: 1694-6. 6. Triester SL, Leighton JA, Leontiadis GI, et al. A meta-analysis of the yield of capsule endoscopy compared to other diagnostic modalities in patients with non-stricturing small bowel Crohn’s disease. Am J Gastroenterol 2006; 101: 954-64. 7. Dionisio PM, Gurudu SR, Leighton JA. Capsule endoscopy has a significantly higher diagnostic yield in patients with suspected and established smallbowel Crohn’ s disease: a meta-analysis. Am J Gastroenterol 2010; 105: 1240-8. 8. Petruzziello C, Onali S, Calabrese E, et al. Wireless capsule endoscopy and proximal small bowel lesions in Crohn’s disease. World J Gastroenterol 2010; 16: 3299-304. 9. Mehdizadeh S, Chen G, Barkodar L, et al. Capsule endoscopy in patients with Crohn’s disease: diagnostic yield and safety. Gastrointest Endosc 2010; 71: 121-7. 10. Cheifetz A, Kornbluth AA, Legnani P, et al. The risk of retention of the capsule endoscope in patients with known or suspected Crohn’s disease. Am J Gastroenterol 2006; 101: 2218-22. 11. Bourreille A, Ignjatovic A, Aabakken L, et al. Role of small-bowel endoscopy in the management of patients with inflammatory bowel disease: an international OMED-ECCO Consensus. Endoscopy 2009; 41: 618-37. 12. Tukey M, Pleskow D, Legnani P, et al. The utility of capsule endoscopy in patients with suspected Crohn ’s disease. Am J Gastroenterol 2009; 104: 2734-9. 13. Figueiredo P, Almeida N, Lopes S, et al. Small bowel capsule endoscopy in patients with suspected Crohn’s disease. Diagnostic value and complications. Diagn Ther Endosc 2010 doi: 10.1155/2010/101284. 14. Mergener K, Ponchon T, Gralnek I, et al. Literature review and recommendations for clinical application of small-bowel capsule endoscopy, based on a panel discussion by international experts. Consensus statements for small-bowel capsule endoscopy, 2006/2007. Endoscopy 2007; 39: 895-909. 15. May A, Manner H, Schneider M, Ipsen A, Ell C. Prospective multicenter trial of capsule endoscopy in patients with chronic abdominal pain, diarrhea and other signs and symptoms (CEDAP-Plus Study). Endoscopy 2007; 39: 606-12. 16. Gralnek IM, De Franchis R, Seidman E, et al. Development of a capsule endoscopy scoring index for small bowel mucosal inflammatory change. Aliment Pharmacol Ther 2008; 27: 146-54. 17. Gal E, Geller A, Fraser G, Levi Z, Niv Y. Assessment and validation of the new capsule endoscopy Crohn’s disease activity index (CECDAI). Dig Dis Sci 2008; 53: 1933-7. 18. Girelli CM, Porta P, Malacrida V, et al. Clinical outcome of patients examined by capsule endoscopy for suspected small bowel Crohn’s disease. Dig Liver Dis 2007; 39: 148-54. 19. Solem CA, Loftus EV Jr, Fletcher JG, et al. Smallbowel imaging in Crohn’s disease: a prospective, blinded, 4-way comparison trial. Gastrointest Endosc 2008; 68: 255-66. 20. Leighton JA, Legnani P, Seidman EG. Role of capsule endoscopy in inflammatory bowel disease: where we are and where we are going. Inflamm Bowel Dis 2007; 13: 331-7. 21. Sidhu R, Sanders DS, Morris AJ, McAlindon ME. Guidelines on small bowel enteroscopy and capsule endoscopy in adults. Gut 2008; 57: 125-36. 22. Leighton JA, Gralnek IM, Richner RE, et al. Capsule endoscopy in suspected small bowel Crohn’s disease: economic impact of disease diagnosis and treatment. World J Gastroenterol 2009; 15: 5685-92. 23. Levesque BG, Cipriano LE, Chang SL, et al. Cost effectiveness of alternative imaging strategies for the diagnosis of small-bowel Crohn’s disease. Clin Gastroenterol Hepatol 2010; 8: 261-7. 24. Cohen SA, Gralnek IM, Ephrath H, et al. Capsule endoscopy may reclassify pediatric inflammatory bowel disease: a historical analysis. J Pediatr Gastroenterol Nutr 2008; 47: 31-6. C.M. Girelli: La capsula endoscopica nella malattia di Crohn 25. Mow WS, Lo SK, Targan SR, Dubinsky MC, et al. Initial experience with wireless capsule enteroscopy in the diagnosis and management of inflammatory bowel disease. Clin Gastroenterol Hepatol 2004; 2: 31-40. 26. Maunoury V, Savoye G, Bourreille A, et al. Value of wireless capsule endoscopy in patients with indeterminate colitis (inflammatory bowel disease type unclassified). Inflamm Bowel Dis 2007; 13: 152-5. 27. Mehdizadeh S, Chen G, Enayati PJ, et al. Diagnostic yield of capsule endoscopy in ulcerative colitis and inflammatory bowel disease of unclassified type (IBDU). Endoscopy 2008; 40: 30-5. 28. Murrell Z, Vasiliauskas E, Melmed G, et al. Preoperative wireless capsule endoscopy does not predict Indirizzo per la corrispondenza: Dott. Carlo M. Girelli Ospedale di Circolo via Arnaldo da Brescia, 1 21052 Busto Arsizio (VA) E-mail: [email protected]; [email protected] outcome after ileal pouch-anal anastomosis. Dis Colon Rectum 2010; 53: 293-300. 29. Bourreille A, Jarry M, D’Halluin PN, et al. Wireless capsule endoscopy versus ileocolonoscopy for the diagnosis of postoperative recurrence of Crohn’s disease: a prospective study. Gut 2006; 55: 978-82. 30. Biancone L, Calabrese E, Petruzziello C, et al. Wireless capsule endoscopy and small intestine contrast ultrasonography in recurrence of Crohn’s disease. Inflamm Bowel Dis 2007; 13: 1256-65. 31. Pons Beltran V, Nos P, Bastida G, et al. Evaluation of postsurgical recurrence in Crohn’s disease: a new indication for capsule endoscopy? Gastrointest Endosc 2007; 66: 533-40. 245
Scaricare