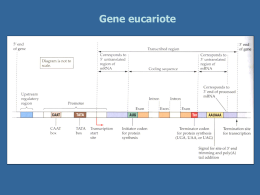
www.antoniosiccardi.net Antonio Siccardi 2004, Swimming Anita Swimming Anita (Siccardi, 2002) 50x70 cm; de-collage on alluminum 22-‐25 se'embre 2014 Biotecnologie Mediche: la Terapia Genica Antonio Siccardi Università degli Studi di Milano ① Individuazione del difetto genetico ② Studio della fisiopatologia, ovvero del funzionamento del gene normale e delle conseguenze delle sue alterazioni ③ Costruzione di modelli animali trattamenti farmacologici (efficaci, non risolutivi) terapia genica (risolutiva) G chr12 Gene normale A chr12 Gene mutante A chr12 Gene mutante chr12 Gene normale riparato Mutazione G->A G ricombinazione omologa G DNA selezione La ricombinazione omologa viene già utilizzata per ottenere animali geneticamente modificati (knock-out, knock-in, transgenici), in cui viene modificata una cellula staminale embrionale (ES) amplificabile e selezionabile in vitro prima di essere reimpiantata in utero in una blastocisti. La ricombinazione omologa non è stata per ora utilizzabile per la terapia genica dell uomo, in cui le cellule da modificare sono ragionevolmente solo cellule somatiche. Il motivo è che la ricombinazione omologa è un fenomeno molto raro, con passaggi in coltura di selezione e clonazione delle cellule geneticamente modificate, non attuabili nel setting clinico, in cui bisogna modificare geneticamente molte cellule bersaglio allo stesso tempo. Questo è ottenibile solo con vettori virali. Per la terapia genica nell’uomo, il gene “sano”, detto transgene, deve essere espresso nel numero maggiore possibile di cellule bersaglio e pertanto trasportato da un vettore molto efficente, quale un vettore retrovirale ψ LTR CMV transgene X LTR Plasmide di espressione Nel caso dei vettori retrovirali, i più usati, il transgene (con un opportuno promotore per la trascrizione) viene clonato in un plasmide che, di virale, contiene solo le regioni LTR (necessarie per la retrotrascrizione e per l integrazione nel DNA della cellula bersaglio) e la regione psi (necessaria per l incapsidamento nel virione). Tutte le altre funzioni virali, necessarie alla produzione di virioni, sono codificate da altri plasmidi nella cellula packaging. Questa precauzione evita la possibilità di ricostituire un virus infettivo. La cellula packaging viene trasfettata con 3 differenti plasmidi. CMV GAG POL PolyA 1.Plasmide di Packaging (geni virali) CMV VSV-G PolyA 2. Plasmide per l Envelope di VSV che si lega a un fosfolipide presente su tutte le memmbrane cellulari (geni virali) ψ LTR CMV transgene X LTR 3. Plasmide di espressione (nessun gene virale) e produce virioni vettori (pseudovirioni) completamente difettivi LTR ψ CMV transgene X LTR RNA nei virioni vettori I virioni vettori trasportano nelle cellule bersaglio il transgene e le proteine necessarie per la sua retrotrascrizione e integrazione nel DNA della cellula bersaglio. Non contengono alcun gene virale. vettore Infezione Integrazione cromosoma LTR ψ CMV Transgene X LTR Non si ottiene la sostituzione del gene mutante con quello sano, ma l aggiunta del gene sano a quello mutante, in molteplici copie che si integrano nel genoma casualmente, cioè in un contesto differente da quello originale. Il gene mutante è situato sul cromosoma 12. Dopo terapia genica con un vettore retrovirale, numerose copie del transgene saranno inserite in più cromosomi (diversi per ogni cellula transfettata). Applicabile solo a geni che non richiedano una regolazione fine: della quantità di proteina (e.g. non applicabile alle catene della emoglobina) della localizzazione cellulare o tissutale (e.g. non applicabile a fattori di trascrizione) Applicabile solo a geni di dimensioni compatibili con la capacità di trasporto del vettore (e.g. non applicabile al gene distrofina, che è gigantesco) Prima della terapia F VIII Tempo di Coagulazione 0% 17 Tempo di Sanguinamento 11 4 mesi post-terapia F VIII Tempo di Coagulazione 13% 4 40 Tempo di Sanguinamento 4 Strategie di terapia genica Approccio ex vivo vettore Approccio in vivo Reinfusione di cellule transfettate vettore - sistemico - in situ Prelievo di cellule Qui la ricerca di terapia genica si interfaccia con la ricerca sulle cellule staminali. L approccio di terapia genica ex-vivo ha maggiori probabilità di successo se le cellule prelevate e ingenierizzate in vitro sono cellule staminali, capaci di proliferazione allo stato indifferenziato e poi di differenziamento terminale. Dal midollo osseo adulto, si possono derivare molti tipi di cellule staminali, non solo quelle della linea ematopoietica. Proliferando in vitro allo stato indifferenziato, le cellule staminali di un soggetto con una malattia genetica possono essere modificate geneticamente, cioè transfettate con il gene sano. Photo courtesy of Van de Silva Ashanti de Silva SCID-ADA -1990 Ryes Evans X-SCID - 2001 Per la terapia genica ex vivo della ADA-SCID, il gruppo del TIGET-HSR di Milano (Bordignon, Aiuti et al.) è stato all avanguardia nel mondo. - Trasfezione di stem cell ematopoietiche (HSC) - Conditioning non-mieloablativo con Busulfan - Trapianto di HSC ADA+ selezionate - Nessun trattamento palliativo con PEG-ADA In 6 mesi, ricostituzione immune Cellule T >>>>>>>>>>>> 100% ADA+ Cellule mieloidi >>>>> 15% ADA+ Aiuti et al. Science 296:2410-2413, 2002 La dimostrazione che l integrazione è avvenuta nelle cellule staminali emopoietiche (HSC) consiste nel dimostrare che lo stesso evento di integrazione è presente in tutte le linee di cellule ematiche. Per fare questo bisogna preparare primers per la PCR specifici per un particolare evento di integrazione, e usarli per monitorare la presenza della stessa integrazione nelle cellule del sangue, a distanza di tempo. La stessa integrazione è stata dimostrata in cellule T, cellule B, granulociti, etc., indicando che un precursore comune era stato trasfettato e poi si è differenziato nei vari tipi cellulari Terapia genica 7 9 12 mesi Pt3 T cells Gran T cells Gran B cells Erythr Integrantspecific PCR Aiuti et al., 2002 Terapia genica ex vivo della X-SCID Alain Fischer, Hopital Necker, Parigi - 2000 - Trasfezione di stem cell ematopoietiche (HSC) - Trapianto di HSC γc+ selezionate - 10 pazienti In 6 mesi, ricostituzione immune Ricostituzione di cellule T, B e NK Guarigione clinica Terapia genica ex vivo della X-SCID Alain Fischer, Hopital Necker, Parigi - 2000 Due bambini su 10 hanno sviluppato una forma di leucemia di tipo T. In entrambi è stata ritrovata una integrazione nelle vicinanze dell oncogene LOM-2 (coinvolto nella regolazione della divisione cellulare). Entrambi i bambini sono guariti dopo chemioterapia. Questo evento (2000), insieme alla morte di Jesse Gelsinger (1999), un ragazzo di Philadelphia affetto da deficenza di ornitinatranscarbamilasi e trattato con un vettore adenovirale, hanno causato un blocco a livello mondiale della sperimentazione clinica della terapia genica per quasi 10 anni, in attesa che appropriate misure di sicurezza fossero individuate e attuate. L’analisi approfondita dei siti di inserzione degli LTR dei retrovirus (RV) e dei lentivirus (LV) nel genoma umano ha dimostrato profonde differenze: i secondi sono molto più sicuri e inducono attivazione di oncogeni con frequenza molto minore. Tale attivazione, dovura alla attività dell’enhancer e del promotore virali (situati in nella regione U3 dell’LTR-5’) può essere ulteriormente ridotta utilizzando vettori LV auto-inattivanti, che eliminano tali sequenze. Per la trascrizione del transgene si usa poi un promotore interno più debole e sequenze di terminazione che minimizzano l’overflow della trascrizione ai geni vicini. I ve'ori auto-‐ina6van7 (SIN) Negli LTR virali normali, la regione U3 contiene promotore ed enhancer. Durante la RT la regione U3 al 5’ viene copiata dalla regione U3 al 3’ (che era identica a quella al 5’ originale). Negli LTR del vettore SIN, la regione U3 al 5’ contiene promotore ed enhancer, mentre quella al 3’ è mutata e non contiene ne’ promotore ne’ enhancer. Durante la RT la regione U3 al 5’ viene copiata dalla regione U3 al 3’ (che è mutata). La copia integrata quindi non può più essere trascritta per intero. Solo il GOI viene trascritto da un promotore interno. LENTIVIRAL HEMATOPOIETIC STEM CELL GENE THERAPY IN PATIENTS WITH WISKOTT-‐ALDRICH SYNDROME AiuJ et al. Science 23 August 2013: Vol. 341 no. 6148 1233151 DOI:10.1126/science.1233151 LENTIVIRAL HEMATOPOIETIC STEM CELL GENE THERAPY BENEFITS METACHROMATIC LEUKODYSTROPHY Biffi et al. Science 23 August 2013: Vol. 341 no. 6148 1233158 DOI:10.1126/science.1233158 L espressione dei transgeni è limitata nel tempo, perchè subentra una risposta immunitaria transgenespecifica (CTL contro il prodotto del transgene, anche se è self ). Naldini e coll. (TIGET-HSR) hanno dimostrato che la risposta immunitaria è dovuta all espressione del transgene da parte delle antigen-presenting cells (APC, monociti-macrofagi e cellule dendritiche). Qui la ricerca sulla terapia genica si interfaccia con un altro campo della ricerca a sviluppo esplosivo, quello della funzione dei piccoli RNA nella regolazione della traduzione. He L, Hannon GJ. MicroRNAs: small RNAs with a big role in gene regulation. Nat Rev Genet. 5:522-31, 2004. He L, Hannon GJ. MicroRNAs: small RNAs with a big role in gene regulation. Nat Rev Genet. 5:522-31, 2004. I miRNA si legano alla estremità 3 -non tradotta (UTR) dei messaggeri e bloccano l attività del ribosoma con un meccanismo ancora non compreso. Molti miRNA diversi possono legare lo stesso messaggero. Lo stesso miRNA può legare molti (>50) messaggeri diversi. Un esempio eclatante: il miRNA let-7 blocca la traduzione del messaggero dell oncogene RAS facendo revertire il fenotipo tumorale Per evitare la risposta immune contro il transgene, bisogna bloccarne l’espressione nelle cellule che presentano l’antigene (APC), Naldini e coll. (TIGET-HSR, Milano) hanno introdotto nella estremità 3’ non tradotta del transgene la sequenzabersaglio di un miRNA che si esprime nelle APC (e non in altre cellule, quali gli epatociti). L RNA messaggero del transgene contiene quindi la sequenzabersaglio di un miRNA-APC e viene silenziato nelle APC e non negli epatociti. miRNA-APC AAAAAAA CAP AAAAAAA CAP RISC PROTEINA epatocita PROTEINA APC Questo permette al transgene di evadere la risposta immune e di essere espresso indefinitamente nelle cellule epatiche. Chilomicronemia (Iperlipoproteinemia tipo Ia) = carenza dell’enzima lipoproteina lipasi. Terapia: Glybera, l’unica terapia genica approvata dalla Commissione Europea e in vendita sul mercato. Decine di casi guariti. ADA-SCID (carenza di adenosina-deaminasi. Causa Immunodeficenza grave). Terapia ex-vivo su HSC con LV esprimenti ADA. Circa 20 casi guariti. X-SCID (difetto della catena γ di alcuni recettori per le interleuchine. Causa Immunodeficenza grave). Terapia ex-vivo su HSC con LV esprimenti catena γ. 10/10 casi guariti. 2 bambini sviluppano leucemia relata all’oncogene LOM-2. Sindrome di Wiskott-Aldrich (difetto di WASP, proteina regolatrice del citoscheletro. Causa Immunodeficenza grave). Terapia ex-vivo su HSC con LV esprimenti WASP. 3/3 casi guariti. Leucodistrofia metacromatica ( difetto di ARSA, aril-sulfatasi A; gli accumuli lisosomiali causano difetti motori e cognitivi). Terapia ex-vivo su HSC con LV esprimenti ARSA. 3/3 casi guariti. Coroideremia (altra malattia degenerativa della retina). Somministrazione intraoculare di vettori virali con il transgene REP1 (6/9 pazienti migliorano la capacità visiva). Adrenoleucodistrofia (la malattia dell’”Olio di Lorenzo”, dovuta a un difetto del gene X-ALD). Causa la distruzione progressiva della mielina, la sostanza che riveste le cellule nervose, e delle ghiandole surrenali con la conseguente carenza di alcuni ormoni. Terapia ex-vivo su HSC con LV esprimenti ALD. Emofilia B (fattore IX). Somministrazione intraepatica (la maggior parte dei pazienti presenta sanguinamenti più rari e contenibili). CGD. Malattia Granulomatosa Cronica. La terapia genica ex-vivo di HSC seguita da trapianto è efficace solo se le cellule esprimenti il transgene hanno un vantaggio selettivo (ADA-SCID, X-SCID) ma questo non è il caso del CGD (carenza di NADPH ossidasi nei granulociti) che ha dato risultati inizialmente positivi, ma solo transitori. Parkinson. Cellule incapaci di produrre dopamina riacquistano tale capacità dopo infezione con RV che producono 3 enzimi (tutti pazienti di un piccolo gruppo riacquisiscono controllo muscolare). Leucemia. Terapia ex-vivo di linfociti che vengono resi specifici per un antigene tumore-associato (26/59 in completa remissione). AIDS. CD4 autologhe infettate con VRX496 (codificante un RNA antisenso anti-env). 5/5 pazienti mostrano ridotte cariche virali e miglior risposte immuni anti HIV. Bibliografia essenziale: http://en.wikipedia.org/wiki/Gene_therapy Ritorniamo al G chr12 Gene normale A chr12 Gene mutante A chr12 Gene mutante chr12 Gene normale riparato Mutazione G->A G ricombinazione omologa G Nucleasi Cas9 Nucleasi Cas9 RNA guida N C C cromosoma L’ RNA guida contiene al 5’ 20 basi omologhe al DNA bersaglio. La Nucleasi Cas9 viene posizionata sulla sequenza bersaglio dall’RNA guida e introduce un taglio a doppia elica a monte della sequenza PAM (= NGG) Nucleasi Cas9 Nucleasi Cas9 RNA guida N C C Sequenza variabile gene bersaglio-specifica sintetizzata ad hoc Sequenza costante gRNA Scaffold cromosoma L’ RNA guida contiene al 5’ 20 basi omologhe al DNA bersaglio. a Nucleasi Cas9 viene posizionata sulla sequenza bersaglio dall’RNA guida introduce un taglio a doppia elica a monte della sequenza PAM (= NGG) Gene della Nucleasi Cas9 PAM = sequenza adiacente al sito di taglio gRNA = RNA guida DSB = Rotture a doppia elica NHEJ = riunione non omologa di estremità (causa delezioni) HR = Ricombinazione Omologa (ricostituzione del genotipo wt, oppure inserzione controllata di sequenze desiderate) PAM = sequenza adiacente al sito di taglio gRNA = RNA guida DSB = Rotture a doppia elica NHEJ = Riunione non omologa di estremità (causa delezioni e inattivazione del gene) PAM = sequenza adiacente al sito di taglio gRNA = RNA guida (sequenza wt) HR = Ricombinazione Omologa >> ricostituzione del genotipo wt In alternativa, si possono costruire altri genotipi mutanti, oppure inserire sequenze marker (e.g. di geni di resistenza o di proteine fluorescenti ) Riparazione in situ del gene mutante A chr12 Gene mutante chr12 Gene normale riparato G ricombinazione omologa G La tecnologia CRISP-R / Cas9 permette di affrontare la terapia genica di tutte quelle malattie per le quali era impensabile utilizzate i vettori virali, che aggiungono il gene sano senza riparare quello mutato e che non consentono la fisiologica regolazione della attività del gene, attuabile solo nel contesto genomico naturale Malattie per le quali è impensabile utilizzare vettori virali Che cosa manca alla applicazione clinica della nuova tecnologia? Le localizzazioni dell’RNA guida (e quindi della Nucleasi Cas9) non sono ancora totalmente controllabili: seppur raramente, avvengono appaiamenti e tagli a doppia elica anche in altre regioni del DNA, anche non completamente omologhe. La tecnologia deve essere raffinata, per ridurre le localizzazioni aspecifiche o renderle innocue facendo suicidare le cellule in cui queste avvengano. www.antoniosiccardi.net Antonio Siccardi, 2009 Dance for all (Berlin)
Scarica