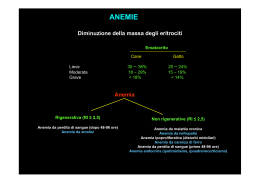
Le Leanemie anemie da damalattia malattia cronica cronicanell’anziano: nell’anziano: fisiopatologia fisiopatologiaeeclinica clinica The Definition of Anemia in Older Persons Male: Male: Hb Hb<< 13 13gr/dl; gr/dl;Female: Female: Hb Hb<< 12 12gr/dl gr/dl At these Hb levels the mortality risk was increased 2-folds Izaks JAMA1999; 281, 1714-1718 Figure 3. Percentage of persons 65 years and older with ACI and UA according to number of conditions present Guralnik, J. M. et al. Blood 2004;104:2263-2268 Copyright ©2004 American Society of Hematology. Copyright restrictions may apply. Prevalenza dei tipi di anemia Hillman and Finch, 1974 Common causes of anemia in the elderly Cause of anemia Percentage of cases Anemia of chronic disease 30-45 Iron deficiency 15-30 Posthemorragic 5-10 Vit. B12, folate deficiency 5-10 Chronic leukemia or lymphoma 5 Myelodisplastic syndrome 5 No identifiable cause 15-25 Data from Joosten E, Pelemans W, Hiele M, Noyen J, Verghaeghe R, Boogaerts MA. Prevalence and causes of anaemia in a geriatric hospitalized population. Gerontol 1992;38:111-7. Anemie ipoproliferative Caratterizzate da bassi valori di reticolociti (< 1.5%) o meglio, retic. assoluti < 100.000/mm3 (retic. % x RBC/mm3) •Causa più frequente di anemia nell’adulto e nell’anziano (> 75%) •Da sanguinamento cronico •Da infiammazione/malattia cronica •Nutrizionali Anemie da emorragia • La causa tra le più frequenti di anemia nell’anziano (secondo taluni la più frequente fino al 50% dei casi) • 1 ml di sangue contiene 0.5 mg. di Fe • Morfologia: ipocromiche microcitiche • Laboratorio: sideremia, ferritina ↓; transferrina ↑ • Nell’uomo anziano i depositi di Fe sono in media 1200 mg., nella donna dalla menopausa in poi passano da 300 a 800 • 3-4 ml/die sono sufficienti e non sono rilevati dal paz. • Cause più frequenti: - farmaci - neoplasie - diverticolosi - angiodisplasie Anemie da carenza di B12 e/o folati • • • • • • • Per quanto riguarda i folati, la causa più frequente è la carenza nella dieta; per quanto riguarda la B12 invece le 3 cause più frequenti sono la gastrite atrofica,la gastrectomia e la sindrome da malassorbimento. I depositi di folati nell’organismo assicurano un’autonomia massima di 6 mesi. 25% dei pazienti con carenza di folati non sono macrocititci I livelli di folati sierici non sono utili nella diagnosi di carenza di folati; meglio la determinazione della folatemia eritrocitaria Valori elevati di omocistina sierica si riscontrano nel 90% ei pazienti carenti di folati. coesiste carenza di B12 anche in presenza di incremento di metilmalonato Terapia per carenza di Folati: aaf. Folinico 1 mg/die. ACD: rilevanza del problema • La 2a causa di anemia dopo la sideropenica • Responsabile del 52% delle anemie in pazienti che si sono presentati ad un pronto soccorso di ospedale pubblico nel biennio 1985-1986 • Presente nel 27% dei pazienti seguiti in Day Hospital per artrite reumatoide • Presente nel 58% dei pazienti ricoverati presso unità ospedaliere di reumatologia Cash JM., Am. J. Med 1990 Incidenza di anemia in 573 p. consecutivi ammessi al Salt Lake City Veterans Hospital. 90 80 70 60 50 Non Anemici Anemici 40 30 20 10 0 20-45 46-64 65-74 > 75 Baraldi-Junkins, Haematol Oncol Clin. North Am. 2000 Cause di anemia in pz. > 65 aa. ospedalizzati • • • • • • • • • Cause multiple: Nessuna causa ACD Malnutrizione Infezione Emorragia intraoperatoria Altre cause emorragiche Carenza marziale Ipogonadismo 53% 17% 10% 9% 4% 3% 1% 1% 1% Baraldi-Junkins, Haematol Oncol Clin. North Am. 2000 Anemia da malattia cronica (ACD) CONDIZIONI ASSOCIATE: • • • • • • Infezioni croniche Infiammazioni croniche non infettive/collagenoptie Politraumi gravi Ustioni estese Malattie neoplastiche Varie – Epatopatia alcoolica – Insuff. cardiaca congestizia – Trombloflebite /DVT – Malattia coronarica cronica 75% 20% ACD: categorie etiologiche -1 Anemia iporigenerativa associata a infiammazione da: Infezione batterica Reazione immune Necrosi tessutale Neoplasia ACD: categorie etiologiche -2 Anemia iporigenerativa causata dalle citochine “infiammatorie” TNF-α α IL-1, IL-2, IL-6 IFN-γγ prodotte da popolazione CD 68+ (macrofagi), CD 4+ (linfociti TH) e CD8+ (CTL) IRON metabolism in man FUNCTIONAL COMPOUNDS •Haemoglobin •myoglobin Stores 1000 mg. •haem enzymes Absorption 1mg/day Tissue 500 mg. •non-haem enzymes 2300 mg. 320 mg. 80 mg. 100 mg. STORAGE COMPLEXES Excretion 1 mg/day Red cells 2300 mg. •ferritin 700 mg. •haemosiderin 300 mg. Total 3800 mg. Cook and Finch, 1979 Fe fegato intestino plasma Fe-TF Fe-TF EPO Fe-TF Fe-TF Ferritina G.R. SRE midollo M1.7 Absorption of dietary iron Duodenum Non-haem Haem Fe Fe DMT1 HCP1 Enterocyte brush border Luminal or apical side Fe Hephaestin Basolateral side Ferroportin Plasma Transferrin Fe3+ Fe3+ Transferrin Fe3+ Fe2+ Non-haem Hephaestin Transfer and haem appears ofiron iron toare work from taken with enterocyte into ferroportin the to enterocytes plasma to oxidize is initially through the iron by ferroportin for different loading pathways. onto transferrin in the These pathways then appear to plasma merge within the cell M1.9 Absorption of iron is linked to body iron needs by hepcidin sourcef of IO and chelation Body iron IN 1–2 mg 1–2 mg FPN OUT Fe Adjustment of total body iron to needs is via subtle regulation of absorption FPN Hepcidin Hepcidin also regulates release of iron from: • Liver stores • Macrophages involved in recycling of iron for hemoglobin M1.6 Regulation of cellular iron release Fleming RE et al. N Engl J Med 2005;352:1741–1744 Hepcidin: a key iron regulator in humans Hepatocyte Tfr2 Fe Hepcidin Enterocyte Macrophage Fe Fleming and Sly, PNAS 2001; 28: 8160-8162 M1.14 Normal distribution and turnover of body iron Erythron 2g 20–30 mg/day Parenchyma 0.3 g Liver 1 g 20–30 mg/day 2–3 mg/day Transferrin 1–2 mg/day 20–30 mg/day Reticuloendothelial macrophages 0.6 g Gut Iron balance is achieved in the normal state Hershko C et al. Ann NY Acad Sci 1998;850:191–201, permission pending M2.2 Imbalance of distribution and turnover of body iron with transfusion therapy Erythron 20–40 mg/day NTBI Parenchyma Transfusions Transferrin Reticuloendothelial macrophages Gut Iron balance is disturbed by blood transfusion because the body cannot remove the excess iron Hershko C et al. Ann NY Acad Sci 1998;850:191–201, permission pending NTBI=non-transferrin-bound iron NTBI: non-transferrin-bound Iron A volte descritto come: •DCI (Direct chelatable Iron •LPI (labile plasma iron) •Ferro con capacità ossidante, circolante nel plasma in condizioni di sovraccarico marziale, non legato alla transferrina, e responsabile del danno diretto ossidativo del Fe ai tessuti •Compare in circolo con valori di Fe> 400 mmol/gr. dry weight di LIC, valori di ferritina sierica > 2500 ng/ml, e saturazione TF > 75%. Pensi-Pootrakul: Blood 2004; 104, 1504-1510 Quale patogenesi Anaemia of chronic disorders Pathogenesis: • impaired iron release from SRE • reduced supply of EPO to marrow cells • defect of BM erythroid precursors Weiss G. Hematology 2000 1 Ridotto rilascio di Fe dal SRE (“blocco Reticolo-Endoteliale”) Fe fegato intestino plasma Fe-TF Fe-TF EPO 2 Fe-TF 1 Fe-TF 3 Ferritina SRE G.R. midollo “Blocco RE”: patogenesi Aumentata sintesi di Epcidina • Aumentata nella ACD • Diminuita nella ipossia e nella anemia • Assente in molte forme di emocromatosi Rivera S.: Blood 105; 1797, 2005 Epcidina: meccanismo di azione Fleming, Robert E. and Sly, William S. (2001) Proc. Natl. Acad. Sci. USA 98, 8160-8162 Copyright ©2001 by the National Academy of Sciences Pathophysiological Mechanisms Underlying Anemia of Chronic Disease Weiss G and Goodnough L. N Engl J Med 2005;352:1011-1023 Nemeth E J. Clin. Invest.2004; 113, 1271-1276 2 Ridotta disponibilità di EPO EPO: meccanismo d’azione • • • • Favorisce l’entrata di BFU-E in ciclo previene l’entrata in apoptosi di CFU-E aumenta la sintesi di m-RNA per catene globiniche aumenta l’espressione di TFR sulla superficie della cellula M.T. Bertero Haematologica 1977 FAS TNF-α, IFN-γ + FAS-L De Maria Blood 1999; 93: 796-803 EPO The erythroblastic island FAS TNF-α, IFN-γ + CD 68 FAS-L De Maria R.: Blood 93: 796, 1999 EPO Riduzione tasso ed efficacia di EPO • I valori di EPO sono inappropriati ai livelli di anemia • Elevati livelli di TNF-α e IFN-γ riducono la produzione di EPO da parte del rene • Elevati livelli di TNF-α e IFN-γ riducono la proliferazione di CFU-E indotta da EPO • TNF-α e IFN-γ prodotte da CD4+ linfociti infiltranti il rene causano un danno diretto alla area peritubulare renale e riducono la produzione di mRNA per EPO M.T. Bertero Haematologica 1977 Valori di EPO in ACD e sideropenia Erslev, Eur. J. Haematol 2000 3 Difetto dei progenitori eritroidi (Incremento dell’apoptosi) TNF-α e apoptosi T linfociti autologhi attivati e formazione di CFU-E Means J., Cell Physiol. 1992 Anemia e MDS FAS-L FAS FAS-L CD 68 TNF De Maria R.: Blood 93: 796, 1999 IFN-γ effects on BFU-E and CFU-E 140 120 100 80 60 40 20 0 0 30 39 138 45 51 90 61 0 50 100 50 500 33 1000 IFN-gamma (U/mL) Normal colonies Apoptotic colonies Dai C.H.: Blood 91:1235, 1998 Effects of Fas-Ig on LTC-IC in normals and MDS patients 700 600 500 400 No treatment Fas-Ig 300 200 100 0 MDS Normal Gersuk G.: Br. J. Haematol 103; 176, 1998 CTL CD 34 TNF+ IFNγγ F FL F FL IL 2 IFNγγ CD 4+ TNF+ IFNγγ IL 1 ATTIVAZ. CD 68+ CD 33 F FL BFU-E F FL F FL FL F A P O P T O S I EMATOLOGIA-CN ACD: diagnosi Quando studiarla ? Proposte: • Nei casi lievi (Hb> 11, < 12 gr/dl): - con indici ipocromici microcitici • Nei casi più gravi (Hb < 11 gr/dl): - con indici normocromici normocitici • Negli altri casi: - sorveglianza ACD: laboratorio Laboratorio: morfologia normocromica normocitica/microcitica sideremia → o ↓ ferritina ↑ o →, PCR, VES, α 2 ↑ può associarsi ad anemia sideropenica In caso di IRC: inadeguata produzione di EPO In caso di neoplasia: ↑ γ-IFN, TNF- α, IL-1, ↓ EPO Saturazione transferrina Cook and Finch, 1979 Ferritina sierica (ng/(ml) Ferritina sierica Probabile diagnosi _______________________________________________ < 20 Carenza marziale 20-50 Carenza marziale + ACD >50 ACD Sears D. Med. Clin. North. Am. 1992 Coesistenza di ACD e sideropenia Quali test Metabolismo Fe: metodi di studio Ferritina sierica: espressione diretta del ferro di deposito 1 ng/ml = 8 mg Fe deposito Recettore solubile TF nel siero: espressione inversa della disponibilità di ferro ai tessuti Rapporto TF receptor/ferritina •48 pz. con anemia sideropenica (IDA) •68 paz. con ACD (ACD) •17 paz con IDA + ACD (COMBI) Punnonen K., Blood 89: 1052, 1997 1 - Ferritina sierica Punnonen K., Blood 89: 1052, 1997 2 - Recettore TF Punnonen K., Blood 89: 1052, 1997 3 - Rapporto TFR/ferritina Punnonen K., Blood 89: 1052, 1997 Serum Levels That Differentiate Anemia of Chronic Disease from Iron-Deficiency Anemia Weiss G and Goodnough L. N Engl J Med 2005;352:1011-1023 Algorithm for the Differential Diagnosis among Iron-Deficiency Anemia, Anemia of Chronic Disease, and Anemia of Chronic Disease with Iron Deficiency Weiss G and Goodnough L. N Engl J Med 2005;352:1011-1023 ACD: quale terapia ? Therapeutic Options for the Treatment of Patients with Anemia of Chronic Disease Weiss G and Goodnough L. N Engl J Med 2005;352:1011-1023 M1.15 Transfusion therapy results in iron overload 200–250 mg iron: Whole blood: 0.47 mg iron/mL ‘Pure’ red cells: 1.16 mg iron/mL Porter JB. Br J Haematol 2001;115:239–252 • • Transfusion 1 blood unit contains 200 mg iron • ~20 g iron transfused with 100 blood units – Normal body iron: 3-4 g • • In MDS ~90% of patients with MDS become transfusion dependent • Overload can occur after 10–20 transfusions Iron overload is an inevitable consequence of multiple blood transfusions 1- Terapia trasfusionale Vantaggi: Svantaggi: •Efficacia immediata •Reazioni trasfusionali •Efficace in pz. refrattari a EPO •Sovraccarico marziale •Meno costosa di terapia con EPO •Problemi logistici (Day Hospital) •Disponibilità limitata •Minore impatto sulla qualità di vita 2- Terapia con EPO Vantaggi: Svantaggi: •Trattamento fisiologico •Efficace solo in 2/3 dei pazienti •Netto miglioramento della qualità di vita •Efficace solo dopo 4 settimane •Terapia domiciliare possibile •Terapia costosa •Ottima tolleranza 2- Terapia con EPO Linee guida • • • • • • • Iniziare con dosaggi superiori a quelli da uremia: 10.000 UI 3v/wk s.c. Prima valutazione dopo 4 settimane: se incremento di Hb > 0.5 gr/dl proseguire a dose invariata se incremento di Hb < 0.5 gr/dl proseguire con 20.000 UI 3v/wk s.c. Seconda valutazione dopo 8 settimane: se incremento di Hb > 0.5 gr/dl proseguire con 20.000 UI 3v/wk se incremento di Hb < o.5 gr./dl -> OFF THERAPY Erslev AJ. Eur. J. Haematol 2000 Linee guida proposte (dopo 15 gg. di Tx) Ludwig H., Blood 1994 3 – Terapie sperimentali? •Infliximab •Inibitori della epcidina •Chelanti Fe (L1deferiprone, deferasirox)
Scaricare