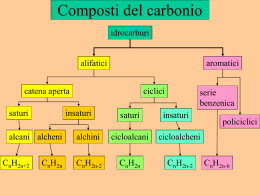
Proprietà generali • Formula molecolare CnH2n+2 • Numero di C possibili da 1 a 100 circa • Formula di struttura: lineare, ramificata • Stato fisico a condizioni normali (20° e 1atm) gas: da 1 a 4 C totali (metano, etano, propano, butano) liquido: da 5 a 17 C solidi: da 18 C in poi Sono poco reattivi (paraffine, da parum affinis=poco affini alla maggior parte delle sostanze acide, basiche e ossidanti), ma facilmente ossidabili (combustione) con sviluppo di notevole quantità di calore. • Sono apolari Fonti • Naturali: i primi (particolarmente il metano) è prodotto diretto di decomposizione batteria (biogas) • Fossili petrolio e gas naturale (i primi 4, maggiormente metano) • Sintesi da alcheni, alchini (reazione di idrogenazione), idrocarburi alogenati, monossido di carbonio+idrogeno, da aldeidi e chetoni, da acidi carbossilici (decarbossilazione) Usi • Data la loro facilità a «infiammarsi» (soprattutto i più leggeri) sono usati principalmente come combustibili e carburanti (benzine, GPL, gasolio), • Allo stato liquido sono utilizzati anche come carburanti solventi neutri e lubrificanti • Allo stato solido sono usati come combustibili (cere) e (sotto forma di bitumi, catrame) come materiale collante (es. per asfalto) e impermeabile (es. per tetti o altri rivestimenti). • Con trattamenti opportuni sono utilizzati per sintetizzare altri composti : Es. attraverso il reforming (ristrutturazione) da alcani lineari si possono ottenere cicloalcani, paraffine ramificate ecc. In reazione con alcheni (alchilazione) si ottengono miscele ottime come carburati di aerei (benzine avio). In reazione con il cloro, fluoro, bromo e Iodio danno gli alogenoderivati (es. CFC) Proprietà generali • Formula molecolare CnH2n • Numero di C possibili da 3 a 100 • Formula di struttura: ciclica • Stato fisico a condizioni normali (20° e 1atm) liquido: da 3 a 20 C (dal ciclopropano al cicloicosano) solidi: da 21 C in poi (dall’icosakaihenano all’ettano) • Ad eccezione dei primi due (esplosivi), hanno gli stessi comportamenti degli alcani (solo generalmente più reattivi, data la «tensione» dovuta alla struttura chiusa). • Sono apolari Fonti • Fossili petrolio • Sintesi da alcheni + carbene CH2N2 (un composto molto reattivo). Per idrogenazione del benzene si ottiene il cicloesano. Si possono ottenere anche facendo reagire i dicloroalcani a catena aperta con un metallo (es. zinco). Usi • In generale sono gli stessi degli alcani (combustibili, carburanti, solventi). Ciclopropano e ciclobutano vengono usati negli esplosivi. • Vengono usati per produrre altri composti (alogenuri, alcani a catena aperta eccc.) Proprietà generali • Formula molecolare CnH2n • Numero di C possibili da 2 a 100 circa • Formula di struttura: lineare, ramificata • Stato fisico a condizioni normali (20° e 1atm) come i corrispondenti alcani, in particolare, i composti con meno di cinque atomi di carbonio sono gas incolori e quelli con più di cinque sono, salvo rare eccezioni, liquidi incolori. Con più di 15 sono solidi • Sono più reattivi dei corrispondenti alcani per via del doppio legame (più debole) • Hanno di solito un forte odore, qualche volta sgradevole • Sono apolari Produzione • Naturali Etilene, isoprene (2-metil-1,3-butadiene), i suoi derivati caroteni, terpeni (olii essenziali) e altri si ritrovano nelle piante, ma costituiscono solo un quantitativo trascurabile (tracce) • Fossili fino a cinque atomi di carbonio si ottengono puri dall’industria petrolifera (cracking termico degli idrocarburi) • Sintesi Sono molti i metodi di preparazione, ma più diffusi sono due: la deidroalogenazione degli alogenuri alchilici e la disidratazione degli alcoli. Usi • Possono essere gli stessi degli alcani (combustibili, carburanti, solventi, produzione di alogenuri ecc.). • L’uso principale è, comunque, quello della produzione di plastiche (PE, PET, PVC) della gomma (isoprene: 2-metil-1,3-butadiene), come basi per la produzione di composti profumati e coloranti. • Possono essere usati per produrre alcani (deidrogenazione) PE Polietilene: polimeri di etilene PET Polietilenteraftalato: polimeri di etilene con aggiunta di acido teraftalico PVC Polivinilcloruro: polimeri di cloroetilene (o clorovinile) N.B. L’etilene senza un idrogeno (radicale) si chiama etenile oppure vinile PE PET PVC Proprietà generali • Formula molecolare CnH2n-2 • Numero di C possibili da 3 a 100 • Formula di struttura: ciclica • Stato fisico a condizioni normali (20° e 1atm) come i corrispondenti alcheni a catena aperta. • Sono più reattivi dei corrispondenti a catena aperta per via delle tensioni anulari • Sono apolari Fonti e usi vedi alcheni Il più importante è il benzene (1,3,5,cicloesatriene) È usato come solvente, come antidetonante e come base per diversi prodotti: medicine, materie plastiche, caucciù sintetico, alcuni coloranti, napalm. I suoi derivati vengono classificati come «composti aromatici» dato che la sua presenza si riscontra nella maggior parte delle sostanze naturali e non aromatiche e profumate Proprietà generali • Formula molecolare CnH2n-2 • Numero di C possibili da 2 a 100 circa • Formula di struttura: lineare, ramificata • Stato fisico a condizioni normali (20° e 1atm) come i corrispondenti alcani • Sono altamente infiammabili con sviluppo di maggior calore rispetto ad alcani e alchini • Sono apolari Produzione • Fossili scarsi nel petrolio • Sintesi L’alchino di maggiore importanza industriale è l’acetilene, che viene preparato per azione dell’acqua sul carburo di calcio (CaC2) • Gli alchini superiori si ottengono dall’acetilene per reazione del suo sale metallico (acetiluro) con un alogenuro alchilico Usi A parte l’acetilene usato per tagli e saldature, vengono utilizzati come basi per vari prodotti industriali (stessi come per gli altri idrocarburi)
Scarica