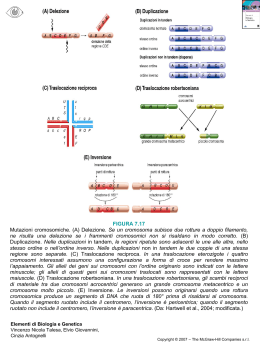
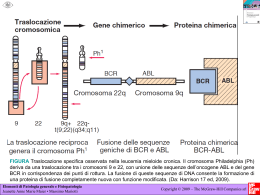
FACOLTA’ MEDICINA E ODONTOIATRIA Laurea triennale in Tecniche di Laboratorio Biomedico Traslocazioni cromosomiche e infertilità di coppia Relatore Liana Marcucci Laureanda Antonella Di Stefano Matricola 1212077 Anno Accademico 2010/2011 Antonella Di Stefano 0 INDICE 1 INTRODUZIONE …………………………...……………………………….. 2 1.1 Traslocazioni cromosomiche ………...…………………………… 2 1.1.1 Meccanismi di origine ………...…………………………….... 2 1.1.2 Classificazione delle traslocazioni ….…………………....... 4 2 PARTE SPERIMENTALE ..………………………………………………. 10 2.1 Materiali e metodi ………………………………………………. 10 2.1.1 Studi citogenetici …..……………………………...… 10 2.1.2 Analisi FISH ………………………...………………… 13 2.1.3 Analisi PCR …………………......…………………..... 14 2.1.4 Analisi di alberi genealogici familiari ...………….. 15 3 RISULTATI ……………………………………………………………….… 36 4 CONCLUSIONI …………………………………………………………….. 39 5 BIBLIOGRAFIA ……………………………………………………………. 44 Antonella Di Stefano 1 1 INTRODUZIONE 1.1 Traslocazioni cromosomiche Le traslocazioni cromosomiche sono tra le più comuni anomalie genetiche. Queste alterazioni si riscontrano a seguito dell’analisi del cariotipo e da ricerche statistiche si è visto che sono presenti nello 0,2% dei neonati, nello 0,6% delle coppie infertili e fino al 9,2% nei pazienti con aborti ricorrenti. I portatori di traslocazioni bilanciate hanno un rischio maggiore di concepire embrioni con anomalie cromosomiche (Pappalardo, 2010). 1.1.1 Meccanismi di origine Le traslocazioni sono riarrangiamenti cromosomici che si originano da eventi di rottura a doppio filamento del DNA cromosomico. Eventi di rottura insorgono fisiologicamente durante la duplicazione del DNA ad opera delle Topoisomerasi. Le DNA topoisomerasi sono enzimi di importanza cruciale per il mantenimento dell’integrità genomica e per la regolazione delle strutture topologiche del DNA. Tutte le DNA topoisomerasi presentano due caratteristiche fondamentali: la prima è la capacità di rompere e, poi, risaldare lo scheletro fosfodiesterico del DNA in due successive reazioni di transesterificazione; la seconda caratteristica delle DNA topoisomerasi è che, una volta formatosi l’intermedio DNA–proteina, l’enzima permette alle estremità dei filamenti spezzati di essere separate, aprendo così un Antonella Di Stefano 2 passaggio per un altro segmento di DNA a doppio o a singolo filamento. Questo passaggio di un segmento di DNA attraverso la rottura di un altro segmento provoca un cambiamento topologico del DNA, come ad esempio una variazione del numero di legame, oppure la decatenazione di due anelli di DNA catenati. Dalla scoperta della prima DNA topoisomerasi I in E. coli nel 1971 questi enzimi sono stati trovati in tutte le cellule eucariote e procariote. Sulla base della capacità di tagliare un singolo o un doppio filamento di DNA, questi enzimi sono classificati, rispettivamente, in DNA topoisomerasi di tipo I e II (Baker et al., 2009). Un secondo evento fisiologico che determina rottura del DNA, si verifica nella gametogenesi durante la profase I meiotica, mediante il processo di crossing-over, un importante meccanismo di ricombinazione del materiale genetico che permette una maggiore varietà nei prodotti della riproduzione sessuata (Klug et al., 2007). Durante il crossing-over non si ha né perdita né acquisizione di materiale genetico, perché esso determina scambi reciproci. Inoltre, le caratteristiche chimico-fisiche del DNA rendono questa molecola stabile e dinamica e suscettibile di diversi tipi di risposta a insulti ambientali. La sequenza nucleotidica può, infatti, modificarsi per gli errori prodotti spontaneamente dalla DNA-polimerasi, per la rottura spontanea di regioni cromosomiche fragili o per l’effetto di agenti chimici e fisici genotossici. Fisiologicamente, le cellule hanno sviluppato differenti meccanismi di riparazione del DNA che garantiscono una relativa stabilità Antonella Di Stefano 3 del genoma attraverso l’intervento di “guardiani del genoma” come la proteina ATM. Alcuni meccanismi di riparazione riparano correttamente (error free) e non lasciano tracce della mutazione indotta. Tuttavia se il danno è consistente e prolungato, intervengono meccanismi meno accurati di riparazione che sono invece “error prone”, inclini quindi all’errore, come ad esempio i Sister Chromatid Exchange (SCE), visualizzazione citogenetica di crossing-over somatici. 1.1.2 Classificazione delle traslocazioni Le traslocazioni possono essere classificate in: 1. traslocazioni germinali; 2. traslocazioni somatiche. Traslocazioni germinali Sono traslocazioni ereditarie presenti a livello degli ovociti e degli spermatozoi; Sono causa di un aumentato rischio riproduttivo, sia per abortività ricorrente, sia per la possibilità di avere figli nati vivi con uno sbilanciamento cromosomico e quindi con una sindrome cromosomica. Se ne possono distinguere diversi tipi. - Traslocazione reciproca bilanciata: l’incidenza di queste traslocazioni è di 1 su 625 nati (Traversa et al., 2010) e sono dovute ad uno scambio di regioni tra cromosomi non omologhi. Queste fanno seguito ad una rottura singola di due cromosomi e possono comportare variazioni nella lunghezza dei cromosomi che restano, però, sempre monocentrici. Solo di rado nella traslocazione possono essere coinvolti anche più cromosomi Antonella Di Stefano 4 (traslocazioni complesse o “jumping translocations”). Le traslocazioni reciproche, quando bilanciate e familiari, non comportano anomalie del fenotipo (Ventruto et al, 2001). Per definizione, una traslocazione reciproca bilanciata conserva integra la quantità di materiale cromosomico normale. I punti di rottura che si trovano nella cromatina non informativa sviluppo consentono embrionale. lo Se, invece, il punto di rottura colpisce geni normalmente espressi, la cui informazione è essenziale per le varie fasi dello sviluppo, potrebbe essere l’embrione eliminato con aborto spontaneo. Per quanto riguarda i portatori maschili di una traslocazione bilanciata, la possibilità di generare spermatozoi con anomalie cromosomiche varia dal 20 all’80%, secondo il tipo di traslocazione, i cromosomi coinvolti e la posizione dei punti di rottura. - Traslocazioni reciproche bilanciate “de novo”: insorgono nella gametogenesi di uno dei due genitori, che risultano quindi avere cariotipo normale. Le cause che portano allo sviluppo di una mutazione de novo possono essere diverse, ma comuni sono quelle indotte da mutageni fisici quali le radiazioni. Il rischio di anomalie nel fenotipo è più elevato rispetto Antonella Di Stefano 5 a quello determinato dalle traslocazioni reciproche bilanciate (circa il 10%) e solitamente vengono scoperte casualmente in individui con insuccessi riproduttivi, in adolescenti con anomalie dello sviluppo sessuale o durante le analisi cromosomiche prenatali; in quest’ultimo caso, non essendo possibile una conferma a livello fenotipico, è difficile stabilire se queste traslocazioni siano realmente bilanciate. - Traslocazioni sbilanciate robertsoniane: si verificano quando due cromosomi acrocentrici si uniscono a livello dei centromeri; il risultato è un singolo cromosoma anomalo che contiene entrambi bracci lunghi dei due cromosomi originali, con conseguente perdita dei bracci corti e spesso di un centromero, per cui le cellule dei portatori bilanciati risultano aneuploidi (45 cromosomi). Poiché sui bracci corti di tutti i dieci cromosomi acrocentrici sono localizzati i geni per l’RNA ribosomiale, la perdita di due bracci corti non comporta effetti fenotipici. L’incidenza di queste traslocazioni è di 1/900 nati (Traversa et al., 2010). Il 5% di tutti i casi di Sindrome di Down è originato da una traslocazione robertsoniana, la maggior parte delle volte tra i cromosomi 14 e 21. I portatori di questa traslocazione sono aneuploidi con apparenti 45 cromosomi dei quali uno è Antonella Di Stefano 6 costituito dai due bracci lunghi dei cromosomi 14 e 21 e risultano fenotipicamente normali (Berend et al, 2003). Traslocazioni somatiche e cancro Sono traslocazioni sporadiche poiché insorgono in una cellula somatica. In relazione ai punti di rottura questa cellula può guadagnare un vantaggio replicativo che, con successivi eventi di mutazione, la trasforma in una cellula tumorale. In particolari situazioni, spesso in presenza di concomitanti fattori ambientali mutageni che creano una situazione di stress per la cellula, la frequenza di induzione del danno e la sua gravità risultano superiori rispetto alla capacità dei sistemi di riparazione della cellula. Si ha, quindi, un danno irreversibile nella cellula e di conseguenza una proliferazione sregolata. Il meccanismo di attivazione per traslocazione cromosomica è particolarmente frequente nelle neoplasie del sistema ematopoietico e nei sarcomi. La caratteristica costante delle traslocazioni cromosomiche studiate finora è rappresentata dall’alterazione nella struttura o nella regolazione di un protooncogene. Due sono i meccanismi di base attraverso cui una traslocazione può agire. Da un lato, la traslocazione può allontanare il protooncogene dalle sue normali strutture regolatorie e posizionarlo sotto nuovi elementi di controllo. Come conseguenza, il protooncogene può essere espresso in tessuti nei quali normalmente è silenziato o, nel caso sia espresso già nel tessuto normale da cui il tumore deriva, può essere sottratto ai fini meccanismi di controllo che lo regolano in condizioni fisiologiche. Antonella Di Stefano 7 Un secondo meccanismo attraverso cui una traslocazione può agire è rappresentato dalla formazione di un trascritto di fusione, derivante dall'unione di due geni localizzati nei due punti di rottura dei cromosomi coinvolti nella traslocazione. T (9; 22) Tutti i casi di leucemia mieloide cronica propriamente detta presentano una caratteristica anomalia citogenetica, il cromosoma Philadelphia, derivante dalla traslocazione t (9; 22). Questa traslocazione sposta l’oncogene ABL, che normalmente mappa in 9q34 e codifica per una tirosinchinasi citoplasmatica, sul cromosoma 22q11, dove si localizza il gene BCR. Di conseguenza si forma un trascritto di fusione che codifica per un mRNA ibrido BCR/ABL e per una proteina chimerica chiamata p210. La conseguenza funzionale della traslocazione BCR/ABL è la localizzazione citoplasmatica e l’attivazione costitutiva del dominio tirosinchinasico di ABL. Bersaglio della fosforilazione da parte di BCR/ABL sono numerose proteine coinvolte nella proliferazione, differenziazione, sopravvivenza, adesione e riparazione del DNA nelle cellule staminali emopoietiche. Antonella Di Stefano 8 Se una regione di un cromosoma viene rilocalizzata o riarrangiata in seguito a traslocazione, la normale espressione dei geni contenuti in quella regione cromosomica può essere modificata (effetto posizione). Questo è particolarmente vero se il gene viene a essere posizionato all’interno o vicino a certe regioni del cromosoma che sono compattate e inerti da un punto di vista trascrizionale quale è l’eterocromatina. Nonostante i molti danni, le traslocazioni, come tutte le mutazioni, svolgono un ruolo importante nell'evoluzione: ad esempio, scimpanzé, gorilla e oranghi hanno tutti 48 cromosomi, mentre l'uomo ne possiede 46. Il secondo cromosoma umano, che è grosso e metacentrico, presenta bande G sovrapponibili a quelle osservate su due differenti cromosomi acrocentrici dei primati. Questo fatto, potrebbe essere il sintomo che in un antenato dell'uomo si sia verificata una fusione centrica, che diede origine ad un grosso cromosoma metacentrico. Inoltre, altri riarrangiamenti cromosomici hanno portato all’evoluzione dei geni delle catene α e β dell’emoglobina umana e all’evoluzione del cromosoma Y a partire da una coppia di omologhi. Tuttavia l’insorgenza di una mutazione cromosomica in una cellula, germinale o somatica, potrebbe causare mutazioni geniche o anomalie durante la meiosi. Quindi, data la diversità e la frequenza di questi riarrangiamenti cromosomici, è consigliabile, soprattutto in presenza di anomalie cromosomiche familiari e in caso di problemi di fertilità eseguire l’analisi del cariotipo seguito, se necessario, da altre analisi specifiche. Antonella Di Stefano 9 2 PARTE SPERIMENTALE Studio di: Traslocazioni bilanciate autosoma/autosoma; Traslocazioni sbilanciate robertsoniane; Traslocazioni reciproche bilanciate “de novo”; Traslocazioni cromosoma sessuale/autosoma. L’analisi è stata effettuata mediante l’utilizzo di alberi genealogici familiari, cariotipo standard, FISH e PCR. 2.1 MATERIALI E METODI 2.1.1 Studi citogenetici Allestimento delle colture di linfociti periferici e dei preparati cromosomici I linfociti del sangue venoso periferico eparinizzato (0,5 ml) proveniente dai pazienti analizzati, sono coltivati in terreno RPMI con aggiunta del 20% di siero fetale, antibiotici (penicillina, streptomicina) e 0,1 ml di fitoemoagglutinina M. Per ogni paziente sono allestite tre colture indipendenti; le colture sono incubate per 72 ore a 37 °C; a due di esse, 6 ore prima della fine della coltura, viene aggiunto 1cc di 5- Bromodessosiuridina (BudR), un analogo della Timina, al fine di ottenere preparati sui quali eseguire le colorazioni differenziali per il bandeggio cromosomico R. La terza coltura è mantenuta in terreno standard e verrà Antonella Di Stefano 10 utilizzata per l’allestimento di preparati con bandeggio differenziale G. Nelle ultime 2 ore viene aggiunta a tutte le colture la Colchicina, un alcaloide che svolge azione antimitotica, compromettendo la stabilità dei dimeri di tubulina dei microfilamenti del citoscheletro organizzati in fibre del fuso. Al termine della coltura, le cellule sono centrifugate a 2000 rpm per 6 minuti, viene aspirato il sopranatante e successivamente viene aggiunta una soluzione ipotonica (KCl 0,67 M) per indurre la lisi dei globuli rossi. A questo punto si incuba per 2 minuti in termostato (37 °C), si centrifuga nuovamente e si aspira il sovranatante fino al pellet. Le cellule vengono lavate e fissate per due volte con una soluzione fresca di metanolo/acido acetico (3:1), centrifugate e conservate a +4 °C overnight per consentire al fissativo di raggiungere tutta la cromatina e per rendere rigida, e quindi fragile, la membrana cellulare dei linfociti. I preparati cromosomici vengono quindi allestiti secondo la procedura standard e colorati. Per la ricostruzione del cariotipo vengono analizzate almeno 30 metafasi con una risoluzione media di almeno 400 bande. L’eventuale presenza di mosaicismi viene valutata su un numero minimo di 100 metafasi. Tecniche di colorazione I preparati sono stati colorati sia con la metodica di colorazione classica con Giemsa (70cc di acqua di fonte e 2,5cc di Giemsa, per 10 minuti) sia con le seguenti tecniche di colorazione differenziale: BANDEGGIO RBG: si utilizzano 140cc di tampone Sorensen a pH 6,7 ottenuto unendo 70cc di soluzione A (500cc di H₂o distillata e 4,54 g di Antonella Di Stefano 11 KH₂PO₄) e 70cc di soluzione B (500cc di H₂o distillata e 5,93 g di Na₂HPO₄). A 66,5 cc della soluzione tampone si aggiungono 3,5cc di soluzione Hoechst 33258 (5mg/100cc di H₂o distillata). I vetrini vengono immersi in questa soluzione per 30’ a temperatura ambiente e al buio. Si effettua il lavaggio dei vetrini in H₂o distillata e si procede al montaggio con coprioggetto in 2-3 gocce di tampone Sorensen. La fotolisi della cromatina viene ottenuta mediante esposizione a raggi UV per 30 minuti o alla luce solare per 2 ore. Terminata l’esposizione, i preparati sono denaturati per 1’40’’ a 82 °C e colorati con soluzione Giemsa per 6’. Questo tipo di bandeggio colora selettivamente le regioni di DNA early-replicating, consentendo inoltre la ricerca del cromosoma X inattivato. BANDEGGIO CBG: i preparati vengono immersi per 10 minuti in alcool etilico 95%, poi trasferiti in una soluzione satura di idrossido di Bario Ba(OH)₂ a pH 13,2 per 8 minuti a temperatura ambiente. Dopo essere stati sciacquati in H₂o distillata, vengono denaturati per un’ora a 62°C in una soluzione salina SSC 2X e in seguito colorati per 3’ con soluzione Giemsa al 5%. Questo tipo di bandeggio colora selettivamente l’eterocromatina costitutiva (centromeri, costrizioni secondarie dei cromosomi 1, 9, 16 e regione eterocromatica del braccio lungo del cromosoma Y). Antonella Di Stefano 12 2.1.2 Analisi FISH L’ibridazione in situ con fluorocromi è stata eseguita secondo le indicazioni date dalle ditte fornitrici. I cromosomi, fissati su vetrino, vengono denaturati a 73 °C in formammide a pH 7 e diluita in SSC 2X fino ad una concentrazione finale di 12,6 M. Il tempo di denaturazione è di 2-5 minuti a seconda del periodo di invecchiamento del preparato. L’ibridazione con sonde specifiche denaturate a 95 C° per 5’ è protratta per tutta la notte in camera umida a 37 C°. Al fine di rimuovere sonde di DNA non legate o legate in modo non specifico, vengono eseguiti, al buio, lavaggi stringenti: 2’ in SSC 0,4 a 73°C e 1’ in SSC 2X a temperatura ambiente. I cromosomi sono controcolorati con DAPI (concentrazione finale 0,25 ng/ml) e osservati al microscopio a fluorescenza (Zeiss) con filtri FITC TRIC. Le sonde molecolari utilizzate sono: Sonde per le regioni subtelomeriche del cromosoma 1 (sonda Chromoprobe Multiprobe T-System Cytocell); Sonde per le regioni pseudoautosomiche (PAR1, PAR2) comuni ai cromosomi X e Y (sonda Chromoprobe Multiprobe T-System Cytocell); Sonda per SRY (Vysis LSI SRY/CEP X); Sonda locus DNA specifica per la regione Xp21.2/p21.3 (sonda cosmidica QUINT Essential); Sonda painting per il cromosoma X (sonda COATASOME). Antonella Di Stefano 13 2.1.3 Analisi PCR La PCR è stata eseguita su DNA estratto da leucociti periferici ottenuti da campioni di sangue con metodi standard. Sono state utilizzate sequenze specifiche per le regioni AZFa, AZFb, e AZFc: Regione AZFa: primers sY85 e USP9Y Regione AZFb: primers sY117 e sY142 Regione AZFc: primers sY158 e sY254 Sequenze specifiche per SRY, ZFX/ZFY sono state usate come controllo interno positivo. Estratti di DNA genomico da parte di uomini e donne fertili sono stati utilizzati per il controllo esterno. PAZIENTI Presso il Servizio di Citogenetica del Policlinico Umberto I di Roma sono stati effettuati accertamenti citogenetici mediante cariotipo su soggetti che presentavano problemi di infertilità o che dichiaravano la presenza di anomalie cromosomiche ereditarie in famiglia. Antonella Di Stefano 14 2.1.4 Analisi di alberi genealogici familiari Traslocazioni bilanciate autosoma/autosoma I cromosomi coinvolti negli esempi di famiglie riportate sono: 4, 7, 8, 10, 11, 14, 19, 20 Antonella Di Stefano 15 Famiglia 1: t (7;14) (q21;23) II-6 probando In questa famiglia è mostrata la trasmissione ereditaria della traslocazione in 3 generazioni. Nella III generazione (3-9) è significativa la formazione preferenziale di gameti sbilanciati evidenziati dai numerosi aborti spontanei presenti in minor numero anche nella II generazione. Antonella Di Stefano 16 Famiglia 2: t (7;10) (q11.21;p15) III-3 probando Probabile trasmissione ereditaria in 4 generazioni. Traslocazione bilanciata asintomatica in portatori e rilevata solo in analisi prenatale nel feto della IV generazione. I punti di rottura presenti in questa traslocazione e i cromosomi derivativi rendono difficoltoso l’appaiamento in meiosi, sostenendo l’ipotesi che molti zigoti siano abortiti precocemente. Antonella Di Stefano 17 Famiglia 3: t (4;11) (q21;q23) III-3 probando Traslocazione che coinvolge il cromosoma 4, relativamente con bassa densità genica, e il cromosoma 11 contenente loci sottoposti ad imprinting con loro coinvolgimento nelle prime fasi dello sviluppo embrionale: questo tipo di traslocazione appare compatibile con la trasmissione alla progenie solo se sono le donne portatrici. Gli individui III- 5 e III-6 non si sono sottoposti ad accertamento del cariotipo, ma è ragionevole supporre che non siano portatori di traslocazione, non avendo dichiarato alcun problema riproduttivo. Antonella Di Stefano 18 Famiglia 4: t (11;20) (q23;q13) III-1 probando Traslocazione trasmessa in 3 generazioni. Il coinvolgimento dei cromosomi 11 e 20 determina, come è evidente nella terza generazione, la formazione di un numero significativamente alto di gameti sbilanciati prodotti dalla portatrice II-2 e risultanti in numerosi aborti spontanei. La proporzione attesa di produrre gameti normali e bilanciati è dimostrata dalla nascita di individuo bilanciato (III-1) e da soggetto che non presenta la traslocazione (III-5). Antonella Di Stefano 19 Famiglia 5: t (8;19) (q23;p13) III-2 probando La traslocazione coinvolge il cromosoma 8, con relativa bassa densità genica, e il cromosoma 19, denso di geni attivamente espressi. In questo caso si ipotizza un evidente effetto epigenetico di questa traslocazione che sembra non aver creato problemi riproduttivi nella madre della probanda (II-2), mentre è causa di sterilità nella figlia, costretta infatti a ricorrere a protocolli di fecondazione medicalmente assistita. Antonella Di Stefano 20 Traslocazioni sbilanciate robertsoniane Famiglia 6: der (14;21) (q10;q10) II-2 probando Esempio di famiglia con traslocazione sbilanciata robertsoniana 14, 21 che interferisce gravemente con gli aspetti epigenetici della spermatogenesi. Il soggetto II-2 presenta dispermia. Antonella Di Stefano 21 Traslocazioni “de novo” Traslocazioni insorte “de novo” nella gametogenesi di uno dei due genitori. Famiglia 7: t (2;3) (p24;p22) II-3 probando Traslocazione tra i bracci corti dei cromosomi più grandi e più ricchi in geni del genoma. Anomalia cromosomica che comporta infertilità nel maschio per interferenza con gli aspetti epigenetici della spermatogenesi. Antonella Di Stefano 22 Famiglia 8: t (5;19) (q10;q10) II-1 probando Traslocazione de novo nella probanda con genitori normali. Per questa traslocazione il rischio di aborti è stimato essere del 50%, in quanto i previsti gameti sbilanciati non sono compatibili con lo sviluppo fetale. Per III-1 è stata eseguita l’analisi del cariotipo fetale con diagnosi di cariotipo normale. Antonella Di Stefano 23 Traslocazioni cromosoma sessuale/autosoma Le traslocazioni cromosoma sessuale/autosoma compromettono la fertilità in misura autosoma/autosoma. maggiore Infatti, tutti rispetto i alle maschi traslocazioni portatori di una traslocazione X/autosoma e l’80% dei maschi con una traslocazione Y/autosoma presentano azoospermia. Il restante 20% dei maschi portatori di traslocazioni Y/autosomi ha un numero ridotto di gameti e una frazione variabile di questi, ha un corredo cromosomico sbilanciato. Le traslocazioni Y/autosoma sono riarrangiamenti strutturali con un’incidenza di circa 1/2000 nella popolazione generale e costituiscono un gruppo eterogeneo in quanto possono coinvolgere molti degli autosomi e differenti regioni del cromosoma sessuale. Antonella Di Stefano 24 TRASLOCAZIONE X/16 Famiglia nella quale il probando è un maschio portatore di una traslocazione t (X;16) (p21; p12) e con quadro clinico comprendente ipogonadismo ipogonadotropo, genitali ambigui e ritardo di sviluppo sessuale. La madre e la sorella del probando sono portatrici della stessa traslocazione ma il loro fenotipo è normale. Il confronto dei fenotipi del probando e delle due donne portatrici della stessa traslocazione suggerisce l’esistenza di una regione cromosomica, localizzata sul cromosoma X, che è espressa differentemente nei due sessi e che è sotto controllo epigenetico. Figura 1: Cariotipo parziale dei cromosomi coinvolti nella traslocazione con colorazione differenziale RBG; le frecce sugli ideogrammi dei cromosomi strutturalmente normali indicano i punti di rottura. Antonella Di Stefano 25 Figura 2: t (X;16) (p21;p12) III-2 probando II-3 e III-3 sono portatrici della traslocazione, ma con fenotipo normale. Non è stato possibile eseguire l’analisi del cariotipo a I-1 e I-2. Antonella Di Stefano 26 A B Antonella Di Stefano 27 C Analisi mediante FISH su cromosomi metafasici A-B: ibridazione con sonda cosmidica QUINT Essential DNA specifica per la regione Xp21.2-p21.3; C: ibridazione con sonda painting COATASOME per il cromosoma X; In B e C le frecce indicano il cromosoma X strutturalmente normale. Antonella Di Stefano 28 I risultati ottenuti mediante analisi FISH: confermano i punti di rottura individuati mediante l’analisi standard del cariotipo e permettono di escludere la presenza di altri riarrangiamenti cromosomici oltre alla traslocazione (A, B); dimostrano che la regione Xp21.2-p21.3 riconosciuta dalla sonda specifica è interamente traslocata sul braccio corto del cromosoma 16, indicando che i punti di rottura sono rispettivamente sul cromosoma X nella regione p21.1-p11.4 e sul cromosoma 16 nella regione p12; evidenziano nelle metafasi femminili (B) segnali della sonda di intensità analoga sul cromosoma X strutturalmente normale e su quello riarrangiato, suggerendo che la quantità di materiale genetico non sia modificata, e nelle metafasi maschili (A) un unico segnale sul braccio corto del cromosoma 16 di origine materna; dimostrano che l’intera regione Xpterp21.2, critica per il differenziamento sessuale, e in particolare la regione DSS, non è coinvolta dai punti di rottura della traslocazione. Antonella Di Stefano 29 TRASLOCAZIONE Y /1 Il soggetto esaminato presenta infertilità con valori di FSH, LH e inibina B normali. Le analisi dello sperma indicano una azoospermia non ostruttiva. Il volume di entrambi i testicoli valutato mediante ultrasonografia, risulta leggermente ridotto. Il paziente ha due fratelli, uno riprodottosi, e tre sorelle di cui due con figli. I parenti del paziente non hanno effettuato l’analisi del cariotipo. Antonella Di Stefano 30 Figura 3: t (Y;1) (q11.2;p35) II-2 probando Traslocazione de novo che comporta infertilità, insorta nella gametogenesi paterna Antonella Di Stefano 31 A B Figura 4: Riarrangiamento cromosomico bilanciato: traslocazione reciproca tra il braccio lungo del cromosoma Y e il braccio corto del cromosoma 1; [t (Y;1) (q11.2;p35)]. A. Metafase con bandeggio RBG. B. Metafase con bandeggio CBG specifico per le regioni di etero cromatina costitutiva. Nei riquadri a destra sono mostrati il cromosoma 1 strutturalmente normale e i cromosomi coinvolti nella traslocazione reciproca. Antonella Di Stefano 32 A Figura 5: Analisi FISH di metafasi con traslocazione reciproca bilanciata (Y;1). Freccia gialla: cromosomi strutturalmente normali. Frecce bianche: cromosomi der (Y) e der (1). A. Ibridazione con sonde per le regioni subtelomeriche del cromosoma 1 (segnale verde 1p; segnale rosso 1q). Il cromosoma 1 strutturalmente normale, presenta entrambi i segnali. Il segnale verde sul braccio lungo del cromosoma der (Y), conferma la traslocazione della regione subtelomerica del braccio corto del cromosoma 1. Il segnale rosso, come atteso, si presenta sul braccio lungo del cromosoma der (1). Antonella Di Stefano 33 B B. Ibridazione con le sonde per le regioni pseudoautosomiche (PAR1, PAR2) comuni ai cromosomi X e Y (segnale verde PAR1; segnale rosso PAR2). Il cromosoma X strutturalmente normale presenta entrambi i segnali. Der (Y) presenta solamente il segnale verde PAR1. Der (1) presenta il segnale rosso PAR2 sul braccio corto confermando l’avvenuta traslocazione dell’intera regione YqPAR. Antonella Di Stefano 34 Figura 6: Analisi PCR relativa alle regioni AZFa, AZFb e AZFc. L’elettroforesi dimostra che i profili del DNA delle tre regioni AZF sono normali, sovrapponibili a quelli dei controlli di popolazione. Antonella Di Stefano 35 3 RISULTATI Nei portatori di traslocazioni bilanciate autosoma/autosoma il rischio teorico di avere una progenie sbilanciata è più del 60%; in pratica, i dati statistici ottenuti da analisi su ampi campioni di popolazione correggono il grado di rischio stimandolo in circa il 50%, poiché una percentuale di embrioni sbilanciati va incontro ad aborto in fasi molto precoci della gestazione. Infatti, analisi mediante FISH di spermatozoi di portatori di traslocazione bilanciata, hanno dimostrato che il 50 % dei gameti maschili hanno corredo cromosomico normale o bilanciato in uguale percentuale, e che il restante 50 % di gameti sbilanciati si originano per segregazione adiacente 1. Nella famiglia 1 [ t (7;14) ] e nella famiglia 2 [ t (7;10) ] è coinvolto in entrambi i casi il cromosoma 7, ma nel primo caso questo è traslocato con un acrocentrico e quindi l’appaiamento alla meiosi risulta particolarmente instabile. Di conseguenza è possibile una trasmissione ereditaria, ma con significativa presenza di aborti. Differentemente, nella famiglia 2, il cromosoma 7 è traslocato su un altro cromosoma del gruppo C. La trasmissione ereditaria è documentata in quattro generazioni con simile incidenza di aborti e prole normale, probabilmente per una forte selezione nelle precocissime fasi di sviluppo embrionale. Nelle famiglie 3 [ t (4;11) ] e 4 [ t (11;20) ] è invece coinvolto il cromosoma 11 in cui sono localizzati geni critici per lo sviluppo embrionale (es.famiglia β like delle emoglobine) e geni sottoposti ad imprinting (es. protooncogene tumore di Wilms). Antonella Di Stefano 36 Nella traslocazione robertsoniana [ t (14;21) ], l’appaiamento prende la forma di un trivalente molto instabile con esposti i bracci corti degli acrocentrici; queste regioni NOR, che ospitano i geni per rRNA e intervengono nella formazione del nucleolo, determinano spesso, anche in individui con cariotipo normale, disturbi nella spermatogenesi per interferenza con l’appaiamento XY. Per le traslocazioni cromosomi sessuali/autosoma qui descritte, aberrazioni cromosomiche che coinvolgono invece il braccio corto del cromosoma X sono state descritte in maschi con diverse anomalie quali la Sindrome di Kallmann, l’ipoplasia congenita delle ghiandole surrenali associata a ipogonadismo ipogonadotropo, il ritardo mentale associato a macrorchidismo e la sindrome “sex reversal” associata a duplicazione della regione DSS. Poiché sia le due donne fenotipicamente normali che il maschio con gravi anomalie dello sviluppo sessuale presentano gli stessi alleli attivi sui cromosomi derivativi della traslocazione, si può ipotizzare che la regione coinvolta nel punto di rottura del cromosoma X o del cromosoma 16 svolga un ruolo differente nei due sessi presumibilmente sotto l’azione di fattori epigenetici. Tuttavia dati recenti relativi agli effetti fenotipici di disomie uniparentali materne a carico del cromosoma 16 indicano che i geni di questo cromosoma, sottoposti a imprinting, non svolgono un ruolo specifico nel differenziamento sessuale. Alcuni studi suggeriscono inoltre, che l’inattivazione del cromosoma X e l’imprinting di geni X-linked siano Antonella Di Stefano 37 correlati. Pertanto il fenotipo anomalo del probando potrebbe essere dovuto: - al silenziamento di geni sottoposti a imprinting la cui espressione è essenziale in alcune tappe dello sviluppo sessuale maschile; - alla non corretta riprogrammazione epigenetica durante l’ovogenesi delle regioni cromosomiche coinvolte nella traslocazione. Per quanto riguarda invece i portatori di una traslocazione t (Y;1), basandosi su dati di letteratura, questi risultano sterili quando i punti di rottura si trovano nella regione Yq11 in cui sono localizzati loci AZF. Tuttavia, nel caso qui riportato, nessuna delle regioni AZF è stata interrotta, come dimostrato dall’analisi PCR (Figura 6). Pertanto si può ipotizzare che l’azoospermia osservata nel probando può essere conseguente a: - difetto nella spermatogenesi dovuto all’anomalo appaiamento meiotico a carico del cromosoma Y che impedisce la formazione del bivalente XY e quindi la sua eterocromatizzazione, determinando di conseguenza l’arresto della meiosi; - mutazione per interruzione della sequenza di geni localizzati nei punti di rottura sul cromosoma Y o sul cromosoma 1; - effetto posizione: la giustapposizione dell’eterocromatina Yq nella regione subtelomerica 1, ricca di geni attivamente espressi, può causare la perdita funzionale di alcuni geni critici per la progressione della meiosi causando un difettoso accoppiamento e una difettosa ricombinazione meiotica. Antonella Di Stefano 38 4 CONCLUSIONI L’infertilità, intesa come incapacità di riprodursi dopo un anno di ripetuti e validi tentativi, riguarda il 15% delle coppie nei paesi Occidentali. Nel 50% circa di questi casi il fattore responsabile è di origine maschile (Carrel e al., 2006). Anche se la maggior parte dei casi di infertilità maschile è idiopatica, nel 15% dei maschi infertili la causa può essere ricondotta a fattori genetici quali anomalie cromosomiche e mutazioni geniche. I pazienti portatori di alcuni tipi di anomalie cromosomiche producono, con un’alta frequenza, spermatozoi con assetto cromosomico sbilanciato, risultato diretto di anomalie costituzionali ereditarie o conseguenza di errori meiotici durante la spermatogenesi. La correlazione tra fattori genetici e infertilità ha assunto particolare rilevanza soprattutto con l’introduzione delle tecniche di fecondazione assistita. In particolare la tecnica ICSI (Intra Cytoplasmic Sperm Injection), nella quale è assente qualsiasi forma di selezione naturale dei gameti, permette la riproduzione anche di individui sterili, portatori di mutazioni geniche o anomalie cromosomiche. A differenza della FIVET che necessita sia di un numero ottimale di spermatozoi sia della capacità di completare con successo la sequenza di eventi che portano alla fecondazione, la ICSI consiste nell’iniezione diretta di uno spermatozoo nel citoplasma dell’ovocita (Merchant et al, 2011). L’iniezione intracitoplasmatica di pronucleo maschile viene eseguita anche con spermatidi ottenuti da biopsia testicolare in presenza di azoospermia, Antonella Di Stefano 39 come nel caso di individui con Sindrome di Klinefelter a mosaico. Per questo protocollo i dati sono però ancora preliminari per valutare eventuali rischi per l’embrione. Alcuni casi di infertilità maschile, con arresto parziale o completo della spermatogenesi, risultano da errori durante la diacinesi nella profase meiotica, nel corso dell’appaiamento dei cromosomi X e Y e della formazione della “vescicola sessuale”, che deve garantire la completa eterocromatizzazione e il silenziamento della coppia XY. Un errore durante il processo meiotico può essere responsabile per il 9% di infertilità maschile non ostruttiva. Altri meccanismi responsabili della ridotta capacità riproduttiva, possono essere ricondotti a mutazioni geniche o microdelezioni delle regioni AZF. Per ognuna di queste situazioni sono naturalmente discriminanti le condizioni ambientali cellulari, che possono influenzare diversamente l’effetto delle anomalie ereditarie, come mostrato nella famiglia 5, in cui lo stesso tipo di traslocazione mostra diverse conseguenze sulla fertilità. La riduzione della fertilità nei portatori di traslocazione è quindi correlata alla formazione di gameti sbilanciati e, nei maschi, a difetti della spermatogenesi. Infatti, nelle traslocazioni robertsoniane e in quelle reciproche, durante la profase I si verifica l’appaiamento tra i cromosomi riarrangiati e i loro omologhi, formando una configurazione denominata rispettivamente trivalente e quadrivalente. Le possibili segregazioni dei cromosomi coinvolti possono generare gameti bilanciati o sbilanciati (J Shamash et al., 2011). Studi meiotici hanno dimostrato che il difetto nella Antonella Di Stefano 40 spermatogenesi, nei portatori de traslocazioni robertsoniane, è correlato con un’aumentata frequenza di associazioni tra configurazione trivalente e il bivalente X-Y durante lo stadio di pachitene. Inoltre, nei portatori di traslocazioni reciproche, se i segmenti traslocati hanno una dimensione ridotta, si può verificare mancanza di sinapsi tra regioni omologhe e conseguente contatto di queste regioni con il bivalente X-Y (vescicola sessuale). L’instaurarsi di contatti tra regioni cromosomiche e bivalente XY durante la meiosi maschile, costituisce un evento che disturba le successive fasi della meiosi e determina quindi arresto della spermatogenesi. I primi studi di modalità di trasmissione delle traslocazioni sono stati condotti sul materiale proveniente dagli aborti spontanei. L’analisi degli spermatozoi provenienti dalle biopsie testicolari ha consentito, mediante l’uso della ibridazione in situ (FISH), di ottenere significativi dati sul comportamento e le modalità delle anomalie cromosomiche nel critico processo di appaiamento e segregazione dei cromosomi omologhi durante la meiosi. Questo studio non può essere eseguito sulla donna a causa della mancanza di accesso diretto ai gameti femminili. Con lo sviluppo della PGD (Diagnosi Genetica Preimpianto) è stato possibile analizzare nuovi dati relativi alle situazioni di trasmissione sia femminile che maschile sui portatori di traslocazioni bilanciate. Questa tecnica ha contribuito a portare nuove informazioni sul comportamento meiotico dei cromosomi e su come questi si ridistribuiscono durante il processo, al fine di capire in particolare come si altera il meccanismo della Antonella Di Stefano 41 meiosi nei portatori di traslocazione bilanciata. La PDG è una procedura complementare alle tecniche di diagnosi prenatale, che permette di identificare la presenza di malattie genetiche o di alterazioni cromosomiche in embrioni in fasi molto precoci di sviluppo, generati in vitro da coppie a elevato rischio riproduttivo, prima del loro impianto in utero. La PDG associata all’ibridazione in situ fluorescente (FISH) offre l’opportunità di individuare e selezionare gli embrioni da trasferire. Nonostante i notevoli vantaggi forniti dalla FISH-PDG, ci sono ancora limiti tecnici che comportano il rischio di avviare gravidanze di embrioni sbilanciati o portatori della stessa incapacità riproduttiva parentale (Shamash et al., 2011). La casistica raccolta da Belén Lledó e dai suoi collaboratori dell’Istituto Bernabeu in Spagna, dove la diagnosi preimpianto è permessa, ha consentito di aumentare i dati a disposizione per comprendere il comportamento delle anomalie cromosomiche durante la meiosi. Su un totale di 260 ovociti trattati con la ICSI, se ne sono fecondati 183 (70,38%) e la biopsia su una singola cellula embrionaria (blastomero) è stata eseguita su 127 embrioni. Di questi solo 37 (31,4% del totale degli embrioni analizzati) sono stati identificati come embrioni normali o bilanciati. I ricercatori hanno riscontrato un'incidenza complessiva di embrioni sbilanciati del 68,6%, ma non hanno osservato una differenza se ad essere portatori di traslocazione bilanciata siano le donne o gli uomini. Antonella Di Stefano 42 In considerazione dell’alta frequenza di anomalie cromosomiche e genetiche nelle coppie con poliabortività e dell’incalzante richiesta di ricorrere a fecondazioni medicalmente assistite è opportuno e necessario verificare, in via preliminare, l’accertamento del cariotipo dei pazienti e successivamente del cariotipo fetale o del tessuto abortivo. Antonella Di Stefano 43 BIBLIOGRAFIA 1. Antonelli A., Marcucci L., Elli R., Tanzi N., Paoli D., Radicioni A., Lombardo F., Lenzi A., Gandini L., 2010, ” Semen quality in men with Y chromosome aberrations”, international journal of andrology ISSN 01056263 2. Braun-Falco M, Schemmp W, Nevinny-Stickel-Hinzpeter C & Ko¨hn FM. (2007) Azoospermia due to a unique de novo balanced reciprocal translocation (Y;1) (q12;q25). J Androl 28, 647–651 3. Carrel DT, De Jonge C, Lamb DJ, 2006, The genetic of male infertility: a field of study whose time is now, Arch Androl 52:269-274 4. C.P. Chen, P C Wu, C J Lin, S R Chern, F J Tsai, C C Lee, D D Town, W L Chen, L F Chen, M S Lee, C W Pan, W Wang, (2010), Unbalanced reciprocal translocations at amniocentesi, Taiwanese Journal of Obstetrics & Gynecology 50, 48-57 5. F.Sun, M.Oliver-Bonet, P.J. Turek, E.Ko and R.H. Martin, (2005), Meiotic studies in an azoospermic human translocation (Y;1) carrier, Molecular Human Reproduction Vol.11, No.5 pp. 361–364 Antonella Di Stefano 44 6. Gasser S., Raulet D., 2006, The DNA damage response, immunity and cancer. Seminars in Cancer Biology, Natural killer cells in cancer, 16, 344347 7. G Ogur, E V Assche, W Vegetti, G Verheyen, H Tournaye, M Bonduelle, A Van Steirteghem, I Liebaers, 2006, Chromosomal segregation in spermatozoa of 14 Robertsonian translocation carriers, Molecular Human Reproduction Vol.12, No.3 pp. 209–215 8. J Shamash,S Rienstein, H Wolf-Reznik, El Pras, M Dekel, T Litmanovitch, M Brengauz, B Goldman, H Yonath, J Dor, J Levron, A Aviram-Goldring, (2011), Preimplantation genetic haplotyping a new application for diagnosis of translocation carrier’s embryos- preliminary observations of two robertsonian translocation carrier families, J Assist Reprod Genet 28:77–83 9. Marcucci Liana, Petrinelli P., Antonelli A., Proietti M., Elli R. 2001, “Xp21.1-11.4 chromosome region could be involved in male sexual development” Wurzburg, 14th International Chromosome Conference 10. Mary Ann Handel and John C. Schimenti, “Genetics of mammalian meiosis: regulation, dynamics and impact on fertility” . Nature reviews, volume 11 (124-136) 2010 Antonella Di Stefano 45 11. Mridula Nambiar and Sathees C. Raghavan, (2011), How does DNA break during chromosomal translocations?, Nucleic Acids Research, Vol. 39, No. 14 5813–5825 12. M.V. Traversa, L. Carey and D. Leigh, (2010), A molecular strategy for routine preimplantation genetic diagnosis in both reciprocal and Robertsonian translocation carriers, Molecular Human Reproduction, Vol.16, No.5 pp. 329– 337 13. Nicole M. Baker, Rakhi Rajan and Alfonso Mondrago, 2009, Structural studies of type I topoisomerasi, Nucleic Acids Research, Vol. 37, No. 3 693–701 14. R Merchant, G Gandhi and G N Allahbadia, 2011, In vitro fertilization/intracytoplasmic sperm injection for male infertility, Indian J Urol. 2011 Jan-Mar; 27(1): 121–132 15. S A Berend, S L Page, W Atkinson, C McCaskill, N E Lamb, S L Sherman, L G Shaffer, 2003, Obligate Short-Arm Exchange in De Novo Robertsonian Translocation Formation Influences Placement of Crossovers in Chromosome 21Nondisjunction, Am. J. Hum. Genet. 72:488–495 Antonella Di Stefano 46 16. S Pappalardo, 2010, “Padri con traslocazioni cromosomiche e rischio per i figli” ; Andrologia # 87, vitachenasce.org 17. V Tassistro, R Ghalamoun-Slaimi, J Saias-Magnan, M R Guichaoua, (2009), Chronology of meiosis & synaptonemal complex abnormalities in normal & abnormal spermatogenesis, Indian J Med Res 129, pp 268-278 18. Zheng X, Oancea C, Henschler R, Moore MAS, Ruthardt M (2009) Reciprocal t(9;22) ABL/BCR Fusion Proteins: Leukemogenic Potential and Effects on B,Cell Commitment. Plos one 4(10): e7661 LIBRI CONSULTATI: 1. R L Naussbaum, R R McInnes, H F Willard, 2007, Genetics in Medicine, New York, Saunders 2. Valerio Ventruto, Gianfranco Sacco, Fortunato Lonardo, 2001, TestoAtlante di Citogenetica Umana – Guida al riconoscimento e alla interpretazione delle anomalie cromosomiche in età prenatale e postnatale, Milano, Springer Verlag 3. Ricki Lewis, 2011, Genetica Umana. Concetti ed applicazioni, Roma, Piccin Antonella Di Stefano 47
Scarica