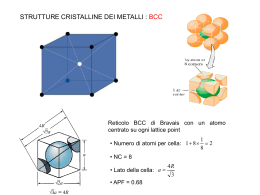
Deformazione plastica nei metalli Frenkel calcolò per primo lo stress meccanico necessario a deformare permanentemente (plasticamente) un cristallo perfetto. Tale deformazione permanente avviene mediante lo scorrimento di un piano atomico su uno ad esso adiacente. Il risultato ottenuto da Frenkel è che tale sforzo teorico è circa 1/10 di G. Lo sforzo che viene misurato sperimentalmente è però circa 1/100 di G. Meccanismo di deformazione plastica nei metalli La deformazione plastica è dovuta al moto delle dislocazioni: un dislocazione si muove se è applicato uno sforzo di taglio nella direzione perpendicolare al suo asse. Tale processo è detto scorrimento. Il piano cristallografico lungo il quale si sposta l’asse della dislocazione è detto piano di scorrimento La rottura dei legami è “step by step” Il moto di una dislocazione è analogo al modo di locomozione di un bruco. Densità di dislocazioni: lunghezza totale delle dislocazioni per unità di volume o numero di dislocazioni che intersecano un’area unitaria. Le dislocazioni non si muovono con la stessa facilità in tutti i piani cristallografici ed in tutte le direzioni. Esistono delle direzione preferenziali di scorrimento. Il meccanismo step by step avviene con maggiore difficoltà all’aumentare della distanza tra atomi del reticolo che hanno posizioni tra loro intercambiabili. Per lo scorrimento avviene di preferenza lungo le direzioni (direnzioni di scorrimento) e nei piani (piani di scorrimento) aventi la massima densità atomica. La combinazione di piani e direzioni di scorrimento si definisce sistema di scorrimento Slip plane Slip distance Crystal structure N° of slip systems examples BCC 6 x 2 =12 a–Fe, Mo FCC 4 x 3 =12 Al, Cu, g-Fe HCP 1 x 3 =3 Mg, Zn 90 F cos F cos cos cos cos A cos A F cos F cos cos cos cos A cos A Il valore di sufficiente a produrre scorrimento in un cristallo è detto sforzo di taglio indotto critico c: esso rappresenta lo sforzo minimo per poter iniziare lo scorrimento ed è una proprietà del materiale. Il valore massimo dello sforzo di taglio indotto si ha quando = = 45° Esercizio: BCC, applicata in [010] , calcolare nel piano di scorrimento C = 45° Considerando il triangolo rettangolo ABC: A B BC AB tg arctg a 2 54.7 a Densità lineare di atomi Consideriamo una direzione all’interno del reticolo cristallino, gli atomi (per definizione di struttura cristallina: ordinata e ripetitiva) sono distribuiti uniformemente lungo detta direzione. Sia r la distanza tra due atomi adiacenti. La densità lineare di atomi è semplicemente pari all’inverso della distanza ripetitiva r tra gli atomi: rl = 1/r Nel calcolare rl vanno contati soltanto gli atomi il cui centro si trova direttamente sulla direzione considerata SI NO Densità planare di atomi Consideriamo un piano all’interno del reticolo cristallino, gli atomi (per definizione di struttura cristallina: ordinata e ripetitiva) sono distribuiti uniformemente su tale piano. Si definisce densità planare di atomi il numero di atomi per unità di area rA = n/A Nel calcolare rA vanno contati soltanto gli atomi centrati sul piano di interesse STRUTTURE CRISTALLINE DEI METALLI : BCC Reticolo BCC di Bravais con un atomo centrato su ogni lattice point 1 • Numero di atomi per cella: 1 8 2 8 • NC = 8 • Lato della cella: a • APF = 0.68 4R 3 STRUTTURE CRISTALLINE DEI METALLI : FCC 1 8 1 2 Reticolo FCC di Bravais con un atomo centrato su ogni lattice point 1 1 • Numero di atomi per cella: 6 8 4 2 8 • NC = 12 • Lato della cella: a • APF = 0.74 4R 2 STRUTTURE CRISTALLINE DEI METALLI : HCP d 60° a c Reticolo esagonale di Bravais con 2 atomi per ogni lattice point • Numero di atomi per cella: 1 4 1 1 4 2 6 12 • NC = 12 • dimensioni della cella: a 2R • APF = 0.74 atomo a 2/3, 1/3, 1/2 c 1.633a Strutture cristalline dei materiali ceramici • I materiali ceramici sono composti tra elementi metallici e non-metallici per i quali i legami interatomici sono totalmente ionici o principalmente ionici con carattere parzialmente covalente • La struttura cristallina può essere pensata come composta da ioni elettricamente carichi anziché atomi. Gli ioni metallici, o cationi, sono caricati positivamente in quanto hanno ceduto i loro elettroni di valenza agli atomi non metallici, o anioni, che risultano quindi carichi negativamente. • Il cristallo deve essere elettricamente neutro. La formula chimica di un composto indica il rapporto esiste tra anioni e cationi o la composizione che permette di ottenere il bilancio di cariche. (Es: CaF2 → Ca2+ + 2 F-). •La struttura cristallina è influenzata dalle dimensioni relative tra gli anioni e i cationi, in particolare: r/R → NC (numero di coordinazione)* In cui r è il raggio dello ione più piccolo (catione) e R è il raggio dello ione più grande (anione). *NC = numero di atomi adiacenti (direttamente a contatto) che circondano un atomo di riferimento. Strutture cristalline dei materiali ceramici Ogni catione tende a circondarsi de massimo numero di anioni possibile e viceversa. Le strutture cristalline stabili si formano quando gli anioni che circondano un catione sono tutti a contatto con quel catione. Per uno specifico NC esiste un rapporto critico, o minimo, r/R per il quale si stabilisce questo contatto anione-catione. Ad esempio per NC=3 si ha che il minimo rapporto r/R è pari a 0.155. Questo rapporto critico si realizza quando gli anioni sono tangenti tra loro e a contatto con il catione. cos 30 30° 3 R r 0.155 2 rR R Strutture cristalline dei materiali ceramici Ancora se ad esempio consideriamo un rapporto r/R=0.2 il massimo NC realizzabile è pari a 3. Infatti ogni tentativo di posizionare un quarto anione a contatto con il catione comporta che gli anioni vadano a sovrapporsi. massima possibile instabile possibile Strutture cristalline dei materiali ceramici Esiste quindi per ogni valore del NC un intervallo di valori del r/R per i quali la struttura cristallina con quel NC è stabile. Numero di coordinazione Rapporto tra i raggi r/R 2 0<r/R<0.155 3 0.155≤r/R<0.225 4 0.225≤r/R<0.414 6 0.414≤r/R<0.732 8 0.732≤r/R<1 12 1 IPF = Volume occupato dagli ioni appartenenti alla cella / Volume della cella Strutture cristalline dei materiali ceramici: MX Cloruro di Cesio CsCl: • no BCC (ioni diversi) ma simple cubic con 2 atomi per lattice point • 2 ioni per cella (1 di Cs+ e 1 di Cl-) • NC=8 Strutture cristalline dei materiali ceramici: MX Cloruro di Sodio NaCl: • FCC di Na+ e FCC di Clinterpenetrate tra loro: è una FCC con 2 ioni per lattice point • 8 ioni per cella (4 di Na+ e 4 di Cl-) •NC = 6 Strutture cristalline dei materiali ceramici: MX Blenda o Solfuro di Zinco (ZnS): • FCC di S e Zn in posizione tetraedica • 8 ioni per cella (4 di S e 4 di Zn) •NC = 4 Strutture cristalline dei materiali ceramici: MX2 Fluorite (CaF2): • FCC Bravais lattice con 3 ioni per ogni lattice point ( 2 F- e 1 Ca+) • 12 ioni per cella (8 di F- e 4 di Ca+) •NC = 8 Strutture cristalline dei materiali ceramici: MX2 Silice (SiO2): • FCC Bravais lattice con 6 ioni per ogni lattice point ( 4 O2- e 2 Si4+) • 24 ioni per cella (16 di O2- e 4 di Si4+) •NC = 4 La caratteristica della silice è che essa è costituita da un network continuo di tetraedri SiO44-. La condivisione degli anioni O2- tra tetraedri adiacenti da luogo alla formula chimica SiO2. Strutture cristalline dei materiali ceramici: MaNbXc Titanato di Bario (BaTiO3): • simple cubic Bravais lattice con 5 ioni per ogni lattice point ( 1 Ba2+, 1 Ti4+ e 3 O2-) • 5 ioni per cella ( 1 Ba2+, 1 Ti4+ e 3 O2-) •NC = 6 Strutture cristalline del Carbonio Il Carbonio può presentarsi in varie forme cristalline: questo fenomeno è detto polimorfismo o allotropia. La configurazione stabile dipende dalle condizione di pressione e temperature in cui il solido si trova. Il carbonio a temperatura ambiente si presenta in forma di grafite, mentre ad elevate pressioni prevale la forma allotropica del diamante. Diamante Strutture cristalline del Carbonio Grafite Fullerene C60 Grafite e diamante formano un solido reticolato, in ci tutti glia atomi di carbonio formano legami primari con gli atomi adiacenti attraverso tutto il solido. In modo opposto nel fullerene gli atomi sono legati tra loro a formare le molecole sferiche. Nello stato solido le unità C60 formano una struttura cristallina FCC. Strutture cristalline del Carbonio: nanotubi
Scarica