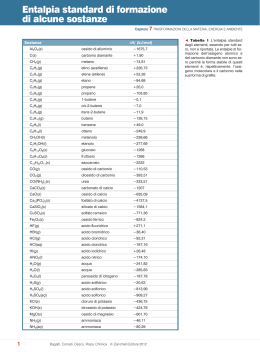
Regole e convenzioni della nomenclatura IUPAC, tradizionale e di Stock Ogni specie chimica viene rappresentata univocamente con una formula e indicata con un nome mediante simboli ed indici numerici che indicano rispettivamente gli elementi ed il numero degli atomi presenti nella molecola La nomenclatura segue specifiche regole e convenzioni stabilite dall’organismo internazionale IUPAC (International Union of Pure and Applied Chemistry) nonostante per molti composti sia ancora in uso la nomenclatura tradizionale Nomenclatura tradizionale Trae origine dalla distinzione degli elementi in metalli e non metalli; indica con suffissi e prefissi i diversi stati di ossidazione degli elementi; permette di distinguere facilmente gli acidi dalle basi e tra ossidi, perossidi e superossidi. ancora molto usata per gli idrossidi, gli ossiacidi e i loro sali. Nomenclatura IUPAC Si “compone” il nome della specie chimica esplicitando la formula ovvero mettendo in evidenza il numero di atomi ed il numero di ossidazione degli elementi corrispondenza logica dal punto di vista letterale e numerico. Da preferire per gli ossidi acidi e gli idruri ma anche per gli ossidi di alcuni metalli con più di un n.o. Notazione di Stock Fa riferimento al numero di ossidazione che gli elementi presentano nella molecola, ma ne dà specificazione mettendoli tra parentesi in cifre romane. È da preferire per gli ossidi dei metalli, gli idrossidi e per i sali binari di metalli che presentano più di un n.o. Numero d'ossidazione (n.o.) NUMERO che si attribuisce a ciascun atomo in un composto e rappresenta una carica elettrica formale (reale nel caso dei composti ionici), positiva (se si attribuisce all’elemento la perdita di elettroni) o negativa (se si attribuisce all’elemento l’acquisto di elettroni) Nel caso di composti ionici il n.o. corrisponde all’effettiva carica dell’atomo Nelle molecole in cui siano presenti legami covalenti il n.o. rappresenta una grandezza convenzionale Uno stesso elemento può presentare n.o. diversi. Regole per l’attribuzione del n.o n.o. = 0: in tutti gli elementi allo stato elementare e quando gli atomi presenti nella molecola sono uguali, cioè non esiste differenza di elettronegatività. Es: H2; Br2; O2 In tutti i composti l'ossigeno ha n.o. = 2 (tranne nei perossidi dove n.ox. = 1 Es. H2O2; nei superossidi è -1/2) In tutti i composti l'idrogeno ha n.o. = +1 (tranne negli idruri metallici NaH in cui è 1) La somma algebrica dei n.o. di uno ione (monoatomico o poliatomico) è uguale alla carica dello ione stesso. Quindi, il n.o. dello ione ferrico Fe3+ è +3; il n.o. dell’N nello ione ammonio NH4+ è 3. La somma algebrica dei n.o. degli atomi di una molecola è sempre = 0. Quindi, per calcolare il n.o. dello S nell’acido solforico H2SO4 si procede così: 0 = 4 ·n.o. (O) + 2 ·n.o. (H) +n.o. (S) 0 = 8 + 2 + n.o.(S) quindi S = + 6 +1 +6 2 H2SO4 LA CLASSIFICAZIONE DEI COMPOSTI INORGANICI La nomenclatura si basa sulla distinzione fondamentale dei composti in: BINARI, formati da due soli tipi di elementi IDRURI IDRACIDI OSSIDI BASICI OSSIDI ACIDI SALI BINARI di idracidi TERNARI, formati da tre diverse specie di elementi IDROSSIDI o BASI OSSIACIDI o ACIDI OSSIGENATI SALI TERNARI (o QUATERNARI) di ossiacidi MAPPA CONCETTUALE DEI COMPOSTI CHIMICI METALLI + ossigeno + idrogeno OSSIDI + acqua IDROSSIDI IDRURI SALINI SALI + idrogeno F,Cl,Br,I NON METALLI + ossigeno ANIDRIDI + idrogeno IDRACIDI + acqua OSSIACIDI IDRURI COVALENTI COMPOSTI BINARI I composti binari si possono distinguere in ionici e molecolari con ossigeno (ossidi basici e ossidi acidi) con idrogeno (idruri e idracidi) Sali degli idracidi OSSIDI BASICI METALLO + OSSIGENO +n Formula generale con le dovute semplificazioni dei pedici Me2On NOMENCLATURA TRADIZIONALE OSSIDO DI....... 2 NOTAZIONE DI STOCK se il metallo ha un OSSIDO DI.......... solo n.o. IUPAC Si enumerano gli se il non-metallo atomi presenti ha un solo n.o. usando i prefissi mono, -bi, -tri, ecc. se il metallo ha due n.o. e nell’ossido si OSSIDO DI Me se il non-metallo OSSIDO....OSO presenta con n.o. (numero romano) ha più di un n.o. più basso. se il metallo ha due n.o. e nell’ossido si OSSIDO.....ICO presenta con n.o. più alto. 1. Il metallo ha un solo n.o. K +1 Ca +2 Al +3 2. K2O ossido di potassio CaO ossido di calcio Al2O3 ossido di alluminio o triossido di dialluminio (parzialmente ionico) Il metallo ha più di un n.o. OSSIDI ACIDI o ANIDRIDI NON-METALLO + OSSIGENO +n Formula generale 2 X2On NOMENCLATURA TRADIZIONALE se il NMe ha un solo ANIDRIDE.......... n.o. o, presentando ICA due n.o. si presenta con n.o. più alto ANIDRIDE...... OSA con le dovute semplificazioni dei pedici IUPAC Si enumerano gli atomi presenti usando i prefissi mono, -bi, -tri, ecc. se il NMe ha due n.o. e si presenta con n.o. più basso. Nel caso in cui il n.o. possano essere quattro (come nel caso del Cl) nella nomenclatura tradizionale si usano prefissi e suffissi: +1 +3 +5 +7 IPO…….OSA …….OSA …….ICA PER…….ICA Elemento n.o Formula B +3 B2O3 C +2 N P Cl Nome tradizionale Nome IUPAC anidride borica triossido di diboro CO ossido di carbonio monossido di carbonio +4 CO2 anidride carbonica diossido di carbonio +1 N2O protossido di azoto ossido di diazoto +2 NO ossido di azoto monossido di azoto +3 N2O3 anidride nitrosa triossido di diazoto +4 NO2 diossido di azoto diossido di azoto +4 N2O4 ipoazotide tetrossido di azoto +5 N2O5 anidride nitrica pentossido di diazoto +3 P2O3 anidride fosforosa triossido di fosforo +5 P2O5 anidride fosforica pentossido di difosforo +1 Cl2O anidride ipoclorosa monossido di dicloro +3 Cl2O3 anidride clorosa triossido di dicloro +5 Cl2O5 anidride clorica pentossido di dicloro +7 Cl2O7 anidride perclorica eptossido di dicloro IDRURI IDRURI IONICI = METALLO + IDROGENO NaH idruro di sodio CaH2 idruro di calcio IDRURI COVALENTI = NON-METALLO + IDROGENO (alcuni sono noti con i nomi comuni) NH3 triidruro di azoto = ammoniaca PH3 triidruro di fosforo= fosfina CH4 tetraidruro di azoto = metano IDRACIDI = IDROGENO + (alcuni) NON-METALLI Nome IUPAC del composto PURO HF HCl HBr HI H2S HCN fluoruro di idrogeno Nome del composto IN SOLUZIONE acido fluoridrico cloruro di idrogeno acido cloridrico bromuro di idrogeno acido bromidrico Residuo acido F ione fluoruro Cl ione cloruro Br ione bromuro ioduro d’idrogeno acido iodidrico I solfuro di diidrogeno cianuro d’idrogeno acido solfidrico HS S2 CN acido cianidrico Nome del residuo acido ione ioduro ione idrogenosolfuro ione solfuro ione cianuro SALI BINARI = METALLO – NON METALLO Formula generale -n +m MnXm dove +n e +m sono rispettivamente i n.o. del metallo e del non-metallo COMPOSTI TERNARI I principali composti ternari sono: gli idrossidi gli ossiacidi i sali degli ossiacidi IDROSSIDI = OSSIDO + H2O Formula generale +m M(OH)m Gli idrossidi sono composti sostanzialmente ionici costituiti da un catione metallico e dallo ione idrossido OH–. Si prendono tanti ioni OH– quanto vale il n.o. del metallo. Nella formula il metallo si trova a sinistra e il gruppo ossidrile a destra. Formula NaOH (Na+OH) Mg(OH)2 (Mg2+ 2OH) Al(OH)3 (Al 3+ 3OH) Fe(OH)2 (Fe2+ 2OH) Formule e nomi di idrossidi comuni tradizionale Stock Idrossido di sodio idrossido di sodio idrossido di magnesio idrossido di magnesio diidrossido di magnesio idrossido di alluminio idrossido di alluminio triidrossido di alluminio idrossido ferroso idrossido di ferro(II) diidrossido di ferro idrossido di ferro(III) idrossido di rame(I) triidrossido di ferro idrossido di rame Fe(OH)3 (Mg2+ 2OH) idrossido ferrico CuOH (Cu+OH) idrossido rameoso Cu(OH)2 (Cu2+ 2OH) Idrossido di sodio IUPAC idrossido rameiico idrossido di rame(II) OSSIACIDI= OSSIDO ACIDO o ANIDRIDE + H2O (a volte più di una molecola) Gli acidi ossigenati (ossiacidi) sono composti ternari covalenti formati da idrogeno, ossigeno e da un elemento non metallico. Hanno formula generale HnXOm seguendo l’ordine di elettronegatività crescente da sinistra a destra. Nella nomenclatura tradizionale, la più utilizzata, si utilizza la desinenza -oso per i numeri di ossidazione minori la desinenza -ico per i numeri di ossidazione maggiori Qualora tali desinenze non siano sufficienti, si fa ricorso ai prefissi ipo(per indicare il numero di ossidazione più basso) e per- (per indicare quello più alto). Come esempio si vedano gli acidi ossigenati del cloro scritti nella tabella precedente. Nella tabella seguente è riportata anche al nomenclatura IUPAC secondo le recenti raccomandazioni del 2010. formula n.o. chimica non-met H2CO3 HNO2 HNO3 H3PO3 H3PO4 H2SO3 H2SO4 HClO HClO2 HClO3 HClO4 H2CrO4 H2MnO4 HMnO4 +4 +3 +5 +3 +5 +4 +6 +1 +3 +5 +7 +6 +6 +7 nomenclatura tradizionale acido carbonico ac. nitroso ac. nitrico ac. (orto)fosforoso ac. (orto)fosforico ac. solforoso ac. solforico ac. ipocloroso ac. cloroso ac. clorico ac. perclorico ac. cromico ac. manganico ac. permanganico Raccomandazione IUPAC 2010 diidrogeno triossocarbonato idrogeno diossonitrato idrogeno triossonitrato triidrogeno triossofosfato triidrogeno tetraossofosfato diidrogeno triossosolfato diidrogeno tetraossosolfato idrogeno monossoclorato idrogeno diossoclorato idrogeno triossoclorato idrogeno tetraossoclorato diidrogeno tetraossicromato diidrogeno tetraossimanganato idrogeno tetraossimanganato SALI degli OSSIACIDI Sono sempre ionici e costituiti da cationi quasi sempre metallici, mentre gli anioni derivano dalle molecole di acido dopo sottrazione di uno o più H+. Na2SO4 solfato di sodio ioni presenti nel reticolo cristallino: SO42- e Na+ Per scrivere la formula dei sali neutri degli ossiacidi di cui è dato il nome tradizionale seguire le seguenti regole: scrivi il simbolo dello ione metallico ( o dello ione ammonio eventualmente, se il sale è un sale di ammonio) con il suo N.O.; scrivi la formula dell’ossiacido: se non la ricordi, ricava la sua formula dalla reazione anidride (ossido acido)+ acqua; togli gli atomi di H dalla formula dell’acido per ottenere il residuo acido (nella tabella sono elencati i residui acidi più comuni per formare sali neutri) che avrà tante cariche negative quanti sono gli H+ tolti; accoppia catione e anione con il metodo della carica incrociata ESEMPIO 1 – Scrivi la formula del carbonato di calcio 1. Scrivi il simbolo dello ione calcio: Ca2+ 2. Poiché il sale ha desinenza – ato esso deriva dall’acido carbonico 3. Ricava la formula dell’acido carbonico (se non la ricordi) in cui C ha n.o. = +4: anidride carbonica + H2O acido carbonico CO2 + H2O H2CO3 4. poiché il sale è neutro, togli gli ioni H+ e trova il residuo acido (che avrà tante cariche negative quanti sono gli ioni H+ tolti) CO32 5. accoppia catione e anione con il metodo della carica incrociata in modo che il numero complessivo di cariche positive e negative si uguale: per bilanciare le due cariche positive devi prendere 1 ione CO32 Ca2+/ CO32 Formula del sale: CaCO3 ESEMPIO 2 – Scrivi la formula del solfito di alluminio 1. Scrivi il simbolo dello ione alluminio: Al3+ 2. Poiché il sale ha desinenza – ito esso deriva dall’acido solforoso 3. Ricava la formula dell’acido solforoso (se non la ricordi) in cui S ha n.o. = +4: 4. anidride solforosa + H2O acido solforoso SO2 + H2O H2SO3 4. poiché il sale è neutro, togli gli ioni H+ e trova il residuo acido (che avrà tante cariche negative quanti sono gli ioni H+ tolti) SO32 5. accoppia catione e anione con il metodo della carica incrociata in modo che il numero complessivo di cariche positive e negative si uguale: per bilanciare le due cariche positive devi prendere 1 ione CO32 Al3+/ SO32 Formula del sale: Al2 (SO3)3
Scaricare