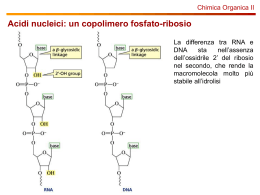
FOTOMETRIA I valori di T sono convertiti in E o assorbanza (A) Per risalire dai valori di E alla concentrazione della soluzione in esame : Noto il coefficiente di estinsione molare Noto il cammino ottico Si allestisce una CURVA STANDARD di una soluzione a concentrazione nota Assorbanza 280nm Conoscendo il valore dell’assorbanza del campione si può Interpolare graficamente il valore della sua concentrazione 1,25 1,00 . 0,75 0,50 0,25 0’5 1,0 1,5 2,0 2,5 Concentrazione albumina mg Lo studio delle radiazioni assorbite da una sostanza (SPETTRO DI ASSORBIMENTO) può essere utilizza A SCOPO ANALITICO • Il colore delle sostanze è dovuto al fatto che esse assorbono specifiche radiazioni e ne lasciano passare o riflettono altre • SOSTANZA COLORATA: assorbe solo alcune radiazioni che costituiscono la luce bianca e lascia passare tutte le altre • SOSTANZA INCOLORE: non assorbe nessuna radiazione che costituisce la luce bianca ma assorbe radiazioni a lunghezza d’onda comprese nell’ultravioletto o nell’infrarosso Il massimo dell’assorbimento dipende dai gruppi funzionali presenti nelle molecole ed identifica LO SPETTRO DI ASSORBIMENTO ASSORBIMENTO DELLA LUCE ULTRAVIOLETTA DA PARTE DEGLI Aa AROMATICI Il triptofano e la tirosina Assorbono la luce ultravioletta, ciò spiega perché la maggior parte delle proteine hanno un caratteristico assorbimento della luce ad una lunghezza d’onda di 280nm Spettri di di assorbimento della luce da parte dei comuni nucleotidi, gli spettri sono quasi identici, per effettuare misure di assorbimento viene usata la luce a 260 nm I citocromi possono essere distinti in base agli spettri diassorbimento della luce LUNGHEZZA D’ONDA Applicazioni • METODI DIRETTI • Sfruttano le proprietà ottiche delle molecole analizzate PROTEINE = 280 nm • • • • • ACIDI NUCLEICI = 260 nm METODI INDIRETTI Amminoacidi = ninidrina (570nm) Proteine = biureto (540) Zuccheri = proprietà riducenti Enzimi = substrati o prodotti Metodi enzimatici indiretti • Reazioni enzimatiche accoppiate in cui il prodotto viene utilizzato come substrato in un’altra reazione nella quale è coinvolta una sostanza cromofora Glucosio ossidasi • Glucosio + O2 + H2 O = ac. Gluconico + H2 O2 perossidasi • H2 O2 + sost. Ridotta (incolore) • Glucosio + ATP = • = sost. colorata Glucosio-6-fosfato + ADP Glucosio-6-fosfato + NADP = 6-fosfogluconato + NADPH La riduzione dell’anello nicotinamidico produce una nuova banda di assorbimento della luce con un massimo a 340 nm ESTRAZIONE ACIDI NUCLEICI Isolamento di DNA o RNA da tessuto o da cellule Eucariotiche o procariotiche E’ possibile estrarre acidi nucleici partendo dai Compartimenti cellulari in cui essi sono presenti Varie fonti: Tessuti animali Tessuti vegetali Eucarioti o procarioti Virus Mitocondri o cloroplasti Liquidi biologici ESTRAZIONE ACIDI NUCLEICI • è il primo passo nelle applicazioni di biologia molecolare. • Esiste una serie di metodi, tra i quali la scelta si effettua sulla base del: Materiale di partenza (organo intero, tessuto, coltura cellulare, sangue, liquido biologico) Tipo di acido nucleico desiderato (ssDNA, dsDNA, RNA) Applicazione post-estrazione prevista (PCR, sequencing, cloning, restrizione enzimatica). La qualità dell’acido nucleico estratto (quantità, purezza) ROTTURA DELLE CELLULE Rompere la parete o la membrana cellulare Separare gli acidi nucleici da altri componenti cellulari Metodi meccanici: omogeneizzatore Vibrazioni ultrasoniche Metodi non meccanici: Congelamento/scongelamento Shock osmotico Agenti litici OMOGENIZZAZIONE/FRANTUMAZIONE Per ottenere un “omogenato” Molto usati sono i METODI MECCANICI MEZZO PER L’OMOGENIZZAZIONE • Soluzione ISOTONICA • A composizione salina bilanciata • Soluzione TAMPONATA • DEVE ASSICURARE L’INTEGRITA’ FISICA E METABOLICA DEGLI ORGANULI • Mg2+ aiuta a conservare l’integrità di nuclei e ribosomi • EDTA agente chelante inattivatori di proteasi • DTT – b-ME agenti riducenti METODI NON MECCANICI Digestione enzimatica (es. lisozima per la parete batterica) Detergenti o solventi organici (SDS, Triton, acetone, toluene) Shock osmotico (soluzioni ipotoniche) Congelamento/scongelamento Metodi non meccanici • 1- Lisi blanda (batteri) permette la • • • • • formazione di piccoli pori nella membrana utilizando Triton e lisozima, in questo modo è possibile isolare solo DNA plasmidico mentre il DNA cromosomiale rimane attaccato alla membrana interna; 2- Lisi spinta in cui le membrane vengono completamente frantumate utilizzando detergenti anionici quali SDS. Con la lisi spinta si isolano acidi nucleici totali (DNA cromosomiale, mRNA, rRNA,tRNA ecc) . ESTRAZIONE DI ACIDI NUCLEICI • Tutte le metodiche per l’estrazione di acidi nucleici • utilizzano 3 fasi: • 1. Una lisi cellulare (spesso combinata con • l’inattivazione delle nucleasi cellulari) • 2. La deproteinizzazione del campione lisato • 3. La precipitazione dell’acido nucleico CENTRIFUGAZIONE • Principio della separazione mediante centrifugazione Particelle in sospensione con massa e/o densità diverse Sedimentano sul fondo di una provetta a velocità diverse Deproteinizzazione Dopo la rottura della membrana plasmatica si otterà una miscela complessa costituita da varie componenti cellulari come: DNA, RNA, lipidi, mono e polisaccaridi, proteine e sali • Rimozione delle proteine dal lisato cellulare è una tappa importante perché: • tra le proteine sono presenti enzimi capaci di degradare gli acidi nucleici, • presenza di proteine capaci di legarsi agli acidi nucleici impedendone la funzione e/o la purificazione. ALLONTANAMENTO PROTEINE • Sistemi di deproteinizzazione • Cloroformio-alcool isoamilico Le proteine formano un gel all’interfase cloroformioacqua, mentre gli acidi nucleici rimangono in soluzione • Sodio dodecil Solfato SDS • Detergente anionico che si lega alle proteine alterandone la struttura secondaria • Enzimi proteolitici • PROTEINASI K: una endopeptidasi aspecifica molto attiva Allontanamento proteine TRATTAMENTO con FENOLO Una o piu’ estrazioni fenoliche elimina residui proteici e lipidici (il fenolo si lega al core delle proteine denaturandole ed è un solvente dei lipidi) Fenolo a pH basico (inibisce la DNAsi) per estrazione di DNA Fenolo a pH acido (inibisce le ribonucleasi) per RNA Uguale volume di fenolo al sopranatante che diventa lattescente dopo agitazione, quindi si centrifuga cloruro ASSORBIMENTO DELLA LUCE ULTRAVIOLETTA DA PARTE DEGLI Aa AROMATICI Il triptofano e la tirosina Assorbono la luce ultravioletta, ciò spiega perché la maggior parte delle proteine hanno un caratteristico assorbimento della luce ad una lunghezza d’onda di 280nm Spettri di di assorbimento della luce da parte dei comuni nucleotidi, gli spettri sono quasi identici, per effettuare misure di assorbimento viene usata la luce a 260 nm COME DETERMINARE LA CONCENTRAZIONE DEL ACIDO NUCLEICO ESTRATTO • la purezza e la concentrazione del acido nucleico estratto mediante letture spettrofotometriche a 260nm • 1 OD = 50 mg/ml di DNA • 1 OD = 40 mg/ml di RNA • Il rapporto tra le OD misurate a 260 nm e 280 nm fornisce una indicazione della purezza dell’acido nucleico esaminato • Una soluzione di DNA o RNA puro dovrebbe avere un • rapporto A260/A280 di 1,8 e 2,0 rispettivamente. Separazione di DNA plasmidico da quello del cromosoma batterico Mediante centrifugazione all’equilibrio in gradiente di Cloruro di Cesio DOSAGGIO ACIDI NUCLEICI
Scaricare