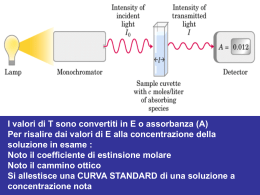
Lezione 5-6 martedì 5 aprile 2011 corso Biotec vettori biologici II Aula 6A ORE 14.00-16.00 scelta di un vettore come abbiamo detto dipende dall’uso o dall’applicazione che ne vogliamo fare I punti salienti dell’uso: isolare dei brevi segmenti moltiplicarli studiarne la sequenza nucleotidica trasferirli nel genoma di altre cellule controllandone l'incorporazione e l'espressione ricapitolazione clonaggio classico 1) estrazione del DNA dalle cellule di un organismo 2) digestione con enzimi di restrizione (adesso amplificazione per PCR) 3) inserimento in un vettore di clonaggio, in grado di replicarsi autonomamente nella cellula ospite 4) trasferimento del costrutto di DNA nella cellula ospite 5) selezione dei cloni cellulari contenenti il DNA nuovo, capaci quindi di sintetizzare il prodotto e/o la funzione, codificati dal nuovo gene trasferito. 6) Se si vuole far esprimere la proteina codificata dal costrutto si impiegano vettori di espressione concetto di vettore già sviscerato: per vettore si considera la struttura che veicola un frammento di DNA per la serie di usi che è molto ampia. solo da rammentare che un plasmide può fungere da vettore, ma un vettore non è necessariamente un plasmide considerando sistemi eucariotici Il materiale necessario di partenza è dato dagli acidi nucleici e dai metodi di estrazione purificazione di acidi nucleici Il primo passo di qualunque tecnica di biologia molecolare consiste nell’isolare e purificare gli acidi nucleici. I protocolli sperimentali variano a seconda del materiale di partenza del tipo di acido nucleico che si vuole separare dal tipo di esperimento che si deve effettuare, ecc. In tutti i casi dovremo : 1. Rompere la parete e/o la membrana cellulare 2. Separare gli acidi nucleici dagli altri componenti cellulari 3. Separare gli acidi nucleici tra loro (per es. il DNA dal RNA) sorgenti o fonti diverse di A.N. qualunque tipo di struttura biologica cellulare contiene acidi nucleici diversi tipi di utilizzazione: clonaggio di frammenti genomici DNA genomico per PCR con frammenti lunghi oltre le 10 kb DNA genomico per PCR con frammenti corti per analisi di SNPs e VNTR (var. numb. tand. rep.) secondo la lunghezza dei frammenti di Ac. Nucl. da ottenere si usano accorgimenti diversi da cellule in coltura - cellule batteriche o eucariotiche in coltura in sospensione: separazione dal mezzo di coltura mediante centrifugazione - campione da cellule aderenti come fibroblasti si devono tripsinizzare - campione di tessuto (fresco o congelato a –20°C o a -195°C in azoto liquido per evitare la degradazione da parte di enzimi presenti nelle cellule, che vengono così inattivati): frazionamento ed omogenizzazione del tessuto - lisi delle cellule, affinché queste rilascino i loro componenti cellulari. come fare la lisi Le membrane delle cellule animali sono solubilizzate con detergenti quali SDS o altri solventi blandi per lisare le membrane, quando avviene la lisi si liberano anche tutte le nucleasi che devono essere inattivate (digeriscono DNA e RNA) Per un campione di tessuto è necessaria un’iniziale omogenizzazione che è realizzata mediante: • Metodi meccanici: omogeneizzatore a pestello (potter). • Vibrazioni ultrasoniche • Congelamento/scongelamento Una centrifugazione permette di eliminare i detriti cellulari dal contenuto cellulare rilasciato nel mezzo, che è costituito da varie componenti cellulari come DNA, RNA, lipidi, mono e polisaccaridi, proteine e sali. separare gli A.N. dal resto Oltre alle membrane ed al resto delle strutture particellari centrifugabili ci sono le parti in soluzione del citosol e del nucleo Oltre ad eliminare le proteine può essere necessario eliminare alternativamente DNA o RNA indesiderati Per le preparazioni di DNA, per eliminare l’RNA si usa la ribonucleasi A (RNasi); Per le preparazioni di RNA, per eliminare contaminazioni di DNA invece è utilizzata la desossiribonucleasi (Dnasi). Anche queste attività enzimatiche vanno poi eliminate inattivando con calore o con fenolo-cloroformio arricchire e rimuovere La rimozione delle proteine dal lisato cellulare è particolarmente importante sia perché •tra le proteine sono presenti enzimi capaci di degradare gli acidi nucleici, •per la presenza di proteine capaci di legarsi agli acidi nucleici impedendone la funzione e/o la purificazione. •I DNA possono essere metilati e gli enzimi di restrizione potrebbero digerire male, si usano ceppi batterici “met “ mutanti oppure per studiare lo stato di metilazione di cellule eucariotiche si usano enzimi isoschizzomeri che digeriscono lo stesso sito ma solo se non è metilato e un altro che digerisce comunque il sito met +/- purificazione le purificazioni non sono mai assolute, a seconda del grado di purificazione si può parlare di arricchimento, separazione Le proteine sono rimosse dalla preparazione mediante varie tecniche da usare in combinazione, o l’una in alternativa all’altra. - uso di enzimi proteolitici, come pronasi e proteinasi K. - la Pronasi: miscela di almeno 4 enzimi proteolitici di cui due endopeptidasi (serina- e metallo-proteasi) e due esopeptidasi (carbossi e ammino-petidasi). - la Proteinasi K, così detta per il suo potere di idrolizzare la cheratina, è una endopeptidasi di origine fungina. Gli enzimi proteolitici andranno poi eliminati di solito con fenolo cloroformio che lascia in fase acquosa gli acidi nucleici. fenolo cloroformio (alcohol isoamilico) Estrazione con fenolo [miscela di fenolo: cloroformio: alcool isoamilico (25:24:1) pH 7.88.0, con pH acido si degrada il DNA e si estrae RNA] E’ la tecnica comunemente utilizzata per rimuovere le proteine dagli acidi nucleici, e consiste nel trattare la soluzione acquosa contenente gli acidi nucleici con una miscela fenolo/cloroformio, immiscibile (quasi) in acqua. Tale procedura può essere usata da sola o dopo la digestione con enzimi proteolitici, al fine di rimuoverli. caratteristiche del fenolo E’ un forte denaturante delle proteine che le lega mediante legami H, alterandone la struttura. Le proteine denaturate, con i gruppi idrofobici esposti, diventano solubili nella fase fenolica o precipitano all’interfase fenolo-acqua. C6H5OH E’ un solvente dei lipidi e delle molecole di RNA contenenti lunghi tratti di poli(A). Cloroformio - completa la denaturazione delle proteine - rimuove i lipidi - grazie alla sua elevata densità facilita la separazione della fase acquosa (contenente il DNA deproteinizzato) da quella organica (fenolica) stabilizzando l’interfaccia tra le due fasi. Alcol isoamilico: stabilizzante riduce la schiuma che si forma nel corso dell’estrazione. Fenolo instabile Si ossida e si aggiungono degli antiossidanti per stabilizzarlo, è tossico, è stato usato anche come disinfettante, brucia la pelle, si neutralizza col sapone o con gli alcali, normalmente a pH 7.8 Dopo centrifugazione si ottengono tre fasi: 1) superiore, che contiene la soluzione di acidi nucleici; 2) interfase, di proteine denaturate; 3) inferiore, fase fenolica contenente lipidi e proteine Fase acquosa (DNA e RNA) ricche di aminoacidi idrofobici. Interfase (proteine denaturate) Fase fenolica (proteine solubili) precipitazione di A.N. Uso dell’ isopropanolo per la precipitazione vantaggio: uso di volumi inferiori (0,7 volumi per 5’ a Temp Amb) svantaggio: meno volatile dell’etanolo e quindi di più difficile rimozione Lavaggio del pellet Dopo centrifugazione, il pellet di acido nucleico va “lavato” in etanolo 70% con H2O e ricentrifugato. Tale lavaggio rimuove i sali precipitati e isopropanolo. Risospensione del DNA Il pellet dopo essiccazione è risospeso in adeguato tampone a bassa forza ionica, in genere TE (Tris-EDTA) a pH 7.6-8.0, alla concentrazione desiderata condizioni del DNA Separazione di acidi nucleici tra di loro Separazione del DNA plasmidico da quello genomico Si sfruttano le differenze chimico-fisiche tra questi due tipi di macromolecole plasmidi (3-8 kb) si trovano prevalentemente in forma circolare super-avvolta (supercoiled) in forma circolare rilassata in forma lineare nick Plasmide superavvolto (supercoiled) Plasmide circolare rilassato Plasmide linearizzato DNA cromosomale è presente sotto forma di grossi frammenti lineari (intorno a 25 Kpb e oltre) DNA plasmidico e nucleare Per separare il DNA plasmidico da quello cromosomale a) si innalza del pH del mezzo fino ad un valore di circa 12 o l’ebollizione della soluzione per pochi minuti b) si riporta la soluzione in condizioni normali (pH neutro o temperatura ambiente) i plasmidi saranno in grado di rinaturarsi velocemente riassumendo una forma circolare covalentemente chiusa i frammenti cromosomali lineari non saranno in grado di rinaturare correttamente e si aggregano dando luogo ad una massa reticolata insolubile che viene eliminata per centrifugazione, lasciando il DNA plasmidico in soluzione. maggior purezza Alternativamente, la purificazione può essere effettuata mediante: - Ultracentrifugazione in gradiente all’equilibrio di densità di cloruro di cesio-bromuro di etidio Il bromuro d’etidio, si intercala tra le basi del DNA, determinando un parziale svolgimento della doppia elica. DNA circolare chiuso e superavvolto intercala una certa quantità di etidio limitata. In questo caso la molecola assume una forma più compatta, con il conseguente incremento della densità di galleggiamento. Molecole di DNA circolari rilassate e lineari sono invece in grado di intercalare una maggiore quantità di etidio che ne provoca un maggior srotolamento. Di conseguenza il DNA lineare sarà meno denso. Le due differenti forme di DNA possono essere separate mediante ultracentrifugazione in gradiente di densità di CsCl/EtBr, una tecnica di separazione che sfrutta le differenze di densità delle diverse molecole. Questo DNA è altamente puro e utile per trasfezioni. vari metodi e kit di estrazione i kit piu’ utilizzati si basano sull’utilizzo di: matrici silicee: gli acidi nucleici si legano alle particelle della matrice differenti tipi di acido nucleico adsorbono più o meno bene alla matrice di silice, a seconda della forza ionica e del pH della soluzione dopo avere lavato la matrice silicea, gli acidi nucleici sono eluiti con un tampone a bassa concentrazione salina o con acqua e sono pronti per le successive reazioni
Scarica