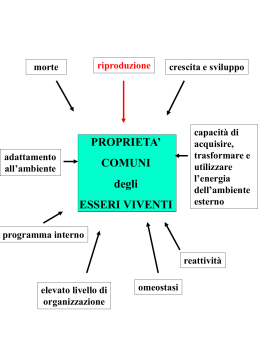
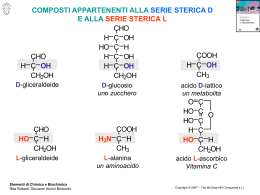
Il fenomeno dell’attività ottica dei composti chirali Per i composti inorganici è spesso sufficiente usare la formula bruta per indicare senza equivoci di quale composto si parla. Per i composti organici è indispensabile far ricorso alla formula di struttura, meglio ancora se in forma tridimensionale: Formula di struttura del metano Formula tridimensionale del metano Infatti con la sola formula bruta non è possibile distinguere tra composti costituiti dagli stessi elementi e che hanno lo stesso numero di atomi per ogni elemento, ma disposti nello spazio in modo diverso (isomeria). Il numero dei possibili isomeri aumenta notevolmente all’aumentare del numero di atomi di carbonio presenti nella molecola. Due molecole presentano stereoisomeria quando, essendo identiche per ogni altro particolare strutturale, si differenziano per l’orientamento nello spazio dei rispettivi atomi o gruppi atomici costituenti. Sono diastereoisomeri due stereoisomeri che non sono enantiomeri, hanno cioè un altro tipo di stereoisomeri ma non sono uno l’immagine dell’altro. Gli isomeri cis-trans sono diastereoisomeri: cis-dibromoetilene e trans-dibromoetilene Un altro tipo di stereoisomeria è l’isomeria ottica. Si presenta quando l’atomo di carbonio ha quattro sostituenti diversi, quindi non è sovrapponibile alla propria immagine speculare, né per spostamento, né per rotazione. Si dice allora che la molecola è chirale (dal greco χειρ, “mano”) e l’atomo di carbonio è asimmetrico (nelle formule viene spesso segnato con un asterisco). Per la possibilità di esistenza di chiralità di una determinata molecola è indispensabile che questa non presenti una piano di simmetria: solo le molecole asimmetriche partecipano al fenomeno. I due isomeri ottici sono detti enantiomeri o antipodi ottici. Sono molecole chirali. Gli enantiomeri fanno ruotare il piano di vibrazione della luce polarizzata in direzioni opposte, per il resto le loro proprietà chimiche e fisiche coincidono. Si dice che sono otticamente attivi. La miscela equimolecolare delle due forme si chiama racemato ed è otticamente inattiva. L’attività ottica di una molecola significa che il piano della luce ruota di un angolo caratteristico per la molecola. Se si guarda nella direzione della sorgente di luce, verrà definita destrogira [e si indica con (+)] una rotazione del piano di polarizzazione in senso orario. La rotazione contraria si chiama levogira e si indica con (-). I due angoli di rotazione hanno identica grandezza, solo il senso di rotazione è diverso. Le miscele racemiche vengono indicate con (±). Questa proprietà è importantissima in campo biologico, perché estremamente frequente nelle biomolecole. Gli enzimi sono attivi specificatamente su uno dei due enantiomeri e non reagiscono con l’altro. L’impiego di enzimi costituisce uno dei metodi di separazione degli enantiomeri. Inoltre, le biosintesi producono quasi sempre solo una delle due forme otticamente attive, mentre le preparazioni in laboratorio generano una miscela racemica, in quanto le probabilità che si formi (per sintesi) uno o l’altro degli enantiomeri sono identiche. Per rappresentare graficamente molecole complesse con più di un atomo di carbonio asimmetrico (soprattutto i carboidrati) si usa il sistema proposto da Fischer nel 1891. Nelle proiezioni di Fischer: la catena più lunga viene disposta verticalmente, con gli atomi di carbonio asimmetrici che giacciono nel piano del foglio; l’atomo di C con il maggior grado di ossidazione viene scritto in alto; e linee orizzontali raffigurano legami diretti all’insù rispetto allo stesso piano, quelle verticali sono riferite a legami che si dirigono al di sotto del piano di scrittura; la raffigurazione può essere ruotata di 180° nel piano del foglio ma non di 90°.
Scaricare