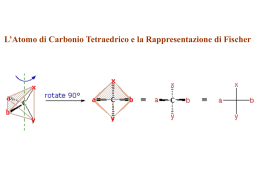
UD 21 · Le multiformi proprietà del carbonio Analogamente, sono isomeri di posizione, rispondenti alla formula C5H10: ClHC — — CHCl la loro configurazione spaziale deve necessariamente essere diversa: esse costituiscono perciò una coppia di isomeri geometrici, che si possono rappresentare così: H (1) H H H H H—C—C—C—C—C—H H H H H H H H Cl H—C—C—C—C—C—H H 2-pentene H H a) Modello tridimensionale di dicloroetene cis. Non così accade nelle molecole nelle quali è presente un legame doppio tra carbonio e carbonio, C — — C (σ + π), come nel caso della molecola del 1,2-dicloroetene (C2H2Cl2): ClHC — — CHCl Cl H isomero trans- Sperimentalmente si può dimostrare che: l’isomeria geometrica si verifica solo nel caso in cui i due atomi di carbonio impegnati nel doppio legame siano entrambi legati ad atomi o a gruppi atomici diversi. Modello tridimensionale di dicloroetene trans. Indicando genericamente con A e B gli atomi o i gruppi atomici legati agli atomi di carbonio si ha: Isomeria geometrica (isomeria cis-trans) esiste la possibilità di libera rotazione dei due gruppi CH2Cl intorno al legame che li unisce, visto che esso è un legame σ, semplice e molto robusto. Una struttura di questo tipo può essere paragonata a un’asticciola che reca alle sue estremità due girandole, la cui rotazione è libera e non danneggia in alcun modo l’insieme: non esistono isomeri geometrici. b) Indicando: a) come isomero cis- quello in cui i due atomi di cloro (Cl) risultano posti dalla stessa parte rispetto al piano ideale in cui è posto il doppio legame; b) come isomero trans- quello in cui i due atomi di cloro risultano situati da parti opposte rispetto allo stesso piano. Si definiscono stereoisomeri quei particolari isomeri nei quali gli atomi componenti sono legati tra loro nello stesso modo, ma differiscono per la loro disposizione spaziale. – Nelle molecole tenute insieme da soli legami semplici (σ) come la seguente: ClH2C — CH2Cl H C—C isomero cis- 21.5.3 La stereoisomeria L’isomeria geometrica, ovvero isomeria cis-trans, si riscontra quando nella molecola esistono impedimenti alla libera rotazione di gruppi atomici in essa presenti. Se ne trovano esempi sia nelle molecole contenenti doppi legami C — — C, sia in quelle con struttura ciclica. Cl H H 1-pentene Si possono distinguere due tipi diversi di stereoisomeria: 1 – isomeria geometrica (isomeria cis-trans); 2 – isomeria ottica o enantiomeria. Cl C—C H che, a parità di catena, differiscono per la posizione in essa del doppio legame. A B A B A B A B B A A A forma cis forma trans B A A A strutture equivalenti isomeri geometrici non isomeri – Nelle molecole con struttura ciclica, l’impedimento alla libera rotazione intorno ai legami C — C è rappresentato dalla rigidità del piano molecolare. Un esempio è fornito dal 1,2 diclorocicloesano, che può esistere nelle due forme isomere cis e trans: H2C H2C In questo caso, infatti, la libera rotazione dei due gruppi CHCl intorno al doppio legame è impedita dalla presenza del legame π che irrigidisce la struttura. Ricorrendo all’esempio precedente, la molecola può infatti essere paragonata a due girandole unite in questo caso da 2 asticciole che ne bloccano il movimento. Poiché esistono due molecole reali aventi proprietà fisico-chimiche diverse, che però rispondono entrambe alla formula 562 MODULO MODULO 5 La chimica del carbonio H2C CH2 H H CH2 C C Cl Cl isomero cis- H2C Cl H CH2 C C H Cl isomero trans- isomeri geometrici 563 CH2 5
Scaricare