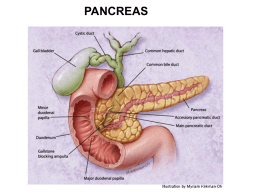
LA PANCREATITE NEL CANE Giovanni Aste, Andrea Boari Introduzione La pancreatite è l’infiammazione del parenchima pancreatico, solitamente sterile, e rappresenta la patologia del pancreas esocrino più comune nel cane e nel gatto. Similmente a quanto avviene in medicina umana, la pancreatite può essere classificata in acuta e cronica esclusivamente in base alle caratteristiche isto-patologiche1. Nella pancreatite acuta l’infiammazione del parenchima pancreatico non viene associata ad alterazioni istologiche permanenti, al contrario nella pancreatite cronica si riscontrano alterazioni istologiche strutturali, permanenti, del parenchima quali atrofia e fibrosi. In entrambe le forme si può riscontrare un infiltrato neutrofilico o linfo-plasmacitario e si può assistere allo sviluppo di complicazioni locali (necrosi del parenchima, versamento peripancreatico, presenza di pseudo-cisti, ascessi pancreatici, steatonecrosi peripancreatica) o sistemiche (SIRS, Systemic Inflammatory Response Syndrome; DIC, Disseminated Intravascular Coagulation). La gravità della pancreatite e la prognosi sono dipendenti dallo sviluppo di queste complicazioni, locali e sistemiche. La classificazione in acuta e cronica della pancreatite non ha una rilevante corrispondenza clinica: infatti cani affetti da pancreatite cronica possono presentare un quadro clinico acuto e cani affetti da forme acute possono mostrare episodi ricorrenti associati a lieve sintomatologia. La pancreatite cronica è una condizione irreversibile, caratterizzata da alterazioni strutturali e spesso da lunghi periodi di malattia sub-clinica, silente, dalla progressiva distruzione del parenchima pancreatico e dalla graduale perdita della funzione organica. Si possono riconoscere sintomi gastro-enterici ricorrenti di lieve entità (diarrea, ematochezia) che possono esitare in un aggravamento acuto compatibile con la progressione della patologia. L’insufficienza pancreatica esocrina non è una condizione frequente, ed infatti è necessario l’atrofia di più del 8090% del tessuto pancreatico per evidenziare la caratteristica sintomatologia associata alla maldigestione/malassorbimento dei principi nutritivi. Più complesso il rapporto causa-effetto tra diabete mellito e pancreatite acuta e cronica, descritto da alcuni autori ma ancora non del tutto chiarito 2. La pancreatite acuta può, al contrario della forma cronica, essere una patologia del tutto reversibile una volta identificate e risolte le cause che la sottendono anche se purtroppo nella maggior parte dei casi si tratta di forme idiopatiche, le cui cause sono difficilmente identificabili. La diagnosi di pancreatite acuta o cronica non riveste particolare importanza riguardo al trattamento immediato rivolto alla risoluzione della sintomatologia e il ristabilirsi delle condizioni cliniche, ma è fondamentale nella formulazione delle ipotesi diagnostiche mirate all’identificazione delle possibili cause, dei meccanismi ezio-patogenetici sottesi nonché alla formulazione di una corretta prognosi. Eziopatogenesi La reale prevalenza della pancreatite ad oggi rimane poco conosciuta. La difficoltà maggiore comunemente riscontrata nello sviluppo dell’indagini epidemiologiche risiede nella necessità di una diagnosi istologica, unica valutazione che presenta sensibilità e specificità caratteristiche di strumento diagnostico di riferimento. La pancreatite nel cane, comunque, è generalmente ritenuta piuttosto comune, tale da essere considerata nella diagnosi differenziale fra le patologie responsabili di vomito con e senza la presenza di addome acuto. In base ai dati pubblicati non esiste una vera e propria predisposizione genetica di razza sebbene le razze di piccola taglia quali i terrier, i barbone nano e altre razze quali Schnauzer nano, Cavalier King Charles Spaniel, Collies, Boxer, Cocker Spaniel, York Shire Terrier sono maggiormente rappresentate. La maggior parte di questi studi epidemiologici sono retrospettivi e si basano sulla presenza di una sintomatologia clinica riconoscibile e sulla conferma isto-patologica ( fig. 1 e 2 ) di pancreatite spesso raggiunta dopo la morte del paziente e sono inevitabilmente influenzati dalla popolazione canina di riferimento alla struttura clinica veterinaria. Le esatte cause alla base dello sviluppo della pancreatite nel cane rimangono ad oggi ancora da accertare. E’ opinione comune che all’origine del processo patologico vi sia l’attivazione precoce ed inappropriata dello zimogeno tripsinogeno a tripsina e di altre proteasi pancreatiche all’interno degli acini pancreatici con sopraffazione delle difese locali tissutali (PSTI, Pancreatic Secretory Trypsin Inhibitor) e delle molecole antiproteasiche (α1 antitripsina, α2 macroglobuline) in circolo. L’attivazione degli zimogeni avviene proprio all’interno delle cellule degli acini dove causa una falla nella rigorosa segregazione degli zimogeni e delle proteasi (idrolasi) lisosomiali (catepsina B) che porta alla fusione dei lisosomi con i granuli di zimogeno a alla formazione di grossi vacuoli autofagici. Si realizza in tal modo, una “co-localizzazione” di idrolasi lisosomiali e di enzimi pancreatici, che verrebbero così attivati in sede anomala. Questa iniziale attivazione può essere riconducibile a fenomeni stress-ossidativi o ipotensivi che trovano rinforzo nella diminuzione del pH all’interno dell’acino e nella elevata concentrazione di calcio intra-citoplasmatico che insieme alla CCK (colecistochinina) agisce come mediatore intracellulare del rilascio delle proteasi lisosomiali. Ne consegue lo sviluppo di una risposta infiammatoria locale con migrazione di neutrofili direttamente attribuibile all’attivazione della tripsina e chimotripsina e alla conseguente liberazione di ROS (reactive oxygen species) e NO (ossido nitrico)3. Esiste una complessa interrelazione tra infiammazione e la liberazione di particolari citochine come le interleuchine IL-8 responsabili dell’iniziale migrazione neutrofilica e della up-regulation delle ICAM-1 (intercellular adhesion molecule-1) che promuovono l’adesione dei neutrofili alla pareti endoteliali. I fattori che svolgono un ruolo principale nella progressione del processo infiammatorio includono le alterazioni a carico del microcircolo pancreatico, il danno derivante dal rapporto ischemia/riperfusione tissutale, l’evoluzione da apoptosi a necrosi cellulare e la stimolazione e complessa interrelazione tra vari mediatori di infiammazione e vie patogenetiche (complemento, chinina-callicreina, sostanza P, sistema renina-angiotensina). L’attivazione massiva di varie citochine (TNFα, IL-1-2-6, NO, ROS, PAF platelets activating factors) e chemochine (IL-8,MCP1,RANTES/CCL5, Regulated on activation normal T-cells exspressed and activated/ CC chemokine ligand 5) porta allo scatenamento di un fenomeno complesso definito come “cytokines-storm” con amplificazione e perpetuazione della risposta infiammatoria locale, conseguente edema, necrosi del tessuto pancreatico, necrosi del grasso peri-pancreatico e possibile coinvolgimento sistemico con sviluppo di una infiammazione sistemica (SIRS) 3. Le ragioni per cui la tripsina si attiva precocemente all'interno del pancreas nel cane permangono sconosciute a differenza di quanto avviene nell’uomo dove le forme idiopatiche sono inferiori al 10% ed esiste una forte predisposizione genetica ereditaria legata a mutazioni genetiche la maggiore delle quali è a carico del gene del tripsinogeno cationico la cui alterazione della struttura molecolare rende la molecola resistente all’idrolisi dopo l’attivazione intra-pancreatica. Tale tipo di mutazione nell’uomo è sufficiente a provocare pancreatite senza il coinvolgimento di altri fattori predisponenti4. Un recente studio condotto su cani di razza Schnauzer nano non è stato in grado di identificare mutazioni genetiche a carico del gene del tripsinogeno cationico parimenti a quanto riportato nell’uomo, quanto la presenza di alterazioni a carico di un altro gene, l’inibitore secretorio pancreatico della tripsina (SPINK 1)5. Tuttavia le mutazioni di quest’enzima nell’uomo non sono ritenute responsabili dello sviluppo di pancreatite se non in associazione con altri importanti fattori di rischio. Nel Cocker Spaniel, inoltre, è stata documentata una pancreatite cronica con aspetti istologici di colangite distruttiva del tutto simili alla pancreatite cronica autoimmune dell’uomo 6. Numerosi sono i fattori di rischio documentati nel cane (tabella I), tuttavia è difficile stabilire quanti di questi siano effettivi fattori scatenanti come le condizioni che ne determinano l’importanza nello sviluppo della patologia. La dieta è tradizionalmente considerata tra i maggiori fattori predisponenti lo sviluppo di pancreatite nel cane e più precisamente le diete a elevato contenuto in grassi e basso tenore in proteine. Gli “errori” alimentari intesi come ingestione di materiale alimentare inusuale, per composizione o quantità, rivestono per il momento un significato aneddotico, non supportato da evidenze scientifiche 7. Condizioni di iperlipemia e meglio ancora di ipertrigliceridemia sono spesso osservate nei cani affetti da pancreatite e possono essere considerate importanti fattori di rischio nello Schnauzer nano8, mentre ancora rimane non chiaro il loro ruolo nei cani di altre razze. Obesità e lo sviluppo di pancreatite appaiono tradizionalmente connesse per l’elevata incidenza della pancreatite nei soggetti obesi. E’ ragionevole supporre che i soggetti obesi si alimentino con diete poco controllate nella quantità e nella loro composizione in lipidi, calorie, mentre è piuttosto evidente che lo sviluppo di pancreatite segua un decorso più grave in soggetti obesi piuttosto che nei soggetti magri. Ipertrigliceridemia, obesità possono essere condizioni comuni a patologie endocrine quali ipotiroidismo, iperadrenocorticismo e diabete mellito, potenzialmente connesse allo sviluppo di una grave forma di pancreatite2. Inoltre è stata descritta una significativa associazione tra gli stati infiammatori a carattere cronico e la liberazione di adipochine da parte del tessuto adiposo quale fattore coadiuvante lo sviluppo di pancreatite nell’uomo ed in medicina veterinaria. Effettivi ed importanti fattori scatenanti sono considerati gli stati ipotensivi ed di ipoperfusione d’organo, condizioni che spesso si verificano in corso di interventi chirurgici e durante le procedure anestesiologiche in corso di indagini diagnostiche avanzate (TAC, endoscopie, piccoli interventi ambulatoriali), così come secondariamente a grave disidratazione e in corso di shock. Un importante numero di segnalazioni nell’uomo e in medicina veterinaria testimoniano l’elevata incidenza della pancreatite nel post- intervento e ridimensionano il ruolo della pancreatite “traumatica”, dovuta a manualità del chirurgo sull’organo, a favore di un’eziologia ischemica, dovuta al deficit del circolo periferico3,4. Molti sono i farmaci implicati fra i fattori scatenanti la pancreatite nell’uomo, sebbene spesso venga a mancare un significativo legame tra l’utilizzo dei farmaci in questione e lo sviluppo della patologia. Molti di questi farmaci vengono impiegati in medicina veterinaria56 (tabella I) fra questi i corticosteroidi sono stati rimossi dalla lista dei possibili fattori a rischio in quanto ad oggi è poco credibile che l’impiego anche prolungato di cortisonici possa portare allo sviluppo di pancreatite nel cane 2 così come è stato riconsiderato l’impiego degli stessi nella terapia. L’ostruzione sperimentalmente indotta del sistema dei dotti pancreatici comporta atrofia e fibrosi dell’organo, infiammazione e edema del parenchima pancreatico in relazione alla stimolazione della secrezione pancreatica. Nell’uomo varie sono le condizioni che portano ad ostruzione parziale o completa del sistema duttale, calcoli biliari, spasmo dello sfintere, edema del dotto pancreatico o della parete del duodeno, neoplasia e trauma addominale. Scarse sono le segnalazioni in merito nel cane, mentre più evidente è l’associazione tra pancreatite e reflusso del succo duodenale nel sistema dei dotti pancreatici. Il succo pancreatico raggiunge il duodeno attraverso il dotto pancreatico mediante un flusso unidirezionale. Studi sperimentali dimostrano quanto le caratteristiche di unidirezionalità del flusso rappresentino uno dei meccanismi difensivi allo sviluppo di pancreatite nel cane. Il reflusso duodenale è comunque un’evenienza insolita per la competenza strutturale dello sfintere e della porzione della mucosa parietale duodenale corrispondente. Esistono però situazioni dove questi meccanismi di difesa possono perdere di efficacia come ad esempio in tutte quelle condizioni implicanti un aumento della pressione all’interno del lume duodenale, quali la presenza di vomito persistente, situazione conseguenti al verificarsi di traumi chiusi addominali, ad interventi chirurgici coinvolgenti il duodeno prossimale e il pancreas, la presenza di neoplasie o di corpi estranei lineari o di altra natura. Infine nel cane, è stata riconosciuta la presenza di pancreatite come potenziale complicazione in corso di Babesiosi9 ma non è ancora conosciuto il reale ruolo delle malattie infettive nella patogenesi della pancreatite canina. Scarse e poco rilevanti le pubblicazioni riguardo l’identificazione di batteri mediante esame culturale-batteriologico (Pseudomonas aeruginosa, Klebsiella pneumonia) da formazioni ascessuali a carico del tessuto pancreatico nel cane. Di fatto la maggior parte delle formazione ascessuali rinvenute a carico del pancreas nel cane risultano sterili. Nell’uomo lo sviluppo di infezione batteriche in corso di pancreatite rappresenta un complicazione estremamente sfavorevole cui si associa un significativo aumento di mortalità nei pazienti ospedalizzati, tale condizione si rileva raramente nella pratica clinica veterinaria. Segnalamento e anamnesi La pancreatite colpisce cani di qualsiasi età con un’incidenza maggiore nei cani sovrappeso (Body Condition Score, BCS > 6) ed adulti. Come descritto precedentemente non esiste una documentata predisposizione genetica di razza ma in base alle recenti pubblicazioni al riguardo, la patologia viene segnalata con maggior frequenza nelle razze di piccola taglia ed in quelle già descritte precedentemente (York Shire Terrier, Schnauzer nano, Cavalier King Charles Spaniel, Collies, Boxer, Cocker Spaniel). Rivestono particolare interesse anamnestico le informazioni riguardo i trattamenti farmacologici pregressi (es. bromuro di potassio, fenobarbitale nei soggetti epilettici, utilizzo di immunosoppressivi quali azatioprina in soggetti affetti da IBD, antimoniato di N-metilglucosamina nei soggetti affetti da leishmaniosi canina, etc..), l’alimentazione (tipo di dieta, quantità giornaliera ed apporto in calorie, presenza di “errori” alimentari), gli stati patologici compatibili con l’evoluzione della patologia (malattie endocrine, gastro-intestinali infiammatorie acute o croniche, insufficienza renale acuta, disidratazione grave, shock cardio-circolatorio). Segni clinici I segni clinici osservabili in corso di pancreatite variano notevolmente in base alla forma clinica, lieve, moderata o grave. Nelle forme di pancreatite lieve la sintomatologia clinica è spesso silente, sub-clinica o di lieve entità con segni gastroenterici quali vomito, diarrea, ematochezia spesso autolimitanti. I cani con pancreatite moderata-grave possono presentare inappetenza fino all’anoressia (91 % dei casi), vomito (90%), debolezza (79%), dolore addominale (58%), disidratazione (46%) diarrea (38%), che nelle forme più gravi possono accompagnarsi a febbre, sintomi respiratori (tachipnea, dispnea), ittero e shock cardio-circolatorio1. Nell’uomo il segno clinico più evidente di pancreatite è il dolore addominale (circa il 90% dei casi), nel cane la presenza di dolore addominale può essere in gran parte sottostimata in relazione alla difficoltà nel determinarne la presenza e la gravità. L’atteggiamento di preghiera, caratterizzato dalle zampe anteriori e dallo sterno appoggiati sul pavimento e le zampe posteriori in stazione, è compatibile con uno stato di algia addominale di una certa gravità e non è sempre rilevabile nei cani sofferenti di pancreatite (figura 3). Il rilevamento del sintomo dolorifico passa necessariamente dall’esame clinico e dalla palpazione dell’addome. Recentemente sono stati applicati degli indici clinici per la determinazione del dolore e la quantificazione della sua gravità attraverso la valutazione dell’atteggiamento e del comportamento del paziente, il differente grado di reattività alle manualità, la presenza di segni clinici correlabili quali tachicardia, tachipnea, ipertermia mediante l’applicazione di una semplice scala descrittiva da 0 a 410 . L’utilizzo di indici clinici descrittivi nella valutazione del dolore nel paziente affetto da pancreatite permette una classificazione pratica ed efficace in base alla gravità dello stesso (tabella II) e l’impiego tempestivo ed opportuno di piani terapeutici analgesici adeguati alle necessità del paziente. Complessi sono i sistemi multifattoriali messi a punto in medicina umana per la rilevazione delle possibili variabili clinico-patologiche e delle complicazioni organiche insorgenti durante le forme gravi di pancreatite (Ranson, Glasgow, Acute Phisiology and Chronic Health Evaluation – APACHE II). Questi sistemi appaiono effettivamente in grado di descrivere la severità dell’infiammazione, la presenza di necrosi tissutale e l’indirizzo prognostico del trattamento ma necessitano di valutazioni dinamiche e continuative che trovano fondamentale applicazione nelle unità di medicina intensiva altamente specializzate. Nell’uomo, inoltre, sono stati identificati una serie markers associati alla gravità della infiammazione del tessuto pancreatico (interleuchine IL-6, IL-8, IL-18, le fosfolipasi PLA2 2, la proteina C Reattiva CRP, le PMN-elastasi e metallopeptidasi -9, la amiloide - A sierica SAA, il tripsinogeno-2, la pro-calcitoninca e le ICAM -1) fra i quali la valutazione dell’interleuchina IL-6 e delle ICAM-1 trovano una maggiore rilevanza clinica nella determinazione precoce della gravità della pancreatite e della mortalità ad essa legata. In medicina veterinaria da tempo molta è l’attenzione dedicata alla valutazione in circolo delle proteine di fase acuta, della CRP in particolare, nelle patologie infiammatorie acute e croniche. Le proteine di fase acuta sono parte di una complessa reazione non-specifica che fa seguito al danno tissutale, mirata principalmente alla rimozione delle condizioni scatenanti e al ristabilirsi dell’omeostasi fisiologica. La produzione di CRP è stimolata da interleuchine infiammatorie quali IL-6, IL-1 e dal TNF-α. Le maggiori funzioni biologiche della CRP sono legate alla stimolazione della fagocitosi batterica, all’induzione di altre citochine, all’inibizione della chemiotassi e alla modulazione della funzione dei neutrofili. La concentrazione sierica della CRP è stabile e l’aumento è da mettere in relazione a diverse condizioni infiammatorie, fra le quali la pancreatite. Recenti studi infatti confermano l’associazione tra l’aumento dei valori della CRP e la presenza nei cani di pancreatite, ma l’elevata variabilità esistente tra i valori stessi non consente di poter discriminare i soggetti affetti dalle forme gravi da quelli affetti da forme moderate e quindi di poter utilizzare la CRP come indice prognostico di gravità11. Una ragionevole spiegazione a ciò può essere cercata nel fatto che la concentrazione della CRP è fortemente influenzata dal momento in cui avviene la determinazione in relazione all’inizio della sintomatologia. Secondo quanto riportato recentemente nel cane le concentrazioni di CRP diminuiscono durante il trattamento e a partire dal secondo giorno dalla comparsa dei segni clinici. I valori di CRP ottenuti nei primi due giorni dall’inizio delle manifestazioni cliniche di pancreatite presentano infatti un’elevata correlazione con quello che è l’esito clinico-prognostico11. Il monitoraggio continuativo, giornaliero, del valore delle CRP in circolo può quindi rappresentare un indice prognostico predittivo in cani affetti da pancreatite e sottoposti a terapia. Recentemente sono stati predisposti, in modo simile a quanto già avvenuto in medicina umana, degli schemi comparativi di valutazione dei principali indici clinici che prendono in considerazione i fattori che maggiormente influenzano l’evoluzione, la gravità della pancreatite ed il coinvolgimento dei vari organi e sistemi11. Un indice clinico di gravità dunque, che considera le alterazioni clinicopatologiche multi organiche e le complicazioni sistemiche e locali pancreatiche ai fini e prognostici e terapeutici (tabella III). Gli apparati presi in considerazione sono: A) il sistema cardio-circolatorio dove viene valutata la presenza di alterazioni a carico della frequenza cardiaca, anomalie del ritmo, la presenza di complessi prematuri ventricolari, tachicardia ventricolare ed alterazioni del polso periferico. Viene inoltre determinata la pressione arteriosa sistemica per individuare gli stati ipotensivi o ipertensivi in relazione alla concentrazione di albumina sierica. B) L’ apparato respiratorio, dove vengono valutati la presenza di tachipnea (> 40 atti respiratori al minuto), dispnea, rumori respiratori e segni indicanti stati di sofferenza del parenchima polmonare (polmonite, ARDS). C) L’apparato gastro-intestinale, dove sono rilevanti i segni clinici attribuibili alla perdita di integrità intestinale e a ipocinesia-ipotonia (es. ematochezia, melena, rigurgito o vomito). Fondamentali a tal fine, sono le informazioni anamnestiche riguardanti il periodo di anoressia che precede l’alimentazione enterale o il ripristino dell’alimentazione fisiologica. La palpazione addominale inoltre è uno strumento importante per percepire masse addominali (infiammatorie o neoplastiche), liquido libero in cavità e la presenza di dolore addominale. D) A carico del sistema epato-biliare vengono valutate le alterazioni enzimatiche caratteristiche di reattività epatica e di colestasi. E) Per il sistema ematopoietico sono prese in considerazione la presenza di leucocitosi-leucopenia, la presenza di neutrofili tossici e banda, le anomalie della coagulazione e la presenza di DIC. F) Per il sistema endocrino vengono valutati la presenza di diabete mellito preesistente, il grado di scompenso, l’eventuale chetoacidosi diabetica. G). Per l’apparato urinario vengono presi in considerazione i valori di azotemia quali indici di ipoperfusione renale e sistemica. H) Per gli indici clinici, infine viene considerata la presenza delle complicazioni locali a carico del parenchima pancreatico quali la formazione di pseudocisti, raccolte di fluidi peripancreatiche e la presenza di ascessi. Per ogni alterazione a carico dei vari sistemi organici viene attribuito un punteggio la cui somma va a rappresentare l’indice di gravità del processo flogistico e il suo valore prognostico. Più elevato è il valore dell’indice clinico maggiore è il coinvolgimento sistemico, maggiore è la gravità della pancreatite nel cane. Infine, nell’uomo sono stati condotti vari studi che basandosi sugli indici di gravità determinati in soggetti affetti da pancreatite, ne hanno valutato il rischio di mortalità. Sono 5 i fattori principali che, nell’uomo, contribuiscono alla determinazione della gravità della patologia e per i quali il tasso di mortalità è significativamente elevato: azotemia, alterazione dello stato mentale, la presenza di SIRS, l’età avanzata (> 60 anni) e la presenza di complicazioni respiratorie (spt versamento pleurico ). Uno studio simile è stato effettuato applicando l’indice clinico di gravità completo dei dati clinico-laboratoristici di cui sopra nei cani affetti da pancreatite grave nelle 24 ore seguenti l’ospedalizzazione 11. Fra i vari fattori a rischio valutati, il digiuno prolungato, inteso come periodo di anoressia di 3 o più giorni e precedente gli interventi di alimentazione enterale, è risultato essere il fattore con la maggior incidenza sulla gravità della malattia e sul tasso di mortalità. Le principali alterazioni emato-biochimiche evidenziabili in cani affetti da pancreatite dipendono dalla gravità del processo infiammatorio, similmente a quanto accade per lo sviluppo della sintomatologia. Nei cani affetti da pancreatite grave l’alterazione ematologica più frequentemente riscontrata è la trombocitopenia (59% dei casi), che nelle forme più gravi viene associata alla presenza delle alterazioni compatibili con lo sviluppo di DIC (aumento della concentrazione dei DD meri – FDPs, diminuzione della concentrazione del fibrinogeno a fronte della presenza di una stato infiammatorio grave, diminuzione della antitrombina III, aumento dei tempi della coagulazione PT, aPTT). Nel 55% dei cani è presente una leucocitosi neutrofilica di entità lievemoderata, caratterizzata dalla presenza di neutrofili banda e tossici, di leucopenia (15%) come sequela del sequestro dei neutrofili nel tessuto infiammato o nel liquido di versamento addominale12 e di anemia (29%) di solito non-rigenerativa e associata a poichilocitosi lieve (cheratociti, acantociti, leptociti). Al profilo biochimico di base si possono evidenziare l’aumento lieve-moderato degli enzimi epatici (ALT, AST, SAP, γGT) e della bilirubinemia compatibili con lo sviluppo di un’epatite reattiva e alla presenza di colestasi di solito lieve-moderata. Nei casi gravi è possibile altresì rilevare alterazioni elettrolitiche compatibili con una stato di disidratazione grave e la presenza di vomito (es. ipernatriemia, ipokalemia, iperfosfatemia, ipomagnesemia), alterazioni dell’equilibrio acidobase indicative dello sviluppo di acidosi sistemica e l’aumento della concentrazione di creatinina e BUN indici di ridotta perfusione renale e dello stato di ipovolemia. Frequente il rilievo di ipoalbuminemia e ipocalcemia quest’ultima legata al processo di saponificazione degli acidi grassi conseguente allo stato infiammatorio-necrotizzante del parenchima pancreatico e del tessuto adiposo peri-pancreatico, per lo più associati a ipercolesterolemia e ipertrigliceridemia. L’esame delle urine può riflettere lo stato di disidratazione in atto o lo sviluppo di una nefropatia su base ischemica (iso-ipostenuria, presenza di cilindri patologici, proteinuria). Nei cani affetti da pancreatite si può notare ancora l’aumento delle attività delle amilasi e delle lipasi non-specifiche sieriche, che se di entità superiori a 3-5 volte il valore massimo di normalità con segni clinici compatibili con la pancreatite, possono effettivamente essere compatibili con pancreatite. Tuttavia tali test sono dotati di ridotta sensibilità e specificità tale da sconsigliarne il loro utilizzo nella diagnosi di pancreatite. Nella diagnostica per immagini l’impiego della radiografia addominale nei cani affetti da pancreatite grave, può mostrare una perdita o una diminuzione dei contrasti della porzione craniale destra dell’addome, la dilatazione dell’ileo tra l’antro pilorico e il duodeno discendente, lo spostamento laterale dello stomaco a sinistra e del duodeno discendente a destra mentre il colon trasverso si sposta caudalmente12. La valutazione di questi rilievi presenta una forte componente soggettiva tale da rendere piuttosto complessa la formulazione di una diagnosi radiografica di pancreatite ma in grado comunque di poter escludere o confermare in diagnosi differenziale altre patologie quali ad esempio la presenza di corpi estranei gastrici o intestinali. Le radiografie toraciche solitamente non presentano alterazioni tranne la presenza di versamento pleurico di entità lieve-moderata nei soggetti affetti da forme di pancreatite grave a coinvolgimento sistemico. L’ecografia addominale (fig. 4 -5- 6 ) è considerata ad oggi uno strumento diagnostico di buona specificità e sensibilità (68%) nella diagnosi di pancreatite nel cane, nonostante quanto riportato in uno studio dove circa il 50% di cani con lesioni al parenchima pancreatico evidenziate mediante laparotomia esplorativa non sono state rilevate dall’esame ecografico1,13. La sensibilità della metodica dipende inevitabilmente dalla apparecchiatura utilizzata e dall’abilità dell’operatore e numerosi sono gli aspetti ecografici compatibili con pancreatite la cui variabilità appare fortemente influenzata dalla gravità, dalla durata e dalla diffusione dell’infiammazione al tessuto pancreatico e peripancreatico. Inoltre la valutazione ecografica del parenchima pancreatico e particolarmente del lobo sinistro del pancreas del cane, può essere resa difficoltosa da condizioni quali obesità e taglia del soggetto, dolorabilità addominale, gas nello stomaco e nel colon trasverso. Elementi importanti nella valutazione diagnostica ecografica di pancreatite del cane sono rappresentati dall’aumento del volume dell’organo, alterazioni dell’ecogenicità del tessuto pancreatico e del tessuto peripancreatico, presenza di fluido libero in addome, presenza di gas nel duodeno e l’aspetto corrugato della parete dello stesso. La necrosi del tessuto pancreatico è normalmente associata alla diminuzione dell’ecogenicità del parenchima spesso correlata ad iperecogenicità della regione peripancreatica conseguente a steatonecrosi. La presenza di aree ipoecogene all’interno del parenchima pancreatico non sono di per sé indicative di pancreatite, in quanto compatibili con stati di ipoalbuminemia o ipertensione portale nel cane14. L’iperecogenicità diffusa del parenchima pancreatico può essere indicativa di fibrosi del tessuto e si osserva raramente nelle pancreatite cronica. In uno studio recente15 condotto su cani anziani, clinicamente sani, più del’80% dei casi ha presentato alterazioni pancreatiche compatibili con iperplasia nodulare, correlabile ad aspetti ecografici caratteristici di un’ ecogenicità fortemente eterogenea, mista, del tessuto pancreatico (aree ipoecogene alternate ad aree iperecogene). Le alterazioni della normale ecogenicità del tessuto pancreatico, alla luce dei progressi tecnologici ed il grado di risoluzione raggiunto dalle apparecchiature utilizzate, possono sovrastimare la presenza della infiammazione pancreatica nel cane, se non vengono associate alla presenza di altri aspetti quali l’aumento del volume dell’organo, l’iperecogencità dei tessuti peripancreatici e la presenza di fluido peripancreatico o libero in addome. Altri aspetti meno comunemente osservabili in corso di pancreatite nel cane sono la dilatazione della papilla pancreatica e del dotto pancreatico, mentre importante ai fini terapeutici e prognostici è il riconoscimento delle complicazioni a carico del tessuto pancreatico quali la presenza di pseudocisti, cisti da ritenzione e di ascessi pancreatici. La presenza di neoplasie pancreatiche possono costituire elementi di difficile differenziazione dalle forme di iperplasia nodulare pancreatica e di pancreatite nel cane. I tumori del pancreas esocrino sono rari, fra questi il più comune nel cane è l’ adenocarcinoma, visualizzabile sotto forma di noduli o masse ipo o isoecogeni di varie dimensioni. Si sviluppa a partire dalle cellule acinari o dal sistema duttale del pancreas, si localizza preferenzialmente nella porzione centrale (corpo) dell’organo e con la crescita può comprimere il dotto biliare comune e invadere i tratti adiacenti di stomaco e duodeno. Tra le neoplasie endocrine pancreatiche (insulinoma, glucagonoma, gastrinoma) il tumore delle cellule beta pancreatiche offre aspetti che variano dalla presenza di una lesione nodulare singola o multipla le cui dimensioni non superano i 2,5 cm, all’alterazione non ben definita dell’ecogencità di un area del parenchima. Molte delle neoplasie pancreatiche maligne possono coinvolgere i linfonodi meseraici ed il fegato che di conseguenza dovrebbero esser sempre sottoposti a valutazione ecografica in caso di evidenti alterazioni del parenchima pancreatico. La tomografia assiale (TC) computerizzata nell’uomo rappresenta la metodica diagnostica maggiormente utilizzata nella identificazione della necrosi pancreatica. L’utilizzo della TC nel cane non è al momento una tecnica molto applicata nella diagnosi di pancreatite nel cane, a causa delle ridotte dimensioni dell’organo, della scarsa disponibilità dello strumento e del costo elevato. Pochi comunque sono gli studi al riguardo16,17 per poter valutare la reale sensibilità della TC nella diagnosi di pancreatite grave nel cane rispetto a quanto dimostrato dall’ecografia. Recentemente l’applicazione della Risonanza Magnetica (RM), l’utilizzo di studi contrastografici (CEUS, contrast-enhanced transabdominal ultrasound) in ecografica e l’uso dell’ecoendoscopia (Endoscopic Ultrasound, EUS) hanno trovato largo spazio nell’uomo nella diagnosi della malattie infiammatorie e neoplastiche del pancreas. Queste metodiche hanno al momento poche applicazioni in Medicina Veterinaria18 ed appaiono difficilmente impiegabili in un protocollo diagnostico di routine nel cane affetto da pancreatite. Diagnosi La diagnosi di pancreatite rappresenta una vera sfida diagnostica che comporta la valutazione complessiva di vari “indizi” clinico-patologici. L’interpretazione delle informazioni anamnestiche riguardanti le possibili cause scatenanti e il concorso effettivo dei fattori predisponenti, la valutazione accurata dei segni clinici in ragione della gravità della patologia, la corretta interpretazione dei dati ematologici e biochimici in merito al coinvolgimento sistemico e la valutazione delle immagini diagnostiche prevalentemente rappresentata dall’impiego della ecografia addominale, costituiscono i punti fondamentali al fine di una corretta formulazione diagnostica. Nella diagnosi di pancreatite nel cane accanto ai fattori precedenti, notevole è l’importanza dell’esame isto-patologico del tessuto pancreatico e la valutazione dei markers specifici di infiammazione pancreatica. L’esame isto-patologico ad oggi rappresenta la metodica diagnostica di riferimento nella diagnosi di pancreatite del cane. Limitanti appaiono però le condizioni cliniche dei soggetti affetti da pancreatite sintomatica che spesso risultano difficilmente compatibili con le procedure idonee al conseguimento di un corretto campione bioptico. L’indagine citologica, meno soggetta a rischi di esecuzione, non offre le stesse caratteristiche di sensibilità e specificità diagnostica dell’esame istologico, mentre può invece essere impiegata con una certa utilità nella diagnosi differenziale di neoplasia pancreatica (es. adenocarcinoma). Fra i markers di pancreatite nel cane le molecole ad oggi che rivestono un significativo valore clinico-diagnostico sono rappresentate dalle lipasi pancreatiche specifiche canine (cPL, canine pancreatic lipase). Il test inizialmente basato su di una metodica RIA, Radio-Immuno-Assay (cPLI)19 e di seguito da una metodica immuno-enzimatica (spec-cPLTM)20, valuta la concentrazione delle lipasi specifica canina di origine pancreatica. Recenti studi di immuno-localizzazione hanno di fatto accertato l’esclusiva presenza cPL a carico del parenchima pancreatico e quindi l’aumento della concentrazione sierica delle cPL può ragionevolmente essere correlato ad infiammazione del tessuto pancreatico mentre una significativa diminuzione può essere indicativa di una perdita della funzionalità pancreatica esocrina21. Il spec-cPLTM è ad oggi il test per la valutazione delle lipasi pancreatiche del cane commercialmente più diffuso. Esso si basa su di una metodica ELISA (Enzime Linked Immuno Sorbent Test) che utilizza un peptide di origine ricombinante canino come antigene e anticorpi monoclonali. Il spec-cPLTM presenta una buona correlazione e riproducibilità nei confronti del metodo cPLI, ma rispetto a questo offre un diverso range diagnostico: sono infatti considerati cani non affetti da pancreatite i soggetti con una concentrazione di cPL < 200μg/L, mentre sono considerate fortemente indicative di pancreatite le concentrazioni di cPL >400μg/L. I valori di cPL compresi tra 200μg/L e 400μg/L sono considerati “grigi”, border-line. Ancora, buona correlazione con la metodologia ELISA precedente e buona riproducibilità offre il test in-house semiquantitativo di recente introduzione lo SNAP-cPLTM per la valutazione delle cPL del cane, che offre semplicità di esecuzione e rapidità21,24. Secondo recenti studi condotti su cani affetti da pancreatite diagnosticata post-mortem mediante esame isto-patologico, entrambe le metodiche cPLI (RIA) e spec-cPLTM presentano una sensibilità complessiva del 63,6% superiore a quella presentata dalla rilevazione della concentrazione delle lipasi totali (31,8%) e delle amilasi (40,9%) sieriche21,25. La sensibilità delle cPLI e spec-cPLTM aumenta all’aumentare della gravità del quadro infiammatorio presentando una sensibilità pari al 21 % nelle pancreatiti lievi fino al 71% per le forme moderate (considerando come cut-off il valore di spec-cPLTM > 400μg/L). I test presentano un’ elevata specificità quando vengono confrontati i valori relativi ai soggetti sani (non affetti da pancreatite) con quelli relativi ai soggetti affetti da pancreatite, in relazione al cut off utilizzato: per < 200μg/L pari al 95% (95% CI 83,1- 99,4) e 97% (95% CI 86,8-99,9) per il limite del >400μg/L. In base ai dati di una recente analisi condotta sui valori delle spec-cPLTM in cani affetti da pancreatite con diagnosi istologica e raggruppati in base alla gravità dei segni clinici, il test mostra avere elevata specificità (maggiore al 80% considerando il valore cut-off < 200μg/L) nell’identificazione dell’infiammazione pancreatica. Tuttavia appaiono necessari ulteriori indagini in merito al comportamento del test in cani affetti da insufficienza renale acuta22. I valori delle lipasi pancreatiche specifiche canine evidenziate dai test sopracitati rappresentano sicuramente una guida importante nella diagnosi di pancreatite nel cane ma la loro rilevanza clinica deve essere ancora approfonditamente valutata soprattutto nelle situazioni cliniche complesse (es. pancreatite non sintomatica, diagnosticata mediante istologia e nella pancreatite in associazione a patologie sistemiche quale per es. peritonite settica). Interessanti i dati in merito ai valori di SNAP-cPLTM in cani con addome acuto, dove si evidenzia una scarsa correlazione tra la positività al test e la presenza di pancreatite nei cani esaminati ed una buona correlazione con i valori negativi allo SNAP-cPLTM nei soggetti affetti da patologie diverse 23 . Risultati simili a quanto riportato in un recente studio statistico Bayesiano condotto su 84 cani affetti da pancreatite24, in base al quale i valori di spec-cPLTM < 200 μg/L e /o negativi allo SNAP-cPLTM sono da considerarsi indicativi per l’assenza clinica di pancreatite. Inoltre, il metodo dello SNAP-cPLTM non è scevro della presenza di valori falsi positivi in quanto è un metodo semiquantitativo, colorimentrico la cui lettura è soggettiva in quanto dipendente dall’osservatore. Nel caso in cui valori negativi allo SNAP-cPLTM contrastino con le osservazioni cliniche-patologiche o semplicemente in caso di lettura dubbia, equivocabile, è consigliabile ripetere la determinazione delle cPL mediante il metodo spec-cPLTM per la conferma del dato. In conclusione si può ritenere che i valori positivi allo spec-cPLTM o positivi allo SNAP-cPLTM possono essere associati alla condizione di pancreatite qualora siano in combinazione con la presenza di segni clinici e di aspetti di diagnostica per immagini compatibili con il sospetto clinico, mentre i valori negativi allo spec-cPLTM o negativi allo SNAP- cPLTM possono escludere in termini di buona probabilità la presenza di pancreatite tra le cause responsabili della insorgenza dei sintomi clinici. Recentemente è stato descritto l’utilizzo della Elastasi Pancreatica sierica-1 (PE-1) come marker di pancreatite nel cane27. Il test appare offrire una buona sensibilità (61%) che si fa più elevata (92%) nei soggetti con pancreatite grave e pare non essere influenzata dalla clearance renale. Il ruolo dell’elastasi pancreatica-1 nell’uomo è stato ampiamente descritto in relazione alla diagnosi ed allo sviluppo della risposta sistemica associata a pancreatite, nel cane ulteriori studi sembrano necessari per valutare la reale efficacia clinico-diagnostica della molecola. Terapia La terapia della pancreatite nel cane è fondamentalmente una terapia di supporto, legata alla forma clinica con cui la patologia decorre e alle manifestazioni cliniche collegate. Nella pancreatite grave il quadro clinico-sintomatologico è spesso dominato dallo sviluppo di una sindrome infiammatoria multi-organica a carattere sistemico e la terapia è necessariamente intensiva e mirata al supporto funzionale degli apparati coinvolti e al ripristino delle condizioni cliniche generali. Le forme di pancreatite lieve e moderata spesso sono responsabili di un quadro sintomatologico poco evidente quanto aspecifico (vomito, diarrea, ematochezia spesso autolimitanti) o clinicamente silente, e l’approccio terapeutico è rivolto prevalentemente al superamento delle criticità sintomatiche. In ogni caso alla base della corretta gestione terapeutica della pancreatite nel cane, in ogni sua forma, vi è la comprensione dei meccanismi eziopatogenetici, l’esclusione dei principali fattori predisponenti e quando possibile, l’identificazione e la risoluzione della cause scatenanti. In questo senso viene valutata la sospensione della somministrazione di farmaci quali azatioprina, bromuro di potassio, L-asparaginasi, antimoniato di N-metil-glucamina nei soggetti sintomatici, vengono utilizzate diete a ridotto tenore in grassi ed elevato contenuto proteico, vengono prontamente corrette le condizioni compatibili con gli stati di disidratazione, ipovolemia e gli eventuali squilibri idro-elettrolitici ed acido-base. Inoltre di importanza rilevante ai fini terapeutici appaiono la diagnosi precoce ed il trattamento delle patologie concomitanti alla pancreatite. Infatti la presenza di malattie infiammatorie croniche a carattere sistemico (es. IBD), endocrinopatie (es. diabete mellito, chetoacidosi diabetica, iperadrenocorticismo) e malattie settiche, sottese o concomitanti al processo infiammatorio del tessuto pancreatico rappresentano importanti fattori coinvolti nello scatenamento dello stesso e della sua persistenza, comportando gravi complicazioni alla corretta gestione terapeutica dei soggetti affetti. Fluidoterapia Nell’approccio terapeutico alla pancreatite sintomatica grave, uno dei fattori patogenetici di maggior importanza nella progressione della gravità dell’evento infiammatorio è rappresentato dall’alterazione del microcircolo pancreatico comprendente vasocostrizione arteriolare, aumento della permeabilità ed insufficiente perfusione capillare. Il danneggiamento del microcircolo tissutale riconosce un’origine multifattoriale e rappresenta il risultato dell’azione del rilascio massivo di citochine pro-infiammatorie e fattori vasoattivi con conseguente ischemia, stasi circolatoria, formazione di microtrombi conseguenti allo stato di ipercoagulabilità secondaria al drastico aumento dell’interazione leucociti-endotelio ed attivazione della fibrinolisi. Le alterazioni della coagulazione e l’aumento della viscosità del sangue portano alla compromissione del microcircolo pancreatico esacerbando l’ischemia tissutale. L’aumento della permeabilità capillare conduce alla formazione di edema all’interno delle cellule dell’acino e alla conseguente migrazione di cellule infiammatorie (prevalentemente neutrofili). Il danno cellulare che ne consegue porta alla progressiva ed irreversibile riduzione di capillari e necrosi del tessuto pancreatico. Lo spasmo vasocostrittivo dei principali vasi pancreatici avviene già nelle fasi iniziali del processo infiammatorio e nell’uomo è correlato in maniera significativa alla drastica riduzione della perfusione tissutale e all’aumento della percentuale di mortalità nei soggetti ricoverati 28. Inoltre il ripristino del flusso capillare nel tessuto già gravemente danneggiato può amplificare in maniera drammatica la risposta infiammatoria mediante la produzione di xantina ossidasi e la liberazione dei ROS e culminare nell’attivazione intracellulare di proteasi e nella distruzione tissutale. Un’ immediata ed aggressiva terapia fluida mirata al reintegro dello stato di idratazione può correggere la condizione di ipovolemia legata al terzo spazio, incrementare la perfusione del tessuto pancreatico e coadiuvare il ripristino della microcircolazione pancreatica. Inoltre un adeguato trattamento fluido è in grado di correggere le conseguenze relative allo stato ipotensivo a carico dell’apparato gastro-enterico preservandone l’integrità e la funzione, condizioni che appaiono fondamentali ai fini dell’efficacia del trattamento e alla formulazione di una prognosi favorevole11. I valori dell’ematocrito (Hct), della concentrazione di BUN e creatinina sierica sono considerati degli importanti parametri correlati allo stato di idratazione, di ipovolemia ed alla ridotta perfusione periferica. Hct, BUN e creatinina rappresentano quindi un sistema di valutazione semplice anche se indiretto del possibile danno pancreatico.28 Inoltre il monitoraggio di questi parametri permette di riconoscere precocemente i soggetti refrattari all’ iniziale terapia idratante e di intraprendere in modo adeguato le misure di monitoraggio e di terapia intensiva più efficienti (es. utilizzo di farmaci inotropi e cronotropi positivi). La scelta del tipo di fluido da utilizzare nella terapia infusionale dei soggetti affetti da pancreatite grave è ancora oggetto di controversie. Cristalloidi isotonici Ad oggi la soluzione Ringer lattato rappresenta nell’uomo come nel cane il cristalloide isotonico maggiormente utilizzato nella terapia fluida di rimpiazzo in relazione ai volumi e alle elevate velocità di infusione necessari al corretto ripristino emodinamico e perfusionale (nel cane 50 - 100 ml/Kg/ora). Inoltre in medicina umana un recente studio comparativo tra la somministrazione di soluzioni Ringer lattato e soluzione fisiologica (NaCl 9%) in pazienti affetti da pancreatite necrotizzante, ha mostrato come l’utilizzo della soluzione Ringer Lattato appaia correlato ad una risposta più che significativa nella riduzione dello sviluppo dell’infiammazione sistemica. L’impiego di NaCl 0,9% in relazione alle quantità e alle velocità utilizzate nella terapia fluida della pancreatite non è scevro da complicazioni quali lo sviluppo di acidosi ipercloremica che mediante il rilascio di citochine quali ad esempio le NF-κB, può contribuire all’aggravarsi dello stato infiammatorio. Recente è l’impiego nella pancreatite grave della soluzione Ringer etil-piruvato nella quale il lattato è sostituito dal piruvato, forma stabile che appare associata a un significativo effetto antiossidante in grado di ridurre l’edema, la necrosi pancreatica e agire efficacemente sulla componente infiammatoria28. Sebbene scarsi risultano gli studi in medicina veterinaria a questo proposito, l’uso della soluzione Ringer etil-piruvato appare connesso ad una significativa modulazione di importanti mediatori di infiammazione quali la interleuchina IL-6, IL10 e il TNF2α nello shock settico in relazione allo sviluppo di SIRS29 ; di conseguenza il suo impiego nelle infiammazioni gravi a carattere sistemico quali appunto la pancreatite potrebbe risultare nel cane di pari efficacia a quanto ampiamente dimostrato nell’uomo. L’utilizzo di soluzioni cristalloidi isotoniche nella correzione delle alterazioni emodinamiche caratteristiche dello stato di gravità della pancreatite è doverosamente associato alla somministrazione di elevati volumi e velocità di infusione che spesso risultano poco tollerati per la distribuzione caratteristica di queste soluzioni nei vari comparti intravascolare, interstiziale e intracellulare. Di conseguenza la somministrazione di fluidi cristalloidi isotonici può condurre ad ipertensione polmonare, edema polmonare interstiziale e allo sviluppo di una sindrome respiratoria acuta, complicazioni importanti ai fini della gestione intensiva del paziente affetto da pancreatite. Cristalloidi ipertonici Recenti studi hanno valutato l’utilizzo delle soluzioni saline ipertoniche (NaCl al 7%, 5% o 3%) nella fluido terapia in corso di pancreatite nell’uomo e nel cane. Le soluzioni saline ipertoniche sono soluzioni cristalloidi che agiscono primariamente promuovendo lo spostamento di fluidi dallo spazio interstiziale a quello vascolare. Nelle gravi forme infiammatorie l’utilizzo di fluidi cristalloidi ipertonici quali NaCl al 7%-5%-3% è associato all’immediato ripristino del volume circolatorio e della pressione arteriosa sistemica, al miglioramento della contrattilità cardiaca e conseguentemente al ripristino della perfusione tissutale periferica. Inoltre l’impiego di queste soluzioni appare correlato significativamente ad un’efficace attività di modulazione della risposta infiammatoria citochina-dipendente e dell’attività leucocitaria28. La somministrazione di soluzioni saline ipertoniche in associazione con i fluidi cristalloidi isotonici consente di ridurre considerevolmente il volume di quest’ultimi ridimensionando il rischio di edema polmonare e minimizzando nel contempo le complicazioni legate alla caratteristica ipertonicità delle stesse. Le maggiori complicazioni riguardanti l’utilizzo delle soluzioni saline ipertoniche sono rappresentate dal lieve o moderato aumento della concentrazione di sodio ematico e dell’osmolarità plasmatica, la diminuzione lieve- moderata di potassio e bicarbonato con trascurabili conseguenze cliniche. Un’aggressiva terapia ipertonica può invece essere associata ad insufficienza renale e mielinolisi centrale pontina28. Gli stati di marcata disidratazione (>8%) rappresentano sicuramente le controindicazioni più rilevanti alla somministrazione di soluzioni ipertoniche cristalloidi in quanto sono caratterizzati dalla ridotta disponibilità di fluidi da parte del compartimento interstiziale e dal conseguente rischio di aggravamento delle condizioni legate all’ ipoperfusione tissutale. Le soluzioni saline ipertoniche sono somministrate alla velocità di 4-6 ml/Kg per via endovenosa lenta (10 -20 minuti), velocità maggiori a 1 ml/Kg/minuto possono esitare in pericolose risposte vagomediate (ipotensione, bradicardia, broncocostrizione) oltre a comportare le complicazioni renali e neurologiche già citate precedentemente. L’effetto conseguente la somministrazione delle soluzioni saline ipertoniche è piuttosto rapido ad instaurarsi ma transitorio a causa delle caratteristiche di distribuzione proprie dei cristalloidi. In questo senso negli ultimi anni in medicina veterinaria hanno trovato un importante impiego nell’ottimizzazione della risposta emodinamica e del suo mantenimento la somministrazione di soluzioni miste, ipertoniche cristalloidi e colloidi sintetici in associazione. Questo tipo di soluzioni rappresentano un’ottima combinazione tra l’effetto iperosmolare immediato dei cristalloidi ipertonici e la capacità di mantenere nel tempo un’efficace pressione colloido-osmotica tipica dei colloidi. Miscele costituite da una parte di soluzione NaCl 23,4% e due parti di soluzione colloide (hetastarch o destrano 70) sono state utilizzate con efficacia in medicina veterinaria nella terapia fluida dello shock (endotossico, traumatico ed emorragico) e delle gravi forme infiammatorie complicate da SIRS30. Sebbene non vi sia un’evidenza clinica a tale riguardo l’utilizzo dei colloidi nella terapia della pancreatite è da sempre considerata superiore rispetto ai cristalloidi nel ripristino di una risposta emodinamica efficace. Colloidi I colloidi sono soluzioni polidisperse costituite da macromolecole (> 20.000 dalton) che favoriscono il movimento di fluido dallo spazio extravascolare a quello vascolare mediante l’aumento della pressione colloido-osmotica. Le soluzioni colloidi rispetto alle cristalloidi presentano un prolungato effetto intravascolare, richiedono un minore volume di infusione e sono meno legate allo sviluppo di complicazioni quali l’edema polmonare. D’altro canto la somministrazione di colloidi può essere associata a diverse complicazioni quali coagulopatie, sovraccarico del volume intravascolare, danno renale iperoncotico (uomo spt.), stravaso interstiziale per rottura delle membrane capillari e reazioni anafilattiche (uomo spt.). Le coagulopatie (diminuzione della concentrazione del fattore VIII e del fattore di Von Willembrand, alterazione della funzionalità piastrinica, interferenza con la stabilità del coagulo) sono le principali complicazioni segnalate in medicina veterinaria e sono fondamentalmente correlate allo stato di emodiluizione riconducibile alla somministrazione di eccessive quantità di fluidi. Attualmente i colloidi sintetici di recente introduzione, quali pentastarch, tetrastarch (Voluven) sono quelli più utilizzati in corso di pancreatite nell’uomo e nel cane e presentano caratteristiche compatibili con un minore impatto sulla funzionalità emostatica (tabella IV). In generale i colloidi sono composti da polimeri di glucosio ricavati dall’amilopectina per sostituzione di gruppi idrossi-etilici in posizione C2, C3, C6 al fine di prevenire la rapida degradazione delle molecole stesse da parte delle amilasi sieriche. Tra le varie molecole colloidali esistono alcune differenze legate al diverso peso molecolare e alle caratteristiche di idrossilazione quali il rapporto di sostituzione C2/C6 ed il grado di sostituzione (DS) che possono condizionare l’efficacia e impiego delle molecole stesse. Il rapporto di sostituzione è la relazione tra i gruppi idrossi-etilici a livello degli atomi di carbonio C2 e C6 della molecola colloidale e rappresenta la caratteristica che più condiziona l’emivita della molecola e conseguentemente l’effetto colloidosmotico in questo senso: più elevato è il rapporto di sostituzione maggiore è l’emivita della molecola, più prolungato l’effetto colloidosmotico. Il grado di sostituzione indica il numero di gruppi idrossi-etilici per molecola (es. 0,4 = 4 gruppi su 10 molecole) che è inversamente correlato alla degradazione della stessa (più è elevato DS più lenta la degradazione). L’impiego di colloidi sintetici con basso DS (< 0,4) e basso peso molecolare (<200 Kdalton) quali ad esempio Voluven, Extender, Tetraspan appare strettamente connesso alla maggior facilità di escrezione renale, alla ridotta interferenza sulla funzione coagulativa e ad un’efficace modulazione della risposta infiammatoria attraverso il mantenimento dell’integrità capillare e la riduzione della permeabilità a livello del microcircolo con evidenti effetti sulla perfusione periferica e l’integrità dei tessuti. Il colloidi sintetici vengono somministrati nel cane alla dose di 20 ml/kg/ giorno, che può arrivare anche a 50 ml/Kg/ giorno per le recenti molecole con basso peso molecolare e ridotto DS (Voluven, Tetraspan, Extender). La via di somministrazione può avvenire mediante infusione continua 0,5 ml/Kg/ora – 1ml/Kg/ora fino a 2 ml/ Kg /ora o attraverso boli endovenosi ripetuti. Ossiemoglobina Fra i colloidi sintetici di certo interesse nei pazienti affetti da pancreatite è l’utilizzo del HBOC (Hemoglobin-based oxigen carriers) in relazione allo stato di ipossia tissutale secondaria alle gravi alterazioni a carico del microcircolo sanguigno caratteristico delle forme gravi a carattere sistemico. Gli HBOC sono glutameri di emoglobina stroma-free ultra purificata che vengono polimerizzati per aumentare il loro effetto intravascolare. Gli HBOC migliorano l’ossigenazione dei tessuti mediante l’aumento del contenuto di emoglobina e il volume di precarico, anche se la concentrazione plasmatica di emoglobina può non subire aumenti rilevanti causa l’emodiluizione conseguente ai fluidi somministrati in associazione. L’Ossiemoglobina è l’unico HBOC prodotto e approvato in medicina veterinaria ed è ricavata dall’emoglobina di bovino mediante polimerizzazione (stroma free). La maggior indicazione riguardo l’impiego di ossiemoglobina è legata alla capacità di aumentare la perfusione del microcircolo attraverso l’aumento della fluidità e dell’l’ossigenazione in quei distretti tissutali difficilmente raggiungibili dai globuli rossi. L’ossiemoglobina viene somministrata alla dose di 10-30 ml/Kg ed ha un emivita di 18 – 42 ore in base alla dose rispettivamente somministrata. L’HBOC ha proprietà antiossidanti NO-scavengers, inibendo la produzione di nitrati e nitriti perossidi a partire dalla combinazione NO- ROS. D’altro canto proprio queste proprietà possono portare a fenomeni vasocostrittori NO dipendente con ripercussione sul microcircolo. Recentemente nell’uomo l’utilizzo della HBOC è stato efficacemente associato alla somministrazione di Hetastarch combinando le capacità dell’ossiemoglobina alle caratteristiche reologiche del colloide con aumento del precarico volumetrico, miglioramento efficace della perfusione del microcircolo e dell’ossigenazione tissutale31. Questo approccio terapeutico rappresenta nell’uomo una tra le più interessanti opzioni terapeutiche nella gestione della pancreatite acuta, e sebbene non vi siano studi adeguati in medicina veterinaria è opinione degli autori che abbia le caratteristiche per rappresentare, dopo una opportuna validazione scientifica, una scelta terapeutica di notevole efficacia nelle forme sintomatiche e gravi di pancreatite nel cane. Plasma Il plasma è un colloide naturale il cui utilizzo appare indispensabile insieme alla somministrazione di sangue in toto alla prevenzione delle complicazione emorragiche conseguenti ad alterazioni coagulative. Il plasma fresco congelato si ottiene dal sangue in toto previa centrifugazione e congelamento entro 8 ore dal prelievo, congelato mantiene le sue caratteristiche per un periodo che va dai 6 mesi (-20°C) ai 12 mesi (-30°C). Le proprietà terapeutiche del plasma fresco congelato sono legate principalmente al rimpiazzo dei fattori della coagulazione, di albumine, αmacroglobuline, immunoglobuline e di fattori anti-infiammatori importanti nel trattamento della SIRS. Secondo quanto riportato da vari studi il plasma non può essere considerato una fonte significativa di albumine, infatti nel cane sono necessari elevati volumi per ottenere un significativo incremento plasmatico della concentrazione di albumina (circa 45 ml/Kg di plasma fresco per ottenere l’aumento di 1g/dL di albumina) né può essere utilizzato efficacemente nel ripristino del volume circolatorio al pari dei colloidi sintetici32. Attualmente in medicina veterinaria non vi sono studi prospettici controllati in grado di valutare l’efficacia della somministrazione del plasma fresco congelato nel trattamento dei cani affetti da pancreatite. Anche se l’utilizzo di plasma in corso di pancreatite sia da anni consigliato dai principali gastroenterologi veterinari, un recente studio retrospettivo condotto su 77 cani affetti da pancreatite34 ha mostrato come la somministrazione di plasma fresco congelato non comporti maggiori benefici terapeutici rispetto a trattamenti fluidocolloidali comparativi, al pari di quanto evidenziato in medicina umana dove la somministrazione di plasma non rappresenta l’opzione terapeutica raccomandata nel trattamento della pancreatite. Tuttavia l’impiego del plasma congelato fresco nella pancreatite deve essere comunque considerato indispensabile nel trattamento e nella prevenzione delle alterazioni coagulative conseguenza del grave processo infiammatorio e del massivo rilascio di citochine pro-infiammatorie e fattori vasoattivi che conducono alla formazione di microtrombi e ad ischemia tissutale. Il plasma fresco congelato viene somministrato entro 1 ora dallo scongelamento alla velocità di 6-10 ml/Kg in più somministrazioni a causa della breve emivita dei fattori della coagulazione e a seconda delle gravità delle anomalie coagulative riscontrate. Il monitoraggio della funzione coagulativa mediante i test PT, aPTT, la valutazione dei prodotti della fibrinolisi (FDP, D-Dimeri) e del fibrinogeno è di estrema utilità nell’identificazione delle indicazioni alla somministrazione di plasma e delle quantità relative in relazione alla gravità della coagulopatia in atto, inoltre fornisce utili elementi per l’interruzione della somministrazione. L’ utilizzo di sangue in toto si rende necessaria in quei pazienti dove le alterazioni a carico della funzionalità coagulativa si rendono responsabili di quadri emorragici a carattere incessante. Il sangue in toto viene trasfuso alla dose massima di 20 ml/Kg /giorno, previa valutazione della compatibilità attraverso i test specifici (DEA, cross-match). Le somministrazioni prolungate di colloidi sintetici o naturali necessitano del monitoraggio della pressione colloido osmotica plasmatica (COP) che può essere stimata dalla concentrazione dell’albumina e delle proteine totali. L’albumina plasmatica è infatti responsabile di circa il 60-70% della COP mentre la rimanente parte è dovuta in grossa parte alle globuline plasmatiche con un contributo pressoché trascurabile per le altre cellule sanguigne. Nel cane la COP è pari a 20,8 ± 1,8 mmHg che nel sangue intero è di 19,9 ± 2,1 mmHg, mentre la COP esercitata da una concentrazione di albumina di 7 g/dL è pari a 28 mmHg in vivo e a 19,8 mmHg in soluzione. In tabella sono riassunti i principali fluidi e le velocità d’infusione impiegati nella trattamento della pancreatite del cane. Insieme alla COP, ovvero alla valutazione della concentrazione della albumina e delle proteine sieriche, altri parametri devono essere considerati nel monitoraggio della terapia fluida in corso di pancreatite e delle sue complicazioni. In particolare ricordiamo la concentrazione sierica di BUN e creatinina quali indici di perfusione, il rilevamento dei parametri emodinamici quali la pressione arteriosa sistemica, l’elettrocardiogramma, la pressione venosa centrale (quando possibile), la valutazione elettrolitica ed acido-base e l’out-put urinario. Controllo del dolore Il controllo del dolore rappresenta una parte essenziale del trattamento della pancreatite nel cane. Infatti il dolore viscerale di forte intensità può essere responsabile in caso di pancreatite grave dall’aggravamento dello stato di ipoperfusione e dello shock, fino alla manifestazione di disturbi del ritmo cardiaco. Instaurare un piano analgesico sistematico è quindi una priorità assoluta nella gestione del paziente affetto da pancreatite grave. Vari sono gli agenti analgesici utilizzati (tabella IV) fra cui quelli di maggior utilizzo sono rappresentati dagli oppioidi. La via di somministrazione preferita è quella endovenosa e nel caso di dolore grave, non trattabile, la via epidurale. Nell’analgesia dei soggetti affetti da pancreatite è da evitare l’utilizzo dei farmaci anti-infiammatori non steroidei sia singoli o in associazione, sia per la scarsa efficacia nel controllo del dolore acuto sia per gli importanti effetti collaterali (erosioni, ulcere gastro-duodenali) legati alle concomitanti condizioni di ipoperfusione caratteristiche della patologia. Controllo del vomito Il vomito è il sintomo più frequente nella pancreatite del cane spesso connesso all’impossibilità del mantenimento di un’alimentazione efficace in relazione all’apporto delle calorie necessarie all’aumento delle richieste energetiche metaboliche caratteristiche dello stato di grave infiammazione. Il trattamento anti-emetico nei pazienti affetti da pancreatite sintomatica è quindi fondamentale ai fini di una corretta gestione terapeutica nutrizionale e idratante e necessita dell’utilizzo di molecole altamente efficaci (vedi tabella V). I meccanismi patogenetici che sottendono al vomito nella pancreatite del cane sono associati alla presenza di afferenze centrali e viscerali di notevole intensità quali la necrosi e la distensione del parenchima pancreatico, l’azione diretta degli agenti emetici circolanti a livello centrale, la distensione e l’infiammazione del duodeno e dell’ileo e la presenza steatonecrosi e peritonite. In medicina veterinaria al momento non esistono pubblicazioni riguardo la valutazione comparativa dell’efficacia di un singolo anti-emetico rispetto ad un altro in soggetti affetti da pancreatite. Nell’uomo in uno studio sperimentale sulla pancreatite condotto su modello animale (nei ratti) è stato dimostrato come l’infusione continua di dopamina sia correlata ad una significativa riduzione della gravità dell’infiammazione e ad un migliore esito terapeutico35. L’efficacia della somministrazione di dopamina appare direttamente associata alla riduzione della permeabilità del microcircolo pancreatico piuttosto che all’azione diretta della molecola sul flusso sanguigno all’organo. Nei cani con pancreatite l’utilizzo di anti- emetici antagonisti dopaminergici (metoclopramide 0,2-0,5 mg/Kg IM,PO,SC ogni 6 – 8 ore o 5 – 20 µg/Kg EV in CRI ) potrebbe teoricamente comportare degli svantaggi legati all’inibizione degli effetti dopaminergici sulla permeabilità del circolo capillare anche se mancano, a questo riguardo, gli studi clinici atti a dimostrarne l’evidenza. La metoclopramide rappresenta un potente antiemetico che esplica la sua azione a livello della CTZ (Chemoreceptor Trigger Zone) mediante azione antagonista nei confronti della dopamina e diretta agonista sui recettori 5HT4. L’azione sui 5HT4 si esplica principalmente attraverso un rilevante effetto cinetico positivo a livello dello stomaco e del tratto prossimale del duodeno. La metoclopramide è 20 volte più potente nel controllo del vomito rispetto le fenotiazine e derivati, alte dosi (> 0,5- 1mg/Kg IM, PO, SC, ogni 6-8 ore o dosi > 20 µg/Kg EV in CRI) però possono far prevalere l’azione antagonista della molecola sui recettori 5HT3 portando ad una drastica riduzione dell’efficacia o addirittura provocando l’emesi. L’associazione tra metoclopramide e glucocorticoidi ( spt desametasone 0,1 – 0,5 mg/Kg SC, IV o metilprednisolone 1 – 5 mg/Kg IM, SC) è stata utilizzata nel controllo del vomito acuto ed incoercibile secondario a chemioterapia nell’uomo. L’esatto meccanismo d’azione dei glucocorticoidi nel controllo del vomito non è al momento conosciuto e rari sono i lavori in medicina veterinaria che al pari dell’uomo ne documentano l’associazione con la metoclopramide. Il maropitant è una molecola relativamente recente che esplica un effetto anti-emetico sia a livello centrale che periferico attraverso il blocco dei recettori NK-1 (neurochinina-1). La somministrazione di maropitant (1-2 mg/ Kg PO, SC una volta al giorno) appare efficace nel controllo del vomito acuto nei soggetti affetti da pancreatite sintomatica, inoltre l’azione del maropitant sui recettori NK-1 è responsabile anche della riduzione della sostanza P, neuromediatore implicato nella patogenesi del dolore con effetti diretti sulla permeabilità capillare. Secondo quanto riportato da uno studio sperimentale condotto su modello animale36 durante l’infiammazione pancreatica si assiste a significativa up-regulation dei recettori NK-1 e dei livelli di sostanza P ad essi intimamente correlata. Il blocco dei recettori NK-1 non appare però correlato ad una significativa modulazione dell’infiammazione del parenchima pancreatico quanto alla ridotta incidenza di complicazioni a lunga distanza quali quelle polmonari (ARDS). Efficace appare ancora l’utilizzo di antiemetici antagonisti della serotonina quali ondasetron (0,5 mg/Kg dose carico EV unica somministrazione seguita da 0,5 mg/Kg EV /ora) e dolasetron (0,6 mg/Kg EV,SC ogni 24 ore). Gli antagonisti della serotonina agiscono prevalentemente a livello della CRTZ (ChemoReceptor Trigger Zone) e trovano impiego nei soggetti affetti da pancreatite nel controllo del vomito incoercibile e refrattario al trattamento iniziale. L’efficacia terapeutica di questi composti è stata documentata nel controllo del vomito di origine neoplastica dove è stato possibile evidenziare delle diversità esistenti nella capacità enti-emetica delle varie molecole appartenenti a questa classe. Attualmente la molecola più efficace nella gestione del vomito incoercibile è rappresentata dal dolasetron37 a causa dell’attività agonista sui recettori 5-HT3 del suo metabolita attivo e al potenziamento dell’attività anti-emetica conseguente. Terapia antiacida L’utilizzo di farmaci regolatori dell’acidità gastrica nel trattamento della pancreatite nel cane trova fondamento in due principali motivazioni: a) la riduzione della stimolazione dell’attività esocrina del pancreas correlata alla diminuzione delle secrezioni acide dello stomaco; b) la prevenzione dello sviluppo di lesioni erosive ed ulcerative a carico della mucosa gastrica comuni alle condizioni di ipovolemia, ipoperfusione e peritonite focale. Sebbene attualmente non vi siano studi clinici che abbiano dimostrato l’evidenza dell’efficacia terapeutica della somministrazione degli antiacidi nella riduzione del dolore addominale, nella diminuzione della nausea e della durata del periodo di ospedalizzazione, appare invece evidente l’esistenza di una significativa correlazione tra la diminuzione del pH gastrico e l’ampliamento del danno infiammatorio conseguente ad una maggiore attivazione dei granuli di zimogeno all’interno dell’acino pancreatico38. I farmaci antiacidi maggiormente utilizzati nel controllo del pH gastrico nella pancreatite del cane sono rappresentati dagli inibitori della pompa protonica quali pantoprazolo (1 mg/ Kg EV ogni 24 ore) e omeprazolo (0,5 – 1 mg/Kg PO ogni 24 ore almeno 30’ prima del pasto) e dagli antagonisti H2 quali la famotidina (0,5 – 1 mg/Kg EV, IM, SC, PO ogni 12- 24 ore), ranitidina (0,5 – 2 mg/Kg EV, SC; 2 – 4 mg/Kg PO 8 – 12 ore) e la più recente nizatidina (5mg/Kg PO ogni 24 ore). L’omeprazolo è somministrato per bocca 30 minuti prima del pasto in formulazioni gastro-resistenti (viene inattivato a pH acido), la sua biodisponibilità aumenta all’aumentare del pH intestinale così come la concentrazione plasmatica che cresce nei primi 4-5 giorni di terapia. Il pantoprazolo invece può essere somministrato per via endovenosa, e secondo quanto riportato in un recente studio sperimentale sulla pancreatite acuta appare associato ad una significativa riduzione della perdita di integrità delle cellule degli acini pancreatici con conseguente diminuzione della gravità dell’infiammazione tissutale. Gli inibitori della pompa protonica esplicano la loro azione a livello dei canalicoli delle cellule parietali gastriche legandosi in maniera covalente ed irreversibile ai gruppi sulfidrici del complesso potassio-adenosina-trifosfato (H+, K+ - ATPase) inibendone la risorsa energetica necessaria al funzionamento. L’enzima risulta inibito in maniera permanente e la secrezione di acida riprende solo dopo la formazione di una nuova molecola, generalmente dopo 24-48 ore, dopo l’interruzione del farmaco. Per questo motivo la durata di azione degli inibitori della pompa protonica è più lunga dell’effettiva emivita della molecola. La massima efficacia d’azione è inoltre subordinata al raggiungimento dell’ottimale concentrazione di accumulo del farmaco a livello delle cellule parietali e può essere raggiunta non prima di 3-5 giorni dall’inizio della somministrazione. Proprio per questo motivo ai fini di una risposta antiacida rapida gli inibitori della pompa protonica sono utilizzati in associazione a farmaci antisecretori antistaminici quali famotidina (0,5 mg/Kg EV ogni 12 ore) o ranitidina (1 mg/Kg ev ogni 8 -12 ore) nei primi 3 – 5 giorni dall’inizio della somministrazione. La famotidina è tra gli H2 antagonisti il farmaco che possiede maggior efficacia terapeutica abbinata ad una più lunga durata d’azione. La famotidina infatti appare 32 volte più potente della cimetidina e 4,5 volte più della ranitidina. Gli antagonisti H2 sono inibitori reversibili che influiscono sulla concentrazione di H+ e pepsina a livello delle secrezioni gastriche, la loro azione è immediata (circa 1 ora dalla somministrazione EV) e correlata alla dose e al tempo di somministrazione (almeno due volte al giorno) (tabella VII). Gestione alimentare La grave infiammazione del tessuto pancreatico implica una fondamentale alterazione del metabolismo di base quale l’instaurarsi di uno stato catabolico connesso alla perdita significativa di azoto proteico11,41. Nella pancreatite grave una serie di fattori contribuiscono all’impossibilità di provvedere alle necessità energetiche attraverso l’alimentazione spontanea: la presenza di dolore, nausea, vomito e le condizioni compatibili con una diminuita peristalsi gastro-intestinale (ileo paralitico) quali la grave disidratazione e la diminuzione della perfusione periferica. In aggiunta la necrosi tissutale e lo sviluppo di condizioni diabetogene conseguenti al grave stato infiammatorio del tessuto pancreatico possono gravare in modo esasperato sull’aumento delle richieste energetiche41. Studi sperimentali nell’uomo e nel cane documentano come lo stato di inappetenza – anoressia sia significativamente associato ad atrofia della mucosa intestinale, incremento del tasso di cellule intestinali in apoptosi, alterazione della composizione della mucina prodotta dalle globet cells site nella porzione più profonda delle cripte intestinali ed alla drastica riduzione del trasporto di aminoacidi quali glutammina e arginina. L’insieme complessivo di queste alterazioni conduce alla perdita di integrità ed all’aumento della permeabilità della barriera intestinale, condizioni che sono alla base dello sviluppo della traslocazione batterica ed in maniera particolare contribuiscono all’estensione dello stato infiammatorio ed allo sviluppo di SIRS in soggetti affetti da pancreatite grave41,42. NPO (Nihil per os), “niente per bocca” rappresenta un concetto storico nel trattamento della pancreatite acuta nell’uomo e nel cane riguardante la necessità di mettere “a riposo” l’attività esocrina delle cellule pancreatiche dal feed-back positivo dovuto alle stimolazioni provenienti dalla presenza dei vari principi nutritivi all’interno del lume intestinale e proteggere così il parenchima pancreatico dall’estensione del processo autodigestivo. Questa teoria è stata in questi ultimi anni messa in discussione da quanto riportato in vari studi sperimentali e clinici43,44 in base ai quali le secrezioni pancreatiche esocrine appaiono fondamentalmente diminuire in corso di pancreatite ed in genere durante tutte le infiammazioni gravi a carattere sistemico. Inoltre studi condotti sul cane contestano l’esistenza di un significativo feed-back positivo tra la presenza di nutrimento nel lume del duodeno e del digiuno e l’aumento delle secrezioni esocrine pancreatiche43,50. La presenza di alimento nel lume intestinale viene indicata come il principale stimolo alla rigenerazione della mucosa intestinale, alla liberazione dei fattori di crescita ed al ripristino di un adeguato flusso sanguigno. Inoltre l’alimentazione enterale appare in grado di ridurre la produzione di citochine di origine splancnica, modulare la risposta infiammatoria acuta e ridurre la perdita di proteine mediante l’attenuazione del catabolismo. Nella gestione della pancreatite grave è dunque fondamentale provvedere in maniera precoce alle necessità energetiche connesse al grave stato infiammatorio e parimenti al mantenimento dell’integrità della barriera gastro-intestinale. Vari modelli sperimentali di pancreatite nel cane hanno dimostrato i vantaggi connessi all’utilizzo dell’alimentazione enterale (EN), intraluminale, rispetto l’impiego della nutrizione parenterale (PN), endovenosa, riguardo alla modulazione dell’infiammazione pancreatica e alla diminuzione del rischio di traslocazione batterica44. Inoltre studi clinici comparativi45,46 nell’uomo hanno confermato i vantaggi della EN nella riduzione dell’insorgenza delle complicazioni batteriche e dei tempi dell’ospedalizzazione rispetto alla PN. Mancano ad oggi studi di revisione sistematica e di metaanalisi che comparino EN e PN allo stato di digiuno completo e valutino in maniera più oggettiva l’efficacia terapeutica in modo indipendente dalle complicazioni connesse alle diverse tecniche nutrizionali (PN/EN). Nutrizione Parenterale La nutrizione parenterale consiste nella somministrazione per via endovenosa di principi nutritivi elementari quali glucosio, aminoacidi e lipidi a scopo energetico. Viene distinta in nutrizione parenterale totale (TPN) e parziale (PPN) a seconda della quantità di calorie apportate in relazione alle richieste energetiche identificate in base al calcolo del RER (Resting Energy Requirement) mediante la seguente formula RER = 30 x (peso corporeo Kg) + 70 per animali compresi tra i 3 ed i 25 Kg, RER = 70 x (peso corporeo Kg)0,75 per animali sotto i 3 Kg o sopra i 25 Kg. Nella TPN vengono somministrati per via venosa centrale (vena giugulare) le quantità di glucosio, lipidi e aminoacidi pari alle Kcal indicate dalla RER, nella PPN la somministrazione può avvenire per via venosa periferica (vena cefalica, vena safena) e le quantità in Kcal sono pari al 70% della RER (tabella VIII). Nei soggetti affetti da pancreatite grave l’utilizzo della nutrizione parenterale è limitato dal rischio d’insorgenza delle complicazioni connesse alla gestione del catetere, allo sviluppo di alterazioni legate al metabolismo, all’osmolarità plasmatica e agli squilibri elettrolitici (tabella IX). La PPN è la forma di nutrizione parenterale maggiormente utilizzata nei soggetti affetti da pancreatite grave in relazione alla minor concentrazione osmolare e al minor impatto metabolico. La PPN viene utilizzata soprattutto in quei soggetti che sviluppano una completa intolleranza riguardo alla EN in tutte le sue forme e laddove persista uno stato di prolungata anoressia (> 4-5 gg). La somministrazione delle necessarie calorie in PPN dovrebbe avvenire sempre in maniera graduale e progressiva per evitare complicazioni legate allo sviluppo di nausea e di vomito e delle alterazioni elettrolitiche compatibili (Na, P, K). Il volume di nutrizione parenterale viene calcolato in base al 30% della RER al primo giorno di somministrazione, al 50% della RER al secondo giorno fino alla somministrazione del 70% della RER al terzo giorno. L’aumento progressivo del volume e della quantità delle calorie è reso possibile dalla valutazione del grado di tolleranza del paziente alla somministrazione PPN (assenza dei sintomi e delle alterazioni elettrolitiche e glicemiche). Le soluzioni per la PPN hanno caratteristiche di osmolarità compatibili con l’impiego venoso periferico (vena cefalica, vena safena) il che comporta l’utilizzo di soluzioni di partenza a ridotta osmolarità (es. glucosio al 5% piuttosto che soluzioni al 50%) e l’impiego di elevati volumi d’infusione (1500 ml per 20 Kg di peso corporeo nel cane). Per questo motivo le soluzioni PPN vengono somministrate preferibilmente in infusione continua ad una velocità di 2 – 3 ml/Kg/ora. Nutrizione Enterale L’impiego della EN nella pancreatite grave del cane avviene mediante il posizionamento nelle prime 12 ore dal ricovero di una sonda enterale preferenzialmente per via naso-digiunale, gastrodigiunale o naso-gastrica. La nutrizione enterale digiunale trova impiego in tutti quei pazienti dove la somministrazione gastrica non viene tollerata. La EN digiunale può essere effettuata per via chirurgica laparotomica o transcutanea, ma le complicazioni legate all’invasività delle procedure e allo stress esercitato sul paziente possono risultare importanti (peritonite settica, infiammazioneinfezione della ferita chirurgica, dislocamento ed occlusione della sonda) e tali da sconsigliarne il ricorso. Metodi alternativi nel posizionamento della sonda digiunale vedono l’utilizzo dell’endoscopia e della fluoroscopia47,48 e riconoscono tre diverse tecniche: a) tecnica “ pull- along” per la quale si rende necessaria l’assistenza endoscopica e l’utilizzo di pinze endoscopiche “grasping-forceps” di solito a dente di topo o ad alligatore con cui agganciare l’estremità della sonda digiunale alla quale può essere applicata una sutura fino al posizionamento della stessa in digiuno; b) tecnica di “Seldinger” che prevede l’iniziale posizionamento in endoscopia o fluoroscopia di una sonda-guida nel digiuno cui far seguire quello della sonda alimentare; c) tecnica “push-along” che prevede il posizionamento nel digiuno attraverso la spinta manuale diretta della sonda enterale fino ed attraverso il piloro, passaggio che può essere facilitato dall’utilizzo in endoscopia delle “grasping-forceps” utili nel direzionare la punta della sonda. Il posizionamento della sonda naso-digiunale prevede necessariamente l’impiego dell’anestesia generale (es. butorfanolo 0,05mg/Kg IV + diazepam o lorazepam 0,5 mg/Kg EV + propofol 2 – 6 mg/Kg EV e mantenimento in isofluorano ed ossigeno) e l’utilizzo di sonde enterali specifiche (Entriflex, Dobbhoff, Fredrick Miller) del diametro medio di circa 8 French e di materiale anallergico, elastico e distendibile al fine di evitare il rischio di complicazioni quali l’infiammazione della mucosa nasale, lo stimolo allo starnuto, epistassi, rottura dei punti di sutura con dislocazione della sonda, occlusione del lume dovuto ad ostruzione secondaria alla somministrazione del cibo o alla formazione di restringimenti o pieghe angolari48. La nutrizione digiunale presenta alcune difficoltà legate alla disponibilità delle strumentazioni necessarie (endoscopio o fluoroscopio), alla realizzazione tecnica e ai tempi di esecuzione (in media 35 – 40 minuti). Recentemente uno studio su 10 cani affetti da pancreatite grave ha dimostrato come la nutrizione enterale pre-pilorica (gastrica) condotta per via esofagostomica possa essere considerata una valida alternativa all’alimentazione digiunale in quanto facile, di rapida esecuzione e non associata a rilevanti complicazioni quali vomito, nausea o dolore addominale 42 . Le diete enterali destinate al supporto nutrizionale in pazienti affetti da pancreatite grave presentano caratteristiche specifiche correlate all’elevato grado di digeribilità e di assorbimento, all’elevata efficienza nell’utilizzo metabolico e nella riduzione del residuo alimentare, alla facilità di somministrazione. La nutrizione enterale in soggetti anoressici deve inoltre essere ben tollerata dalla mucosa gastro-intestinale per non esitare nell’aggravamento dello stato irritativo-flogistico preesistente. Nei cani affetti da pancreatite acuta l’alimento enterale ha la primaria funzione di soddisfare le necessità caloriche secondarie al grave stato infiammatorio, corrispondere ai requisiti di elevata digeribilità compatibili con la via di somministrazione preferenziale (naso-digiunale, naso-gastrica) ed attenersi alle principali caratteristiche qualitative (es. ridotto tenore in grassi e fibra non digeribile, aumentato tenore proteico) che possano apportare i benefici diretti all’integrità della mucosa intestinale con il minimo grado di stimolazione dell’attività pancreatica. In merito a quest’ultima considerazione, viene evidenziato come, ad oggi, non esistano studi nel cane che documentino in maniera chiara l’effetto delle varie combinazioni dietetiche sulla risposta infiammatoria pancreatica e sulla stimolazione dell’attività pancreatica. Interessante quanto riportato in un recente studio condotto su cani sani dove non è apparso significativo lo stimolo derivante dalla somministrazione di diete a vario contenuto in grasso sull’attività esocrina pancreatica valutata attraverso la concentrazione sierica del TLI e del cPLI50. Attualmente le diete commerciali utilizzate nella nutrizione enterale sono numerose e principalmente suddivisibili in due gruppi: le diete polimeriche, che trovano indicazione nei pazienti con una mantenuta funzionalità gastro-intestinale e le diete a formulazione definita rivolte a quelle condizioni associate al ridotto assorbimento intestinale. Le diete polimeriche contengono macronutrienti proteici quali caseina, soia, proteine dell’uovo, trigliceridi a medialunga catena, carboidrati complessi, vitamine idro e liposolubile ed elettroliti, con una densità calorica pari a 1ml/1,5 Kcal ed una osmolarità media di circa 350mOsm/Kg. Sono indicate soprattutto per vie di somministrazione naso-esofagea, naso-gastrica o gastrica percutanea (PEG) in quei soggetti dove lo stato di anoressia non è prolungato e l’integrità funzionale del tratto gastroenterico si ritiene mantenuta. Varie sono le formulazioni commerciali che possono trovare corrispondenza nell’alimentazione enterale naso-gastrica, naso-esofagea o gastrica-transcutanea come diete polimeriche (vedi tabella X). Le diete a formulazione definita, invece, contengono di solito peptidi e principi nutritivi elementari, polimerici in forma predigerita (es. Peptamen Nestlè Health care). La fonte proteica è rappresentata da peptidi e da aminoacidi, i carboidrati sono maggiormente oligosaccaridi o monosaccaridi, basso è il contenuto in grassi che sono prevalentemente costituiti da trigliceridi a media-catena, presenti inoltre complessi vitaminici, amminoacidici ed elettroliti. Le diete a formulazione definita trovano generale indicazione nei soggetti affetti da patologie multi-organiche con alterata funzionalità gastro-intestinale e possibile coinvolgimento sistemico e sono impiegate nella somministrazione naso-digiunale, esofagodigiunale e gastro-digiunale. Ciononostante recenti studi hanno valutato l’impiego di diete polimeriche liquide (es. Clin Care Abbott Animal Health) nell’alimentazione digiunale senza evidenziare differenze significative riguardo la presenza di effetti collaterali quali nausea e vomito e l’andamento clinico-prognostico. Notevole importanza riveste la supplementazione di complessi amminoacidici essenziali quali arginina (350 mg/giorno), glutammina (> 500 mg/giorno) e taurina (> 250mg /giorno) nella nutrizione enterale dei cani affetti da pancreatite grave in ragione della sostanziale alterazione del profilo amminoacidico rappresentata dalla carenza di amminoacidi ramificati (BCAA) (arginina, serina, glicina, metionina, glutammina, alanina, citrullina) e dall’alterato rapporto BCAA/AAA (aminoacici aromatici, fenilalanina, tirosina) compatibili con la gravità dello stato infiammatorio51. Le linee guida generali per la somministrazione della EN sono sommariamente descritte in tabella XI. Le quantità in Kcal da fornire con la EN nel cane affetto da pancreatite grave possono essere quelle espresse dal calcolo della MER (Metabolic Energy Requirements), ottenuto dal prodotto della RER [Resting Energy Requirement = 30 x (peso corporeo Kg) + 70 per animali compresi tra i 3 ed i 25 Kg, RER = 70 x (peso corporeo Kg)0,75 per animali sotto i 3 Kg o sopra i 25 Kg ] per un fattore che correla le necessità energetiche alla stato di malattia ed è pari a 1,3 (MER = RER x 1,3) . La quantità in Kcal determinata dalla MER viene quindi convertita in mL/Kg/ giorno a seconda della densità calorica caratteristica della dieta enterale considerata (es. Clini Care = 1 Kcal /1,0 ml, se 481 Kcal sono le Kcal espresse dalla MER di un cane di 10 Kg, 481 ml è il volume di EN da somministrare al giorno). Il volume (ml) ottenuto può essere somministrato in due modalità diverse, attraverso boli intermittenti intervallati da 4 – 6 ore l’uno dall’altro o attraverso la somministrazione continua (ml/ora). La somministrazione enterale continua appare preferibile a quella intermittente per la minor incidenza di complicazioni legate alla quantità di volume somministrato e all’impatto sulla mucosa gastro-intestinale ed è quindi associata ad un grado maggiore di tolleranza da parte del paziente. L’alimentazione enterale deve comunque seguire una somministrazione graduale e progressiva in modo da non provocare nel paziente sintomi quali vomito, nausea, dolorabilità addominale. Nelle prima somministrazione il volume giornaliero deve essere pari circa a 1/3 della MER totale calcolata, la quota calorica viene quindi aumentata progressivamente nei due giorni a seguire fino ad ottenere la somministrazione del 100% della MER giornaliera. La somministrazione enterale può avvenire attraverso l’uso di pompe specifiche per EN (es. Medfusion 2012, Kangaroo), ideali per ottenere un’infusione costante, o per semplice caduta utilizzando una sacca (bottiglia) vuota di fluidi collegata alla sonda alimentare attraverso un deflussore. La dieta non deve essere somministrata fredda ma ad una temperatura compresa tra i 25 ed i 35°C per evitare contrazioni o crampi intestinali ed occorre effettuare costante pulizia del lume della sonda alimentare mediante l’infusione di 3- 5 ml di soluzione fisiologica tiepida prima e dopo l’utilizzo. Il pasto enterale deve essere controllato e sostituito al massimo ogni 8 ore per evitare alterazioni organolettiche e igieniche dello stesso. Il paziente viene strettamente controllato dal punto di vista clinico per escludere lo sviluppo di complicazioni quali sintomi gastro-enterici (vomito, diarrea, dolorabilità addominale), e laboratoristici (glicemia, alterazioni elettrolitiche, Na, K, P) in particolare durante e dopo la somministrazione di diete enterali ad osmolarità ed densità calorica elevate e/o di volumi considerevoli. Corticosteroidi I corticosteroidi sono stati per molto tempo considerati fra i farmaci potenzialmente in grado di indurre pancreatite acuta nel cane in merito all’ associazione tra l’aumento degli enzimi pancreatici non specifici (amilasi e lipasi sieriche) e l’impiego di desametasone riportata in alcuni tra i primi studi condotti sull’argomento. Questi studi peraltro non sono mai riusciti a documentare nessun tipo di effetto diretto degli steroidi sul tessuto pancreatico52. Anche se teoricamente ogni farmaco è in grado di scatenare pancreatite acuta nel cane attualmente non vi sono dimostrazioni evidenti riguardo la somministrazione dei corticosteroidi. Il ruolo dei corticosteroidi nella terapia della pancreatite è ad oggi riconsiderato alla luce dell’ evidente azione esplicata dagli stessi sulla totalità delle vie dell’infiammazione. Infatti i corticosteroidi esplicano un potente effetto anti-infiammatorio attraverso l’inibizione del rilascio dei mediatori pro-infiammatori e la riduzione a) del sequestro dei neutrofili a livello del circolo polmonare, b) dell’adesione leucocitaria alla superficie endoteliale a livello dei capillari polmonari, c) del rilascio di elastasi e dei radicali liberi dai neutrofili attivati d) della permeabilità vascolare. Recentemente è stato proposto un ruolo anti-infiammatorio specifico dei corticosteroidi nei confronti della pancreatite relativamente alla capacità di aumentare il grado di apoptosi e di conseguenza la produzione di proteine-associate alla pancreatite (PAP) che eserciterebbero un effetto protettivo sul tessuto pancreatico nei confronti dell’infiammazione53. Un’ altra possibile indicazione dell’impiego dei corticosteroidi nella pancreatite acuta grave è in relazione allo sviluppo dell’insufficienza surrenalica secondaria al grave stato infiammatorio. La CIRCI (Critical Illness-Related Corticosteroid-Insufficiency) si verifica in quelle condizioni di assoluta resistenza tissutale agli effetti dei corticosteroidi che possono incorrere a seguito di un grave e prolungato stato infiammatorio54. In particolare l’impiego di idrocortisone a basso dosaggio è addirittura raccomandato nello shock ipolemico endotossico nell’uomo in caso di ipotensione non responsiva alla terapia convenzionale (fluidi e farmaci vasopressori), e del metilprednisone nel danno polmonare acuto55. L’impiego dei corticosteroidi in corso di pancreatite nell’uomo e nel cane è ancora oggetto di valutazione. Punti chiave Nel cane la predisposizione genetica non è ancora del tutto chiarita, i fattori di rischio principali sono legati alle condizioni di ischemia-ipoperfusione d’organo, alla dieta, obesità, somministrazione di farmaci, condizioni che favoriscono il reflusso pancreatico. Anoressia, dolore addominale, vomito sono i segni clinici aspecifici che accompagnano le forme clinicamente “evidenti” di pancreatite. Le forme lievi di solito presentano sintomatologia da assente a lieve Il coinvolgimento di vari organi ed apparati è associato a pancreatite grave e comporta una prognosi peggiore. Le alterazioni emato-biochimiche sono aspecifiche e per lo più legate allo stato di ipoperfusione d’organo-ipovolemia e allo sviluppo di una malattia infiammatoria sistemica. Gli aspetti più significativi di diagnostica per immagine sono rappresentati dai rilievi ecografici che hanno una sensibilità e specificità pari al 68%. L’indagine ecografica, oltre che operatore e strumento dipendente, mostra differenti aspetti in base alla gravità, durata e diffusione dell’infiammazione tissutale pancreatica e peripancreatica L’aumento delle lipasi pancreatiche specifiche cPL rappresenta il test più sensibile per la diagnosi di pancreatite canina. La gestione della pancreatite del cane comprende: Terapia fluida per il ripristino della perfusione periferica e della funzionalità del microcircolo attraverso la somministrazione di cristalloidi e colloidi in associazione. Gestione del dolore mediante l’utilizzo di analgesici adeguato all’intensità del dolore viscerale (spt oppiodi). Gestione del vomito e terapia antiacida (uso di antiemetici ad azione centrale e di antiacidi efficaci). Gestione Alimentare: ruolo centrale dell’alimentazione Enterale in caso di pazienti anoressici. Alimentazione Parenterale in caso di intolleranza alla prima ed per stati di anoressia prolungata. Bibliografia 1) STEINER JM, Canine Pancreatic Disease, In Textbook of Veterinary Internal Medicine, Ettinger SJ, Feldmann EC (eds) Saunders Elsevier, 7^ ed. Vol. 2: 1695-1701 2010 2) HESS RS, KASS PH, VAN WINKLE TJ, WASHABAU RJ. Evaluation of risck factors for fatal acute pancreatitis in dogs. Journal of American Veterinary Medical Association, 214 (1):46-51, 1999 3) MANSFIELD C. Pathophysiology of Acute Pancreatitis: Potential application from experimental models and Human Medicine to Dogs. Journal Veterinary Internal Medicine, 26:875-887, 2012 4) DIMAGNO EP, CHIARI S. Acute pancreatitis. In: Feldman M, Friedman LS, Sleisemger MH (eds) Gastrointestinal and liver disease. Philadelphia,WB Saunders. 913-941. 2002 5) BISHOP MA, JORG JM, LISA EM et al. Evaluation of the trypsinogen cationic gene for potential mutations in miniature Schnauzer with pancreatitis. The Canadian journal of Veterinary Research. 68:315-318, 2004 6) WATSON PJ, ROULOIS A, SCASE T, et al. Characterization of chronic pancreatitis in English Cocker Spaniels. Journal of Veterinary Internal Medicine, 25(4):797-804, 2011 7) LEM KY, FOSGATE GT, NORBY B, at al. Associations between dietary factors and pancreatitis in dogs. Journal of American Veterinary Medical Association, 233:1425-1431, 2008 8) XENOULIS PG, SUCHODOLSKI SJ, SWIN E, et al. Correlation of serum triglyceride and canine lipase immunoreactivity (cPLI) concentration in Miniature Schnauzer. Journal of Veterinary Internal Medicine, 20: 750-751, 2006 9) MÖHR AJ, LOBETTI RG, VAN DER LUGT JJ. Acute pancreatitis: a newly recognised potential complication of canine babesiosis. Journal Sud African Veterinary Association, 71(4):232-9, 2000. 10) MICH PM, HELLYER PV. Objective, categoric methods for assessing pain and analgesia. In Textbook of Veterinary Pain Management, Gaynor JS, Muir WW (eds), Mosby Elsevier 2^ ed. Cap. 6: 78-109, 2009 11) MANSFIELD CS, FLEUR EJ, ROBERTSON ID, Development of severity index for dogs with acute pancreatitis. Journal of American Veterinary Medical Association, 233 (6):936-944. 2008 12) HESS RS, SAUDERS HM, VAN WINKLE TJ, et al. Clinical, clinical-pathologic, radiographic and ultrasonographic abnormalities in dogs with fatal acute pancreatitis: 70 cases (1986-1995). Journal of American Veterinary Medical Association, 213(5). 665-70. 1998 13) PASTORE GE, LAMB CR, LIPSCOMB V. Comparison of the results of abdominal ultrasound and exploratory laparotomy in the dog and cat. Journal of American Hospital Association, 43(5): 264-269, 2007 14) LAMB CR. Pancreatic edema in dogs with hypoalbuminemia or portal hypertension. Journal of Veterinary Internal Medicine, 13(5):498-500, 1999 15) NEWMAN SJ, STEINER JM, WOOSLEY K, et al. Correlation of age and incidence of pancreatic exocrine nodular hyperplasia in the dog. Veterinary Pathology, 42(4):510-3 16) SPILLMANN T, LITZLBAUER HD, MORITZ A, et al: Computed tomography and laparoscopy for the diagnosis of pancreatic diseases in dogs, Proceedings of the 18th Forum of the ACVIM, Seattle, p 485, 2000, 17) JAEGER JQ, MATTOON JS, BATEMAN SW, et al. Combined use of ultrasonography and contrast enhanced computed tomography to evaluate acute necrotizing pancreatitis in two dogs. Veterinary Radiology and ultrasound, 44(1):77-79, 2003 18) KOOK PH, BALOI P, RUETTEN M, et al. Feasibility and safety of endoscopic ultrasound fine needle aspiration of the pancreas in dog. Journal of Veterinary Internal Medicine, 26(3):513517, 2012 19) STEINER JM, WILLIAMS DA. Development and validation of a radioimmunoassay for the measurement of canine pancreatic lipase immunoreactivity in serum of dogs. American Journal of Veterinary Research, 64: 1,237- 1, 241, 2003 20) STEINER JM, TEAGUE SR, WILLIAMS DA. Development and analytic validation of an enzyme-linked immunoassay for the measurement of canine pancreatic lipase immunoreactivity in serum. Canadian Journal of Veterinary Research, 67: 175-182, 2003 21) STEINER JM, NEWMAN SJ, XENOULIS PG, et al. Sensitivity of serum markers for pancreatitis in dogs with macroscopic evidence of pancreatitis. Veterinary Therapeutics, 9:263272, 2008 22) MANSFIELD CS, ANDERSON GA, O’HARA AJ. Association between canine specific pancreatic lipase (Spec-cPLTm) and histologic exocrine pancreatic inflammation in dogs: assessing specificity. Journal of Veterinary Diagnostic Investigation. 2012 (in stampa). 23) HAWORTH M, SWINDELLS K, HOGOOD G, et al. Clinical utility of SNAP cPL in dogs with acute abdominal disease (abstract). Australian College of Veterinary Scientist, College Science Week Proceedings. 2011 24) McCORD K, MORLEY PS, ARMSTRONG J, et al. A Multi-Institutional Study Evaluating the Diagnostic utility of Spec cPLTM and SNAP®cPLTM in Clinical Acute Pancreatitis in 84 Dogs. Journal of Veterinary Internal Medicine, 26: 888-896, 2012 25) TRIVEDI S, MARKS SL, KASS PH, et al. Sensivity and Specificity of Canine PancreasSpecific Lipase (cPLI) and Others Markers for Pancreatitis in 70 Dogs with and without Histopathologic Evidence of Pancreatitis. Journal of Veterinary Internal Medicine, 25: 12411247, 2011 26) MANSFIELD CS, Clinical diagnosis and Management of Canine Acute Pancreatitis, In Companion Animal Nutrition Summit, Nestlé Purina, The Gastrointestinal Tract in Health and Disease, pre-print, 61-69. 2012 27) MANSFIELD CS. Specificity and sensivity of serum caninum pancreatic elastase-1 concentration in the diagnosis of pancreatitis. Journal of Veterinary Diagnostic Investigation, 23:691-697. 2011 28) TRIKUDANATHAN G., NAVANEETHAN U, SWAROOP V S. Current Controversies in Fluid Resuscitation in Acute Pancreatitis. A Systematic Review. Pancreas, 41: 827-834, 2012 29) YU DH, NOH DH SONG RH, et al. Ethyl Pyruvate Downregulates Tumor Necrosis Factor Alplha and Interleukin (IL)-6 and Up-regulates IL-10 in Lipopolysaccharide-Stimulated Canine Peripheral Blood Mononuclear Cells. Journal of Veterinary Medical Science, 72(10): 13791381, 2010 30) HOPPER K, SILVERSTEIN D, BATEMAN S. Shock Syndromes. In Di Bartola (ed) Fluid, Electrolyte, and Acid-Base disorders in Small Animal Practice, 4^ ed, Elsevier Saunders: 564569, 2012 31) FREITAG M, STANDK TG, KLEINHANS H et al. Improvement of impaired microcirculation and tissue oxygenation by hemodilution with hydroxyethyl starch plus cell-free hemoglobin in acute porcine pancreatitis. Pancreatology, 6(3): 233-239, 2006 32) HONENHAUS AE. Blood transfusion and blood substitutes. In Di Bartola (ed) Fluid, Electrolyte, and Acid-Base disorders in Small Animal Practice, 4^ ed, Elsevier Saunders: 587, 2012 33) WEATHERTON LK, STREETER EM. Evaluation of fresh frozen plasma administration in dogs with pancreatitis: 77 cases (1995-2005). Journal of Veterinary Emergency and Critcal Care (San Antonio). 19:617.622 34) SNOW SJ, ARI JUTKOWITZ L, BROWN AJ. Trends in plasma transfusion at a veterinary teaching hospital: 308 patients (1996-1998 and 2006-2008). Journal of Veterinary Emergency and Critcal Care (San Antonio) 20(4):441-5, 2010 35) KARANIJA ND, WIDDINSON AL, LUTRIN FJ, et al. The effect of dopamine in a model of biliary acute hemorragic pancreatitis. Pancreas. 6: 392-397 36) PASTOR CM, FOSSARD JL. Are genetically modified mice useful for the understanding of acute pancreatitis? Fed of American Societes for Exp Biol J. 15: 893-897, 2001 37) OGILVIE GK. Dolasetron: a new option for nausea and vomiting. Journal of American Animal Hospital Association. 36: 481-483. 2000 38) WATERFORD SD, KOLODECIK TR, THROWER EC, et al. Vacuolar ATPase regulates zymogen activation in pancreatic Acini. Journal of Biological Chemistry. 280,5: 430-5 39) HACKET T, TUDOR S, FELIX K, et al. Effect of pantoprazolo in experimental acute pancreatitis. Life Sciences. 87:551-557. 2010 40) TOLBERT K, BISSET S, KING A, et al. Efficacy of oral famotidine and 2 omeprazole formulations for the control of intragastric pH in dogs. Journal of Veterinary Internal Medicine. 25: 47-54. 2011 41) IOANNIDIS O, LAVRENTIEVA A, BOTSIOS D. Nutrition support in acute pancreatitis. Journal of Pancreas , 9: 373-390. 2008 42) MANSFIELD CS, JAMES FE, STEINER JM, et al. A Pilot Study to Asses Tolerability of Early Enteral Nutrition via Esophagostomy Tube Feeding in Dogs with Severe Acute Pancreatitis. Journal of Veterinary Internal Medicine, 25:419-425. 2011 43) NIDERAU C, NIDERAU M, LUTHEN R, et al. Pancreatic exocrine secretions in experimental acute pancreatitis. Gastroenterology, 99: 1120-1127. 1990 44) QIN HL, SU ZD, HU LG, et al. Effect of parenteral and early intrajejunal nutrition on pancreatic digestive enzyme synthesis, storage and discharge in dog models acute pancreatitis. World Journal of Gastroenterology, 13: 1123-1128, 2007 45) MARIK PE, ZALOGA GP. Meta-analysis of parenteral nutrition versus enteral nutrition in patients with acute pancreatitis. British Medical Journal, 328: 1407-1412. 2004 46) PETROV MS, KUKOSH MV, EMELYANOV NV. A randomized controlled trial of enteral versus parenteral feeding in patients with predicted acute pancreatitis shows a significant reduction in mortality and in infected pancreatic complications with total enteral nutrition. Digestive Surgery, 23:336 – 344. 2006 47) CAMPBELL SA, DALEY CA. Endoscopically assisted nasojejunal feeding tube placement: technique and results in five dogs. Journal of American Animal Hospital Association, 47(4): e50-55. 2011 48) BEAL MW, BROWN AJ. Clinical experience utilizing a novel fluoroscopic technique for wireguided nasojejunal tube placement in dog: 26 cases (2006-2010). Journal of Veterinary Emergency and Critical Care, 21(2): 151-157. 2011 49) CROWN DT, DEVEY JJ. Clinical experience in jejunostomy feeding tubes in 47 small animal patients. Journal of Veterinary Emergency and Critical Care, 7:7-19. 1997 50) JAMES FE, MANSFIELD CS, STEINER JM, et al. Pancreatic stimulation in healthy dogs fed different diets. American Journal of Veterinary Research, 70: 614-618. 2009 51) CHAN DL, ROZANSKI EA, et al. Relationship among Plasma Amino-Acid, C-reactive Protein, Illness Severity, and Outcome in Critically Ill Dogs. Journal Veterinary Internal Medicine 23:559-563. 2009 52) IMAHORI SC, STUDLEY JG, SCHENK WG. Experimental acute pancreatitis in dogs and effects of steroids. A light and electron microscopy study with reference to pathogenesis. Pathology Research and Practice, 178:483-490. 1984 53) ZANGH H, KANDIL E, LIN Y-Y, et al. Targeted inhibition of gene expression of pancreatitis –associated proteins exarcebates the severity of acute pancreatitis in rats. Scandinavian Journal of Gastroenterology, 39: 870-881. 2004 54) PEYTON JL, BURKIT JM. Critical Illness related Corticosteroid insufficiency in a dog with septic shock. Journal Veterinary Emergency and Critical Care, 19(3): 262-268. 2009 55) MARIK PE, PASTORES SM, ANNANE D, et al. Recommendations for diagnosis and management of corticosteroid insufficiency in critically ill adult patients: consensus statements from an international task force by American College of Critical Care Medicine. Critical Care Medicine, 36: 1937-1949. 2008 56) ASTE G, DI TOMMASO M, STEINER JM, et al. Pancreatitis associated in N-MethylGlucamine therapy in a dog with canine Leishmaniasis. Veterinary Research Communications, (suppl 2) 269-272. 2005
Scarica