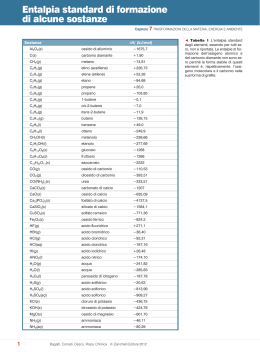
NOMENCLATURA DI COMPOSTI CHIMICI I composti chimici possono essere suddivisi in: • Composti binari: formati da due atomi diversi. • Composti ternari: formati da tre atomi diversi. Ci sono comunque alcune eccezioni che verranno trattate in seguito. COMPOSTI BINARI Si possono suddividere in: • OSSIDI • ANIDRIDI • IDRACIDI • SALI (Da svolgere in seguito) OSSIDI: Sono composti binari formati da METALLO e OSSIGENO nell'ordine citato. Per poter scrivere direttamente la formula di un ossido bisogna ricorrere alle VALENZE ( o NUMERI DI OSSSIDAZIONE) riportati sulla tavola periodica. Nel caso di OSSIDI la VALENZA da considerare è sempre quella con segno positivo relativamente al metallo, mentre l'ossigeno riporta sempre la valenza: - 2. Poichè la molecola è elettricamente neutra il numero di “valenze” positive del metallo deve eguagliare il numero di “valenze” negative dell'ossigeno; questo si ottiene solitamente “incrociando” i numeri di valenza, ad esempio: O(-2) Na(+1) e Na(+1) Costruiamo la formula: O(-2) Incrociamo le valenze in valore assoluto! Na2O1; ; nel caso compaia il numero “1” questo viene sottinteso, quindi la formula finale è: Na2O Nel caso che, incrociando le valenze, si ottengano numeri semplificabili è obbligatorio semplificarli, ad esempio: Pb(+4) O(-2) (incrocio) → Pb2O4 (semplifico) → PbO2 (Formula finale) Occupiamoci ora della nomenclatura comune (La nomenclatura IUPAC è poco utilizzata nei composti inorganici). Quando un metallo riporta una sola valenza il nome dell'ossido è formato da: OSSIDO di …...................... ( seguito dal nome del metallo) Ad es: Na2O = OSSIDO di SODIO Quando un metallo riporta due valenze (è l'unico caso che considereremo!) il nome dell'ossido viene caratterizzato dall'uso di SUFFISSI legati al nome del metallo: si usa il suffisso -OSO quando viene presa in considerazione la valenza più bassa, si usa il suffisso -ICO quando viene presa in considerazione la valenza più alta. Cu(+2)O(-2) (incrocio e semplifico) → CuO OSSIDO RAMEICO. Quando viene assegnato il nome di un OSSIDO si procede a rovescia , ad esempio se indico l'OSSIDO FERRICO scrivo i due atomi coinvolti tenendo conto che devo scegliere la valenza più alta del Ferro, ossia +3. La formula risulterà: Fe(+3)O(-2) quindi, dopo i soliti passaggi: Fe2O3 Per l'OSSIDO di POTASSIO invece non ci sono problemi di scelta: K(+1)O(-2) → K2O REAZIONI DI PREPARAZIONE: 4 Fe + 3 O2 → 2 Fe2O3 Alcuni Esercizi: Al2O3 FeO HgO Ag2O BaO = = = = = Ossido di alluminio Ossido ferroso Ossido mercurico Ossido di argento Ossido di bario Ossido Rameoso = Cu2O Ossido di Zinco = ZnO Ossido Aurico = Au2O3 Ossido di Litio = Li2O Ossido Ferrico = Fe2O3 ANIDRIDI Sono composti binari formati da NON METALLO e OSSIGENO nell'ordine citato. Si procede come per gli ossidi ed anche qui si utilizza solo la valenza positiva, mentre l'ossigeno riporta sempre la valenza -2. Cambia leggermente la nomenclatura che, anche per le anidridi, si basa sempre sul SUFFISSO. Bisogna premettere che alcune valenze per determinati non metalli sono poco usate, segnalo di seguito quelle da usare normalmente per costruire le anidridi: C → +4 N → +3e+5 S → +4e+6 Quando è riportata una sola valenza si usa il nome ANIDRIDE seguito dalla radice del non metallo e dal suffisso -ICA. Ad es. B(+3) O(-2) → B2O3 Anidride BORICA Quando sono riportate 2 valenze si usa il nome ANIDRIDE seguito dalla radice del non metallo e dal suffisso -OSA (per la valenza più bassa) o -ICA (per la valenza più alta). Ad es. P(+3) O(-2) → P(+5) O(-2) → P2O3 ANIDRIDE FOSFOROSA P2O5 ANIDRIDE FOSFORICA Un caso particolare è costituito dal gruppo degli alogeni (VII Gruppo A) nel quale sono disponibili 4 valenze, in questo caso si ricorrerà all'uso dei prefissi oltre che a quello dei suffissi. Elemento +1 Prefisso +3 Suffisso +5 +7 Prefisso Suffisso Prefisso Suffisso Prefisso Suffisso Cloro Ipo- -oso - -oso - -ico Per- -ico Bromo Ipo- -oso - -oso - -ico ---------------------- Iodio Ipo- -oso ---------------------- - -ico Per- -ico Poichè non esiste la valenza +7 per il Bromo, non esiste l'anidride Perbromica, come non esiste l'anidride Iodosa non esistendo la valenza +3 per lo iodio. Per risalire dal nome alla formula si procede al contrario, ad es. se indico l' ANIDRIDE CARBONICA devo scegliere la valenza più alta del carbonio (nel caso del carbonio l'unica disponibile): + 4; ora costruisco la formula: C(+4) O(-2) → C2O4 (semplifico) → CO2 REAZIONI DI PREPARAZIONE: 2 Cl2 + 7 O2 → 2 Cl2O7 Alcuni esercizi: B2O3 = Cl2O7 = SO3 = SiO2 = P2O3 = Anidride ipoclorosa Anidride arsenica Anidride nitrica Anidride carbonica Anidride iodica IDRACIDI Sono composti formati da IDROGENO e NON METALLO nell'ordine citato. Per poter scrivere la formula dell'idracido si considera l' IDROGENO sempre con valenza +1, mentre il NON METALLO viene considerato sempre con la sua valenza negativa. Di conseguenza gli idracidi sono pochi: H(+1) S(-2) → H(+1)F(-1) → H(+1)Cl(-1) → H(+1)Br(-1) → H(+1)I(-1) → H2S HF HCl HBr HI ACIDO SOLFIDRICO ACIDO FLUORIDRICO ACIDO CLORIDRICO ACIDO BROMIDRICO ACIDO IODRIDRICO La nomenclatura si indica con il termine ACIDO seguito dalla radice del NON METALLO e dal SUFFISSO: -IDRICO. COMPOSTI TERNARI Si possono suddividere in: • • • IDROSSIDI OSSIACIDI SALI (da svolgere in seguito) IDROSSIDI Un idrossido è un composto formato da METALLO, OSSIGENO E IDROGENO nella sequenza indicata ed è formato dalla reazione di un OSSIDO e ACQUA. La formula viene scritta indicando il simbolo del metallo seguito da tanti gruppi OH quant'è la valenza del metallo. la valenza del metallo viene ricavata dalla tavola periodica ed è indicata nella nomenclatura utilizzando il suffisso - OSO quando si considera la valenza più bassa e con il suffisso -ICO quando si considera la valenza più alta. Se è presente una sola valenza si indica il nome del metallo. Ad esempio: L' IDROSSIDO di ARGENTO è Ag (+1) che ha una sola valenza ed è perciò indicato con 1 gruppo OH, ed è quindi seguito da 2 gruppi OH AgOH. L' IDROSSIDO FERROSO utilizza il Fe con la valenza più bassa: Fe (+2) ed è quindi seguito da 2 gruppi OH Fe(OH)2. L' IDROSSIDO FERRICO utilizza il Fe con la valenza più bassa: Fe (+3) ed è quindi seguito da 3 gruppi OH Fe(OH)3. REAZIONI DI PREPARAZIONE: Fe2O3 + 3 H2O → 2 Fe(OH)3 Alcuni esercizi: Cu(OH)2 Al(OH)3 AuOH Ca(OH)2 HgOH = = = = = Idrossido di potassio Idrossido aurico Idrossido rameoso Idrossido di stronzio Idrossido ferroso OSSIADICI Un ossiacido (che per comodità dopo chiameremo acido) è un composto formato da IDROGENO , NON METALLO e OSSIGENO nell'ordine indicato ed è formato dalla reazione di ANIDRIDE più ACQUA. La formula viene scritta indicando per primo l' IDROGENO ( che ha sempre valenza +1), il NON METALLO (alla valenza prevista dalla nomenclatura) e, per ultimo, l' OSSIGENO (che ha sempre valenza -2), dei tre atomi che compaiono solo l'ossigeno può avere valenza negativa e deve essere rispettata la neutralità elettrica. Per ricavare la formula dalle valenze occorre però una condizione indispensabile: sapere quanti IDROGENI ci sono in quell'ossiacido! Questo può essere facilmente realizzato utilizzando la seguente tabella: Livello Gruppo III A Gruppo IV A Gruppo V A Gruppo VI A Gruppo VII A Numero di H presenti nell'ossiacido 2 B - H3 C - H2 N - H ------ ----- 3 ----- Si - H4 P - H3 S - H2 Cl - H 4 ----- ----- As - H3 Se - H2 Br - H 5 ----- ----- ----- Te - H2 I - H Conoscendo il numero di idrogeni che compete ad ogni ossiacido è possibile costruire la formula. La nomenclatura si rifà all'anidride da cui deriva l'ossiacido. Ad esempio se voglio costruire la formula dell'acido solforico procederò nel modo seguente: Scrivo il numero di H presenti nell'acido che contiene lo zolfo: H(+1)2. Poi scrivo la valenza corretta dello zolfo: essendo presente il suffisso -ICO devo scegliere la valenza più alta: +6: S(+6). Scrivo l'Ossigeno: O(-2) e faccio i calcoli relativi alla neutralizzazione delle cariche. H(+1)2S(+6)O(-2) Ci sono: 2 x +1 = +2 e +6 = +8 cariche positive, devono essercene altrettante negative, poiché ogni O(-2) devo prendere 4 O(-2) = -8 cariche negative. La formula è quindi : H2SO4. Data la formula, per risalire al nome si procede in modo contrario: si calcolano le cariche negative relative all'ossigeno e quelle positive relative all'idrogeno, per sottrazione si ricavano le cariche del non metallo. Ad es. H3PO4 Ci sono -2 x 4 = -8 cariche negative sull'ossigeno e ci sono +1 x 3 = + 3 cariche positive sull'idrogeno, per differenza devono esserci 8 – 3 = 5 cariche positive sullo zolfo, il che corrisponde alla valenza più alta disponibile quindi il nostro acido sarà :Acido Fosforico. REAZIONI DI PREPARAZIONE: P2O3 + 3 H2O → 2 H3PO3 Acido Fosforoso Dall'anidride risalgo alla valenza del fosforo (+3), quindi la applico all'acido e costruisco la formula. Alcuni esercizi: HClO2 = H2SO3 = H3AsO4 = HNO3 = HIO4 = Acido borico Acido ipobromoso Acido carbonico Acido fosforico Acido silicico Risoluzione degli esercizi proposti: OSSIDI: Al2O3 FeO HgO Ag2O BaO = = = = = Ossido di alluminio Ossido ferroso Ossido mercurico Ossido di argento Ossido di bario Ossido Rameoso = Cu2O Ossido di Zinco = ZnO Ossido Aurico = Au2O3 Ossido di Litio = Li2O Ossido Ferrico = Fe2O3 ANIDRIDI: B2O3 = Anidride borica Cl2O7 = Anidride perclorica SO3 = Anidride solforica SiO2 = Anidride silicica P2O3 = Anidride fosforosa Anidride ipoclorosa Cl2O Anidride arsenica As2O5 Anidride nitrica N2O5 Anidride carbonica CO2 Anidride iodica I2O5 IDROSSIDI: Cu(OH)2 Al(OH)3 AuOH Ca(OH)2 HgOH = = = = = Idrossido rameico Idrossido di alluminio Idrossido auroso Idrossido di calcio Idrossido mercuroso Idrossido di potassio KOH Idrossido aurico Au(OH)3 Idrossido rameoso CuOH Idrossido di stronzio Sr(OH)2 Idrossido ferroso Fe(OH)2 OSSIACIDI: HClO2 = Acido cloroso H2SO3 = Acido solforoso H3AsO4 = Acido arsenico HNO3 = Acido nitrico HIO4 = Acido periodico Acido borico H3BO3 Acido ipobromoso HBrO Acido carbonico H2CO3 Acido fosforico H3PO4 Acido silicico H4SiO4 SALI I sali possono essere: • Binari • Ternari • Con più atomi (Casi particolari) Per imparare a scrivere direttamente la formula di un sale occorre imparare a dissociare sia gli idrossidi che gli acidi (sia idracidi che ossiacidi). DISSOCIAZIONE IDROSSIDI: Dissociare un idrossido vuol dire separare il metallo (che darà origine ad un catione) dai gruppi OH che compongono la formula. Nella dissociazione utilizzeremo solo il catione metallico, mentre i gruppi OH che restano andranno a costituire l'acqua che è sempre uno dei prodotti di reazione. Il catione metallico proveniente dalla dissociazione dell'idrossido porta tante cariche negative quanti sono i gruppi OH presenti nella sua formula, ad esempio: (Ogni gruppo OH ha una carica – perchè risulta dal bilacio delle cariche: -2 per O e +1 per >H) Ancora : Al(OH)3 → Al+3 + 3 OHDISSOCIAZIONE IDRACIDI: Gli idracidi si dissociano separando l'H dal non metallo e ricordando che H vale sempre +1. Ad es, HCl → H+ + ClAncora: H2S → 2 H+ + S2- In questo caso siamo interessati all'anione! DISSOCIAZIONE OSSIACIDI: Gli idracidi si dissociano separando l'H+ dal resto della molecola e ricordando che H vale sempre +1. Il resto della molecola (composto generalmente da due atomi) riporta la carica negativa in numero pari al numero di idrogeni presenti nella formula. Ad es. HNO3 → H+ + NO3Ancora: H2SO4 → 2 H+ + SO42- Alcuni esercizi: Dissociare: H4SiO4 = H2S = H3PO4 = Fe(OH)3 = Ba(OH)2 = KOH = Risoluzione: 4 H+ + SiO442 H+ + S23 H+ + PO43- Fe3+ + 3 OHBa2+ + 2 OHK+ + OH- Una volta dissociati acidi (sia idracidi che ossiacidi) ed idrossidi si possono costruire i SALI. Un sale è formato dal CATIONE proveniente dall'idrossido unito all'ANIONE proveniente dall'acido. Va comunque mantenuta la neutralità elettrica!!! Essendo il residuo acido (cioè l'ANIONE) spesso formato da più atomi, bisogna considerarlo come una unica entità . Per quanto riguarda la nomenclatura bisogna che essa tenga conto di entrambe le componenti da cui derivano i sali, per questo motivo si segnala PER PRIMO il residuo acido il cui suffisso viene cambiato in: -ITO se proviene da un ossiacido che termina in -OSO -ATO se proviene da un ossiacido che termina con -ICO -URO se proviene da un idracido che termina con il suffisso -IDRICO. I prefissi IPO- e PER- relativo agli ossiacidi derivanti da elementi del'VIII gruppo A (Alogeni) rimangono invariati. Il resto della nomenclatura deriva dall' IDROSSIDO e mantiene la nomenclatura del catione: - di ….............. (nome del metallo) - ….................... (nome del metallo), suffisso -OSO per la valenza più bassa - ….................... (nome del metallo), suffisso -ICO per la valenza più alta. Facciamo qualche esempio: Vogliamo costruire il CARBONATO DI SODIO Dalla nomenclatura si evince che l'anione proviene dall'ACIDO CARBONICO riferimento è quello DI SODIO. e l'drossido di Acido Carbonico: H2CO3 → Residuo acido: CO32Idrossido di sodio: NaOH → Catione: Na+ Mettendo insieme i due ioni si ottiene l'acido, scrivendo prima il Catione poi l'Anione: Na+ CO32- = Na2CO3 Carbonato di sodio Vogliamo costruire l'IPOCLORITO DI BARIO Dalla nomenclatura si evince che l'anione proviene dall'ACIDO IPOCLOROSO riferimento è quello DI BARIO. e l'drossido di Acido ipocloroso: HClO → Residuo acido: ClOIdrossido di bario: Ba(OH)2 → Catione: Ba+2 Mettendo insieme i due ioni si ottiene l'acido, scrivendo prima il Catione poi l'Anione: Ba2+ ClO- = Ba(ClO)2 Ipoclorito di bario Vogliamo costruire il SOLFATO FERRICO Dalla nomenclatura si evince che l'anione proviene dall'ACIDO SOLFORICO riferimento è quello FERRICO. e l'drossido di Acido solforico: H2SO4 → Residuo acido: SO42Idrossido di bario: Fe(OH)3 → Catione: Fe+3 Mettendo insieme i due ioni si ottiene l'acido, scrivendo prima il Catione poi l'Anione: Fe3+ SO42- = Fe2(SO4)3 Solfato ferrico Vogliamo costruire il SOLFURO di ALLUMINIO Dalla nomenclatura si evince che l'anione proviene dall'ACIDO SOLFIDRICO riferimento è quello di ALLUMINIO. e l'drossido di Acido solfidrico: H2S → Residuo acido: S2Idrossido di alluminio: Al(OH)3 → Catione: Al+3 Mettendo insieme i due ioni si ottiene l'acido, scrivendo prima il Catione poi l'Anione: Al3+ S2- = Al2S3 Solfuro di alluminio. Per risalire dalla formula al nome si procede, come al solito, a rovescio. Si assegnano le cariche del catione e dell'anione in base agli indici di reazione, ad es.: K2 CO3 → K+ + CO32- Ora basta ricostruire l'idrossido di partenza : K+ → KOH Idrossido di Potassio e all'acido di partenza: CO32- → H2CO3 Acido Carbonico Il sale si chiamerà quindi: Carbonato di Potassio. REAZIONI DI PREPARAZIONE: Il sale viene preparato per reazione tra idrossido ed acido, ottenendo come prodotto sale e acqua. Ad es. Hg(OH)2 + H3BO3 → Idrossido mercurico + Acido borico Hg2+ + BO33- → Hg2+ BO33- = Hg3(BO3)2 BORATO MERCURICO Alcuni esercizi: Fe(BrO3)2 = Cu3PO3 = Au2 (SO4)3 = K2S = AgNO3 = Risoluzione: Bromato ferroso Fosfito rameoso Solfato aurico Solfuro di potassio Nitrato di argento Silicato di Sodio = Periodato di Calcio = Ipoclorito di Alluminio = Cloruro Rameico = Arseniato di Bario = Na4SiO4 Ca(IO4)2 Al(ClO)3 CuCl2 Ba3(AsO4)2
Scaricare