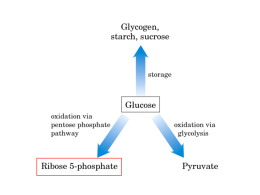
Glicogeno, amido, saccarosio Riserva Glucosio Ossidazione mediante la via del pentosio fosfato Ribosio 5-fosfato Ossidazione mediante la glicolisi Piruvato Fase preparatoria Fase di recupero energetico Tutti gli intermedi glicolitici sono fosforilati. 1) Gli intermedi fosforilati non possono uscire dalla cellula. 2) I composti fosforilati ad alta energia che si formano nel corso della glicolisi (1,3-bisfosfoglicerato e fosfoenolpiruvato) donano i loro gruppi fosforici all’ADP e formano ATP. 2) Il gruppo fosforico favorisce il legame del substrato all’enzima. 1) Fosforilazione del glucosio Enzima: esochinasi I substrati di quasi tutti gli enzimi NTP-dipendenti sono i complessi formati da magnesio (o manganese) e nucleoside trifosfato Lo ione magnesio neutralizza alcune cariche negative del NTP, riducendo le interazioni ioniche non specifiche tra l’enzima e il gruppo polifosforico del nucleotide Lo ione magnesio mantiene il nucleotide in una conformazione ben definita che può essere riconosciuta dall’enzima. Lo ione magnesio fornisce ulteriori punti di interazione tra il complesso ATPMg2+ e l’enzima. Enzima Adattamento indotto dell’esochinasi In rosso il glucosio Adattamento indotto nell’esochinasi Le modificazioni conformazionali indotte dal legame del substrato creano un ambiente molto più apolare intorno al glucosio il che favorisce la donazione del gruppo fosforico terminale dell’ATP. L’adattamento indotto assicura che si formi una conformazione cataliticamente attiva dell’enzima solo quando sono legati sia il donatore che l’accettore del fofosfato, impedendo trasferimenti dispendiosi del gruppo fosforico all’acqua 2) Conversione del glucosio-6-fosfato in fruttosio 6-fosfato Enzima: fosfoesosio isomerasi o fosfoglucosio isomerasi Il glucosio-6-fosfato, un aldoso, viene trasformato in fruttosio-6-fosfato, un chetoso. 3) Fosforilazione del fruttosio-6-fosfato a fruttosio-1,6-bisfosfato Enzima: fosfofruttochinasi 1 Formazione della gliceraldeide 3-fosfato per scissione (4) e isomerizzazione (5) Enzima: aldolasi Rottura del fruttosio 1,6-bisfosfato Scissione del fruttosio 1,6-bisfosfato in glicaraldeide 3-fosfato e diidrossiacetone fosfato. I prodotti delle restanti tappe della glicolisi sono costituiti da unità a tre atomi di carbonio anziché da unità a sei atomi di carbonio. L’enzima aldolasi è così chiamato in base alla natura della reazione inversa, una condensazione aldolica. DHAP= diidrossiacetone fosfato GAP= gliceraldeide 3-fosfato 5) Interconversione dei trioso fosfato Enzima: trioso fosfato isomerasi Struttura della trioso fosfato isomerasi 8 filamenti β circondati da 8 α eliche: il barile αβ Meccanismo catalitico della trioso fosfato isomerasi Il glutammato 165 trasferisce un protone tra gli atomi 1 e 2 con l’ausilio dell’istidina 95. L’istidina 95 facilita la catalisi donando un protone per stabilizzare la carica negativa che si sviluppa sul gruppo carbonilico sull’atomo C-2. La forma rara dell’istidina carica negativamente è stabilizzata da interazioni con altre parti dell’enzima Struttura della trioso fosfato isomerasi L’ansa impedisce all’intermedio instabile enediolo di abbandonare l’enzima chiudendo il sito attivo sino a quando l’isomerizzazione non è completata Gli atomi C1, C2 e C3 diventano indistinguibili rispettivamente dagli atomi C6, C5 e C4. 6) Ossidazione della gliceraldeide 3-fosfato a 1,3-bisfosfoglicerato Enzima: Gliceraldeide 3-fosfato deidrogenasi La fosforilazione è accoppiata all’ossidazione della gliceraldeide 3-fosfato La reazione catalizzata dalla gliceraldeide 3-fosfato deidrogenasi è la somma di due reazioni: 1) Ossidazione dell’aldeide a un acido carbossilico ad opera del NAD+ (termodinamicamente favorevole) 2) Unione dell’ acido carbossilico e dell’ortofosfato a formare un acilfosfato (termodinamicamente sfavorevole) Se queste reazioni si svolgessero in successione la seconda avrebbe un’energia di attivazione troppo alta per avvenire a velocità significativa. I due processi devono essere accoppiati. Struttura della gliceraldeide 3-fosfato deidrogenasi Il sito attivo include un residuo di cisteina e un residuo di istidina adiacenti a un NAD+ legato Meccanismo catalitico della gliceraledeide 3-fosfato deidrogenasi La reazione procede attraverso un intermedio tioestere, che permette che l’ossidazione della gliceraldeide sia accoppiata alla fosforilazione del 3fosfoglicerato L’intermedio tioestere ha un’energia libera più alta di quella dell’acido carbossilico libero Reazione non accoppiata Reazione accoppiata Reazione catalizzata dalla gliceraldeide 3-fosfato deidrogenasi Lo iodoacetato è un potente inibitore della gliceraldeide 3fosfato deidrogenasi 7) Formazione dell’ATP dall’ 1,3-bisfosfoglicerato Enzima: Fosfoglicerato chinasi Idrolisi dell’ 1,3-bisfosfoglicerato Il prodotto dell’idrolisi è il 3-fosfoglicerato il cui gruppo carbossilico, dopo la formazione, può andare incontro a dissociazione. La ionizzazione e le strutture di risonanza rendono possibile la stabilizzazione dei prodotti della reazione idrolitica. Un ulteriore contributo alla variazione di energia libera è dovuto alla stabilizzazione per risonanza del Pi. …….formazione del piruvato e generazione della seconda molecola di ATP (tappe 8, 9 e 10). 8) Conversione del 3-fosfoglicerato in 2-fosfoglicerato Enzima: Fosfoglicerato mutasi Meccanismo catalitico della fosfoglicerato mutasi L’enzima viene inizialmente fosforilato mediante trasferimento di un gruppo fosforico dal 2,3 BPG. Il 2,3 BPG si comporta da cofattore: è necessario in piccole quantità per iniziare il ciclo e poi viene continuamente rigenerato dal ciclo stesso. Solo negli eritrociti il 2,3 BPG è presente in alte concentrazioni (5 mM) e regola l’affinità dell’emoglobina per l’ossigeno Sono necessarie quantità catalitiche di 2,3-bisfosfoglicerato per mantenere un residuo di istidina del sito attivo in forma fosforilata 9) Deidratazione del 2-fosfoglicerato a fosfoenolpiruvato Enzima: Enolasi Si forma un enolo. Un enolfosfato ha un elevato potenziale di trasferimento del gruppo fosforico; Un estere fosforico di un normale alcol ha un potenziale di trasferimento del gruppo fosforico basso. Idrolisi del fosfoenolpiruvato Piruvato (forma enolica) Piruvato (forma chetonica) Il prodotto dell’idrolisi può esistere in due forme tautomeriche, mentre il reagente ha una sola forma, la forma enolica. Il prodotto è più stabile del reagente. 10) Trasferimento del gruppo fosforico dal fosfoenolpiruvato all’ADP (formazione della seconda molecola di ATP). Tautomerizzazione del piruvato Consumo e produzione di ATP nella glicolisi Molecole di ATP Reazione Glucosio Æ Glucosio 6-fosfato -1 Fruttosio 6-fosfato Æ Fruttosio 1,6-bisfosfato -1 2 x 1,3-bisfosfoglicerato Æ 2 x 3-fosfoglicerato +2 2 x Fosfoenolpiruvato Æ 2 x piruvato +2 Resa complessiva +2 Glicolisi Glucosio + 2 ATP + 2 NAD+ + 4 ADP + 2 Pi Æ 2 Piruvato + 2 ADP + 2 NADH + 2 H+ + 4 ATP + 2 H2O semplificando i termini comuni Glucosio + 2 NAD+ + 2 ADP + 2 Pi Æ 2 Piruvato + 2 NADH + 2 H+ + 2 ATP + 2 H2O ΔGo’ = - 85 kj/mole Gli intermedi glicolitici sono incanalati fra i siti attivi degli enzimi Gli enzimi della glicolisi vengono considerati normalmente componenti solubili nel citosol delle cellule, ma vi sono numerosi risultati sperimentali che tendono a suggerire che questi enzimi all’interno della cellula esistano come complessi multienzimatici. Quando una cellula viene aperta, per purificare gli enzimi citosolici, la diluizione della soluzione del citosol contenente complessi proteici non covalenti favorisce la dissociazione dei complessi nei suoi costituenti. Incanalamento di un substrato tra due enzimi della via glicolitica Differenti destini del piruvato. Si forma etanolo a partire dal piruvato nei lieviti e in parecchi altri microorganismi Si forma lattato a partire dal piruvato in un’ampia gamma di microorganismi, ed anche nelle cellule degli organismi superiori quando la quantità di ossigeno è limitante come nel tessuto muscolare durante l’attività fisica intensa Una quantità di energia molto maggiore può essere estratta aerobicamente mediante il ciclo dell’acido citrico e la catena di trasporto degli elettroni La formazione e il consumo di NADH, localizzati entro la via glicolitica. La fermentazione indica la degradazione anaerobica del glucosio (e di altri nutrienti organici) per ottenere energia sotto forma di ATP. La fermentazione lattica Nella fermentazione lattica (o lattacida) il NAD+ viene rigenerato dal NADH mediante la riduzione del piruvato a lattato. La fermentazione alcolica I lieviti ed alcuni microorganismi fermentano il glucosio ad etanolo e CO2. La tiamina pirofosfato (TPP) e il suo ruolo nella decarbossilazione del piruvato Protone acido, la sua perdita genera un carbanione La tiamina pirofosfato è la forma coenzimatica della vitamina B1 (tiamina). La TPP ha una funzione rilevante nelle reazioni in cui si ha la rottura di un legame adiacente a un gruppo carbonilico. La tiamina pirofosfato (TPP) e il suo ruolo nella decarbossilazione del piruvato La tiamina pirofosfato (TPP) e il suo ruolo nella decarebossilazione del piruvato 1) Il carbanione della TPP agisce come un nucleofilo, attaccando il carbonio carbonilico del piruvato 2) In seguito alla decarbossilazione si forma un carboanione. L’anello tiazolico della TPP si comporta come una trappola per elettroni, stabilizzando il carbanione per risonanza Dopo la protonazione (3), il prodotto della reazione, l’acetaldeide, viene rilasciato (4) e un protone si dissocia per rigenerare il carbanione della TPP (5) Alcune reazioni in cui la tiamina pirofosfato è un cofattore essenziale Il sito attivo dell’acol deidrogenasi Il sito attivo contiene uno ione zinco legato a due residui di cisteina e a un residuo di istidina. Lo ione zinco lega il substrato acetaldeidico attraverso il suo atomo di ossigeno, polarizzandolo in modo che possa accettare più facilmente un idruro dal NADH Una fermentazione su scala industriale Mantenimento dell’equilibrio redox Vie di alimentazione della glicolisi Rimozione del residuo di glucosio terminale dall’estremità non riducente di una catena di glicogeno ad opera della glicogeno fosforilasi. La glicogeno fosforilasi catalizza la reazione in cui il legame glicosidico (α1Æ4), viene attaccato dal fosfato inorganico producendo il rilascio di glucosio 1-fosfato. Parte dell’energia del legame glicosidico viene conservata mediante la formazione dell’estere fosforico nel glucosio 1-fosfato. Demolizione del glicogeno vicino a un punto di ramificazione (α1Æ6) Dopo la rimozione sequenziale dei residui terminali di glucosio da parte della glicogeno fosforilasi, i residui di glucosio vicini a una ramificazione sono staccati mediante un processo a due tappe che richiede l’azione di un “enzima deramificate” bifunzionale. Il glucosio 1-fosfato viene poi convertito in glucosio 6-fosfato dall’enzima fosfoglucomutasi. Glucosio 1-fosfato ' Glucosio 6-fosfato Nel fegato è presente l’enzima Glucosio 6-fosfatasi che catalizza la reazione Glucosio 6-fosfato + H2O ' Glucosio + Pi La maggior parte del fruttosio viene metabolizzato dal fegato usando la via del fruttosio 1, fosfato. Fruttosio + ATP Æ Fruttosio 1-fosfato + ADP enzima: fruttochinasi - Il fruttosio 1-fosfato viene quindi convertito in gliceraldeide e diidrossiacetone fosfato dalla fruttosio 1-fosfato aldolasi. - Il diidrossiacetone fosfato viene poi convertito in gliceraldeide 3-fosfato dall’enzima glicolitico trioso fosfato isomerasi. - La gliceraldeide viene poi trasformata dalla trioso chinasi: Gliceraldeide + ATP Æ Gliceraldeide 3-fosfato + ADP. Il fruttosio può anche essere fosforilato a fruttosio 6-fosfato dall’esochinasi. Nel muscolo, nel tessuto adiposo e nel rene questa è la via principale di utilizzo del fruttosio. Mannosio Mannosio + ATP Æ Mannosio 6-fosfato + ADP enzima: esochinasi Il Mannosio 6-fosfato viene poi isomerizzato ad opera della fosfomannosio isomerasi in fruttosio 6-fosfato. Via di conversione del D-Galattosio 1-fosfato in D-Glucosio 1-fosfato I disaccaridi della dieta vengono idrolizzati a monosaccaridi Maltosio + H2O Æ 2 D-Glucosio enzima: maltasi Lattosio + H2O Æ D-Galattosio + D-Glucosio enzima: lattasi Saccarosio + H2O Æ D-Fruttosio + D-Glucosio enzima: saccarasi Trealosio + H2O Æ 2 D-Glucosio enzima: trealasi L’intolleranza al lattosio La lattasi nell’endotelio intestinale: Sebbene tutti i bambini possiedano una lattasi intestinale, molti di loro smettono di produrre questo enzima da adulti diventando intolleranti al lattosio. La lattasi può essere identificata trattando una fettina di tessuto intestinale con un anticorpo che si lega in modo specifico a questo enzima. a) Adulto che ha conservato alti livelli di lattasi b) Adulto con un’intolleranza al lattosioi Vie di alimentazione della glicolisi Cancro e glicolisi Le condizioni ipossiche esistenti all’interno di una massa tumorale determinano l’attivazione del fattore di trascrizione inducibile dall’ipossia (HIF-1), che induce l’adattamento metabolico (aumento degli enzimi glicolitici) e attiva i fattori angiogenici che stimolano la crescita di nuovi vasi sanguigni. Regolazione del catabolismo dei carboidrati In ogni via metabolica vi è almeno una reazione che è lontana dall’equilibrio a causa della bassa attività dell’enzima cha la catalizza. La velocità di questa reazione non è limitata dalla disponibilità del substrato, ma soltanto dall’attività dell’enzima. La reazione viene detta limitata dall’enzima e la velocità di questa tappa determina quella della via nel suo complesso. In genere queste tappe che limitano la velocità sono reazioni molto esoergoniche e quindi irreversibili nelle condizioni intracellulari. Gli enzimi che catalizzano queste tappe esoergoniche che limitano la velocità sono di solito il bersaglio delle regolazioni metaboliche. Glicolisi e gluconeogenesi sono regolate in modo coordinato PFK-1 = fosfofruttochinasi -1; FBPase-1 = fruttosio 1,6-bisfosfatasi. Tre reazioni della glicolisi sono così esoergoniche da essere praticamente irreversibili; sono quelle catalizzate dalla esochinasi, dalla PFK-1 e dalla piruvato chinasi. L’esochinasi del muscolo viene inibita allostericamente dal suo prodotto, il glucosio 6fosfato I mammiferi hanno diverse forme di esochinasi, tutte capaci di catalizzare la conversione del glucosio in glucosio 6-fosfato. Proteine diverse in grado di catalizzare la stessa reazione sono dette isoenzimi. La forma predominante di esochinasi nel fegato è l’esochinasi D, detta anche glucochinasi La glucochinasi continua a fosforilare il glucosio anche se i livelli di glucosio 6-fosfato sono elevati. La glucochinasi ha una elevata KM per il glucosio e diventa efficiente quando il glucosio è abbondante. La funzione della glucochinasi epatica è quella di fornire glucosio 6-fosfato per la sintesi del glicogeno. Il glucosio 6-fosfato non è solo un intermedio della glicolisi (¼glicogeno, via dei pentosio-fosfato). La prima reazione irreversibile utilizzata dalla sola via glicolitica è la fosforilazione del fruttosio 6-fosfato a fruttosio 1,6-bisfosfato. La fosfofruttochinasi-1 è il principale sito di controllo della glicolisi La fosfofruttochinasi - 1 è il principale elemento di regolazione della via glicolitica nei mammiferi. L’enzima del fegato viene inibito da elevate concentrazioni di ATP. Struttura della fosfofruttochinasi 1 Elevate concentrazioni di ATP fanno diminuire l’affinità dell’enzima per il substrato fruttosio 6-fosfato. L’azione inibitrice dell’ATP viene abolita dall’AMP. Perché l’AMP e non l’ADP? Quando l’ATP viene utilizzato rapidamente, l’adenilato chinasi può formare ATP a partire da ADP: ADP + ADP ' ATP + AMP L’AMP è il segnale per lo stato a bassa energia. -Elevate concentrazioni di ATP fanno diminuire l’affinità dell’enzima per il substrato fruttosio 6-fosfato. -L’azione inibitrice dell’ATP viene abolita dall’AMP. -La fosfofruttochinasi -1 è inibita dal citrato, il primo intermedio del ciclo dell’acido citrico. Elevati livelli di citrato indicano che le necessità energetiche e la richiesta di metaboliti per le vie biosintetiche sono soddisfatte. Il principale regolatore allosterico della fosfofruttochinasi-1 (PFK-1) è il fruttosio 2,6 bisfosfato. Il fruttosio 2,6 bisfosfato è un potente attivatore della PFK-1. Il fruttosio 2,6 bisfosfato si forma dal fruttosio 6-fosfato ad opera della fosfofruttochinasi 2 (PFK-2) Il fruttosio 2,6 bisfosfato viene idrolizzato a fruttosio 6-fosfato da una specifica fosfatasi la fruttosio 2,6 bisfosfatasi (Fbasi-2) La fosfofruttochinasi 2 e la fruttosio 2,6 bisfosfatasi sono presenti in una unica catena polipeptidica (detta enzima tandem) e sono reciprocamente regolate dalla fosforilazione di un residuo di serina. Proteina fosforilata ↑ attività fosfatasica Proteina defosforilata ↑ attività chinasica Regolazione della sintesi e della degradazione del fruttosio 2,6-bisfosfato Una diminuzione della concentrazione del glucosio ematico, segnalato dal glucagone, determina la fosforilazione dell’enzima bifunzionale (aumento attività fosfatasica) e quindi fa diminuire la concentrazione di fruttosio 2,6-bisfosfato, rallentando la glicolisi. Un aumento della concentrazione di fruttosio 6-fosfato, che segue ad un aumento del glucosio ematico, accellera la formazione di fruttosio 2,6-bisfosfato facilitando la defosforilazione dell’enzima (aumento dell’attività chinasica). La piruvato chinasi viene inibita da concentrazioni elevate di ATP L’ATP inibisce la piruvato chinasi allostericamente, diminuendo l’affinità dell’enzima per il suo substrato, il fosfoenolpiruvato. La piruvato chinasi viene anche inibita dall’Acetil-CoA e dagli acidi grassi a catena lunga, importanti combustibili per il ciclo dell’acido citrico. Regolazione della glicogeno fosforilasi La glicogeno fosforilasi è regolata da più effettori allosterici che segnalano lo stato energetico della cellula nonché dalla fosforilazione reversibile che risponde a segnali ormonali quali l’insulina, il glucagone e l’adrenalina. Strutture della fosforilasi a e della fosforilasi b La glicogeno fosforilasi a è fosforilata sulla serina 14 di ciascuna subunità. Questa modificazione favorisce la struttura dello stato R più attivo. Attivazione della fosforilasi chinasi Nel muscolo il fine ultimo della glicolisi è la produzione di ATP Il fegato ha il ruolo di mantenere costante il livello di glucosio nel sangue producendo ed esportando questo metabolita ai tessuti che lo richiedono, e importandolo e conservandolo quando viene introdotto in eccesso con la dieta. Muscolo La fosforilasi b muscolare è attiva in presenza di elevate concentrazioni di AMP, che si lega a un sito di legame per i nucleotidi presente su entrambe le subunità e stabilizza la conformazione della fosforilasi b nello stato R. La glicogeno fosforilasi del fegato è un sensore per il glucosio. Il legame del glucosio sposta l’equilibrio allosterico della glicogeno fosforilasi a epatica dallo stato R (attivo) allo stato T (meno attivo). Se è presente glucosio libero derivante da qualche altra fonte come la dieta, non è necessario mobilitare il glicogeno. Il metabolismo secondario del glucosio Vie cataboliche che, partendo dal glucosio, portano alla formazione di prodotti specializzati necessari alla cellula. La via del pentoso fosfato - produce NAPDH e Ribosio 5-fosfato. Glucosio 6-fosfato + 2 NADP+ + H2O Æ Ribosio 5-fosfato + CO2 + 2 NADPH + 2 H+ Il NAPDH è necessario per le reazioni di biosintesi Il Ribosio 5-fosfato è un precursore nella sintesi dei nucleotidi (presente in: ATP, CoA, NAD+, FAD, DNA, RNA) I trasportatori di elettroni derivati dalla nicotinamide Il NADH viene ossidato dalla catena respiratoria per generare ATP Il NADPH serve come donatore di elettroni nelle biosintesi riduttive Le reazioni ossidative della via del pentoso fosfato (a) Le reazioni ossidative della via del pentoso fosfato (b) La via del pentoso fosfato è molto attiva nel tessuto adiposo in cui è attiva la biosintesi degli acidi grassi che richiede potere riducente nella forma di NADPH. L’attività della via del pentoso fosfato è molto bassa nel muscolo scheletrico. La via del pentoso fosfato Reazione Enzima Parte ossidativa Glucosio 6-fosfato + NADP+ Æ Æ 6-fosfoglucono-δ-lattone + NADPH + H+ Glucosio 6-fosfato deidrogenasi 6-fosfoglucono-δ-lattone + H2O Æ Æ 6-fosfogluconato + H+ Lattonasi 6-fosfogluconato + NADP+ Æ Æ ribuloso 5-fosfato + CO2 + NADPH 6-fosfogluconato deidrogenasi La via del pentoso fosfato Nei tessuti che richiedono più NADPH per le biosintesi riduttive che ribosio 5fosfato da incorporare nei nucleotidi, il ribosio 5-fosfato viene convertito in gliceraldeide 3-fosfato e fruttosio 6-fosfato (reazioni non ossidative della via del pentoso fosfato). 3 ribosio 5-fosfato ' 2 fruttosio 6-fosfato + gliceraldeide 3-fosfato Il ribosio 5-fosfato formato in eccesso dalla via del pentoso fosfato può essere completamente convertito in intermedi glicolitici. Il fruttosio 6-fosfato e la gliceraldeide 3-fosfato sono anche intermedi della via gluconeogenetica. La via del pentoso fosfato Reazione Enzima Parte non ossidativa riboso 5-fosfato ' ribuloso 5-fosfato Fosfopentoso isomerasi ribuloso 5-fosfato ' xiluloso 5-fosfato Fosfopentoso epimerasi xiluloso 5-fosfato + riboso 5-fosfato ' ' sedoeptulosio 7-fosfato + gliceraldeise 3-fosfato Transchetolasi sedoeptulosio 7-fosfato + gliceraldeise 3-fosfato ' ' fruttoso 6-fosfato + eritroso 4-fosfato Transaldolasi Xiluloso 5-fosfato + eritroso 4-.fosfato ' ' fruttoso 6-fosfato + glicaraldeide 3-fosfato Transchetolasi Parte non ossidativa della via del pentoso fosfato transchetolasi C5 + C5 ' C 3 + C7 transaldolasi C 7 + C3 ' C 4 + C6 transchetolasi C 5 + C4 ' C 3 + C6 Parte non ossidativa della via del pentoso fosfato transchetolasi C5 + C5 ' C 3 + C7 transaldolasi C 7 + C3 ' C4 + C6 transchetolasi C 5 + C4 ' C3 + C6 Il risultato complessivo di queste reazioni è la formazione di due esosi e di un triosio a partire da tre pentosi : 3 C5 ' 2 C 6 + C3 C5 + C5 ' C 3 + C7 transchetolasi Il donatore dell’unità bicarboniosa è lo xilulosio 5-fosfato, un epimero del ribulosio 5-fosfato. Un chetosio è un substrato della transchetolasi soltanto se il gruppo ossidrilico su C-3 ha la configurazione dello xilulosio anziché del ribulosio. Il ribulosio 5-fosfato viene convertito nell’epimero appropriato per la reazione della transchetolasi dalla fosfopentosio epimerasi. C3 C5 + C5 ' C 3 + C7 transchetolasi C 7 + C3 ' transaldolasi Intermedio glicolitico C4 + C6 C 5 + C4 ' C3 + C6 transchetolasi Intermedi glicolitici La via del pentoso fosfato Via del pentosio fosfato La somma delle reazioni della via del pentosio fosfato è: 2 Xilulosio 5-fosfato + ribosio 5-fosfato ' 2 fruttosio 6-fosfato + gliceraldeide 3-fosfato Lo xilulosio 5-fosfato può essere formato a partire da ribosio 5-fosfato ad opera dell’azione sequenziale della fosfopentosio isomerasi e della fosfopentosio epimerasi pertanto: 3 Ribosio 5-fosfato ' 2 fruttosio 6-fosfato + gliceraldeide 3-fosfato L’eccesso di ribosio 5-fosfato formato dalla via del pentosio fosfato può essere completamente convertito in intermedi glicolitici. Inoltre, grazie alla via del pentosio fosfato: - Ogni molecola di ribosio ingerita nella dieta può essere convertita in intermedi glicolitici. - Gli scheletri carboniosi degli zuccheri possono essere riarrangiati per soddisfare esigenze fisiologiche Regolazione della via del pentoso fosfato Il glucosio 6-fosfato viene metabolizzato sia dalla via glicolitica sia dalla via del pentosio fosfato. La regolazione della via del pentoso fosfato avviene al livello della prima reazione, la deidrogenazione del glucosio 6-fosfato, che è una reazione irreversibile. Il fattore di regolazione più importante è il livello di NADP+, l’accettore di elettroni in questa reazione catalizzata dalla glucosio 6-fosfato deidrogenasi. La parte non ossidativa della via del pentoso fosfato è controllata principalmente dalla disponibilità dei substrati. Metabolismo del glucosio 6-fosfato in 4 differenti condizioni metaboliche: Quattro modi della via del pentoso fosfato Modo 1: E’ necessario molto più ribosio 5-fosfato che NADPH Es.: cellule in rapida divisione necessitano di ribosio 5-fosfato per la sintesi di DNA Modo 2: Il fabbisogno di NADPH e quello di ribosio 5-fosfato sono bilanciati Modo 3: E’ necessario più NADPH che ribosio 5-fosfato Es.: il tessuto epatico richiede una elevata concentrazione di NADPH per la sintesi di acidi grassi. La via gluconeogenetica risintetizza glucosio 6-fosfato Modo 4: Sono necessari sia NADPH che ATP Il glucosio può essere trasformato in acido glucuronico L’acido glucuronico è importante nella detossificazione e nell’escrezione di composti organici estranei L’UDP-glucuronato è il donatore di unità glucuronosidiche utilizzato da una famiglia di enzimi detossificanti che agiscono su composti non polari come molte tossine ambientali e carcinogeni La coniugazione di questi composti con il glucuronato (glucuronazione) produce derivati più polari rimossi più facilmente dal sangue da parte dei reni. Un modo alternativo per generare energia è una variazione della respirazione in cui l’accettore finale di elettroni è diverso dall’ossigeno (respirazione anaerobica) Un secondo sistema di generazione di energia prevede il ricorso a sostanze chimiche inorganiche invece che organiche. Gli organismi in grado di utilizzare sostanze chimiche inorganiche come donatori di elettroni sono un tipo di chemiotrofi detti chemiolitotrofi. Esempi di donatori di elettroni inorganici sono : l’idrogeno solforato (H2S), l’idrogeno gassoso (H2), il ferro ferroso (Fe2+) e l’ammoniaca (NH3) I chemiolitotrofi hanno dei sistemi di trasporto degli elettroni simili a quelli dei chemioorganotrofi e determinano una forza protomotrice che porta alla sintesi di ATP. L’ossidazione dell’idrogeno. Diversi chemiolitotrofi sono in grado di utilizzare come donatore di elettroni l’idrogeno, H2, un prodotto moilto comune del metabolismo microbico. Bioenergetica negli idrogenobatteri aerobi La riduzione del solfato. Oltre all’idrogeno (H2) l’idrogenasi può anche sfruttare H2 che si genera dal catabolismo dei composti organici come il lattato e il piruvato. Un gran numero di microorganismi, così come le piante verdi, sono fototrofi, usano cioè la luce come fonte di energia nel processo di fotosintesi.
Scaricare