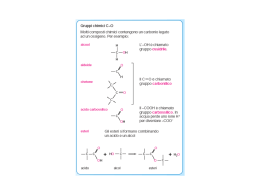
La chimica organica, la chimica della vita 1 - Introduzione....................................................................................................................................2 1.1 Diffusione nell’ambiente......................................................................................................2 1.2 Stabilità dei legami del carbonio..........................................................................................3 1.3 Formule di rappresentazione dei composti organici ............................................................3 2 - Tipi di isomeria...............................................................................................................................4 2.1 Isomeria di struttura (o di posizione) ...................................................................................4 2.2 Isomeria di configurazione...................................................................................................4 2.2.1 Isomeria cis-trans .........................................................................................................4 2.2.2 Enantiomeria (isomeria ottica).....................................................................................5 3 - Gruppi funzionali e cenni di nomenclatura ....................................................................................6 3.1 Tabella dei principali gruppi funzionali...............................................................................6 4 – Gli idrocarburi................................................................................................................................8 4.1 Alcani ...................................................................................................................................8 4.1.1 Il petrolio e la produzione di combustibili ...................................................................8 4.1.2 Prodotti di base della chimica ottenuti da alcani........................................................11 4.2 Alcheni ...............................................................................................................................11 5 – Composti organici contenenti ossigeno .......................................................................................14 5.1 Alcoli........................................................................................................................................15 5.1.1 Caratteristiche fisiche.................................................................................................15 5.1.2 Reazioni di ossidazione..............................................................................................15 5.2 Acidi carbossilici................................................................................................................16 5.2.1 Caratteristiche fisiche.................................................................................................16 5.2.1 Caratteristiche chimiche.............................................................................................16 5.2.3 Acidi carbossilici in natura, acidi grassi saturi e insaturi...........................................16 6- Ammine, amminoacidi e proteine..............................................................................................17 6.1 Caratteristiche fisiche e chimiche delle ammine................................................................17 6.2 Esempi di particolari composti azotati...............................................................................18 6.3 Amminoacidi e proteine.....................................................................................................18 7– Lipidi.............................................................................................................................................20 7.1 Glicerolo e formazione di trigliceridi.................................................................................21 7.2 Saponi e saponificazione....................................................................................................22 7.2.1 Saponi e detergenti: funzionamento e aspetti di problemi ambientali .......................22 7.2.2 Esperienza pratica di laboratorio: produzione di un sapone ......................................23 8 Membrane cellulari e trasporto sostanze....................................................................................24 8.1 Introduzione .......................................................................................................................24 8.2 Componenti delle membrane .............................................................................................25 8.2.1 Fosfolipidi ..................................................................................................................25 8.2.2 I glicolipidi.................................................................................................................25 8.2.3 Colesterolo .................................................................................................................25 8.2.4 Proteine di membrana ................................................................................................26 8.3 Struttura delle membrane ...................................................................................................26 8.4 Trasporto attraverso la membrana......................................................................................28 8.4.1 Osomosi .....................................................................................................................28 8.4.2 Diffusione...................................................................................................................28 8.4.3 Trasporto di sostanze attraverso le membrane...........................................................28 8.4.3.1 Trasporto passivo ...................................................................................................29 8.4.3.2 Trasporto attivo ......................................................................................................29 -2- 1 - Introduzione 1.1 Diffusione nell’ambiente Il carbonio è un elemento non molto presente sulla crosta terrestre (costituisce meno dello 0,1% della massa), ma è però molto diffuso. Si potrebbe quasi dire che ovunque attorno a noi possiamo trovare del carbonio, ad esempio nel carbon fossile, nei carbonati, nei diamanti e negli organismi viventi. Il carbonio è infatti l’elemento base di tutti gli organismi viventi, esso è presente nella maggior parte delle sostanze che compongono una cellula. carbone carbonato di calcio (marmo) diamanti Bradypus variegatus Questo è il motivo per cui la chimica del carbonio era chiamata chimica organica. Fin verso la fine dell’ottocento i chimici ritenevano che solo organismi vivi fossero capaci di produrre composti contenenti carbonio. Oggi invece la produzione di sostanze organiche di sintesi serve per mettere a disposizione una vasta gamma di materiali vari, come, ad esempio, fibre tessili, materie plastiche, farmaci, coloranti. COOH O O Kevlar Nylon 6 e Nylon 6,6 aspirina La chimica del carbonio non è però una chimica diversa da quella degli altri elementi, tutte le leggi della chimica generale valgono anche per questo elemento così speciale. Si sono fatte molte ipotesi per spiegare perché il carbonio è necessario nella chimica della vita. Una potrebbe essere la centralità della posizione che esso occupa nella tavola periodica, è infatti un elemento del quarto gruppo principale, e ha quindi quattro elettroni di valenza. Ha perciò la capacità di formare quattro legami covalenti nello spazio e, di conseguenza, anche molecole ramificate e complesse. La figura accanto rappresenta, come esempio, l’amminoacido alanina. Chimica organica per 1e1e1.doc; autore: Brenn 2 -3- 1.2 Stabilità dei legami del carbonio Un’altra ragione è la stabilità dei legami che il carbonio forma sia con altri atomi dello stesso elemento, sia con altri elementi non metallici meno elettronegativi (es. l’idrogeno) o più elettronegativi (es. azoto, ossigeno, alogeni). Le energie di legame sono H3C CH3 nell’ordine di alcune centinaia di kJ/mol. Il carbonio forma solidi legami semplici (una coppia di elettroni condivisa), doppi (due coppie di elettroni condivisi) e tripli (tre coppie di elettroni condivisi) con altri atomi di carbonio e/o con altri non metalli, purché abbiano un sufficiente numero di elettroni da condividere. H2C HC CH2 CH Il carbonio è in grado perciò di formare una straordinaria varietà di sostanze diverse, da molecole semplici, cioè fatte da pochi atomi, fino a molecole molto complesse, chiamate anche macromolecole, cioè molecole fatte da un enorme numero di atomi tutti legati tra di loro da legami covalenti (a condivisione di elettroni in coppie). La grande varietà di combinazioni fra atomi porta alla presenza di un fenomeno molto diffuso nei composti organici che viene chiamato isomeria, cioè sostanze con caratteristiche fisiche e chimiche diverse ma che hanno la stessa formula molecolare. Esempio C2H6O H H H C H C O H H H H alcool etilico (etanolo) Teb = + 78 °C miscibile con acqua densità = 0,785 kg/dm3 C H O C H H H dimetiletere (etere dimetilico) Teb = - 24 °C poco solubile (quando allo stato liquido) in acqua densità = 0,661 kg/dm3 1.3 Formule di rappresentazione dei composti organici A causa del fenomeno dell’isomeria, nei composti organici è spesso più utile dare informazioni su come gli atomi sono legati tra di loro, disegnare la formula di struttura della molecola, che dare la sola formula molecolare, che dice solo quanti atomi ci sono di ogni elemento. In queste formule si evidenziano i gruppi funzionali (es -OH gruppo funzionale alcolico, -COOH gruppo acido carbossilico), la parte di molecola maggiormente responsabile delle proprietà dell’intera sostanza. Si usano molto spesso, per risparmiare tempo nella rappresentazione delle sostanze, formule di struttura dette simboliche . In questo tipo di formule semplificate non vengono scritti né i simboli dei carboni della molecola, né i legami carbonio-idrogeno. Ciò è possibile visto che il carbonio nei composti molecolari è sempre tetravalente, circondato cioè da quattro legami (coppie di elettroni), i legami mancanti ad un certo atomo di carbonio sono dunque legami carbonio idrogeno in un numero adeguato a che l’atomo sia circondato da otto elettroni in totale. Esempio OH alcool etilico Chimica organica per 1e1e1.doc; autore: Brenn O dimetiletere 3 -4- 2 - Tipi di isomeria Isomeria significa stessa formula chimica molecolare ma diversa struttura dei legami fra atomi o diversa disposizione degli stessi nello spazio, con conseguente diverso comportamento chimico e caratteristiche fisiche. Ci sono diversi tipi di isomeria. 2.1 Isomeria di struttura (o di posizione) In questo tipo di isomeria, gli isomeri differiscono per la struttura delle loro molecole. Gli atomi sono legati con diverse sequenze di legame. Esempio: isomeri a formula C5H12 n-pentano Teb = 36 °C 2-metilbutano Teb = 28 °C 2,2-dimetilpropano Teb = 10 °C Gli isomeri di struttura hanno diverse proprietà chimiche e fisiche. Si osservi anche come le molecole più ramificate abbiano una più bassa temperatura di ebollizione. La causa è la forma delle molecole ramificate che impedisce un impaccamen2to delle particelle come in quelle più lineari, quindi un legame intermolecolare più debole e, di conseguenza, una più bassa temperatura di ebollizione. 2.2 Isomeria di configurazione Si dice isomeria di configurazione quando la sequenza degli atomi e il tipo di legami sono gli stessi, ma è diversa la disposizione nello spazio degli atomi. Ci sono due casi: 2.2.1 Isomeria cis-trans La presenza di doppi legami introduce una disposizione rigida e planare sia degli atomi di carbonio del doppio legame, sia degli atomi direttamente legati ai due atomi di carbonio. Contrariamente ai legami semplici, nei doppi legami non è possibile la rotazione di una parte della molecola attorno al doppio legame. Si dice isomero cis quello in cui la catena di atomi di carbonio continua dalla stessa parte del doppio legame e isomero trans quello in cui la catena continua dall’altra parte del doppio legame. Gli isomeri hanno caratteristiche chimiche e fisiche diverse. La possibile trasformazione di un isomero nell’altro richiede una reazione in cui avvenga la scissione e la formazione di legami covalenti. Esempio Cl Cl trans-1,2-dicloroetilene sostanza apolare Tfusione = - 49.4 °C Tebollizione = 47.2 °C Chimica organica per 1e1e1.doc; autore: Brenn Cl Cl cis-1,2-dicloroetilene sostanza (poco) polare Tfusione = - 81.5 °C Tebollizione = 59.6 °C 4 -5- L’isomeria cis-trans è presente anche nei composti ciclici, che presentano cioè un anello di atomi, prevalentemente di carbonio. La causa è l’impedimento nella rotazione libera degli atomi attorno ai legami dell’anello. I due isomeri si definiscono cis se le catene laterali si trovano dalla stessa parte del piano dell’anello e trans se da parti opposte. Anche in questo caso i due isomeri hanno caratteristiche fisiche e chimiche diverse. Esempio H H H H H CH H 3 H H H CH3 trans-1,2-dimetilcicloesano H H H H H H H H H CH CH3 3 cis-1,2-dimetilcicloesano 2.2.2 Enantiomeria (isomeria ottica) La presenza di un atomo di carbonio che presenta quattro legami semplici con atomi, o gruppi di atomi, differenti costituisce il caso più frequente di chiralità, l’esistenza di due isomeri che sono l’immagine allo specchio l’uno dell’altro, proprio come le nostre mani. Chiralità deriva infatti da chír che in greco significa mano. Le due molecole sono dette enantiomeri e presentano caratteristiche fisiche uguali tranne che nell’interazione di loro soluzioni con la luce. I due enantiomeri ruotano infatti il piano di vibrazione della luce in senso opposto. Questo il motivo per cui, a volte, si parla di isomeri ottici quando ci si riferisce ai due enantiomeri. Le caratteristiche chimiche sono uguali nei confronti di reagenti non chirali, mentre hanno reattività diversa, e, con reagenti chirali, formano prodotti diversi (diastereomeri o diastereoisomeri). Esempio La chiralità è molto diffusa negli esseri viventi, parecchi mattoni costruttivi di sostanze essenziali alla vita come amminoacidi, glucidi e acidi nucleici sono chirali rendendo così chirali anche le macromolecole che si formano. Esempio Chimica organica per 1e1e1.doc; autore: Brenn 5 -6- 3 - Gruppi funzionali e cenni di nomenclatura La grande varietà di composti del carbonio ha portato alla necessità di organizzare le conoscenze raggruppando le sostanze simili per comportamento chimico e fisico. Si osserva che spesso un particolare elemento o un gruppo di atomi presente in una molecola è maggiormente responsabile del comportamento dell’intera sostanza. Si sono quindi scelti un certo numero di gruppi funzionali e si sono classificati i composti organici in base al o ai gruppi funzionali presenti. 3.1 Tabella dei principali gruppi funzionali Struttura Classe Nomenclatura Esempio alcano ............. ano CH3(CH2)CH3 ottano alchene ............. ene CH2=CH2 etene (etilene), reagente per produrre il polietilene alchino .............. ino CH≡CH etino (acetilene), usato nella fiamma per saldature aromatico ........... benzene Idrocarburi benzene Composti alogenati R-X (X alogeno) alogeno derivati CCl2CHCl 1,1,2-tricloroetilene (trielina), smacchiatore, lavaggio a secco CH3CH2OH etanolo, presente nelle bevande alcoliche dietil-etere, anestetico Gruppi funzionali che contengono ossigeno R-O-H alcool R-O-R' etere ..... olo, alcol ..... ico etere ..... ico, (CH3CH2)2O O R H aldeide ..... ale, H2C=O metanale (formaldeide), usata per conservare campioni biologici chetone .......... one CH3COCH3 acetone, solvente per vernici acido carbossilico acido ..... oico CH3COOH acido acetico, presente nell'aceto O R R' O R OH O R' R O estere Chimica organica per 1e1e1.doc; autore: Brenn CH3COOCH2CH3 acetato di etile, solvente 6 -7- Gruppi funzionali che contengono azoto R-NH-R' ammina R-C≡N cianuro o nitrile radicali + ammina CH3-NH-CH2CH3 etilmetilammina, base organica CH2=CH-C≡N acrilonitrile, prodotto di partenza dell'Orlon Gruppi funzionali che contengono azoto e ossigeno O R' R N H ammide HCO-N(CH3)2 dimetilformammide, solvente Gruppi funzionali che contengono zolfo R-S-H R-S-R' tiolo o mercaptano ..... tiolo tioetere, o solfuro radicali+tioetere CH3-SH metantiolo (CH2=CH-CH2)2S diallilsolfuro, odora di aglio Il nome dei composti organici segue regole abbastanza complesse che si cercherà qui di semplificare alla sua essenza. I nomi vengono composti da una radice, che è in relazione al numero di atomi della catena principale di atomi di carbonio, e da desinenze che identificano il o i gruppi funzionali presenti. Questo nome viene preceduto dalla posizione sulla catena, mediante numerazione della catena, dai nomi e delle eventuali ramificazioni (catene laterali). Nome dei primi dieci alcani lineari nome numero di atomi formula di carbonio molecolare metano etano propano butano pentano esano eptano ottano nonano decano 1 2 3 4 5 6 7 8 9 10 CH4 C2H6 C3H8 C4H10 C5H12 C6H14 C7H16 C8H18 C9H20 C10H22 formula di struttura condensata CH4 CH3CH3 CH3CH2CH3 CH3CH2CH2CH3 CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH2CH3 CH3CH2CH2CH2CH2CH2CH3 CH3CH2CH2CH2CH2CH2CH2CH3 CH3CH2CH2CH2 CH2CH2CH2CH2CH3 CH3CH2CH2CH2CH2CH2CH2CH2CH2CH3 Teb (°C) -164 -89 -42 -0.5 36 69 98 126 151 174 H H OH C C HO H H Esempi CH3COCH3 2-propanone 1,2-etandiolo (glicol etilenico) CH3 H2C C C H CH3 CH3 C C C H CH3 H 3C H2 H 3C CH2 2-metil-1,3-butadiene (isoprene) Chimica organica per 1e1e1.doc; autore: Brenn 2,2,4-trimetilpentano (isottano) 7 -8- 4 – Gli idrocarburi Il termine idrocarburi viene usato per indicare quei composti fatti da solo carbonio e idrogeno. Le fonti principali di idrocarburi sono il petrolio (miscuglio molto complesso fatto principalmente di alcani a catena aperta o ciclica) e il gas naturale (prevalentemente metano CH4 con piccole percentuali di altri idrocarburi a basso numero di atomi di carbonio). 4.1 Alcani Gli alcani, contengono solo legami semplici carbonio-carbonio, sono, come anche gli alcheni e i composti aromatici, composti apolari per la presenza di soli legami covalenti apolari. Sono quindi composti caratterizzati da deboli legami intermolecolari, chiamate legame residuo o forze di London, che sono però vieppiù forti all’aumentare del numero di atomi del composto. La conseguenza è che gli idrocarburi con meno di 5 atomi di carbonio si presentano in forma gassosa a condizioni ambientali normali (temperatura di 20°C e pressione di 1 atmosfera), quelli che hanno da 5 a circa 20 atomi di carbonio sono liquidi e sono invece solidi se hanno più di 20 atomi di carbonio. Gli alcani, chiamati anche paraffine (dal latino parum affinis significa poco affini, cioè poco reattivi a temperatura ambiente) vengono usati per due scopi principali: 1 come combustibili, grazie alla reazione esotermica con l’ossigeno. 2 nell’industria petrolchimica, per produrre altre sostanze chimiche che serviranno successivamente per la produzione di materie plastiche e, nell'industria chimica in generale, per la produzione di fertilizzanti, materiali da costruzione, fibre tessili, vernici e coloranti, sostanze e additivi alimentari. 4.1.1 Il petrolio e la produzione di combustibili Il petrolio è un liquido oleoso più o meno denso, infiammabile, di colore variabile da giallastro a nero, costituito essenzialmente da una miscela di idrocarburi fossili. Si trova in quantità sotto la superficie terrestre ed è la principale materia prima dell'industria petrolchimica. Il petrolio accompagna la storia dell'uomo da secoli e fin dall'antichità il greco "naphtha" richiamava il fiammeggiare tipico delle emanazioni petrolifere. Il nome petrolio deriva dalla parola latina petroleum, cioè "olio di roccia". I popoli dell'antichità avevano già ben noti i giacimenti di petrolio superficiali che utilizzavano per produrre medicinali e bitume o per alimentare le lampade. Un’ipotesi della sua formazione è quella secondo la quale i giacimenti si sono formati sotto la superficie terrestre per decomposizione di organismi marini e di piante che crescono sui fondali oceanici. Chimica organica per 1e1e1.doc; autore: Brenn 8 -9- La formazione del petrolio è un fenomeno iniziato molti milioni di anni fa, quando esisteva un'abbondante fauna marina, e che continua ancora oggi. I sedimenti depositati sul fondo degli oceani, accrescendo il loro spessore e dunque il loro peso, sprofondano nel fondale marino; a mano a mano che altri sedimenti si accumulano, la pressione su quelli sottostanti aumenta considerevolmente e la temperatura si alza di diverse centinaia di gradi. Il fango e la sabbia si induriscono trasformandosi in argillite e arenaria, il carbonio precipita, le conchiglie si induriscono trasformandosi in calcare, mentre i resti degli organismi morti si trasformano in sostanze più semplici composte da carbonio e idrogeno, gli idrocarburi appunto, per dare origine al petrolio greggio e al gas naturale. Il petrolio ha densità minore dell'acqua salmastra che riempie gli interstizi dell'argillite, della sabbia e delle rocce di carbonati che costituiscono la crosta terrestre: tende dunque a risalire verso la superficie, passando dai microscopici pori dei più grossi sedimenti sovrastanti. È così che sbocca spontaneamente dalla superficie terrestre. Viene portato alla superficie dalla pressione dei gas sotterranei o mediante pompe; viene poi raccolto in serbatoi e trasportato per mezzo di oleodotti o petroliere nei luoghi di lavorazione. Una volta estratto, il petrolio viene trattato con sostanze chimiche a caldo, per eliminare l'acqua e le particelle solide in esso contenute, e per separare il gas naturale residuo. Viene poi immagazzinato in serbatoi di smistamento, da dove viene trasportato alle raffinerie mediante tubazioni continue (oleodotti), o con navi opportunamente attrezzate (navi cisterna, o petroliere), o con speciali autoveicoli (autocisterne) e carri ferroviari (carri cisterna). Il greggio, che come si è detto è una miscela complessa di idrocarburi, soprattutto alcani, deve essere separato nei suoi componenti. Questo si fa mediante una distillazione nel corso della quale vengono appunto raccolte separatamente le varie fasi, dal top (frazioni leggere, sostanzialmente le frazioni con un numero di atomi di carbonio tra 1 e 5) attraverso i vari piatti estraendo benzine (C6 C9), kerosene (C10 - C12), gasolio (C13 - C14), olio combustibile, (C15 - C20) e infine i bottoms, che sono idrocarburi pesanti quali peci, asfalti, paraffine solide. La separazione viene eseguita nella torre di frazionamento. La torre di frazionamento è composta da una torre cilindrica in acciaio alta circa 30 m e larga 3,50 m. All’interno della torre ad intervalli regolari si trovano dei piatti orizzontali forati, muniti di appositi passaggi, alcuni dei quali sormontati da coperchi detti campane di gorgogliamento. La temperatura della torre è elevata alla base e va diminuendo con l’altezza. Il petrolio che entra alla base della torre è preriscaldato in un forno fino a 400-500°C. I componenti che hanno punto di ebollizione inferiore a quella temperatura, salgono la torre sotto forma di vapore. Incontrando i piatti e le campane di gorgogliamento che sono al di sotto della temperatura di ebollizione, condensano e si depositano sul piatto allo stato Chimica organica per 1e1e1.doc; autore: Brenn 9 - 10 - liquido. Apposite tubazioni possono raccogliere queste frazioni liquide e allontanarle dalla torre. Le frazioni ad elevato punto di ebollizione che non evaporano entrando nella torre, si spostano alla base e, data l’elevata temperatura, passano allo stato aeriforme e, condensando, si raccolgono sui piatti inferiori. Questa fase di distillazione è in realtà quasi sempre divisa in due fasi: una distillazione atmosferica in cui si separano in modo relativamente grossolano idrocarburi leggeri dai pesanti, separando la nafta (che, attenzione, è diversa da quella che viene così denominata nel parlare comune: la prima è una frazione leggera, mentre la seconda è più correttamente definita olio combustibile) dal residuo atmosferico, più pesante, che passa alla distillazione sotto vuoto da cui vengono definitivamente separati l'olio combustibile e altre frazioni pesanti dalle frazioni leggere. I prodotti della distillazione sotto vuoto vengono di solito inviati ai trattamenti di desolforazione (serve ad eliminare lo zolfo elementare presente anche dopo distillazione del petrolio greggio), in cui si inietta idrogeno gassoso che reagisce con lo zolfo e forma H2S (acido solfidrico) gassoso che viene allontanato e poi ridotto di nuovo a zolfo elementare. La desolforazione è indispensabile per ridurre la presenza di zolfo nei combustibili al di sotto delle concentrazioni previste dalle legislazioni dei vari paesi. La combustione dello zolfo residuo presente nei combustibili (in particolare nella nafta, o diesel) produce ossidi di zolfo tossici per gli organismi viventi e tra i maggiori responsabili delle piogge acide. Dalla distillazione sotto vuoto si ottengono quindi i prodotti pesanti, quali gasolio e olio combustibile. Questi vari prodotti, miscugli di composizione più semplice rispetto al petrolio da cui derivano, sono già di per se utilizzabili commercialmente, ma è improbabile che le quantità prodotte rispettino le proporzioni delle quantità richieste dai consumatori. Le proporzioni delle varie frazioni ottenute dipende molto dal tipo di petrolio lavorato. Si sono quindi sviluppate nel tempo delle tecniche di processo mediante le quali le molecole di idrocarburi pesanti vengono spezzate in molecole più leggere, cioè fatte da un numero più piccolo di atomi di carbonio, ad esempio mediante una reazione del tipo: C13H28 + H2 -----> C7H16 + C6H14 Questi processi sono detto processi di “cracking” (letteralmente: spezzettatura) e consentono, nel caso indicato, di ottenere una molecola di eptano ed una di esano (cioè due di benzina leggera) partendo da una molecola di C13, ossia gasolio. Avvengono in grandi reattori grazie a particolari catalizzatori e ad alte temperature. Sono stati anche sviluppati i processi di “reforming” (letteralmente: riformatura, nel contesto va inteso come isomerizzazione) per trasformare molecole lineari in molecole più ramificate e/o cicliche. Questa tecnica ha lo scopo di alzare il potere antidetonante delle benzine per renderle adatte ai motori in cui verranno bruciate, oggi i due valori richiesti in Europa sono di 95 e 98 ottani. Si è osservato che gli isomeri più ramificati e i composti aromatici (derivati del benzene) hanno un più alto potere antidetonante (es. l’isottano, un alcano a 8 atomi molto ramificato ha valore 100 sulla scala degli ottani, scala empirica che serve a misurare la proprietà detonante di un combustibile, l’eptano lineare, non ramificato, ha valore 0). Per il reforming catalitico si usano soprattutto catalizzatori contenenti platino (“platforming”) che serve a trasformare alcani in composti ciclici e composti aromatici. Un tempo questo aumento del potere antidetonante lo si otteneva anche addizionando le benzine di tetraetile di piombo, sostanza che bruciando creava composti del piombo fortemente inquinanti. Chimica organica per 1e1e1.doc; autore: Brenn 10 - 11 - 4.1.2 Prodotti di base della chimica ottenuti da alcani Attraverso tutti questi trattamenti si ottengono, nelle quantità desiderate, tutti i prodotti che il mercato richiede. Tra questi, si distinguono le frazioni pesanti (C20 e oltre), che hanno poco interesse commerciale e che vengono spesso usate in raffineria per produzione di energia in speciali caldaie, e soprattutto la “virgin naphta” che è la principale materia prima per l'industria petrolchimica, industria che trasforma gli alcani e i composti aromatici presenti nel petrolio in una larga serie di sostanze di base che, grazie ad opportune reazioni, verranno poi ulteriormente trasformate in molti materiali di cui ci serviamo quotidianamente, come materie plastiche, gomme sintetiche e di un'infinità di materiali diversi. 4.2 Alcheni Gli alcheni sono idrocarburi che presentano uno o più doppi legami fra atomi di carbonio. Sono anche detti composti insaturi, poiché hanno un numero di atomi di idrogeno inferiore a quello di alcani con lo stesso numero di atomi di carbonio. Le loro proprietà fisiche sono molto simili a quelle degli alcani con lo stesso numero di atomi di carbonio. Se una sostanza presenta più doppi legami, questi possono essere disposti in modo isolato (o non coniugati, almeno due legami semplici separano quelli doppi), coniugato (si alternano legami semplici a legami doppi, come nel β carotene) o cumulato (caso abbastanza raro in cui si susseguono uno dopo l’altro nella molecola). Esempi etene (chiamato anche etilene) CH2=CH2 β-carotene (colorante presente in molti ortaggi, in particolare nelle carote) Come già detto precedentemente, la presenza di doppi legami implica una minore libertà di movimento degli atomi della catena, dando origine a forme spaziali differenti a seconda dell’isomeria cis o trans del doppio legame. Molecole che presentano la forma cis hanno la catena più “raccolta” e quindi temperature di fusione e ebollizione più bassa dovuta al minor impaccamento delle molecole, gli isomeri trans hanno catene più allungate, distese, come le molecole sature, con molecole che si possono avvicinare maggiormente, la conseguenza è che i Chimica organica per 1e1e1.doc; autore: Brenn 11 - 12 - legami intermolecolari sono più forti e quindi le temperature di fusione e ebollizione saranno un po’ più alte. Ciò vale solo se le molecole considerate non contengono altri atomi che rendono la molecola polare. Esempio H H C C H3C H3C H C C CH3 cis-2-butene p.f. -139 °C ma! p.e. 3,7 °C H CH3 trans-2-butene p.f. -106°C p.e. 0,3 °C Gli alcheni sono sostanze piuttosto reattive già a temperatura ambiente. Non sono presenti, se non in basse percentuali, nel petrolio. Si possono produrre a partire da alcani grazie a reazioni di deidrogenazione. Una reazione molto utile è la reazione di polimerizzazione degli alcheni, reazione in cui un numero anche molto grande di molecole si uniscono a formare delle macromolecole chiamate polimeri. Ad esempio, dall’etilene si ottiene la materia plastica più usata e conosciuta, il polietilene (PE). L’unione tra i monomeri avviene grazie agli elettroni del doppio legame che vengono usati per legare un monomero all’altro. Ciò comporta che alla fine della reazione si avranno lunghe catene di molecole che non hanno più doppi legami, ma solo legami semplici e questo spiega la scarsa reattività chimica delle materie plastiche nei confronti dei materiali con cui verranno a contatto, come, ad esempio, alimenti confezionati in fogli di polietilene. Le macromolecole ottenute non sono tutte identiche tra loro, ma differiscono nel grado di polimerizzazione (numero di monomeri che si sono addizionati), quindi si tratta di un miscuglio di molecole con una certa massa molecolare media. Ciò ha per conseguenza che tali materiali plastici presentano un intervallo di temperatura di fusione e la possibilità di dare una particolare forma all’oggetto, forma che verrà mantenuta dopo il raffreddamento. Il grado di polimerizzazione può essere basso (meno di 100 monomeri), medio (tra 100 e 1000) e alto (più di 1000 molecole di alchene). Nella reazione di polimerizzazione si può anche regolare, scegliendo le opportune condizioni di reazione e gli opportuni catalizzatori, il grado di ramificazione desiderato. Schema della reazione di polimerizzazione radicalica: Chimica organica per 1e1e1.doc; autore: Brenn 12 - 13 - Formazione delle ramificazioni: La conseguenza è che dallo stesso alchene di partenza si possono ottenere tutta una gamma di materie plastiche con caratteristiche tecnologiche differenti. Semplificando si può affermare che polimeri ad altissima massa molecolare media danno materiali cristallini molto resistenti, adatti, ad esempio, alla produzione di protesi o giubbotti antiproiettile, polimeri ad alta densità e poco ramificati sono abbastanza resistenti e rigidi, polimeri a bassa densità (basso peso molecolare e alta ramificazione) sono invece meno rigidi e più duttili. Per reazione di polimerizzazione si ottengono parecchi altri materiali plastici di uso comune come, ad esempio: polimero monomero esempi di uso polietilene (PE) CH2=CH2 fogli e pellicole, recipienti a perdere, giocattoli, stoviglie polietilentereftalato (PET) copolimero di acido tereftalico e glicol etilenico per produrre , ad esempio, bottiglie per acqua minerale polipropilene (PP) CH3-CH=CH2 fibre, parti di automobili,imballaggi, rivestimenti ignifughi polivinilcloruro (PVC) Cl-CH=CH2 tubi, rivestimenti, confezione per alimenti polistirene (PS) politetrafluoroetilene (PTFE) Chimica organica per 1e1e1.doc; autore: Brenn CH2 CH CF2=CF2 giocattoli, contenitori, confezioni per alimenti e, come polistirolo espanso (da noi chiamato correntemente Sagex), per imballaggi e isolanti rivestimenti antiaderenti per padelle, isolanti elettrici, tubi anticorrosione 13 - 14 - 5 – Composti organici contenenti ossigeno I composti organici contenenti uno i più atomi di ossigeno sono molti e importanti anche per la chimica della vita, come si vedrà più avanti in questo corso. Si differenziano sia per caratteristiche fisiche, ma anche per quelle chimiche, ad esempio lo stato di ossidazione del carbonio legato all’ossigeno. I composti ossigenati più importanti sono gli alcoli, caratterizzati dalla presenza del gruppo funzionale -OH (ossidrile), le aldeidi e chetoni, presentano un gruppo carbonilico C=O, gli acidi carbossilici che hanno il caratteristico gruppo –COOH, detto gruppo carbossilico e gli esteri, sostanze che si formano dalla reazione fra un acido e un alcol. La presenza in questi composti dell’ossigeno legato al carbonio, caratterizza le proprietà fisiche dei composti delle classi sopra riportate. Il legame ossigeno-carbonio è infatti polare, ma ancora più polare è il legame ossigeno-idrogeno, presente solo in alcoli e acidi carbossilici. Esempi OH CH3CH2OH alcol etilico, o etanolo, viene comunemente chiamato alcol, è presente nelle bevande alcoliche. O CH3COCH3 acetone, un comune solvente organico retinolo, chiamato anche vitamina A, è importante nella chimica della visione O CH3COOH OH acido acetico, è presente nell’aceto, si forma per fermentazione dell’etanolo canfora, estratta dalla pianta della canfora (Cinnamonum camphora) Chimica organica per 1e1e1.doc; autore: Brenn 14 - 15 - 5.1 Alcoli 5.1.1 Caratteristiche fisiche Gli alcoli a basso numero di atomi di carbonio sono liquidi a condizioni ambientali normali e sono ben solubili in acqua. L’alta temperatura di ebollizione degli alcoli rispetto a idrocarburi di pari massa molecolare, e la solubilità in acqua, solvente molto polare, degli alcoli a basso numero di atomi di carbonio sono dovuti alla presenza del gruppo ossidrilico molto polare. Anche aldeidi e chetoni con pochi atomi di carbonio, pur essendo molto meno polari di alcoli e acidi, risultano solubili in acqua. La solubilità decresce rapidamente all’aumentare della lunghezza della catena carboniosa, fatta da legami carbonio-carbonio e carbonio-idrogeno apolari. Ciò rende queste molecole apolari, e quindi insolubili in acqua. La temperatura di ebollizione, per contro, cresce a causa del crescere delle forze intermolecolari di London. 5.1.2 Reazioni di ossidazione La reazione di ossidazione degli alcoli è una caratteristica reazione di ossidoriduzione, può essere provocata, ad esempio, dal reattivo di Jones, una soluzione di anidride cromica CrO3 in ambiente acido (H2SO4). Esempi di reazioni: OH + CrO3 acido alcool primario OH + CrO3 CrO3 +3 O O + Cr OH aldeide acido carbossilico +3 ambiente acido alcool secondario OH + ambiente O + Cr chetone ambiente nessuna reazione acido alcool terziario Gli alcoli primari (il carbonio che porta il gruppo OH non è ramificato) si ossidano fino allo stato di acido carbossilico passando per lo stato intermedio di aldeide. Il cromo +6 si riduce a ione Cr+3 verde. Un vecchio test per la misura dell’alcolemia al volante (test del palloncino) faceva capo a questo reagente e, dalla intensità della colorazione verde all’interno del tubicino in cui si fa passare l’aria espirata, è possibile risalire alla concentrazione di alcool nel sangue. Gli alcoli secondari (il carbonio che porta il gruppo OH ha una ramificazione) si ossidano ai corrispondenti chetoni, gli alcoli terziari (il carbonio che porta il gruppo OH ha due ramificazioni) non si ossidano con questo reagente. Chimica organica per 1e1e1.doc; autore: Brenn 15 - 16 - 5.2 Acidi carbossilici 5.2.1 Caratteristiche fisiche Le caratteristiche fisiche degli acidi carbossilici, composti caratterizzati dal gruppo carbossilico – COOH molto polare, sono simili a quelle degli alcoli. Alta temperatura di ebollizione anche per le sostanze a più basso numero di atomi di carbonio e solubilità in acqua. La solubilità decresce però rapidamente e già acidi con 6 atomi di carbonio risultano quasi insolubili in acqua neutra. Gli acidi carbossilici a lunga catena, cioè con più di 10-12 atomi di carbonio, vengono chiamati acidi grassi. 5.2.1 Caratteristiche chimiche Gli acidi carbossilici devono il loro nome al fatto di avere un idrogeno, quello del gruppo carbossilico –COOH, che può essere ceduto ad altre particelle (basiche) B secondo la reazione di equilibrio acido-base: R-COOH + B R-COO- + BH+ R sta al posto di una catena carboniosa. Gli acidi carbossilici sono in genere acidi deboli, hanno infatti una costante acida Ka inferiore a 1. La reazione di condensazione fra un acido e un alcol porta alla formazione di una famiglia di composti ossigenati chiamati esteri. La reazione è: La reazione è catalizzata dalla presenza di un acido forte, ad esempio acido solforico concentrato, che ha anche funzione di sostanza disidratante ed è utile per “spostare” l’equilibrio verso i prodotti, grazie alla sottrazione dell’acqua dalla reazione. 5.2.3 Acidi carbossilici in natura, acidi grassi saturi e insaturi Gli acidi carbossilici a lunga catena, cioè con più di 10-12 atomi di carbonio, vengono chiamati acidi grassi. In natura compaiono quasi sempre come esteri, in particolare di un alcol, il glicerolo, che ha tre gruppi ossidrilici legati ai tre atomi di carbonio della molecola. Gli esteri del glicerolo sono chiamati trigliceridi (triesteri del glicerolo). La completa insolubilità in acqua è dovuta alla lunga catena apolare. I sali di sodio o di potassio degli acidi grassi sono chiamati saponi, argomento che verrà trattato nel prossimo capitolo. Gli acidi grassi naturali sono quasi esclusivamente a numero pari di atomi di carbonio e hanno catene lineari, non sono cioè ramificati. La spiegazione di questo fatto risiede nel modo come vengono sintetizzati nelle cellule a partire da un “mattone” di base a due atomi di carbonio, l’acetilcoenzima A. L’unione di più mattoni forma acidi carbossilici a vario numero pari di atomi di carbonio. Gli acidi grassi vengono suddivisi in acidi saturi e insaturi. In quelli saturi ci sono solo legami semplici carbonio carbonio, hanno dunque il massimo numero di atomi di idrogeno legati alla molecola, sono appunto “saturi” di idrogeno. Gli acidi grassi insaturi presentano uno o più doppi legami carbonio carbonio, hanno quindi meno idrogeni nella molecola che un corrispondente acido con la stessa lunghezza della catena carboniosa. I doppi legami negli acidi carbossilici naturali non sono tra di loro coniugati e presentano geometria cis dei doppi legami. Chimica organica per 1e1e1.doc; autore: Brenn 16 - 17 - Acidi grassi saturi ed insaturi si differenziano per caratteristiche fisiche: a parità di numero di atomi della catena, gli acidi saturi presentano una temperatura di fusione e di ebollizione maggiore di quelli insaturi. Esempi di acidi grassi naturali, saturi ed insaturi La differenza di temperatura di fusione e di ebollizione è causata dalla maggiore capacità di impaccamento delle molecole di quelli saturi grazie alla maggiore mobilità degli atomi della catena (i legami semplici permettono la libera rotazione delle due parti della molecola). Ciò comporta una minore distanza media fra le molecole e quindi una maggiore forza dei legami intermolecolari, con conseguenti temperature di fusione ed ebollizione più alte. La maggiore rigidità strutturale negli acidi carbossilici insaturi con geometria cis fa sì che le forze di London siano più deboli con più basse temperature dei passaggi di stato. Gli acidi grassi con geometria trans hanno invece temperature di ebollizione comparabili con acidi saturi di pari lunghezza di catena. 6- Ammine, amminoacidi e proteine Come nell'ammoniaca NH3, l'atomo di azoto delle ammine ha geometria piramidale a base triangolare e come l'ammoniaca, anche le ammine sono basiche poiché il doppietto elettronico non condiviso dell'atomo di azoto può essere impiegato per legare uno ione acido H+. Le ammine formano facilmente sali solubili con gli acidi minerali (acido cloridrico o acido solforico) e spesso vengono commercializzate in tale forma. Vengono suddivise in ammine primarie, secondarie e terziarie a seconda del numero di legami azoto-carbonio presenti. NH2 Le ammine aromatiche, ovvero quelle come l'anilina in cui l'azoto amminico è direttamente legato ad un anello aromatico, sono meno basiche perché il doppietto elettronico dell'azoto amminico è parzialmente condiviso con l'anello aromatico per risonanza e quindi meno disponibile ad essere ceduto. 6.1 Caratteristiche fisiche e chimiche delle ammine Le ammine hanno generalmente punti di ebollizione più elevati degli alcani aventi massa molecolare simile, per via dei legami a ponte di idrogeno Chimica organica per 1e1e1.doc; autore: Brenn 17 - 18 - dovuto ai legami covalenti polari azoto-idrogeno. L'intensità del legame a ponte di idrogeno è però meno forte di quanto osservato negli analoghi composti ossigenati (alcoli, acidi carbossilici). Una reazione importante delle ammine con gli acidi carbossilici porta alla formazione di ammidi. H O OH 6.2 + O N N + H2O Esempi di particolari composti azotati Parecchi composti, sia naturali (esempi nella figura a sinistra) che sintetici, contenenti azoto presentano un’intensa attività farmacologica. Gli alcaloidi sono senza dubbio le sostanze di origine vegetale o animale che inducono i maggiori effetti sugli organismi animali Il termine alcaloide è più di tipo farmacologico e medico che di tipo chimico, dato che i vari alcaloidi provengono da una serie di composti organici diversi per gruppi funzionali presenti e l'unico dato chimico che li accomuna è la presenza dell’azoto basico. Possiamo classificarli dal punto di vista chimico, biosintetico oppure rispetto alla loro attività biologica. Il forte effetto sul sistema nervoso è causato dalla loro “somiglianza” con i neurotrasmettitori endogeni. Ne riescono cioè ad imitare il funzionamento a livello delle sinapsi. 6.3 Amminoacidi e proteine Le proteine sono polimeri naturali costituiti da unità di α-amminoacidi legate fra di loro da legami ammidici (peptidici). Sono sostanze essenziali sia per la struttura degli organismi animali (es. muscoli) che per la regolazione delle reazioni chimiche (enzimi). L’idrolisi delle proteine, reazione catalizzata da un pH acido, porta agli amminoacidi liberi, composti che hanno un gruppo funzionale carbossilico (–COOH) e un gruppo basico amminico (-NH2) legato al carbonio adiacente (chiamato carbonio α) quello carbossilico. Tutti gli amminoacidi, tranne la glicina, hanno il carbonio α chirale. Gli α amminoacidi naturali hanno il gruppo ammino a sinistra nella rappresentazione convenzionale detta proiezione di Fischer, sono quindi della serie L. Gli amminoacidi che compaiono nelle proteine degli organismi viventi sono 20 e sono sotto il controllo genetico, nel senso che l'informazione del tipo e della posizione di un amminoacido in una proteina è codificata nel DNA. Chimica organica per 1e1e1.doc; autore: Brenn 18 - 19 - Talvolta, nelle proteine compaiono anche altri amminoacidi, più rari, detti occasionali che vengono prodotti per modifiche chimiche successive alla biosintesi della proteina, che avviene sul ribosoma. In natura sono stati finora scoperti oltre 500 amminoacidi diversi che non fanno parte di proteine e svolgono ruoli biologici diversi. Alcuni sono stati addirittura trovati nelle meteoriti. Piante e batteri sono in grado di biosintetizzare amminoacidi particolari. Oltre a quelli coinvolti nella biosintesi delle proteine, vi sono amminoacidi che svolgono importanti funzioni biologiche quali la glicina, l'acido gammaamminobutirrico (GABA, un γ amminoacido) e l'acido glutammico, che hanno anche una funzione di neurotrasmettitori, la carnitina, coinvolta nel trasporto dei lipidi all'interno della cellula. Alcuni dei 20 amminoacidi ordinari sono detti essenziali, in quanto non possono essere biosintetizzati direttamente da un organismo, devono pertanto essere assunti col cibo. Essenziali per l'uomo sono la lisina, la leucina, l'isoleucina, la metionina, la fenilalanina, la treonina, il triptofano, la valina, e, nei bambini, l'istidina e l'arginina. Le proteine, come già accennato sopra, sono biopolimeri composti da molti L-α-amminoacidi legati tra di loro con legame ammidico (peptidico) che formano quindi lunghe catene chiamate polipeptidi (fino a 100 amminoacidi) o proteine (più di 100 amminoacidi, es mioglobina 153 amminoacidi). La descrizione della complessa struttura tridimensionale di queste lunghe macromolecole viene suddivisa in tre parti: a) Struttura primaria Per struttura primaria si intende la sequenza degli amminoacidi presenti in una proteina. A fianco la sequenza, scritta mediante sigle, dei differenti amminoacidi che compongono l’insulina. b) Struttura secondaria Si potrebbe credere che le proteine, dato che sono lunghissime catene di atomi, abbiano forma spaziale casuale e non ben definita. Ciò non corrisponde alla realtà, in parte per la parziale rigidità del legame ammidico, in parte per i forti legami fra Chimica organica per 1e1e1.doc; autore: Brenn 19 - 20 - parti polari della catena. Molte proteine allo stato puro si presentano in forma cristallina, cioè con molecole ordinate ed impaccate in una struttura ordinata. La forma spaziale che una proteina assume dipende essenzialmente dalla natura dei gruppi R sporgenti dalla catena, e quindi dalla struttura primaria. I gruppi polari tendono a dare legami a ponte di idrogeno fra varie parti della stessa catena o fra parti di catene proteiche diverse. Ciò porta a due possibili disposizioni spaziali: ad alfa elica o a foglietto a pieghe. c) Struttura terziaria La struttura terziaria descrive la complessiva disposizione spaziale delle varie parti, ad α elica o a foglietto, dell’intera proteina. La funzione biologica di una proteina è strettamente in relazione alla forma. Se una proteina viene riscaldata ad una temperatura troppo alta, si denatura, perde cioè la sua forma tridimensionale e così anche la funzione per cui la natura la sintetizza. In questo corso non si intende entrare più nel dettaglio e si rimanda chi fosse interessato ad approfondire le conoscenze a un buon libro di biologia o, per ampliarle senza troppi aspetti complessi, al sito: http://en.wikipedia.org/wiki/Protein. 7– Lipidi Comunemente chiamati "grassi", i lipidi comprendono una grande varietà di molecole, accomunate dalla caratteristica di essere insolubili in acqua e di avere una densità significativamente minore di quella dell'acqua (cioè galleggiano). Dal punto di vista chimico si possono distinguere in: o lipidi idrolizzabili, esterificati con acidi grassi come trigliceridi, cere, steroli, fosfolipidi, glicolipidi; sono decomponibili con enzimi esterasi. o Lipidi non idrolizzabili: biomolecole eterogenee come alcoli alifatici a lunga catena, steroli ciclici (es. colesterolo), steroidi, acidi grassi e loro derivati (es. eicosanoidi), carotenoidi, terpeni e altri ancora. I lipidi più importanti dal punto di vista dell'alimentazione umana sono: o Trigliceridi o Fosfolipidi o Colesterolo I lipidi assolvono nell'organismo umano molte ed importanti funzioni: o apporto energetico (un grammo fornisce circa 38 kJ) o forniscono gli acidi grassi essenziali all'organismo o favoriscono l'assorbimento intestinale delle vitamine liposolubili o sono componenti fondamentali delle membrane cellulari in tutti i tessuti o gli acidi grassi polinsaturi appartenenti alle famiglie ω6 ed ω3 sono precursori di composti che nell'organismo svolgono importanti funzioni regolatorie. o influenzano l'assetto lipidico ematico Chimica organica per 1e1e1.doc; autore: Brenn 20 - 21 - 7.1 Glicerolo e formazione di trigliceridi Come già accennato, in natura gli acidi grassi non sono presenti liberi, ma in forma di esteri con vari OH alcoli, come cere con alcoli a catena molto lunga, e come trigliceridi, triesteri del OH glicerolo, un alcol con tre atomi di carbonio, ciascuno dei quali ha legato un gruppo OH. Il glicerolo è anche chiamato impropriamente OH glicerina. Si definiscono trigliceridi semplici se il glicerolo è esterificato con tre molecole identiche di acido grasso (in alto nella figura a lato), trigliceridi misti quelli in cui sono presenti diversi acidi grassi (in basso nella figura a lato). Tabella della composizione percentuale di acidi grassi in vari oli e grassi ac. Palmitico (C15H31COOH) ac. Stearico (C17H35COOH) ac. Oleico (C17H33COOH) ac. Linoleico (C17H31COOH) Numero di iodio (g I2 per 100 g grasso) 4 - 10 1-5 2 – 10 0-2 8-10 1) 34 - 43 3-6 38 - 40 5 - 11 48-58 burro 23 - 26 10 - 13 30 - 40 4-5 26-45 2) strutto 28 - 30 12 - 18 41 - 48 6-7 46-66 sego 24 - 32 14 - 32 35 - 48 2-4 32-47 olio di ricino 0-1 0-9 3-7 81-90 3) olio di oliva 5 - 15 1-4 69 - 84 4 - 12 74-94 olio di arachidi 6-9 2-6 50 - 70 13 - 26 83-98 4) olio di colza 0-1 0-2 20 - 38 10 - 15 94-106 olio di semi di cotone 19 - 24 1-2 23 - 33 40 - 48 103-115 olio di lino 4-7 2-5 9 - 38 3 - 43 170-204 5) olio di merluzzo 10 - 16 1-2 grasso di cocco grasso di palma 120-190 6) 1) 45-51% ac. laurico (C11H23COOH) 2) 3-4% ac. butirrico (C3H7COOH) 3) 80-92% ac. ricinico (C17H32OHCOOH), un idrossiacido insaturo 4) 2-5% ac. arachidico (C19H39COOH) 5) 25-58% ac. linolenico (C17H29COOH) 6) 31-45% ac. insaturi C20 - C22 Chimica organica per 1e1e1.doc; autore: Brenn 21 - 22 - Le percentuali riportate si riferiscono all’analisi condotta sulle componenti ottenute dopo reazione di scomposizione in acidi liberi dei vari miscugli di trigliceridi. Si può osservare come abbiano aspetto oleoso, a temperatura ambiente, quei miscugli in cui la quota di acidi insaturi esterificati sia alta e grassi quelli con percentuali più elevate di acidi grassi saturi. La spiegazione è da ricondurre al minore impaccamento anche nei triesteri con molte catene con doppi legami cis di acidi insaturi, o maggiore impaccamento nel caso siano presenti prevalentemente catene sature. 7.2 Saponi e saponificazione Per saponi, in senso stretto, si intendono i sali di sodio o di potassio degli acidi grassi. Essi appartengono alla famiglia dei tensioattivi, sostanze caratterizzate dalla presenza nella molecola sia di una parte polare (anionica, come nei saponi, cationica o non ionica) sia di una lunga catena idrocarburica apolare. I saponi si possono ottenere dalla reazione di saponificazione di miscugli di trigliceridi, oli o grassi, animali o vegetali. Schema della reazione: O H2C O O H2C OH HC O O + 3 NaOH H2C O acqua/alcol HC OH O + 3 Na +1 -1O H2C OH La reazione produce quindi il sale di sodio o di potassio dell’acido carbossilico e glicerolo libero. Un tempo veniva condotta mediante lunga bollitura con soda caustica (NaOH) o potassa caustica (KOH), seguita poi da molti lavaggi con acqua per diminuirne l’alcalinità e ottenere così il sapone di Marsiglia. (vedi: http://it.wikipedia.org/wiki/Sapone) 7.2.1 Saponi e detergenti: funzionamento e aspetti di problemi ambientali I saponi, come tutti i tensioattivi, possiedono un residuo idrofobico e un gruppo idrofilo e per questo tendono in acqua a formare degli aggregati di forma più o meno sferica chiamati micelle. I residui idrofobici (code) si orientano verso l’interno della micella con le parti polari o ioniche (teste) verso l’acqua. La carica negativa superficiale delle micelle fa sì che queste siano di dimensioni molto piccole dando origine ad una emulsione (miscuglio eterogeneo liquido liquido) che permette quindi la detergenza dell’unto da un tessuto o dalla pelle. Chimica organica per 1e1e1.doc; autore: Brenn 22 - 23 - L’uso di saponi in acque calcaree, sono quelle acque ricche di ioni calcio e magnesio, portano alla precipitazione dei saponi come sali insolubili di calcio o magnesio. La mancata formazione di micelle impedisce quindi la detergenza. Per ovviare a questo problema, si usano quantitativi di detersivo tanto più elevati tanto più calcarea risulta l’acqua potabile. L’industria chimica ha sintetizzato sostanze tensioattive chimicamente diverse dai saponi che non precipitano in acque calcaree. Un’altra soluzione cui si ricorre in più alle precedenti è di aggiungere opportuni additivi, come ad esempio i polifosfati, che legano gli ioni calcio e magnesio in modo che le sostanze detergenti possano svolgere la loro funzione senza dover aumentare in modo consistente la dose. Ciò ha portato due conseguenze ambientali: da una parte la sintesi e l’utilizzo di sostanze detergenti non biodegradabili (non lo sono quelli che hanno la lunga catena apolare ramificata o contenente anelli aromatici), i saponi lo sono invece al 100%, dall’altra l’uso di additivi contenenti fosforo (polifosfati, ad esempio il trifosfato pentasodico, Na5P3O10) che hanno portato, prima dell’introduzione generalizzata dei depuratori delle acque, all’eutrofizzazione delle acque dei laghi. 7.2.2 Esperienza pratica di laboratorio: produzione di un sapone Sostanze e soluzioni per la sintesi - 10 g di un olio o di un grasso (si consiglia l’olio di oliva il grasso di cocco o un altro grasso vegetale) - 100 mL di miscela di acqua e alcol al 50% v/v (di cui 40 mL utilizzati per la soluzione che segue) - 5 g di NaOH in 40 mL di acqua e alcol al 50% v/v - 150 mL di soluzione 1 M di NaCl Procedimento Per dimostrare la possibilità di ottenere saponi di proprietà diverse fra loro si consiglia di usare in ogni gruppo di studenti un olio o un grasso diverso. Si riscalda su piastra, in un bicchiere da 250 mL forma larga, il grasso o l’olio agitando vigorosamente con un magnete. Aggiungere i 40 mL di soluzione di NaOH in acqua e alcool all’olio o al grasso riscaldato. Di tanto in tanto aggiungere, a piccole dosi, la miscela di acqua e alcol, tanto quanto basta per mantenere costante il volume della miscela di reagenti. Dopo circa 15 minuti la soluzione diviene limpida. Quando la soluzione comincia a schiumare in modo molto evidente, aggiungere 20 mL della soluzione di NaCl e continuare a riscaldare fino alla formazione di grumi di sapone riducendo il volume della miscela. Nella saponificazione del grasso di cocco non si formano grumi e la soluzione rimane limpida e trasparente. Depositare per 10 minuti nel congelatore il bicchiere contenente la miscela di reazione. Filtrare su filtro a pieghe in un imbuto la miscela di reazione. Chimica organica per 1e1e1.doc; autore: Brenn 23 - 24 - Tempo permettendo si può lavare il sapone nel filtro a pieghe con dell’acqua demineralizzata precedentemente raffreddata. Il sapone ricavato dal grasso vegetale ha una granulometria relativamente piccola e un colore giallo chiaro. Il sapone che si è formato con il grasso di cocco è di grossa granulometria e di colore bianco. Il sapone ottenuto dall’olio di oliva è di media granulometria e di colore giallognolo con evidente profumo di sapone. 8 Membrane cellulari e trasporto di sostanze 8.1 Introduzione La membrana cellulare (o plasmatica) costituisce l'involucro della cellula. È formata da un doppio strato di fosfolipidi, attraversata parzialmente o completamente da numerose proteine. Le componenti principali della membrana (proteine, lipidi polari e carboidrati) sono presenti in quantità diverse a seconda del tipo di membrana. Lo spessore della membrana è di circa 8 nm. Per la sua natura lipidica, la membrana è fortemente permeabile alle sostanze liposolubili, quindi apolari. L’osservazione che la membrana viene facilmente attraversata anche dall'acqua e da piccole molecole insolubili nei lipidi, permette di dedurre che la membrana lipidica è costituita al microscopio elettronico di anche da pori o canali che permettono il passaggio delle molecole di Immagine una membrana cellulare piccole dimensioni non liposolubili. La membrana plasmatica, che avvolge ogni citoplasma, oltre a definirne la dimensione, ha il ruolo principale di separare ciò che sta al suo interno da ciò che sta all’esterno. Si crea così la possibilità di organizzare in maniera ordinata le attività chimiche che avvengono all’interno della cellula. La membrana plasmatica non costituisce solo una barriera passiva, ma è in grado di regolare il passaggio delle sostanze. La sua funzione è quindi anche quella di filtro selettivo capace di mantenere concentrazioni diverse fra l’interno e l’esterno e, di lasciare entrare le sostanze nutritive, facendo uscire i rifiuti: ciò permette di mantenere le condizioni in cui possono svolgersi le attività metaboliche. Ogni organello cellulare è delimitato da una o due membrane. Chimica organica per 1e1e1.doc; autore: Brenn 24 - 25 - 8.2 Componenti delle membrane 8.2.1 Fosfolipidi Le molecole fosfolipidiche sono anfipatiche, sono molecole formate sia da una parte idrofila (la "testa" costituita da glicerina, da un gruppo fosfato e da un amminoalcol) sia da una idrofoba (la "coda" formata da acidi grassi). I fosfolipidi possono esssere esteri dal glicerolo e della sfingosina, un alcol più complesso. I fosfolipidi che derivano dal glicerolo sono chiamati fosfogliceridi e sono costituiti da due catene di acidi grassi (formano la coda apolare), una molecola di glicerolo, una di fosfato e una di colina (queste ultime 3 molecole formano la testa polare). I fosfolipidi che derivano dalla sfingosina sono chiamati sfingolipidi, tra cui la sfingomielina. Essa è l’unico fosfolipide di membrana che non deriva dal glicerolo. Nella sfingomielina si trova, al posto del glicerolo, un amminoalcol che contiene una lunga catena idrocarburica. Nella sfingomielina, il gruppo amminico della sfingosina è legato ad un acido grasso mediante un legame ammidico. Inoltre, il gruppo ossidrilico primario della sfingosina è esterificato dalla fosforilcolina. 8.2.2 Glicolipidi I glicolipidi, sono lipidi contenenti un carboidrato. Anche i glicolipidi derivano dalla sfingosina. I glicolipidi differiscono dalla sfingomielina per il tipo di unità che è legato al gruppo ossidrilico della sfingosina. Nei glicolipidi, uno o più carboidrati semplici (invece della fosforilcolina) sono attaccati a questo gruppo. Il glicolipide più semplice è il cerebroside, in cui vi è solo uno zucchero, glucosio o galattosio (isomeri di formula C6H12O6). Chimica organica per 1e1e1.doc; autore: Brenn 25 - 26 - 8.2.3 Colesterolo Un altro lipide presente in alcune membrane è il colesterolo. Esso può inseririsi nelle lamine fosfolipidiche, intercalandosi tra le molecole lipidiche. Per la sua posizione, il colesterolo riduce la libertà di movimento del tratto prossimale (più vicino al glicerolo) delle catene degli acidi grassi. Le membrane plasmatiche di cellule come gli eritrociti e le cellule mieliniche del sistema nervoso sono ricche di questo steroide. 8.2.4 Proteine di membrana Si possono distinguere due tipi di proteine presenti come componenti delle membrane: o Proteine periferiche: si associano alla membrana con interazioni elettrostatiche e legami idrogeno tra il dominio idrofilico della proteina e le teste polari dei lipidi di membrana. Esse possono essere rilasciate dalla membrana mediante trattamenti con reagenti che alterano le interazioni elettrostatiche o rompono i legami a ponte di idrogeno; regolano le attività di enzimi legati alla membrana o limitano la mobilità di altre proteine mantenendole legate a strutture intracellulari. o Proteine integrali: sono legate alla membrana da interazioni idrofobiche tra i lipidi di membrana e i domini idrofobici delle proteine; esse possono essere staccate da reagenti che interferiscono con le interazioni idrofobiche nel doppio strato lipidico. 8.3 Struttura delle membrane I fosfolipidi, in acqua, si dispongono con le code apolari (idrofobiche) in contatto tra loro e le teste polari (idrofiliche) disposte in superficie per interagire con il solvente. Quando i fosfolipidi anfipatici sono dispersi in un ambiente acquoso, si formano 3 tipi di aggregati: -Micelle: sono strutture sferiche con le code apolari raggruppate all’interno della sfera e lontane dall’acqua, mentre le teste polari sono esposte sulla superficie in contatto con l’acqua. -Doppio strato: le molecole lipidiche formano un foglietto bidimensionale. In ogni monostrato le parti idrofobiche non sono a contatto con l’acqua e interagiscono tra loro, mentre le teste polari e idrofile sono in contatto con l’acqua da entrambe le parti del doppio strato. L’assunzione della disposizione a doppio strato è un processo che si compie in modo spontaneo e rapido. Le interazioni idrofobiche sono la forza principale che ne causa la formazione. Chimica organica per 1e1e1.doc; autore: Brenn 26 - 27 - Poiché esso ha i bordi esposti all’acqua, la struttura è instabile e forma un terzo tipo di aggregato lipidico: - Liposoma: il doppio strato si ripiega su se stesso perdendo i bordi idrofobici esposti all’acqua e forma una sfera stabile nell’acqua. Questa vescicola tridimensionale a doppio strato può inglobare acqua, formando un compartimento separato dall’ambiente circostante ed è quindi probabile che le prime cellule fossero simili a liposomi. Il contenuto di proteine nelle membrane varia moltissimo. La mielina, una membrana che isola le cellule nervose, ha un contenuto di proteine molto basso (18%). Le membrane plasmatiche della maggior parte delle altre cellule sono invece molto più attive e contengono pompe, pori, recettori ed enzimi. Il contenuto di proteine di queste membrane plasmatiche costituisce in genere il 50%. Le membrane che trasferiscono energia come le membrane interne dei mitocondri o dei cloroplasti, hanno un contenuto più alto di proteine, circa il 75%. La permeabilità e gli spostamenti delle molecole proteiche o lipidiche all’interno della membrana definiscono un modello a mosaico fluido della struttura delle membrane biologiche. Le proteine sono immerse nel doppio strato fosfolipidico a intervalli irregolari e sono mantenute nella posizione corretta da interazioni idrofobiche tra i lipidi di membrana e i domini idrofobici delle proteine. Siccome le interazioni tra lipidi e proteine non sono dovute a legami covalenti ma a interazioni idrofobiche, ogni molecola lipidica o proteica è fluida, cioè può spostarsi lateralmente nella membrana. All’interno della membrana ci sono le catene degli acidi grassi che formano una parte idrofobica fluida dove le proteine integrali galleggiano. I carboidrati legati ad alcuni lipidi e proteine si trovano all’esterno. Sia le proteine che i lipidi possono spostarsi maggiormente lateralmente, nel doppio strato, che verticalmente. La struttura a doppio strato è stabile, ma le singole molecole di fosfolipidi e steroidi possono muoversi nel piano della membrana, infatti l’interno è fluido. Il moto dei componenti della membrana dipende dalla fluidità, cioè dalla viscosità della membrana stessa. I principali fattori che determinano la fluidità della membrana cellulare sono: 1) temperatura: a bassa temperatura i movimenti sono limitati e il doppio strato è in una struttura paracristallina, mentre ad alta temperatura i lipidi si muovono liberamente e velocemente. 2) composizione degli acidi grassi: le catene degli acidi grassi dei lipidi di membrana possono trovarsi sia in uno stato ordinato e rigido che in uno stato relativamente disordinato e fluido. Il passaggio dallo stato rigido e quello fluido avviene quando la temperatura sale sopra la temperatura di fusione. La temperatura di transizione dipende dalla lunghezza delle catene degli acidi grassi e dal loro grado di insaturazione. Lo stato rigido è dato dalla presenza di acidi grassi saturi perché le loro catene diritte interagiscono molto facilmente fra di loro. D’altra parte, un doppio legame C═C a geometria cis produce nella catena un angolo che interferisce con la disposizione ottimale delle catene degli acidi grassi. Quindi, una catena di acido grasso insaturo è più flessibile di quella di uno saturo e questo effetto è aumentato dalla presenza di più legami doppi. Un altro aspetto da considerare è che le catene lunghe di acidi grassi interagiscono più fortemente di quelle corte. Quindi la fluidità della membrana è aumentata dalla presenza di doppi legami nelle catene degli acidi grassi e dalla brevità delle catene stesse. Le cellule regolano la composizione lipidica delle loro membrane per avere una fluidità costante nelle varie condizioni di crescita. I tre movimenti dei fosfolipidi: 1) Il primo tipo di movimento dei lipidi, molto frequente, riguarda la flessibilità delle catene degli acidi grassi, ed è la diffusione laterale dove una molecola può diffondere velocemente nel doppio strato. 2) Il secondo tipo di movimento, meno probabile della diffusione laterale e più lento, è la diffusione trasversale o diffusione a flip-flop dove un fosfolipide si muove da una faccia della membrana Chimica organica per 1e1e1.doc; autore: Brenn 27 - 28 - all’altra: la testa polare lascia l’ambiente acquoso per entrare nell’interno idrofobico richiedendo energia. 3) Il terzo tipo di movimento è la rotazione dove un lipide ruota su se stesso sempre nello stesso posto. 8.4 Trasporto attraverso la membrana Nel corso dell’evoluzione, la comparsa della capacità delle membrane di mantenere un ambiente interno e uno esterno significativamente differenti ha costituito una tappa fondamentale nel passaggio dal mondo inorganico alle prime forme viventi. I meccanismi biologici di trasporto comprendono l’osmosi, la diffusione, il trasporto passivo e attivo, i canali ionici. 8.4.1 Osmosi Con il termine osmosi si indica un passaggio di acqua attraverso una membrana semipermeabile, in risposta a gradienti di concentrazione di soluti, a gradienti di pressione, oppure a entrambi. Se dunque la concentrazione delle soluzioni esterne alla cellula è diversa da quella esistente al suo interno, possono verificarsi fenomeni assai rilevanti per la cellula stessa. Se la membrana semipermeabile separa due soluzioni isotoniche (cioè che hanno uguale concentrazione), non si ha un movimento osmotico netto di acqua in nessuno dei due sensi. Ma se una delle due soluzioni è ipertonica (quindi contiene più soluti) rispetto all'altra (definita ipotonica), allora l'acqua si muoverà dalla soluzione ipotonica a quella ipertonica. Ad esempio nelle cellule del sangue, i globuli rossi (eritrociti) riescono a vivere e a svolgere le proprie funzioni perché il plasma (cioè il liquido sanguigno in cui si trovano) ha una concentrazione uguale alla loro, ha cioè una pressione osmotica uguale a quella dei gobuli in esso contenuti (soluzione isotonica). 8.4.2 Diffusione La diffusione consiste nel passaggio di molecole attraverso la membrana plasmatica (senza proteine canali) senza consumo di energia, perché il movimento avviene secondo il gradiente di concentrazione, di pressione o di carica elettrica. La membrana può essere direttamente attraversata con questa modalità solo da alcuni tipi di molecole di basso peso molecolare e piccole dimensioni, come l’acqua (osmosi), piccole molecole liposolubili (che possono sciogliersi nei grassi) e gas disciolti. e acqua 8.4.3 Trasporto di sostanze attraverso le membrane Per effetto dei meccanismi di trasporto, diventa possibile anche il passaggio di altre specie molecolari come quelle idrosolubili, molecole di grandi dimensioni, o molecole caratterizzate da una particolare distribuzione di cariche. il passaggio avviene sia secondo il gradiente sia contro il gradiente, e sia verso l’esterno sia verso l’interno, a seconda delle necessità metaboliche della cellula. I passaggi che avvengono contro gradiente richiedono energia, e comportano quindi il consumo di molecole energetiche come l’ATP. Grazie a questi meccanismi, le cellule possono mantenere differenti concentrazioni rispetto all’ambiente esterno, proprietà su cui si basano numerosi fenomeni biologici. Chimica organica per 1e1e1.doc; autore: Brenn 28 - 29 - La membrana plasmatica di tutte le cellule contiene una grande varietà di trasportatori, proteine che attraversano la membrana trasportando sostanze nutrienti all’interno e prodotti di scarto all’esterno della cellula. Molte proteine sono disposte sulla superficie della cellula (recettori) e possiedono siti altamente specifici che legano molecole di segnale extracellulari (ligandi dei recettori). Quando un ligando esterno si lega al suo recettore specifico, la proteina recettrice trasforma il segnale portato dal ligando in un messaggio intracellulare. Per esempio, alcuni recettori di superficie sono associati a canali ionici che si aprono quando il sito del recettore viene occupato, permettendo l’ingresso di specifici ioni; altri inibiscono o attivano enzimi intracellulari posti sulla superficie interna della membrana. Qualunque sia il sistema di traduzione (trasformazione) del segnale, i recettori sulla superficie agiscono come degli amplificatori: una singola molecola di ligando che si lega a un singolo recettore determina un flusso di migliaia di ioni attraverso il canale aperto oppure la sintesi di migliaia di molecole di un messaggero intracellulare ad opera di un enzima attivato. 8.4.3.1 Trasporto passivo Questo tipo di trasporto è una diffusione di molecole che, per le loro dimensioni e natura chimica, non riescono a passare direttamente attraverso la membrana. Nel trasporto passivo, le molecole passano da una parte all’altra della membrana all'interno di molecole proteiche che attraversano completamente lo spessore della membrana stessa, fungendo da canali (proteine canale) che rimangono sempre aperti; questo passaggio avviene esclusivamente nella direzione in cui il soluto migrerebbe per diffusione; per tale motivo, questa modalità di trasporto viene anche indicata come “diffusione facilitata”. Poiché avviene secondo il gradiente di concentrazione (e non si accumula oltre la concentrazione di equilibrio), il trasporto passivo è un fenomeno che ha luogo senza dispendio di energia. Esso permette il passaggio di particelle idrofile, come gli ioni Ca2+, Na+ e K+, molecole di monosaccaridi e di amminoacidi. Nelle membrane si trovano in genere diversi tipi di proteine-canale o pori selettivi, dotate di un’elevata specificità per alcuni tipi di sostanze determinata dal diametro del canale e dalla natura dei gruppi residui dei vari amminoacidi: ad esempio, vi sono canali specifici per il sodio e canali specifici per il potassio. Un altro bell’esempio di trasporto passivo è il trasportatore del glucosio degli eritrociti. Il metabolismo che produce energia nell’eritrocita dipende da un rifornimento costante di glucosio proveniente dal plasma sanguigno, dove la concentrazione dello zucchero viene mantenuta intorno a 5mM. Il glucosio entra nell’eritrocita per diffusione facilitata attraverso uno specifico trasportatore a una velocità 50000 volte più elevata di quella non facilitata. 8.4.3.2 Trasporto attivo Consiste nello spostamento di molecole contro gradiente e accumula il soluto su un lato della membrana (ambiente extracellulare oppure citoplasma). Il trasporto attivo richiede energia e può funzionare solo se tale processo è accoppiato ad un processo esoergonico, come ad esempio una reazione di ossidoriduzione o il consumo di energia fornita da molecole di ATP. Col trasporto attivo si può, ad esempio, spiegare l’abbondanza di iodio in alcune alghe nonostante le bassissime concentrazioni di questo elemento nell’acqua marina, o ancora l’accumulo di determinate sostanze nelle radici delle piante in concentrazioni decisamente superiori a quelle presenti nel terreno. Il funzionamento di questi trasportatori, che prendono il nome di pompe, si basa in genere su un cambiamento della conformazione della proteina: l’attacco della molecola al suo sito modifica la conformazione della pompa proteica; l’ATP fornisce l’energia necessaria all’apertura del canale e al rilascio della molecola dall’altra parte della membrana. Chimica organica per 1e1e1.doc; autore: Brenn 29 - 30 - Le tre classi di sistemi di trasporto differiscono per il numero di soluti trasportati e per la direzione in cui ogni soluto viene trasportato. I sistemi che trasportano simultaneamente due soluti attraverso una membrana, tutti vanno sotto il nome di sistemi di cotrasporto. Quando, come in questo caso, i due soluti si muovono in direzioni opposte, il processo viene detto antiporto. Nel simporto, i due substrati si muovono simultaneamente nella stessa direzione. I trasportatori che trasportano un solo substrato, come nel caso del glucosio, vengono detti sistemi uniporto o trasporto semplice. Bibliografia Harold Hart et al.; Chimica organica, Zanichelli 2003 Lehninger, Principi di biochimica, terza edizione, Zanichelli H. R. Christen, Grundlagen der Chemie, Sauerländer www.wikipedia.com Chimica organica per 1e1e1.doc; autore: Brenn 30
Scaricare