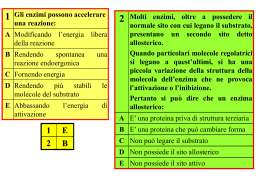
GLI ENZIMI: i catalizzatori delle reazioni nei sistemi biologici Diagrammi dello stato di transizione L'energia di attivazione è l‘energia necessaria al sistema per iniziare un particolare processo L'energia di attivazione consente ai reagenti di formare il complesso attivato o stato di transizione, la cui esistenza è estremamente breve (tempi dell'ordine di 10-15 s). Dallo stato di transizione sono possibili due eventi: si riformano i reagenti iniziali, oppure la formazione dei prodotti della reazione. Entrambi questi eventi risultano possibili in quanto ognuno di questi produce un rilascio di energia (mostrata dall'andamento dell‘entalpia durante la reazione). Tratto da Voet & Voet, Fondamenti di Biochimica Zanichelli Diagrammi dello stato di transizione Diagramma di una reazione catalizzata da enzimi (blu), che mostra il livello di energia in funzione della coordinata di reazione. Si nota che la reazione segua un percorso a cui compete una minore energia di attivazione. L'effetto della catalisi è cinetico cinetico,, e non termodinamico termodinamico:: agisce sugli stadi intermedi di una reazione, ma non ne modifica gli stati finali.. Questo significa che la catalisi non influisce sulla possibilità finali o meno che una reazione avvenga avvenga.. PROPRIETA‘ GENERALI DEGLI ENZIMI Condizioni di reazione più moderate (di norma pH 7.4 e 37°°C) 37 Velocità di reazione più elevate (velocità da 106 a 1012 volte maggiore delle reazioni non catalizzate) Maggiore specificità di substrato (le reazioni hanno difficilmente prodotti collaterali) Possibilità di regolazione (controllo allosterico, variazioni nella quantità di enzima sintetizzato, modificazioni covalenti) Tratto da Voet & Voet, Fondamenti di Biochimica Zanichelli Gli enzimi possono essere: * costitutivi * Proteine semplici * induttivi Metallo proteine Proteine complesse Endo cellulari * oligomerici Extra cellulari monomerici Complessi proteici Enzimi plasmatici Funzionali o costitutivi Generalmente prodotti nel fegato, sono fisiologicamente presenti nel sangue Ceruloplasmina: globulina ad attività Ceruloplasmina: ferroossidasica.. E‘ diminuita nel morbo ferroossidasica di Wilson (epatopatia) Colinesterasi: definita Colinesterasi: pseudocolinesterasi (per distinguerla da quella di origine nervosa) globulina ad attività ferroossidasica ferroossidasica.. E‘ diminuita nelle epatopatie e bloccata da alcuni insetticidi Enzimi dei processi coagulativi: coagulativi: proteasi presenti come zimogeni. Non funzionali o non costitutivi Sono presenti nel sangue spesso in condizioni patologiche secretivi: es. -amilasi secreta dal secretivi: pancreas esocrino e riversata nell‘intestino (pancreatiti (pancreatiti acute) intracellulari: rilasciati nel intracellulari: sangue dopo lesione cellulare es. transaminasi e lattico deidrogenasi (miocardio) o alcool deidrogenasi e isocitrato deidrogenasi (epatite virale) Natura degli enzimi Proteine semplici Metallo proteine proteine:: generalmente metallo proteina + cofattore, Proteine coniugate coniugate:: apoenzima (specificità) + gruppo non proteico (azione (azione;; definito coenzima, se labilmente legato o gruppo prostetico se fortemente legato) Natura degli enzimi Monomerici: una sola unità proteica (proteasi Monomerici: digestive) Oligomerici: più monomeri legati in modo non Oligomerici: covalente (enzimi della glicolisi) Complessi enzimatici enzimatici:: associazione organizzata di enzimi che cooperano in una serie organizzata di reazioni che costituiscono un evento metabolico (sintetasi degli acidi grassi) Isoenzimi Enzimi che esistono in forme molecolari diverse, ma che catalizzano la stessa reazione reazione.. La lattico deidrogenasi E‘ un tetramero costituito da tutte le possibili combinazioni di due diverse catene polipeptidiche A e B. Le 5 forme risultanti catalizzano tutte la stessa reazione:: reazione L(+)lattato +NAD+ piruvato + NAD( NAD(H H+) Significato diagnostico: diagnostico: lesioni d‘organo. Come si riconoscono? Con un‘elettroforesi Isoenzyme pattern of lactate dehydrogenase (LDH) in heart tissue of embryonic, iuvenile and adult mice. The six rows show the pattern -9, -5, -1 days before birth as well as +12 and +21 days after birth and in adult mice. Zimogeni o proenzimi Enzimi presenti in forma inattiva.. Vengono attivati a seguito di tagli inattiva proteolitici.. proteolitici Gli enzimi della coagulazione La cascata della coagulazione COFATTORI E COENZIMI Alcuni cofattori sono associati transitoriamente con l‘enzima e funzionano da cosubstrati (es. NAD+ NAD+)) Molti enzimi (ossidoreduttasi ossidoreduttasi,, transferasi, isomerasi ecc ecc..) hanno bisogno di cofattori per la loro attività attività.. Questi possono essere ioni metallici (Fe3+, Zn2+, Cu2+) o molecole organiche (dette coenzimi, NAD+, FAD+). Gruppi prostetici: cofattori legati in modo permanente all‘enzima, spesso con legami covalenti COFATTORI E COENZIMI Apoenzima (inattivo) + cofattore oloenzima (attivo) I cofattori vengono modificati dalle reazioni enzimatiche e vanno quindi rigenerati per completare il ciclo catalitico Molte vitamine (idrosolubili) sono precursori di coenzimi GLI ENZIMI HANNO UN NOME, ANZI PIU‘ DI UNO…….. UNO…… La International Union of Biochemistry and Molecular Biology ha adottato uno schema per la classificazione funzionale e sistematica degli enzimi Ad ogni enzima vengono assegnati due nomi ed un codice di classificazione costituito da 4 numeri numeri:: Il nome raccomandato è quello più comunemente usato e, spesso, è quello usato in tempi passati passati.. Il nome sistematico è composto dal nome del substrato seguito dalla parola che ne specifica l‘attività che termina in -asi Classificazione secondo la reazione catalizzata Ec 1. 1.1.1 1.1..27 EC sta per Enzyme Commission La 2a e la 3a sezione del numero indicano rispettivamente una sotto classe e una sotto sottosotto-classe che hanno lo scopo di specificare in maggior dettaglio la reazione catalizzata ed hanno un significato diverso da classe a classe. Indicano ad esempio il gruppo chimico coinvolto, il tipo di legame, l'eventuale coenzima, etc. La 4a sezione del numero indica semplicemente il numero progressivo (la posizione) dell'enzima nella sotto sottosottoclasse. 1. OSSIDOREDUTTASI (reazioni di ossidoriduzione) 1.1 su CHCH-OH 1.2 su C=O 1.3 su C=CHC=CH1.4 su CHCH-NH2 1.5 su NADH; NADPH 3. IDROLASI (reazioni di idrolisi) 3.1 esteri 3.2 legami glicosidici 3.4 legami peptidici 3.5 altri legamiC legamiC--N 3.6 anidridi acide 2. TRANSFERASI (trasferimento di gruppi funzionali) 2.1 a un atomo di carbonio 2.2 ad aldeidi o chetoni 2.3 ad acile 2.4 a glicosili 2.7 a gruppi fosforici 2.8 a gruppi contenenti S 4. LIASI (addizioni a doppi legami) 4.1 C = C 4.2 C=O 4.3 C=N 5. ISOMERASI (reazioni di isomerizzazione) 5.1 racemasi 6. LIGASI (SINTETASI) (formazione di legami con rottura di ATP) 6.1 CC-O 6.2 CC-S 6.3 CC-N 6.4 CC-C NOMENCLATURA DEGLI ENZIMI Nome raccomandato: lattico deidrogenasi; nome sistematico: L-lattato lattato:NAD :NAD ossidoreduttasi La reazione è : L-lattato + NAD + piruvato + NADH + H+ http:://www http //www..expasy expasy..org/ org/enzyme enzyme CLASSIFICAZIONE DEGLI ENZIMI Gli enzimi vengono classificati e denominati a seconda della natura della reazione da essi catalizzata: 1. Ossidoreduttasi Ossidoreduttasi:: catalizzano reazioni di ossidoriduzione, cioè il trasferimento di elettroni da una molecola all‘altra Si riconoscono 6 sottoclassi: Ossidasi Deidrogenasi aerobie Deidrogenasi anaerobie Ossigenasi Idroperossidasi Superossido dismutasi CLASSIFICAZIONE DEGLI ENZIMI Ossidasi: catalizzano il trasferimento di 2 atomi di idrogeno (2 elettroni e 2 protoni) da un substrato ossidabile all‘ossigeno atomico a dare acqua. In generale, sono proteine contenenti un metallo che partecipa alla reazione accettando o cedendo elettroni Le polifenolo ossidasi ½ O2 H2 O OH OH o-difenolo O O o-chinone CLASSIFICAZIONE DEGLI ENZIMI Deidrogenasi aerobiche: catalizzano il trasferimento di 2 atomi di idrogeno (2 elettroni e 2 protoni) da un substrato ossidabile all‘ossigeno atomico a dare H2O2. In generale, sono flavoproteine contenenti FAD o FMN saldamente legati alla proteina e spesso un metallo (metalloflavoproteine metalloflavoproteine)) L-aminoacido ossidasi (prima tappa per la deaminazione ossidativa degli aminoacidi) R1 H N H C O FAD/ FMN FADH2 FMNH2 N C H R1 H O- C O C imminoacido R1 aminoacido -O C CO O- -chetoacido O- CLASSIFICAZIONE DEGLI ENZIMI Deidrogenasi anerobiche: catalizzano il trasferimento reversibile di 2 atomi di idrogeno un substrato ossidabile al coenzima ad esse associat0. A secondo del coenzima si classificano come piridiniche (NAD(P)) o flaviniche ( FAD o FMN). Il coenzima è saldamente legato alla proteina e spesso è presente un metallo (metalloflavoproteine) La Glc 6P deidrogenasi (NADP NADP--dipendente dipendente)) La lattato deidrogenasi (NAD NAD--dipendente dipendente)) Dove vanno a finire gli ioni idrogeno? La nicotinammìde svolge il ruolo biologico generale della molecola, potendo donare o accettare atomi di idrogeno. Forma ossidata Forma ridotta Il NADP ha in più un gruppo fosfato esterificato al gruppo ossidrilico del carbonio 2' dell'adenosina. Mentre il NAD(H) è utilizzato perlopiù nei processi catabolici (ovvero nelle reazioni di ossidazione del metabolismo), il NADP(H) viene utilizzato nei processi anabolici, particolarmente nelle reazioni di biosintesi. Dove vanno a finire gli ioni idrogeno? La molecola è costituita da tre anelli condensati, che formano il cosiddetto isoalloazinico il della gruppo flavina, il quale è a sua volta legato al ribitolo tramite l‗atomo di N dell'anello centrale. La molecola, se presenta il gruppo OH del carbonio 5, legato al gruppo fosfato, prende il nome di Flavin Mono Nucleotide (FMN). NOMENCLATURA DEGLI ENZIMI Monossigenasi o ossidasi a funzione mista o idrossilasi idrossilasi:: catalizzano l‘incorporazione di un atomo di ossigeno nel substrato, il secondo O viene ridotto ad acqua da un donatore di H (NADPH(H (NADPH(H+), ascorbato, tetraidrobiopterina ecc. ) La colesterolo 7 7(mono)ossigenasi NADPH(H+) HO O2 NADP+ H2 O HO OH NOMENCLATURA DEGLI ENZIMI (Di)Ossigenasi: catalizzano l‘incorporazione di una molecola di ossigeno nel substrato. Spesso vengono utilizzate nella scissione di anelli aromatici La triptofano 2,3 diossigenasi NOMENCLATURA DEGLI ENZIMI Superossido dismutasi : ―neutralizzano‖ l‘anione superossido . O2 nella reazione di dismutazione bloccando la formazione di radicali liberi dell‘ossigeno La dismutazione catalizzata dalla SOD può essere scritta con le seguenti semi-reazioni: M(n+1)+ − SOD + O2− → Mn+ − SOD + O2 Mn+ − SOD + O2− + 2H+ → M(n+1)+ − SOD + H2O2. dove M = Cu (n=1) ; Mn (n=2) ; Fe (n=2) ; Ni (n=2). In questa reazione lo stato di ossidazione del catione metallico oscilla tra n e n+1. NOMENCLATURA DEGLI ENZIMI 2. Transferasi: Transferasi: catalizzano il trasferimento di gruppi funzionali (transaminasi, chinasi) La Glutamico Glutamico--piruvico transaminasi (EC 2.6.1.15) …e il piridossal fosfato (PALP) NOMENCLATURA DEGLI ENZIMI 2. Transferasi: Transferasi: catalizzano il trasferimento di gruppi funzionali (transaminasi, chinasi) Chinasi ATP: D-esoso 6-fosfotransferasi o Esochinasi (EC 2.7.1.1) Catalizza il trasferimento del gruppo -fosfato dall‘ATP (o un altro NTP) all‘alcool o ad amino gruppi accettori NOMENCLATURA DEGLI ENZIMI 3. Idrolasi: Idrolasi: catalizzano le reazioni di idrolisi (es. peptidasi) O R 1--C---NH NH— —R 2 + H 2 O O R1 --C---O O- + + H3 N— R 2 NOMENCLATURA DEGLI ENZIMI 4. Liasi Liasi:: rottura non idrolitica con formazione di legami covalenti quali CC-C, CC-N, CC-S (es. aldolasi aldolasi,, decarbossilasi, citrato liasi ) CH2---COOH COOH CH---CH --COOH COOH CH---COOH CH OH AC. ISOCITRICO Isocitrato liasi CH2---COOH COOH + COOH CH2--COOH CHO ACIDO SUCCINICO ACIDO GLIOSSICO NOMENCLATURA DEGLI ENZIMI 5. Isomerasi: Isomerasi: catalizzano reazioni di isomerizzazione (es. epimerasi, racemasi racemasi)) 6. Ligasi Ligasi:: formazione di legami accoppiata all‘idrolisi di ATP (piruvato carbossilasi) I complessi enzimatici Rappresentazione schematica delle reazione catalizzate dai 3 enzimi del complesso della piruvato deidrogenasi (PDC), reazione critica nella via metabolica per la produzione di energia nell‘uomo. Due altri enzimi sono associati al complesso complesso:: una specifica chinasi che fosforila E1 a livello dei residui di serina e una fosfatasi specifica in grado di defosforilare defosforilare.. L‘attività della PDC può essere regolata in vivo dalla disponibilità dei piruvato e lipoamide stessi,, ma anche dalla stessi concentrazione di NAD/NADH, CoA//acetil CoA acetil--CoA CoA,, ADP/ATP, e dallo stato fosforilato//defosforilato fosforilato di E1. La cinetica enzimatica Ricordiamo che: Una reazione può avvenire spontaneamente quando G < 0 (esoergonica esoergonica)); se = 0, il sistema è all‘equilibrio;; se è >0 per procedere la reazione ha all‘equilibrio bisogno di energia (endoergonica endoergonica)) Il G di una reazione è indipendente dal percorso (meccanismo molecolare) seguito dalla reazione Anche se l‘equilibrio è favorevole, non è detto che la velocità di reazione sia elevata La differenza tra i livelli di energia dello stato di base e di quello di transizione è detta energia di attivazione (G‡) Momento molecolare transitorio in cui il composto acquista la probabilità di diventare prodotto o di tornare a substrato D. L. Nelson, M. M. Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER 4/E, Zanichelli Editore S.p.A. Copyright © 2006 L‘energia L‘ energia di attivazione (G‡) può essere abbassata aggiungendo un catalizzatore=enzima D. L. Nelson, M. M. Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER 4/E, Zanichelli Editore S.p.A. Copyright © 2006 Attenzione: gli enzimi alterano la velocità di reazione, NON l‘equilibrio Berg et al., BIOCHIMICA 6/E, Zanichelli editore S.p.A. Copyright © 2007 Fattori che influenzano l‘attività enzimatica Concentrazione dell‘enzima Concentrazione del substrato pH del mezzo Temperatura Concentrazione dell‘enzima Per una data concentrazione di substrato, la v0 è proporzionale alla concentrazione dell‘enzima v0 E Concentrazione del substrato: curva di saturazione Km = costante di Michaelis-Menten (1913). E‘ la misura dell‘affinità del substrato per l‘enzima D. L. Nelson, M. M. Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER 4/E, Zanichelli Editore S.p.A. Copyright © 2006 L’equazione di MichaelisMichaelis-Menten - I E+S k1 k-1 ES kcat P+E ES è un intermedio di reazione il cui basso valore di energia di attivazione permette di fare avvenire una specifica reazione, catalizzata da una specifica classe di enzimi, in modo molto favorevole (effetto catalitico). Quando ES, in seguito al raggiungimento di uno stato di equilibrio dinamico, assume un valore di concentrazione che si mantiene costante nel tempo, si dice che è stato raggiunto lo stato stazionario (steady state). state). L’equazione di MichaelisMichaelis-Menten - I E+S KM = k1 k-1 k-1+ kcat ES kcat P+E Complesso di Michaelis k1 Se assumiamo che la tappa limitante sia la demolizione del complesso ES a dare P + E, allora V0 = Vmax S KM + S Questa è l‘equazione di Michaelis-Menten, che evidenzia la velocità di una reazione a singolo substrato catalizzata da un enzima L’equazione di MichaelisMichaelis-Menten - II Se V0 è uguale a ½ di Vmax Vmax/2 Vmax /2 = Vmax S KM + S 1/2 = Semplificando per Vmax S KM = S KM + S Quando la concentrazione di substrato è tale da saturare l’enzima, [ES] = [Et [Et]] la reazione procede alla massima velocità quindi: V = Vmax = kcat [Et Et]] GRAFICO DI LINEWEAVER LINEWEAVER-BURK (o dei doppi reciproci) per la determinazione di Vmax e Km L’equazione di MM può essere trasformata in una equazione lineare rispetto a 1/Vo 1/Vo = 1/Vmax 1/Vmax + 1/[S] * Km/Vmax Km/Vmax La costante catalitica di un enzima (kcat kcat)) è il numero di cicli catalitici completati nell’unità di tempo tempo.. Viene anche chiamata “numero di turnover turnover”” di un enzima ed è di fatto una frequenza frequenza.. E’ definito come il numero di moli di substrato convertite in prodotto al secondo in condizioni di Vmax Vmax,, per mole di enzima enzima.. Kcat = Vmax Vmax/[ /[Et Et]] Il rapporto kcat/Km (costante di specificità) è la misura dell‘efficienza catalitica di un enzima in condizioni di bassa [S] e molti siti disponibili V0 = Vmax S KM + S Riassumendo: 3 2 1 1. Quando S<<Km 2. Quando S=Km 3. Quando S>>Km Le costanti: Vmax = velocità massima, μmoli/sec Km = cost di Michaelis Menten, μmoli V0 = Vmax S = K S KM V0 = Km Vmax = ½ Vmax 2KM Vo = Vmax Riassumiamo……… Riassumiamo ……… Km ( (M): Unità di misura = concentrazione si associa all‘affinità di E per S definisce quanto ―strettamente‖ il S si leghi ad E un basso valore indica alta affinità un alto valore indica bassa affinità Vmax (moli/sec): Unità di misura = concentrazione/tempo Indica lo stato di saturazione di E Quando [S] >>Km, V0 = Vmax Kcat (s-1): Unità di misura = reciproco del tempo Numero di turnover = n. di moli di S che reagiscono per formare P per mole di E per unità di tempo Esprime l‘efficienza della catalisi enzimatica Misura diretta della formazione di P in condizioni ottimali (E saturo) Influenza del pH v0 1.5 pepsina 7.0 9.8 Glutammato arginasi DH pH Influenza della temperatura v0 attivazione denaturazione 30 40 T (°) Come regolare l‘attività enzimatica? Controllo della disponibilità dell‘enzima (velocità di sintesi e/o degradazione) Modificazioni strutturali che influenzano l‘attività (effettori allosterici, modificazioni covalenti, legami cooperativi) Meccanismi di inibizione o attivazione MODELLO DI ENZIMA ALLOSTERICO A. - Modello di un enzima monomerico monomerico.. Il legame con un effettore allosterico positivo (A) al sito attivatore (J) induce un cambio conformazionale che aumenta l‘affinità per il substrato substrato.. Il legame di un effettore allosterico negativo induce una modificazione che porta ad una diminuzione dell‘affinità per il substrato B. Modello di un enzima polimerico polimerico.. Il legame con un effettore allosterico positivo (A) al sito attivatore (J) induce un cambio conformazionale che aumenta l‘affinità per il substrato substrato.. Gli enzimi allosterici NON seguono l‘equazione di M/M. Il S è anche il modulatore + - L‘andamento sigmoide è caratteristico di interazioni cooperative tra diverse subunità. MODELLO DI ENZIMA ALLOSTERICO: la FOSFOFRUTTOKINASI 1 Fru 6P + ATP PFK1 • Enzima tetramerico, caratterizzato da due stati conformazionali T e R • ATP si comporta sia da substrato che da inibitore allosterico • ADP, AMP, Fru 2,6 BP contrastano gli effetti dell’ATP Fru 1,6 BP + ADP Modificazioni post post--traduzionali Modificazioni covalenti (residui aminoacidici che possono accettare la modificazione covalente) Modificazioni post post--traduzionali traduzionali:: la fosforilazione Un INIBITORE è una molecola che interferisce con l‘azione dell‘enzima e rallenta o blocca la reazione. Inibizione reversibile L‘inibitore si lega in modo NON COVALENTE all‘enzima e può essere allontanato aumentando la concentrazione del substrato competitivo misto non competitivo Inibizione irreversibile L‘inibitore si lega in modo COVALENTE all‘enzima e produce un complesso enzimaticamente inattivo e dal quale l‘enzima non può essere rigenerato Inibizione irreversibile L‘inibitore si lega in modo COVALENTE all‘enzima e produce un complesso enzimaticamente inattivo e l‘enzima non può essere rigenerato L‘aspirina e le COX INIBIZIONE COMPETITIVA k1 E+S ES P+E k-1 + I KI EI nessuna reazione L‘inibitore compete con il substrato per il legame sul sito attivo dell‘enzima, quindi riduce la concentrazione di enzima libero disponibile per il legame con il substrato.. L‘inibitore può essere substrato ―scalzato‖ da elevate concentrazioni di substrato (affinità).. (affinità) www.juliantrubin.com/.../400px-Comp_inhib.png INIBIZIONE COMPETITIVA Vmax non varia Km aumenta perché è necessaria una maggiore concentrazione di substrato per raggiungere la Vmax Tratto da Mathews, Van Holde, Ahern –Biochimica – casa Editrice Ambrosiana Tratto da Voet & Voet, Fondamenti di Biochimica - Zanichelli INIBIZIONE INCOMPETITIVA L‘inibitore si lega ad un sito differente da quello del S, ma può legarsi solo al complesso ES. Di conseguenza l‘I è inattivo a basse concentrazioni di substrato,, in cui l‘E è substrato presente prevalentemente in forma libera libera.. Quando la concentrazione del S è tale per cui è presente un‘alta concentrazione di complesso ES, l‘I diventa efficace efficace.. INIBIZIONE INCOMPETITIVA Poichè l‘inibitore necessita del legame del substrato con l‘enzima,, diventa attivo in l‘enzima presenza di alte concentrazioni di substrato substrato,, quindi DIMINUISCE la Vmax. Quando l‘inibitore si lega al complesso ES si genera un nuovo complesso ternario EIS. Per la legge di Azione di Massa l‘equilibrio della reazione si sposta verso dx dx.. In realtà realtà,, l‘effetto dell‘inibitore è quello di aumentare la quantità di S legato all‘E e questo porta ad un apparente aumento dell‘affinità E-S ed una DIMINUZIONE della Km. courses.cm.utexas.edu/.../Lecture-Ch6-2.html INIBIZIONE MISTA o NON COMPETITIVA E+S + I KI EI k1 k-1 +S ES + I P+E K‘I EIS nessuna reazione L‘inibitore non competitivo si lega a siti dell‘enzima che partecipano sia al legame con il substrato che alla catalisi, ma non interferisce con il legame del substrato con il sito attivo.. attivo D. L. Nelson, M. M. Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER 4/E, Zanichelli Editore S.p.A. Copyright © 2006 INIBIZIONE MISTA Km non varia perché l‘inibitore non interferisce con il sito catalitico L‘aumento della concentrazione del substrato non può annullare l‘inibizione perché non competono per lo stesso sito Vmax è modificata + 2I 1/V o +I 1/V m ax N o inib itore 1/S -1/K m Tratto da Voet & Voet, Fondamenti di Biochimica Zanichelli Tratto da Mathews, Van Holde, Ahern –Biochimica – casa Editrice Ambrosiana
Scarica