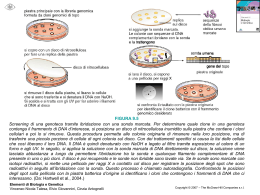
Maria Antonietta Lepore Iperomocisteinemia e poliformismo C677T del gene MTHFR in correlazione con le patologie vascolari e cerebrali ARACNE Copyright © MMVIII ARACNE editrice S.r.l. www.aracneeditrice.it [email protected] via Raffaele Garofalo, 133 a/b 00173 Roma (06) 93781065 ISBN 978–88–548–1667–1 I diritti di traduzione, di memorizzazione elettronica, di riproduzione e di adattamento anche parziale, con qualsiasi mezzo, sono riservati per tutti i Paesi. Non sono assolutamente consentite le fotocopie senza il permesso scritto dell’Editore. I edizione: marzo 2008 Indice Riassunto .................................................................................. 7 Introduzione .............................................................................. 9 Metabolismo ........................................................................... 11 Principi genetici e molecolari ................................................ 13 Materiali e metodi .................................................................. 15 Determinazione di omocisteina plasmatica ............................ 21 Risultati e discussione ............................................................ 23 Bibliografia ............................................................................ 25 Appendice ............................................................................... 29 5 6 Metabolismo Il preciso meccanismo attraverso il quale l’omocisteina aumenta lo stress ossidativo non è, tuttora, completamente conosciuto; potrebbe essere determinato dall’ossidazione del suo gruppo sulfidrilico risultante nella produzione di superossido e perossido di idrogeno (8). L’omocisteina compromette l’attività della glutatione perossidasi e riduce la biodisponibilità dell’ossido nitrico (9). L’omocisteina diminuisce nel tessuto i livelli di vitamine A, C, E, riducendo, così, le riserve di antiossidanti (10). L’acido folico ha un effetto protettivo sullo stress ossidativo omocisteina–indotto, riducendo i livelli di superossido intracellulare e, ad un livello inferiore, sequestrando perossido di idrogeno (11). N–acetil–L–cisteina e vitamina E possono prevenire la sintesi di radicali dell’ossigeno in cellule di neuroblastoma determinato da incremento di omocisteina o riduzione di acido folico. In vitro, la neurotossicità dell’omocisteina può essere ridotta per mezzo di catalasi e superossido dismutasi (12). L’omocisteina funziona come un aminoacido eccitatorio attraverso l’attivazione dei recettori del glutammato metabotropici di gruppo 1 (mGluR) e recettori N–metil–D–aspartato (NMDA) (13). I prodotti di ossidazione e di transulfurazione dell’omocisteina, quali l’acido omocisteinico e l’acido cisteinico, sono, inoltre, agonisti dei recettori del glutammato ionotropi e metabotropi (14). In accordo con tali dati, la somministrazione sistemica di omocisteina o acido omocisteinico può scatenare attacchi epilettici in pazienti con omocistinuria. Tuttavia, la neurotossicità può essere parzialmente contrastata da antagonisti dei recettori di NMDA (15). 11 L’omocisteina è anche un agonista parziale del recettore della glicina e può, perciò, ridurre l’attività del recettore NMDA; questa doppia azione previene la sovrastimolazione da omocisteina del recettore NMDA in condizioni fisiologiche. Invece, in condizioni di livelli elevati di omocisteina e danni della barriera ematoencefalica, come avviene durante un ictus, i neuroni sono esposti ad alti livelli di omocisteina e di glicina e la sovrastimolazione del recettore NMDA porta a danno eccitotossico. L’attivazione di mGluR da omocisteina coinvolge l’attivazione di proteine chinasi C e incrementa la produzione intracellulare di IP3, con risultante aumentata sensibilità del reticolo endoplasmatico verso il Ca++ (16). L’apoptosi è una forma di morte programmata della cellula nella quale questa si restringe con successiva condensazione della cromatina; la cellula, così, esplode ed è fagocitata senza una risposta infiammatoria. Un meccanismo con il quale l’omocisteina promuove l’apoptosi è attraverso la rottura del DNA a causa di un danno dei processi di transmetilazione. Neuroni in coltura, nel tentativo di riparare il danno al DNA, esauriscono le riserve di ATP e viene attivata la via della caspasi (17). Inoltre, lo stress ossidativo causato da HCY aumenta il li– vello dell’attività del NF–kappaB, un fattore di trascrizione fondamentale nel controllo dell’apoptosi (18). Questo comporta un afflusso di Ca++ che induce exocitotossicità secondaria. L’aumento del Ca++ citosolico danneggia i mitocondri con conseguente riduzione di ATP, maggiore accumulo di Ca++, infine apoptosi. HCY, inoltre, aumenta la risposta di stress del reticolo endoplasmatico, innalzando l’espressione delle proteine chaperone e non chaperone (19). HCY è stata correlata ad alterazioni ematologiche e vascolari; infatti, livelli elevati di HCY determinano danni alle cellule endoteliali che predispongono le pareti dei vasi allo sviluppo di aterosclerosi (20). 12 Principi genetici e molecolari Valori elevati di HCY si osservano in errori congeniti allo stato omozigote e, in misura minore, allo stato eterozigote, dei principali enzimi coinvolti nel metabolismo di questo aminoacido:1) cistationina–beta–sintetasi, il cui gene è situato sul braccio lungo del cromosoma 21, a trasmissione autosomica recessiva. Sono stati individuati 16 tipi di mutazioni del gene di CSB (21). Naturalmente, i livelli di omocisteina sono molto più elevati nello stato omozigote rispetto a quello eterozigote, dove sono asintomatici. Nei soggetti omozigoti si ha anche omocistinuria ed in essi vi sono complicanze tromboemboliche, anche in età giovanile, che possono portare ad elevata mortalità, quali infarto miocardico acuto, ipertensione arteriosa essenziale, embolia polmonare, ictus. 2)metilentetraidrofolato reduttasi, il cui gene è situato sul braccio corto del cromosoma 1, a trasmissione autosomica recessiva. Questo enzima ha il polimorfismo C677T, in grado di alterarne la funzionalità, rendendolo termolabile. La mutazione del gene C677T comporta la sintesi di alanina al posto di valina, determinando riduzione dell’attività enzimatica specifica e incremento della termolabilità. 13 14 Materiali e metodi Sono stati esaminati 154 soggetti con iperomocisteinemia di età compresa tra 30 e 58 anni. Ad ogni soggetto è stato prelevato un campione di sangue per l’estrazione di DNA per individuare la localizzazione precisa del gene responsabile dell’iperomocisteinemia in omo/eterozigosi e per il polimorfismo C677T dell’enzima MTHFR. Per estrarre il DNA è stato necessario lisare la cellula, ossia disgregare la membrana plasmatica e la membrana nucleare per liberarne il contenuto, con sostanze detergenti. Al lisato cellulare è stata aggiunta una proteasi e una RNasi in grado di inattivare le proteine e RNA, che potrebbero interferire e contaminare il DNA, rendendolo inutilizzabile. IL DNA, a questo punto, è stato estratto con fenolo e cloroformio rimanendo nella fase acquosa, che è stata successivamente recuperata e il DNA è stato precipitato aggiungendo sodio acetato e 2 volumi di etanolo. Il DNA precipitato, visibile sotto forma di un gomitolo bianco, è stato recuperato dopo centrifugazione. Il sovranatante è stato eliminato e il pellet di DNA è stato lavato con etanolo al 75%. Il DNA recuperato è stato sciolto in acqua e conservato overnight alla temperatura di 4°C. La concentrazione di DNA è stata determinata mediante uno spettrofotometro a lunghezza d’onda di 260 nm. Il DNA così ottenuto, infine, può essere conservato alla temperatura di –20°C e utilizzato al momento opportuno. Il DNA è stato, successivamente, tagliato con una endonucleasi di restrizione in condizioni di digestione parziale; il frammento che contiene il gene C677T è stato separato mediante elettroforesi su gel di agarosio 1,5% e l’estremità preventivamente marcata, rivelata mediante transilluminatore. 15 Tabella 1 – Soluzione di rivelazione del DNA marcato con biotina. Componente Tris base NaCl HCl concentrazione Finale 115mM 120mM 0,5 M quantità 18,5 g 9,8 g 0,1 ml Per evidenziare la posizione del frammento di interesse, è stata utilizzata una sonda per ibridazione, che è una molecola di DNA marcata la cui sequenza è complementare al bersaglio da individuare. La sonda e il bersaglio, essendo complementari, possono appaiarsi e ibridare. La posizione del frammento di interesse è stata identificata grazie al segnale del marcatore associato alla sonda. Per effettuare l’ibridazione, il frammento di interesse è stato posto in una bottiglia di vetro insieme alla sonda marcata e ad una soluzione tampone SSC 20X. La bottiglia è stata fatta ruotare delicatamente su agitatore per alcune ore per consentire alla sonda di ibridare con il frammento bersaglio di interesse. Il frammento è stato, poi, lavato per rimuovere la sonda in eccesso e il segnale della sonda identificato. La sonda ibridata è stata rivelata con il sistema biotina–stre ptavidina; infatti, il DNA è stato ibridato con una sonda specifica a singolo filamento marcata con biotina. Il DNA marcato con biotina è stato rivelato mediante aggiunta di streptavidina–fosfatasi alcalina (SA–AP). La streptavidina si lega strettamente alla biotina. Quindi, è stato aggiunto un substrato cromogeno della fosfatasi alcalina che produce un precipitato blu (v. Tab. 1). La posizione del frammento di DNA nel gel è stata determinata direttamente mediante colorazione con bromuro di etidio a concentrazione di 0,5 microgrammi/ml. L’Etbr si intercala tra le basi del DNA ed evidenzia maggiore fluorescenza. 16
Scaricare