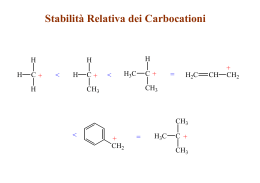
MODULI DI CHIMICA ORGANICA 1. IL CARBONIO Il carbonio è l’elemento che si trova in tutti gli organismi viventi ed è quello caratterizzante la chimica organica, branca della chimica che studia i composti del carbonio. Il carbonio può legarsi con se stesso e anche con una vasta gamma di altri elementi come ad esempio: l’idrogeno negli idrocarburi, gli alogeni negli alogenuri, l’idrogeno e l’ossigeno negli zuccheri e nei grassi, idrogeno, ossigeno e azoto nelle proteine, dando vita ad un elevato numero di diversi composti. Inoltre, legandosi con l’ossigeno forma l’anidride carbonica (CO2), molecola fondamentale per il regno vegetale. 1.1 Il carbonio nella tavola periodica Nella tavola periodica degli elementi, il carbonio, appartiene al secondo periodo e al gruppo IV A, ha simbolo C e numero atomico (Z) 6. Il suo peso atomico, riferito alla media isotopica naturale, è 12,01115 uma. L’isotopo naturale più abbondante è il 12C ( 98,9%), esistono anche il 13C e il 14 C (radioattivo). La sua configurazione elettronica1 è [He] 2s2 2p2. y y z z + s + x px + pz py p S p x p Forma e disposizione spaziale degli orbitali s e p Presenta proprietà non metalliche e valenza più comune quattro anche se apparentemente sembrerebbe dover essere bivalente, avendo solo due elettroni spaiati negli orbitali2 2p. 2px1 2py1 2s2 Configurazione elettronica del carbonio nel suo stato fondamentale 1 Disposizione degli elettroni negli orbitali secondo le regole dettate dalla meccanica quantistica: gli elettroni di un atomo tendono ad occupare gli orbitali disponibili nell’ordine di energia crescente a partire dall’orbitale a minor energia; in ogni orbitale non possono coesistere più di due elettroni che devono avere spin antiparallelo. 2 Regione di spazio intorno al nucleo dove vi è la massima probabilità (almeno il 90%) di presenza dell’elettrone, in base all’energia che esso possiede. M. Ciani – E. Zuccolo – G. Castellani 2 Affinché il carbonio possa formare quattro legami covalenti3, è necessario che siano coinvolti tutti e quattro gli elettroni dello strato esterno e ciò significa che i quattro elettroni devono essere spaiati in modo da potersi accoppiare ciascuno con un elettrone di un altro atomo. Per poter spiegare questo comportamento è necessario introdurre il concetto di ibridazione. 1.2 Teoria dell’ibridazione Perché il C possa formare quattro legami è necessario che un elettrone dell’orbitale 2s venga “promosso” nell’orbitale 2pz vuoto (stato eccitato), così da assumere una configurazione elettronica esterna del tipo: 2s 2p3 2px1 2py12pz1 2s1 Configurazione elettronica del carbonio nello stato eccitato Questa operazione richiede una spesa energetica di circa 96 kcal/mole ma tale energia è compensata dalla possibilità di formare due ulteriori legami. I passaggi sin qui descritti non giustificano ancora appieno la tetravalenza osservata sperimentalmente. I dati sperimentali della molecola di metano, CH4, dimostrano che tutti e quattro i legami che il carbonio forma con ciascun idrogeno sono equivalenti sotto tutti i punti di vista. Con la sola eccitazione di un elettrone s che venisse promosso nell’orbitale p vuoto ci si attenderebbe un legame (quello dell’orbitale s) con caratteristiche diverse dagli altri tre; nell’esempio del metano si dovrebbe prevedere la formazione di tre legami uguali disposti a 90° tra loro, mentre il quarto, quello dell’orbitale s, dovrebbe disporsi il più lontano possibile dagli altri tre e senza un’orientazione precisa. La teoria dell’ibridazione propone un modello in grado di spiegare le osservazioni sperimentali con una perfetta equivalenza dei quattro legami. Banalizzando, l’ibridazione consiste in un ‘rimescolamento’ dei quattro orbitali, quello s e i tre p, del carbonio per giungere a formare 4 nuovi orbitali sp3, tutti ibridi e tutti tra loro equivalenti4, ma con energia e geometria diverse da quelle degli orbitali atomici dello stato fondamentale. Infatti ciascuno dei quattro orbitali ibridi ‘prende’ per un quarto le caratteristiche dell’orbitale 2s e per tre quarti quelle dei tre orbitali 2p. Come si può notare nella figura seguente la forma di un orbitale ibrido sp3 è simile a quella di un orbitale p, ma le dimensioni dei due lobi sono diverse. 3 Legame covalente: avviene tra atomi che mettono in comune una o più coppie di elettroni di valenza per formare molecole. La condivisione avviene al massimo con tre coppie di elettroni, di conseguenza si formano legami covalenti semplici, doppi o tripli. 4 In realtà questa teoria è supportata da complessi calcoli matematici che riguardano la funzione d’onda dell’orbitale 2s e dei tre orbitali 2p. Il risultato è una nuova funzione d’onda che dà la probabilità di trovare l’elettrone in una determinata regione dello spazio determinando in tal modo la ‘forma’ dell’orbitale. M. Ciani – E. Zuccolo – G. Castellani 3 orbitale ibrido sp3 Nel rispetto della regola che impone che gli orbitali si dispongano nello spazio alla massima distanza gli uni dagli altri per minimizzare la repulsione elettrostatica tra le nubi elettroniche, gli orbitali ibridi sp3 si orientano secondo una geometria tetraedrica, cioè vanno a formare fra loro angoli di 109,5°. H H C H H Orientazione spaziale tetraedrica degli orbitali ibridi sp3nella molecola del metano La particolare geometria degli orbitali ibridi sp3 ben si presta alla formazione di legami covalenti: ad esempio, quello che si forma dalla combinazione dell’elettrone di un orbitale sp3 di un atomo di carbonio e dell’elettrone dell’orbitale s di un atomo di idrogeno, è un legame fortemente concentrato nella regione di spazio compresa tra i due nuclei ed è simmetrico rispetto alla linea che li unisce. Questo tipo di legame è detto σ. Va precisato che tale legame è presente sempre tra gli orbitali che formano un legame concentrato sull’asse nucleo – nucleo. Legame σ tra orbitali s e p orbitale atomico s orbitale atomico p orbitale molecolare s-p Legame σ tra orbitali p e p orbitale atomico p orbitale atomico p orbitale molecolare p-p Legame σ tra orbitali ibridi + orbitale ibrido orbitale ibrido orbitale molecolare Va ricordato che gli orbitali ibridi non esistono nell’atomo isolato (stato fondamentale) ma solo quando questo forma legami covalenti. M. Ciani – E. Zuccolo – G. Castellani 4 Non esiste solo l’ibridazione di tipo sp3: l’atomo di carbonio può anche presentare ibridazione sp2 e sp. 180° 120° 109,5° 2 geometria planare sp 180° geometria planare-trigonale sp 120° 3 geometria tetraedrica sp 109,5° Con l’ibridazione sp2 si ha l’ibridazione dell’orbitale 2s e di solo due orbitali 2p: in questo caso sono tre gli orbitali ibridi equivalenti che si dispongono su uno stesso piano con angoli di 120°. La geometria è pertanto planare-trigonale, l’orbitale 2p che non partecipa all’ibridazione si dispone perpendicolarmente al piano sul quale sono disposti gli altri tre. 90° Ibridazione sp2: l’orbitale non ibrido è perpendicolare agli altri tre I tre orbitali ibridi complanari formano legami σ, mentre l’orbitale 2p non ibrido forma un legame detto π con un altro orbitale uguale di un altro carbonio. Affinché il legame π possa realizzarsi, i 2 orbitali p coinvolti devono essere paralleli fra loro, ciò per favorire la massima sovrapposizione degli stessi. Legame π orbitale p + orbitale p orbitale molecolare π L’ibridazione sp2 è presente nei composti che contengono un doppio legame C=C: il doppio legame è costituito da un forte legame σ tra due orbitali ibridi sp2 M. Ciani – E. Zuccolo – G. Castellani 5 e da un legame più debole π che si forma dalla sovrapposizione ‘laterale’di due orbitali non ibridi 2p. H H C H C H Doppio legame C-C nella molecola di etene La presenza di un doppio legame impedisce la libera rotazione lungo l’asse della molecola, a differenza di quanto succede con la presenza del legame semplice σ. Nell’ibridazione sp sono ibridati l’orbitale 2s e un solo orbitale 2p: i due orbitali ibridi ottenuti si dispongono lungo una linea retta orientati in direzioni opposte. Gli altri due orbitali p non ibridi si dispongono perpendicolarmente all’asse degli ibridi sp e perpendicolarmente l’uno rispetto all’altro. L’ibridazione sp è presente nei composti che contengono un triplo legame C: il triplo legame è costituito da un legame σ tra i due orbitali ibridi sp e C da due legami π. La geometria di legame è lineare con angoli di 180°. Due atomi di carbonio impegnati in un triplo legame A conclusione di quanto esposto, si ribadisce che nelle catene dei composti organici, gli atomi di C possono presentare singoli (σ), doppi (σ, π) o tripli (σ,π,π) legami. 1.3 Il carbonio in natura Il carbonio è presente in natura in più forme allotropiche5: diamante: il minerale più duro che si conosca; grafite: una della sostanze più tenere; fullerene; carbonio amorfo. Il diamante6 si forma quando gli atomi di carbonio vengono sottoposti ad un’alta pressione; ogni atomo di atomo, ibridato sp3, è legato ad altri quattro con 5 Proprietà di un elemento di presentarsi in forme chimicamente e fisicamente diverse tra loro. M. Ciani – E. Zuccolo – G. Castellani 6 struttura tetraedrica. Grazie alla forza del legame C-C è la sostanza più dura in termini di resistenza allo sfregamento. Nella grafite7 ogni atomo, ibridato sp2, è legato ad altri tre in un piano composto da anelli esagonali fusi assieme. Come conseguenza della delocalizzazione della nuvola π, data dagli orbitali p non ibridi di ciascun atomo, la grafite conduce la corrente elettrica; si presenta come un materiale tenero e sfaldabile in fogli, poiché sono tenuti assieme da deboli forze di van der Waals. La grafite si presenta untuosa al tatto e lascia tracce di color nero grigio. Struttura della grafite I fullereni8 hanno una struttura simile alla grafite ma si differenziano per la presenza di formazioni pentagonali di atomi di carbonio oltre che esagonali: come conseguenza si presentano fogli che si piegano in sfere, ellissi o cilindri. Il nome deriva da Buckminster Fuller, l’ideatore della cupola geodesica che imita la struttura dei fullereni. Come nella grafite il carbonio è ibridato sp2 ma, in questo caso, gli orbitali p non ibridi, invece di disporsi perpendicolarmente al piano in cui si trovano gli orbitali ibridi, vanno a formare un angolo di 101,6°. In conseguenza a ciò si vengono a creare delle tensioni che comportano dei ripiegamenti dei fogli. I fullereni trovano impiego come superconduttori ma vengono utilizzati anche in campo medico sia per immagini mediche che per curare il cancro. 6 Diamanti naturali sono presenti nei minerali di kimberlite che stanno all’interno di antichi camini vulcanici. La maggior parte dei giacimenti si trova in Africa, soprattutto in Sudafrica, Namibia, Congo e Sierra Leone. 7 La grafite ha numerosi impieghi industriali: è utilizzata principalmente per l' indurimento dell' acciaio e la realizzazione di matite. Un equivalente artificiale della grafite può essere ottenuto riscaldando, ad elevatissima temperatura, dell' antracite in appositi forni elettrici. La grafite si trova in grandi quantità negli Stati Uniti, Russia, Messico, Groenlandia e India. 8 Il grande interesse dei fullereni e derivati nasce dalla vasta gamma di possibilità che essi offrono. Oltre alla superconduttività ad alta T, sono di interesse per l’impiego come ferromagneti molecolari e come trappole molecolari. Sono inoltre di interesse nell’impiego in catalisi, in chimica organometallica e come parti di strutture polimeriche. M. Ciani – E. Zuccolo – G. Castellani 7 Esempi di strutture di fullereni C60 Il carbonio amorfo è la versione strutturalmente disordinata in cui può solidificare il materiale. In questa struttura coesistono in diverse percentuali i tre diversi tipi di legame chimico cui può dar luogo il carbonio con i suoi orbitali ibridati sp, sp2 ed sp3. Appare dunque evidente come questo materiale possa presentarsi in numerose varianti strutturali che coprono una vasta gamma di proprietà fisiche. 2. GLI IDROCARBURI 2.1 Classificazione Gli idrocarburi sono composti del carbonio con l’idrogeno. Possono essere suddivisi in tre grandi gruppi: alifatici e aliciclici aromatici eterociclici Il primo gruppo, idrocarburi alifatici, comprende composti a catena aperta e composti chiusi ad anello con proprietà comunque simili. Gli aromatici sono caratterizzati da proprietà chimiche del tutto particolari che ne fanno un gruppo omogeneo, completamente distinto dagli altri idrocarburi. Gli aromatici in senso stretto sono composti che contengono almeno un anello benzenico. Gli eterociclici sono composti ciclici contenenti nell’anello atomi diversi dal carbonio, come ad esempio azoto o zolfo. Classificazione degli idrocarburi alifatici SATURI IDROCARBURI ALIFATICI ALCANI o paraffine ALCHENI o olefine INSATURI M. Ciani – E. Zuccolo – G. Castellani ALCHINI o acetileni contengono solo legami σ (atomi di C tutti ibridi sp3) contengono doppio legame \ / gruppo funzionale C = C / \ contengono triplo legame gruppo funzionale –C ≡ C 8 3. ALCANI Gli alcani comprendono quegli idrocarburi in cui ciascun carbonio forma quattro legami di tipo σ disposti nello spazio con geometria tetraedrica e angoli di 109,5°; sono idrocarburi saturi, poiché ogni carbonio forma quattro singoli legami cioè il numero massimo possibile di singoli legami per l’atomo di carbonio. Essi sono noti anche come paraffine (dal latino parum affinis) a causa della loro scarsa reattività in condizioni normali. A temperatura e pressione ambiente i più leggeri tra loro (fino a 4 atomi di carbonio) sono gassosi, sono liquidi incolori quelli aventi da 5 a 16 atomi di carbonio, sono solidi cerosi quelli più pesanti.Un esempio comune di miscela complessa di alcani è la benzina , che è costituita da diversi alcani contenenti generalmente 7-8-9 atomi di carbonio, ottenuta soprattutto dalla distillazione frazionata del petrolio, ma anche dal craking catalitico. Il più semplice alcano esistente è il metano, la cui formula grezza è CH4: H H C H H Modello della molecola di metano Quando due atomi di carbonio tetraedrici si uniscono tra loro e con sei atomi di idrogeno si ottiene l’etano, la cui formula grezza è C2H6. H C H H H H C H H H H C H C H H Modello della molecola di etano Il successivo idrocarburo contiene tre atomi di carbonio e otto di idrogeno legati tra loro (C3H8), viene denominato propano. Il termine successivo, a quattro atomi di carbonio, si chiama butano (C4H10). Si nota che estendendo la serie ad un numero indefinito di atomi di carbonio, ogni termine può essere ottenuto aggiungendo un gruppo -CH2- al termine precedente. In tal modo si ottiene la serie omologa9 degli alcani. La formula generale degli alcani è: CnH2n+2 dove n indica il numero degli atomi di carbonio della catena. 9 La serie omologa è un insieme di composti aventi proprietà chimiche simili ma differenti proprietà fisiche, a seconda del rispettivo peso molecolare e della forma delle molecole. M. Ciani – E. Zuccolo – G. Castellani 9 Questa formula indica soltanto quanti atomi di carbonio e di idrogeno sono presenti nella molecola ma non fornisce informazioni sulla sua struttura. Il modo migliore di rappresentare una molecola organica è la formula di struttura, che indica in che modo gli atomi sono concatenati tra loro. Vengono rappresentate qui di seguito le formule di struttura dei primi tre termini della serie omologa degli alcani: H H C H H H metano H H C C H H H H etano H H H C C C H H H H propano Per semplificare la scrittura si possono utilizzare le formule condensate, nelle quali vengono raggruppati insieme gli atomi di idrogeno, nel caso degli idrocarburi, uniti a uno stesso atomo di carbonio e vengono indicati solo i legami fra gli atomi di carbonio. Qui di seguito vengono rappresentate le formule condensate dei primi tre termini della serie omologa degli alcani (nel caso del metano ovviamente formula condensata e formula grezza coincidono): CH4 metano CH3 – CH3 etano CH3 – CH2 – CH3 propano Sia le formule di struttura che quelle condensate sono delle semplificazioni della forma delle molecole e non possono rispettare quella che è la reale disposizione tridimensionale degli atomi nello spazio perché sono disegnate su un piano. Perciò bisogna fare attenzione a non farsi ingannare dalle diverse rappresentazioni. Nei seguenti tre esempi: - C -C - C - C - C - C -C-C-C-C- -C-C-C-C-C- si tratta sempre della stessa molecola che è lineare e non presenta alcuna ramificazione come sembrerebbe nella seconda e nella terza figura. Se infatti si traccia una linea continua lungo la catena degli atomi di carbonio si può passare sopra tutti gli stessi senza interrompersi, questo significa che i carboni sono tutti allineati. M. Ciani – E. Zuccolo – G. Castellani 10 - C -C - C - C - C - C -C-C-C-C- -C-C-C-C-C- A seconda della posizione che occupano nella catena, gli atomi di carbonio vengono definiti: • • • • primari, se sono in posizione iniziale (o di testa) e sono uniti a un solo atomo di carbonio; secondari, se sono uniti a 2 atomi di carbonio; terziari, se sono uniti a 3 atomi di carbonio; quaternari, se sono uniti a 4 atomi di carbonio. H H - C - CH3 CH3 CH3 H - C - CH3 H - C - CH3 H C - primario H C - secondario CH3 C - terziario CH3 CH3 - C - CH3 CH3 C - quaternario 3.1 Cicloalcani Le catene idrocarburiche alifatiche possono essere chiuse, in questo caso la molecola viene definita ciclica: gli alcani a catena chiusa sono chiamati cicloalcani. La catena ciclica per semplicità può essere rappresentata con un poligono regolare i cui vertici rappresentano gli atomi di carbonio, ciascuno legato a due atomi di idrogeno. In questa rappresentazione sia gli atomi di carbonio che gli atomi di idrogeno sono sottointesi: ciclopropano ciclobutano ciclopentano cicloesano La formula generale dei cicloalcani è: CnH2n ,ci sono cioè due atomi di idrogeno in meno rispetto ai corrispondenti alcani a catena aperta, in quanto i due atomi di carbonio terminali si sono uniti. Il cicloalcano più semplice è l’alcano a tre atomi di carbonio. CH2 H2C CH2 esempio di cicloalcano: ciclopropano M. Ciani – E. Zuccolo – G. Castellani 11 3.2 Nomenclatura degli alcani La nomenclatura organica sistematica è nata a Ginevra nel 1892. Da quella data la Union of Pure and Applied Chemistry (IUPAC) si è riunita periodicamente per stabilire, volta per volta, le regole di nomenclatura di una disciplina in costante evoluzione. Per la nomenclatura IUPAC è fondamentale indicare nel nome di un composto organico la disposizione degli atomi, dei gruppi funzionali e dei legami, oltre al numero degli atomi di carbonio allineati nella molecola. Il nome di un alcano ha sempre desinenza –ano e contiene un prefisso che indica il numero di atomi di carbonio nella catena. Solo i primi quattro composti hanno nomi tradizionali, i successivi seguono la nomenclatura IUPAC. Il capofila e il più semplice degli idrocarburi saturi è il metano. Formula di struttura condensata dei primi dieci alcani nome CH4 CH3– CH3 CH3– CH2– CH3 CH3– CH2– CH2– CH3 CH3– CH2– CH2– CH2– CH3 CH3– CH2– CH2– CH2– CH2– CH3 CH3– CH2– CH2– CH2– CH2– CH2– CH3 CH3– CH2– CH2– CH2– CH2– CH2– CH2– CH3 CH3– CH2– CH2– CH2– CH2– CH2– CH2– CH2– CH3 CH3– CH2– CH2– CH2– CH2– CH2– CH2– CH2– CH2– CH3 Metano Etano Propano Butano Pentano Esano Eptano Ottano Nonano Decano 3.3 Gruppi alchilici Si dicono alchilici quei gruppi che contengono un idrogeno in meno rispetto al relativo alcano. Un generico gruppo alchilico si indica comunemente con la lettera R (o G). I nomi dei gruppi alchilici derivanti dagli alcani si ottengono sostituendo la desinenza –ile alla desinenza –ano del corrispondente alcano. Nella tabella seguente vengono riportati alcuni esempi. CH4 formula alcano nome alcano metano C2 H6 etano C3 H8 propano M. Ciani – E. Zuccolo – G. Castellani – CH3 formula gruppo alchilico – C2H5 ( o – CH2 – CH3 ) – C3H7 ( o – CH2 – CH2 – CH3 ) nome gruppo metile etile propile 12 Regole di nomenclatura IUPAC Per assegnare il nome ad un idrocarburo è necessario procedere secondo le regole seguenti: a) scegliere la catena idrocarburica più lunga e assegnare il nome del corrispondente idrocarburo; si considerano le restanti ramificazioni come gruppi sostituenti alchilici e si assegna loro il nome corrispondente; b) gli atomi di carbonio della catena principale vanno numerati partendo dall’estremità più vicina alla ramificazione, nel caso siano presenti più ramificazioni si considera l’estremità vicina al gruppo sostitutivo più semplice; c) la posizione di ciascun gruppo (sostituente alchilico) viene individuata dal numero dell’atomo di carbonio al quale tale gruppo è legato; l’ordine con cui i sostituenti compaiono nel nome deve essere scelto in base all’ordine alfabetico (es. etile, metile, propile ); d) nel caso in cui due sostituenti diversi (R, R’) siano legati allo stesso atomo di carbonio, il numero corrispondente va indicato due volte; se invece i due sostituenti sono identici, oltre a indicare due volte il numero si utilizza anche il prefisso di- davanti al nome del gruppo corrispondente; e) quando nella catena principale sono presenti due o più gruppi uguali si adoperano i prefissi di-, tri-, tetra- ecc. per indicare rispettivamente 2, 3, 4 ecc. gruppi uguali, in tal caso i numeri sono separati da virgole. Ad esempio, per assegnare il nome di un idrocarburo a 8 atomi di carbonio è necessario: individuare la più lunga catena di atomi di carbonio nella struttura; tale catena costituirà la base del nome in funzione del numero di atomi di carbonio che possiede (3: propano, 4: butano, 5: pentano, 6: esano, 7: eptano, 8: ottano, 9: nonano, 10: decano, 11: undecano, etc...); • numerare gli atomi della catena sequenzialmente partendo da una delle estremità; verrà scelta l' estremità in cui gli atomi che recano ramificazioni (uno o più legami con altri atomi di carbonio) hanno i numeri più bassi possibile; M. Ciani – E. Zuccolo – G. Castellani 5 atomi: pentano da sinistra a destra: 2,2,4 --> ok da destra a sinistra: 2,4,4 --> no 13 • nominare le ramificazioni in modo analogo alla catena principale, sostituendo però il suffisso -ano con il suffisso -il (pertanto 1: metil, 2:etil, 3: propil, etc...); • raggruppare le ramificazioni in ordine alfabetico e, qualora ne compaia più di una di un tipo nella formula, indicarne la molteplicità tramite l' opportuno prefisso (di-, tri-, tetra-); 3 gruppi CH3: trimetil- elenco delle • il nome è costituito dall' ramificazioni precedute dal numero di ogni atomo della catena principale che le ospita, seguito dal nome della catena principale. 2,2,4-trimetilpentano Come negli esempi i nomi devono essere scritti di seguito senza interruzioni, i numeri sono separati l’uno dall’altro mediante la virgola e sono separati dai nomi con un trattino. M. Ciani – E. Zuccolo – G. Castellani 14 ISOMERIA Nei composti inorganici ad ogni formula grezza, che esprime la composizione della molecola, corrisponde una sola formula di struttura. Nei composti organici, invece, ad una data formula grezza possono corrispondere due o più formule di struttura (le quali mettono in evidenza i legami tra i singoli atomi e la loro disposizione nello spazio). Questo fenomeno si chiama isomeria. Si dicono isomeri due composti che pur avendo la stessa formula molecolare hanno una diversa disposizione relativa degli atomi o dei legami nella loro struttura. Esistono due tipi principali di isomeria: l’isomeria di struttura e la stereoisomeria. A.1 di catena pag.15 A) di STRUTTURA pag.14 A.2 di posizione pag. 21 A.3 di gruppo funzionale pag. 34 ISOMERIA B) STEREOISOMERIA pag. 21 B.1 isomeria geometrica pag. 21 B.2 isomeria ottica pag. 34 A. ISOMERIA DI STRUTTURA Si dicono isomeri di struttura due o più composti diversi, aventi la stessa composizione elementare quantitativa e quindi la stessa formula grezza, ma differente formula di struttura. Il numero di isomeri cui può dare luogo una determinata formula grezza cresce enormemente all’aumentare del numero di atomi di carbonio in essa contenuti. Basti pensare che, se al composto C4H10 corrispondono due isomeri, al composto C9H20 ne corrispondono 35 e al composto C20H42 ne corrispondono 366319. A ogni isomero compete un proprio nome che lo contraddistingue chimicamente. In certi casi la differenza di struttura è così spiccata che gli isomeri non solo presentano proprietà fisiche diverse, ad esempio punto di fusione10, punto di ebollizione11, densità12, ecc., ma addirittura sono composti chimicamente diversi. 10 11 12 È la temperatura alla quale un solido fonde, cioè passa dallo stato solido a quello liquido. È la temperatura alla quale tutto il liquido tende a passare allo stato aeriforme. Proprietà specifica di ogni tipo di materiale, è data dal rapporto tra la massa dell’oggetto e il suo volume. M. Ciani – E. Zuccolo – G. Castellani 15 L’isomeria di struttura assume aspetti differenti a seconda che si riferisca: alla articolazione della catena carboniosa ( isomeria di catena), che può essere lineare, ramificata, ciclica; alla posizione assunta da un dato sostituente (atomo o gruppo atomico) o da un particolare tipo di legame nella catena carboniosa ( isomeria di posizione); al gruppo funzionale diverso che si determina da una variazione della disposizione degli atomi componenti ( isomeria di gruppo funzionale). A.1 Isomeria di catena Il primo alcano che può dare molecole strutturalmente diverse è il butano C4H10. Con questa formula grezza sono possibili due isomeri di struttura: uno a catena lineare: il butano normale o normal-butano (n-butano); uno ramificato: l’isobutano (che si può anche chiamare 2-metilpropano): CH3 CH3 - CH2 - CH2 - CH3 n-butano CH3 - CH - CH3 isobutano Gli atomi di carbonio negli alcani, come ad esempio in C5H10, possono unirsi secondo due modelli: A.1.1. catena lineare CH3 – CH2 – CH2 – CH2 - CH3 n-pentano A.1.2. catena ramificata CH3 | CH3 – CH – CH2 – CH3 isopentano o 2 - metilbutano M. Ciani – E. Zuccolo – G. Castellani CH3 | CH3 – C – CH3 | CH3 neopentano o 2,2 - dimetilpropano 16 3.4. Reattività degli alcani Gli alcani presentando solo singoli legami hanno una scarsa reattività (per questo sono anche chiamati paraffine). I principali tipi di reazioni evidenziate dagli alcani sono quelle di combustione e di sostituzione. Queste si basano sulla formazione di radicali e sono innescate dalla luce o dal calore. La combustione, ad esempio, è una reazione a catena - a volte esplosiva - in cui il calore sviluppato produce ulteriori radicali che fanno proseguire ed amplificare la reazione stessa. 3.4.1 Reazioni di combustione Gli idrocarburi bruciano all’aria producendo anidride carbonica e acqua e sviluppano una notevole quantità di calore, che è il prodotto principale di questa reazione di ossidazione. Questo tipo di combustione avviene ad esempio nei cilindri di un’automobile, nelle centrali termoelettriche, nelle nostre case quando si utilizza il metano o il GPL (gas di petrolio liquefatto) sia per cucinare che per alimentare gli impianti di riscaldamento. R-H + O2 CO2 + H2O + calore Esempio di generica reazione di combustione Per il metano e l’ottano, ad esempio, le reazioni di combustione sono così schematizzabili: CH4 + 2 O2 C8H18 + 12,5 O2 CO2 + 2 H2O + calore 8 CO2 + 9 H2O + calore Se la combustione avviene in difetto d’aria, può accadere che oltre all’anidride carbonica si formi anche una certa quantità di monossido di carbonio13 (CO), estremamente tossico per gli organismi viventi. Ecco perché è necessario bruciare questi combustibili in buone condizioni di ventilazione (O2) per evitare tragiche conseguenze come quelle a cui si va incontro quando si mantiene acceso un motore di un’automobile all’interno di un luogo chiuso o quando si fa uso di stufe difettose per il riscaldamento. 3.4.2 Reazioni di sostituzione Come dice il nome, durante la reazione, in opportune condizioni, uno o più atomi di idrogeno vengono sostituiti da altri tipi di atomi. La reazione viene catalizzata dalla luce o dal riscaldamento a temperature elevate. Una tipica reazione di sostituzione è la reazione di alogenazione nel corso della quale l’alcano reagisce con gli alogeni14, prevalentemente con cloro e bromo, producendo un composto, chiamato alogenuro alchilico, formato dal gruppo 13 Monossido di carbonio (CO): se presente nell’aria inspirata, dà un composto irreversibilmente stabile con l’emoglobina (carbossiemoglobina), impedendo pertanto il trasporto di ossigeno nel sangue. 14 Si chiamano alogeni gli elementi del settimo gruppo della tavola periodica. M. Ciani – E. Zuccolo – G. Castellani 17 alchilico dell’alcano, unito a uno o più atomi dell’alogeno. Nella reazione si produce inoltre il corrispondente acido alogenidrico. R-H + alcano A2 cloro o bromo luce o calore R-A + alogenuro alchilico HA acido alogenidrico Esempio di generica reazione di alogenazione Esempio a): H H | | H— C — C — H | | H H etano + Br — Br H H | | H— C— C — H | | H Br bromo bromoetano + H — Br acido bromidrico esempio b): facendo reagire metano con cloro si ottiene una miscela di prodotti di reazione variamente alogenati, tra cui il cloroformio15 o triclorometano (CHCl3): CH4 + Cl2 CH3— Cl + CH2— Cl2 + CH— Cl3 + C— Cl4 + clorometano diclorometano triclorometano HCl tetraclorometano 4. ALCHENI Gli alcheni sono composti organici costituiti anch’essi da carbonio e idrogeno (e per questo appartenenti alla più ampia classe degli idrocarburi). Sono anche noti come "olefine". Gli alcheni sono idrocarburi caratterizzati dalla presenza nella molecola di un doppio legame, pertanto i due atomi di carbonio interessati dal doppio legame presentano ibridazione sp2. Questo fa sì che i tre atomi legati ad ognuno dei carboni si trovino ai tre vertici di un triangolo grossomodo equilatero. I due triangoli sono inoltre allineati lungo l' asse del legame e tra loro complanari. Il primo dei due legami C-C è di tipo , formato dalla sovrapposizione di due orbitali ibridi sp2 lungo l' asse del legame; il secondo legame è di tipo π, formato 15 Il cloroformio è un liquido incolore molto volatile, ottimo solvente per oli, resine e grassi. Ha avuto un largo impiego come anestetico generale, ma oggi è sostituito da sostanze meno tossiche. M. Ciani – E. Zuccolo – G. Castellani 18 dalla sovrapposizione in direzione perpendicolare all' asse del legame dei due orbitali p non coinvolti nell' ibridazione (pag. 4). A differenza di quanto accade negli alcani, la rotazione dei due atomi di C, attorno al doppio legame, è impedita. Gli alcheni sono definiti idrocarburi insaturi in quanto, per la presenza del doppio legame, contengono un numero di atomi di idrogeno inferiore rispetto al corrispondente alcano. La formula generale degli alcheni è: CnH2n dove n indica il numero degli atomi di carbonio della catena. Il primo idrocarburo della serie è l’etene o etilene: H2C = CH2 H H C C H H Modello della molecola dell' etene (etilene) Come nel caso degli alcani, gli atomi di carbonio sono uniti tra loro attraverso legami covalenti a formare una catena aperta, lineare o ramificata; due atomi di carbonio adiacenti sono però uniti da un legame covalente doppio. Anche gli alcheni possono avere catena ciclica: un esempio è la molecola di limonene, componente dell’olio essenziale degli agrumi: CH3 H2C CH3 4.1. Nomenclatura degli alcheni La nomenclatura IUPAC degli alcheni segue regole simili a quella degli alcani, tuttavia occorre evidenziare alcune differenze: il nome che viene dato alla catena principale è simile a quanto previsto per gli alcani, ma il suffisso -ano viene sostituito dal suffisso -ene (etene, propene, butene, pentene, esene, eptene, ottene, etc...); il nome che viene dato alla catena principale è simile a quanto previsto per gli alcani, ma il suffisso – ano viene sostituito dal suffisso – ene (etene, propene, butene, pentene, esene, ertene, ottene, etc….); nel numerare la catena principale, il numero più basso possibile dovrà essere assegnato ai due atomi di carbonio coinvolti nel doppio legame. M. Ciani – E. Zuccolo – G. Castellani 19 Esempio 1-butene 2-metil-2-butene L’alchene più semplice è l’etene, chiamato anche con il nome tradizionale di etilene. Anche il secondo termine, il propene, è spesso chiamato con il nome tradizionale di propilene. Dal butene in poi si deve specificare la posizione del doppio legame con un numero che precede il nome. Esempi: CH2 = CH2 etene o etilene CH2 = CH – CH3 propene o propilene CH2 = CH – CH2 – CH3 1-butene CH3 – CH = CH – CH3 2-butene I gruppi alchilici corrispondenti agli alcheni assumono la desinenza –enile: formula alchene CH2 = CH2 nome alchene etene CH2 = CH – CH3 propene formula gruppo alchilico CH2 = CH– CH2 = CH – CH2– nome gruppo etenile (o vinile) 2- propenile (o allile) Gli alcheni a catena aperta che presentano nella molecola due doppi legami vengono chiamati dieni, quelli che presentano tre doppi legami trieni. Essendo composti insaturi, hanno proprietà in gran parte simili a quelle degli alcheni, ma per certe loro caratteristiche si distinguono in modo significativo. La nomenclatura è la stessa degli alcheni, salvo che: per il suffisso, che da –ene diventa –diene ; per i due numeri necessari per indicare la posizione dei due doppi legami. Un diene particolarmente importante è il butadiene, in quanto è uno dei componenti della gomma sintetica, realizzata per la prima volta nel 1939. Questo grazie al processo di vulcanizzazione che consente di ottenere gomme M. Ciani – E. Zuccolo – G. Castellani 20 più resistenti, trova larghissima applicazione, basti pensare ai pneumatici delle auto. formula condensata formula di struttura H H CH2 = CH– CH = CH2 C H C C H C H H 1-3-butadiene 1-3-butadiene I dieni possono essere suddivisi in: Coniugati, quando i doppi legami sono separati da un solo legame semplice. Isolati, quando i doppi legami sono separati da più di un legame semplice. C H C M. Ciani – E. Zuccolo – G. Castellani sp2 H C sp2 H H Cumulati (o alleni), quando i doppi legami non sono separati l' uno dall' altro. H H C sp2 H C sp2 H H H C C C sp2 sp3 H H H C sp2 H sp2 H H C H sp2 sp2 C C sp sp2 H 21 A.2 Isomeria di posizione L’isomeria di posizione si ha quando due alcheni hanno la stessa formula molecolare e la stessa formula di struttura ma differiscono soltanto per la posizione del doppio legame. CH2 = CH – CH2 – CH3 1-butene CH3 – CH = CH – CH3 2-butene B. STEREOISOMERIA Si dicono stereoisomeri i composti in cui le molecole hanno lo stesso scheletro di atomi di carbonio e tutti gli atomi sono legati nella medesima sequenza, ma presentano diversa disposizione spaziale relativa degli atomi o dei gruppi funzionali. Esistono due tipi di stereoisomeria: l’isomeria geometrica e l’isomeria ottica. B.1 Isomeria geometrica ( isomeria cis – trans o isomeria Z – E ) Si riscontra quando nella molecola esistono impedimenti alla libera rotazione di gruppi atomici in essa presenti. se ne trovano esempi sia nelle molecole contenenti doppi legami C=C, sia in quelle con struttura ciclica. Il doppio legame, essendo rigido, impedisce la rotazione delle due parti della molecola intorno al legame. In questi casi le molecole hanno la stessa composizione, ma orientamento spaziale diverso dei gruppi di atomi legati alla catena. il nome del composto è lo stesso, ma si parla di isomero cis (Z) e isomero trans (E). L’isomero cis (Z) ha gli atomi di idrogeno disposti dalla stessa parte rispetto al piano su cui giace il doppio legame, invece nell’isomero trans (E) gli idrogeni sono opposti rispetto al piano del doppio legame. Si prenda ad esempio il 2–butene, la molecola può avere struttura cis o trans: a seconda della posizione del doppio legame, il butene può esistere come 1-butene o 2-butene H C C H3C cis-2-butene H H CH3 H3C C CH3 C H trans-2-butene L’isomeria cis-trans è presente anche nelle molecole cicliche dove si osserva la diversa collocazione dei gruppi funzionali rispetto al piano della molecola: M. Ciani – E. Zuccolo – G. Castellani 22 H H Cl H Cl Cl Cl H cis-1,2-diclorocicloesano trans-1,2-diclorocicloesano Esempio biologico: il retinale è un componente della rodopsina, pigmento presente nelle cellule della retina denominate bastoncelli. Per azione di un fotone che eccita gli elettroni del doppio legame, il legame π si allenta e la molecola ruota passando dalla configurazione cis a quella trans. Questo cambiamento della configurazione stimola una serie di variazioni chimiche che originano l’impulso elettrico lungo il nervo ottico. CHO CHO 11-cis-retinale 11-trans-retinale Reattività di alcheni e alchini Gli alcheni e gli alchini hanno una caratteristica comune: sono composti insaturi in quanto contengono nella loro molecola un doppio (alcheni) o un triplo (alchini) legame. La presenza di un legame multiplo condiziona il loro comportamento: alcheni e alchini hanno una elevata reattività e possono dar luogo a una grande varietà di reazioni. Gli alcheni, in particolare, hanno una grande importanza nell’industria chimica, perché da essi si possono ottenere molte sostanze dotate di interessanti proprietà. Esempio biologico-ambientale: una conseguenza di reattività del doppio legame riguarda l’inquinamento da ozono. L’ozono (O3) è un gas che si trova negli strati alti dell’atmosfera ma che, in particolari condizioni come inquinamento dell’aria e forte irraggiamento solare, può prodursi anche negli strati bassi. L’ozono è un forte ossidante e reagisce fortemente con molecole che presentano almeno un doppio legame spezzandolo (ozonolisi). Poiché le membrane cellulari sono ricche di molecole con gruppi alchenici (es. i fosfolipidi), la presenza di ozono è potenzialmente nociva per gli organismi viventi16. 16 Ozono : provoca anche irritazioni a naso, occhi e gola, attacchi di tosse e senso di oppressione al torace. Indebolisce il sistema immunitario. E’ molto dannoso anche per le piante: compromette i meccanismi della fotosintesi. M. Ciani – E. Zuccolo – G. Castellani 23 4.3 Reattività degli alcheni Mentre le proprietà chimico-fisiche degli alcheni (punti di fusione e di ebollizione, solubilità17) sono molto simili a quelle dei corrispondenti alcani, la loro reattività è molto diversa. Per il fatto di contenere un doppio legame C=C e quindi un gruppo insaturo, gli alcheni sono molto reattivi e danno reazioni tipiche che coinvolgono il doppio legame. Una reazione caratteristica del gruppo funzionale C=C è la reazione di addizione che porta alla formazione di composti saturi. Il doppio legame è formato da un forte legame e da un legame π più debole, pertanto la reazione di addizione prevede la rottura del legame π. Ciò in effetti è quanto si verifica e avviene con la rottura generalmente eterolitica (vedi pag. 30) del legame. Addizione La reazione di addizione è una reazione in cui il reagente viene semplicemente sommato alla molecola organica; questo tipo di reazione è quasi esclusiva di composti contenenti atomi di carbonio legati da legami multipli. Gli elettroni degli orbitali π esercitano nel legame un' azione molto minore degli elettroni degli orbitali e inoltre si trovano ad una distanza maggiore dal nucleo: sono quindi meno saldamente legati e perciò più disponibili per un reattivo alla ricerca di elettroni. Il doppio legame risulta, in definitiva, una «sorgente di elettroni»; agisce cioè come una base di Lewis18. È ovvio quindi che tenda a reagire con composti che hanno una lacuna elettronica, che sono cioè acidi di Lewis19. I reagenti alla ricerca di elettroni si definiscono reagenti elettrofili e la reazione tipica di un alchene è pertanto l' addizione elettrofila. Tra le principali reazioni di addizione al doppio legame troviamo le reazioni di: - addizione di alogeni (alogenazione); - addizione di idrogeno (idrogenazione); - addizione di acqua (idratazione); - addizione di monomeri (polimerizzazione). Alogenazione Nella reazione di alogenazione, all’alchene può essere addizionata o una molecola di alogeno, in particolare il bromo (Br2), o una molecola di acido alogenidrico come l’acido bromidrico (HBr). Nella generica reazione sottoriportata, con XY si può intendere o Br2 o HBr. 17 Ogni sostanza può sciogliersi nello stesso solvente in diversa misura; la solubilità è la massima quantità in grammi di soluto che si può sciogliere in 100 grammi di solvente. 18 Una base di Lewis è una molecola o uno ione negativo che possono dare una coppia di elettroni ad un altro atomo per formare un nuovo legame. 19 una molecola o uno ione positivo che possono accettare una coppia di elettroni da un altro atomo per formare un nuovo legame. M. Ciani – E. Zuccolo – G. Castellani 24 C C + XY C C X Y Idrogenazione La reazione avviene a temperature e pressioni non elevate in presenza di catalizzatori metallici quali platino, palladio o nichel, producendo l' alcano corrispondente. Durante l’idrogenazione dell’alchene il doppio legame viene trasformato in un singolo legame e i due atomi di idrogeno della molecola H2 si uniscono ai due atomi di carbonio, si forma così il corrispondente alcano: R – CH = CH - R'+ H2 R - CH2 - CH2 - R' Questo processo ha applicazione industriale. Infatti, per idrogenazione degli oli ottenuti dalla spremitura dei semi di soia, arachide, girasole ecc., che contengono molecole organiche insature, si ottengono composti saturi, le margarine, che avendo punti di fusione più elevati sono commercializzati come solidi, la reazione viene anche chiamata:“indurimento degli oli”. Se per addizione di idrogeno ad un alchene si ottiene il corrispondente alcano, viceversa, eliminando due atomi di idrogeno da due atomi di carbonio contigui in una molecola di alcano si ottiene la formazione di un doppio legame e quindi deidrogenazione20. la molecola di un alchene Idratazione In presenza di un acido che funge da catalizzatore, una molecola di acqua si addiziona al doppio legame come mostra la figura e si forma un alcol: Questa specifica reazione presenta un particolare interesse industriale, viene infatti utilizzata per la produzione di alcol etilico per via sintetica. 20 Mediante la reazione di deidrogenazione si producono perciò gli alcheni dagli alcani. Questo processo noto come cracking permette a partire dal petrolio formato da grandi molecole di ottenere molecole più piccole e più leggere come prodotti gassosi e benzine. R-CH2-CH2-R' R-CH=CH-R'+ H2 M. Ciani – E. Zuccolo – G. Castellani 25 Polimerizzazione L' addizione di una molecola di alchene ad un' altra identica, ripetuta virtualmente all' infinito produce un esempio di polimero21. Le reazioni di polimerizzazione degli alcheni avvengono per addizione: il doppio legame presente in ciascun alchene si spezza e ogni molecola si unisce a due molecole adiacenti. Tra i materiali ottenuti per polimerizzazione degli alcheni ricordiamo: - il polietilene (PE) che trova impiego nella produzione di pellicole e contenitori per imballaggio di alimenti, bottiglie, tubi ecc. - il polipropilene isotattico22 (nome commerciale moplen) che è largamente usato per articoli casalinghi, igienico-sanitari, da laboratorio e nel settore tessile (nome commerciale meraklon) per produrre articoli di abbigliamento e di arredamento, moquette e cordami. propilene polipropilene - il polivinilcloruro (noto come PVC) che ha vastissime applicazioni in edilizia, elettrotecnica, arredamento, abbigliamento ecc. vinilcloruro polivinilcloruro 21 Per polimero si intende una molecola costruita da una numero enorme di unità semplici, dette monomeri, legate tra loro in modo più o meno regolare.Esistono molti polimeri naturali che si formano attraverso complessi meccanismi enzimatici (proteine, acidi nucleici, cellulosa, resine naturali). L’ esigenza di trovare nuovi materiali per lo sviluppo tecnologico ha stimolato la ricerca chimica, a partire dagli anni 30 del ‘900, a produrre sinteticamente materiali a partire da sostanze diffuse in natura. Le materie plastiche (o materiali sintetici) vengono prodotte utilizzando soprattutto idrocarburi quali metano, etilene, propilene, acetilene, che derivano dal petrolio. 22 Isotattico significa che tutti i gruppi CH3 si trovano dalla stessa parte lungo la catena e questa regolarità conferisce al polimero migliori qualità meccaniche. M. Ciani – E. Zuccolo – G. Castellani 26 5. ALCHINI Gli alchini sono idrocarburi caratterizzati dalla presenza di un triplo legame, pertanto i due carboni interessati dal triplo legame presentano ibridazione sp.Un legame C-C è di tipo σ, formato dalla sovrapposizione di due orbitali ibridi sp lungo l' asse del legame; il secondo ed il terzo legame sono di tipo π, formati dalla sovrapposizione in direzione perpendicolare all' asse del legame delle due coppie di orbitali p non coinvolte nell'ibridazione. Tale doppia sovrapposizione va a formare un unico orbitale approssimativamente a forma di tubo che avvolge l' asse del legame C-C lungo la sua lunghezza. Gli alchini sono idrocarburi insaturi. La formula generale degli alchini è: CnH2n-2 dove n indica il numero degli atomi di carbonio della catena. Il primo idrocarburo della serie è l’etino che viene anche chiamato acetilene ed è anche il più interessante dal punto di vista industriale23. C H H C C H C H molecola dell' etino (acetilene) Come nel caso degli alcani e degli alcheni gli atomi di carbonio sono uniti tra loro attraverso legami covalenti a formare una catena aperta, lineare o ramificata. Due atomi di carbonio adiacenti sono però uniti da un legame covalente triplo. 5.1. Nomenclatura degli alchini La nomenclatura IUPAC degli alchini segue regole simili a quella degli alcani, tuttavia occorre evidenziare alcune differenze: il nome che viene dato alla catena principale è simile a quanto previsto per gli alcani, ma il suffisso -ano viene sostituito dal suffisso -ino (etino, propino, butino, pentino, esino, eptino, ottino, etc...) nel numerare la catena principale, il numero più basso possibile dovrà essere assegnato ai due atomi di carbonio coinvolti nel triplo legame. I radicali corrispondenti agli alchini assumono la desinenza –inile: 23 L’acetilene è impiegato in numerose sintesi chimiche e specialmente nel campo della fabbricazione dei monomeri per resine viniliche oltre che per la fabbricazione di numerosi altri prodotti chimici; viene inoltre impiegato nel cannello ossiacetilenico per il taglio e la saldatura dei metalli in quanto permette di raggiungere temperature di circa 2800 °C. M. Ciani – E. Zuccolo – G. Castellani 27 formula alchino nome alchino formula gruppo alchilico nome gruppo CH ≡ CH etino CH ≡ C– etinile CH ≡ C – CH3 propino CH ≡ C – CH2– 2-propinile CH3 – C ≡ CH propino CH3 C≡C 1-propinile 5.2. Reattività degli alchini Le reazioni degli alchini sono simili a quelle degli alcheni, ma il triplo legame risulta meno reattivo del doppio legame. Tra gli alchini l’unico di interesse rilevante è l’etino o acetilene. Come per gli alcheni, anche la maggior parte della reattività degli alchini si esplica attraverso reazioni di addizione al triplo legame. Le reazioni di addizione possono essere lasciate procedere fino all' ottenimento di composti saturi (cioè con atomi legati tra loro solo da legami semplici) oppure essere condotte in condizioni tali da favorire un' addizione parziale, trasformando quindi il triplo legame in un legame doppio. L’addizione di H2 avviene a temperature e pressioni non elevate in presenza di catalizzatori metallici quali platino, palladio o nichel, producendo alla fine l' alcano (b) corrispondente. Durante l’idrogenazione dell’alchino il triplo legame viene trasformato in un doppio legame e i due atomi di idrogeno della molecola H2 si uniscono ai due atomi di carbonio, si forma così il corrispondente alchene (a): a) R–C C - R'+ H2 b) R–C C - R'+ 2 H2 R – CH = CH - R' R - CH2 - CH2 - R' Gli alchini possono polimerizzare secondo un meccanismo analogo a quanto succede per gli alcheni; in particolari condizioni è stato prodotto in laboratorio il poliacetilene, un polimero la cui struttura è quella di un poliene coniugato costituito da migliaia di atomi. Molecole di questo genere sono interessanti in quanto diventano conduttori di corrente elettrica. 6. IDROCARBURI AROMATICI Il termine «aromatico» fu usato inizialmente per designare i composti organici dotati di odore gradevole. Oggi il termine ha piuttosto un significato “strutturale”, poiché con esso si indicando molecole caratterizzate da un particolare assetto elettronico, che conferisce loro un determinato comportamento chimico. Il primo termine di questa famiglia è il benzene, che ha formula molecolare C6H6, con un rapporto C:H uguale a 1. M. Ciani – E. Zuccolo – G. Castellani 28 Formula di struttura del benzene Fu ben presto chiaro che il benzene si comportava come se contenesse tre doppi legami. Questi doppi legami mostravano tuttavia un' insolita inerzia chimica, tale da non poterli equiparare a "normali" doppi legami carboniocarbonio. Il termine aromatico iniziò ad assumere un significato volto piuttosto a descrivere il loro particolare comportamento chimico, cioè la tendenza a dare reazioni di sostituzione nonostante l' elevato grado di insaturazione. Il problema era quindi quello di definire una struttura del benzene in grado di accordarsi con le osservazioni sperimentali. Struttura di Kekulè del benzene I dati sperimentali sono perfettamente in linea con questa rappresentazione: ogni legame C-C è equivalente e la lunghezza di legame è intermedia tra quella prevista per un legame semplice e uno doppio. La molecola è planare con angoli di 120°; la forma è quindi quella di un esagono regolare. Ogni carbonio ha ibridazione sp2 e i rimanenti orbitali p non ibridati, uno per atomo, sono disposti perpendicolarmente al piano e parallelamente fra loro. In questo modo, i sei elettroni rimanenti possono delocalizzarsi in un unico orbitale esteso a tutto l' anello. È allo scopo di mettere in evidenza questo aspetto che si usa rappresentare il benzene come un esagono con un cerchio al centro. M. Ciani – E. Zuccolo – G. Castellani 29 Il benzene24 a temperatura ambiente è un liquido incolore dall' odore caratteristico, poco solubile in acqua e completamente miscibile con i solventi organici. Il gruppo funzionale ottenuto per rimozione di un atomo di idrogeno (C6H5-) prende il nome di fenile e viene spesso abbreviato con la sigla Ph. 24 Si trova in natura nel petrolio greggio, ma in genere viene sintetizzato partendo da altri composti ottenuti dal petrolio.Il benzene è un cancerogeno riconosciuto che danneggia in modo particolare le cellule germinali.Trova impiego come additivo anti-detonante nella cosiddetta “benzina verde" in sostituzione del piombo tetraetile usato nella ‘’benzina rossa’’; agisce come antidetonante aumentandone il numero di ottani. Negli Stati Uniti, come pure in Europa, in seguito ai suoi effetti nocivi sulla salute, le autorità hanno posto il limite del contenuto di benzene nella benzina all' 1% in volume. Il benzene può venire a formarsi quando materiali ricchi di carbonio subiscono una combustione incompleta. In natura si trova nei fumi dei vulcani e degli incendi boschivi. È presente anche nel fumo di sigaretta. Fino agli anni ’20 fu usato spesso come solvente industriale, in special modo per sgrassare le superfici metalliche. Col crescere della consapevolezza della sua pericolosità è stato via via sostituito da altri solventi nelle applicazioni che comportano un' esposizione diretta. È un importante solvente nonché un reattivo basilare nella sintesi di numerosi composti, farmaci, materie plastiche, gomme sintetiche, polimeri, coloranti. Il maggiore utilizzo del benzene è tuttavia quello di intermedio per la produzione di altre sostanze chimiche. I composti più importanti - in termine di quantità - derivati dal benzene sono lo stirene, materia prima per la produzione di polimeri, l’acido tereftalico, materia prima per il polietilentereftalato (PET), il fenolo ed il cicloesano, utilizzato nella sintesi dei nylon. Minori quantità di benzene vengono impiegate per produrre gomme, lubrificanti, coloranti, detergenti, farmaci, esplosivi e pesticidi. La respirazione di aria contaminata da benzene a livelli elevati produce stati confusionali, tachicardia, mal di testa, tremore ed incoscienza; livelli molto elevati possono essere mortali. Mangiare o bere cibi contaminati da benzene può causare vomito, irritazione delle pareti gastriche, sonnolenza, convulsioni, tachicardia e morte. I più gravi effetti che si manifestano in caso di una lunga esposizione sono principalmente a carico del sangue. Il benzene danneggia il midollo osseo e provoca un calo del numero dei globuli rossi portando all’anemia. Può inoltre ostacolare la coagulazione del sangue e deprimere il sistema immunitario. Tra gli effetti a lungo termine rientra anche la leucemia. Alcune donne esposte a livelli elevati di benzene per molti mesi hanno avuto anomalie nel ciclo mestruale ed una diminuzione del volume delle ovaie. Non è ancora noto se l' esposizione al benzene danneggi il feto durante la crescita e possa ridurre la fertilità maschile. Studi condotti su animali hanno dimostrato che l' esposizione al benzene durante la gravidanza porta a nascite sotto peso, ritardi nello sviluppo osseo e danni al midollo osseo dei nascituri. È possibile misurare l' esposizione al benzene attraverso le analisi delle urine, del sangue e del fiato espirato. Nel primo caso l' analisi può essere però falsata dal fatto che i prodotti di degradazione metabolica del benzene sono gli stessi derivati dal metabolismo di altre sostanze. Negli altri due casi, le analisi vanno eseguite in tempi brevi dopo l' esposizione, dato che il benzene viene metabolizzato abbastanza rapidamente. L' uso del benzene come antidetonante nella cosiddetta "benzina verde" ha reso il traffico urbano una delle principali fonti di inquinamento da benzene dell' aria delle città e del loro hinterland. Si calcola che il traffico automobilistico sia responsabile dell’82% del benzene che inquina l’aria delle aree urbane. Tuttavia, l’esposizione maggiore al benzene da parte dell’organismo deriva dal fumo di sigaretta (45%), da attività come il cucinare con fuoco di legna, verniciare e usare di solventi (34%), per il 18% dal traffico automobilistico e per il 3% dall’industria. M. Ciani – E. Zuccolo – G. Castellani 30 APPROFONDIMENTO Le reazioni della chimica organica Le reazioni della chimica organica implicano normalmente la rottura di legami e la formazione di nuovi. Poiché il legame covalente è sempre formato da una coppia di elettroni condivisa da due atomi (a:b), esso può scindersi essenzialmente in due modi: 1) omolitico o radicalico. In questo caso, ciascun atomo si “prende” un elettrone (a:b a• + b•) e si formano dei radicali. Le reazioni che comportano questo tipo di scissione si dicono radicaliche; sono piuttosto violente, esplosive, e spesso procedono con un meccanismo “a catena”, poiché i radicali, per la presenza dell'elettrone spaiato, sono molto reattivi ed hanno un tempo di vita molto breve. La formazione di radicali è un processo che richiede una certa energia: è favorita dal calore e dai raggi UV. Molto difficile in solventi polari, avviene più rapidamente in solventi apolari. La rottura omolitica è tipica del legame (covalente apolare). 2) eterolitico o ionico. In questo caso il doppietto elettronico viene preso interamente da uno dei due atomi e si formano quindi un anione e un catione (a:b a:– + b+). La rottura eterolitica è frequente nei legami oppure quando vi è una certa differenza di elettronegatività tra i due atomi legati. Gli ioni che si formano sono anch' essi molto reattivi, ma hanno una vita media più lunga dei radicali. La maggioranza delle reazioni organiche procede attraverso meccanismi “ionici”; le reazioni radicaliche sono per lo più limitate ai legami covalenti apolari (o quasi) o a reazioni di polimerizzazione. 7. GRUPPI FUNZIONALI Gli idrocarburi sono considerati i precursori di tutti gli altri composti organici. Possiamo immaginare ogni composto organico come derivante dalla combinazione di un gruppo R (residuo carbonioso) con uno o più gruppi funzionali. Un gruppo funzionale è un atomo o un gruppo di atomi che sostituisce un atomo di idrogeno in una molecola idrocarburica conferendole delle specifiche e caratteristiche proprietà. Il gruppo funzionale è l’unico punto molecolare nel quale possono avvenire reazioni tipiche, il resto della catena carboniosa, che viene indicata genericamente con un simbolico - R25 (gruppo alchilico) o – Ar26 ( gruppo arilico), partecipa scarsamente o non partecipa affatto alle reazioni. Per questa ragione è proprio il gruppo funzionale che conferisce il nome al composto che lo contiene. Molti gruppi funzionali sono polari ( es. –OH, -COOH, -NH2, ecc) e quindi facilmente solubili nei solventi polari, come ad esempio l’acqua, con la quale stabiliscono deboli legami a idrogeno27: per questo vengono detti idrofili. Ciò riveste grande importanza per le funzioni vitali, in quanto gli organismi viventi sono composti mediamente per il 70% di acqua. 25 R = gruppo alchilico derivante da un idrocarburo alifatico Ar = gruppo arilico derivante da un idrocarburo aromatico Legame a idrogeno: questo legame si instaura tra molecole fortemente polarizzate in cui l’idrogeno è legato a atomi molto elettronegativi (N, O, F); quando le molecole si avvicinano si determina un’attrazione elettrica, chiamata ponte a idrogeno o legame a idrogeno, tra l’H di una molecola e gli atomi molto elettronegativi di un’altra molecola; tale legame, pur debole, può influenzare la proprietà delle sostanze (ad esempio la struttura nelle proteine) o l’aumento di volume dell’acqua quando passa allo stato solido o l’alto valore della sua temperatura di ebollizione. 26 27 M. Ciani – E. Zuccolo – G. Castellani 31 I gruppi funzionali non – polari vengono indicati invece come idrofobi. La reattività tipica dei composti è conferita dunque dal gruppo funzionale e non è influenzata (se non in casi particolari) dalla lunghezza o dalla struttura della catena idrocarburica a cui è unito lo stesso. Gruppo funzionale Nome del gruppo Classe del composto C=C doppio legame alchene C C triplo legame alchino - Cl cloro cloruro CH3 - Cl - OH ossidrile alcool H3C - CH2 - OH R – O – R’ alcossi etere H3C - O - CH3 H H aldeide C Esempio C C H–C O H3C - C Etino Metilcloruro Etanolo Metossimetano o dimetiletere Etanale H O chetone Etene H C–H carbonile O H Nome IUPAC Propanone H3C - C - CH3 C O OH - NH2 O H C N O C carbossile acido carbossilico amminico ammina primaria ammidico ammide H estereo O-R estere O H3C - C OH H3C - NH2 O H3C - C Acido etanoico Metilammina Etanammide NH2 O H3C - C Metiletanoato O CH3 8. ALCOLI Si è precedentemente visto come dall’idratazione di un alchene derivi un alcol. Gli alcoli sono caratterizzati dalla presenza del gruppo funzionale –OH legato ad una catena alifatica. Nel caso di alcoli monovalenti il gruppo funzionale sostituisce un solo atomo di idrogeno, mentre negli alcoli polivalenti vengono sostituiti più atomi di idrogeno. Il nome degli alcoli si ottiene da quello del corrispondente idrocarburo sostituendo la lettera finale con il suffisso -olo nel caso degli alcoli monovalenti; CH4 metano CH3 – OH metanolo o alcol metilico CH3 – CH3 etano M. Ciani – E. Zuccolo – G. Castellani CH3 – CH2 – OH etanolo o alcol etilico 32 In caso di catene molto lunghe la numerazione della catena inizia sempre dall’estremità più vicina a –OH e il numero che precede il nome dell’alcol indica a quale carbonio è legato l’ossidrile. CH3 5 CH3 OH 3 4 CH2 C 2 CH 1 CH3 CH3 4,4-dimetil-2-pentanolo A seconda del carbonio sul quale si trova il gruppo –OH, gli alcoli si distinguono in primari, secondari e terziari, ovviamente isomeri tra loro. 1 2 CH2 CH2 OH 3 4 1 CH2 CH3 2 CH3 CH 3 CH2 CH3 4 CH3 CH3 C OH 1-butanolo alcol primario CH3 OH 2-butanolo alcol secondario terz -butanolo o alcol terziario Le tre molecole sono anche un esempio di isomeria di posizione. Nel caso di alcoli polivalenti, che contengono due-tre o più gruppi – OH, la desinenza –diolo, -triolo, -tetraolo è preceduta dal nome del corrispondente idrocarburo e preceduta o seguita da uno dei numeri che identificano la posizione di ogni –OH presente in molecola. Un esempio importante di trialcol è l’1,2,3-propantriolo, noto comunemente come glicerolo, o glicerina, che contiene tre gruppi – OH I I CH2– OH CH – OH CH2– OH 1,2,3 propantriolo o glicerolo 8.1 Proprietà chimiche Le proprietà degli alcoli sono legate alla forte elettronegatività dell’ossigeno e alle coppie elettroniche non impegnate in legami situate sullo stesso. .. CH3 - OH CH3 - CH2 - OH .. metanolo 28 o alcol metilico etanolo 29 o alcol etilico 28 Il metanolo CH3OH,una volta veniva preparato per distillazione secca del legno (spirito di legno); ora è prevalentemente prodotto per reazione tra ossido di carbonio e idrogeno sotto pressione e in presenza di catalizzatori: CH3OH CO + 2H2 Il metanolo è un liquido incolore, volatile e infiammabile; è solubile in acqua in tutte le proporzioni. Ha un odore gradevole e inebriante ma è molto tossico: se ingerito provoca lesioni gravi al sistema nervoso centrale, al fegato ed al nervo ottico (cecità). M. Ciani – E. Zuccolo – G. Castellani 33 Tipiche reazioni degli alcoli sono le ossidazioni mediante ossidanti energici (KMnO4 o Na2Cr2O7) che conducono rispettivamente: a) gli alcoli primari ad aldeidi. Se ulteriormente ossidate le aldeidi formano gli acidi carbossilici corrispondenti R - CH2OH 1/2 O2 - H 2O O R-C 1/2 O2 R-C H alcol primario aldeide b) gli alcoli secondari O OH acido carbossilico a chetoni O OH R - CH - R' alcol secondario 1/2 O2 - H 2O R - C - R' chetone A.3 Isomeria di gruppo funzionale Se due isomeri hanno la stessa formula molecolare, cioè contengono lo stesso tipo di atomi e nello stesso numero, ma gruppi funzionali diversi uniti alla catena, si parla di isomeri di gruppo funzionale. Per esempio, alla formula grezza C4 H10 o corrispondono due isomeri appartenenti a due classi di composti chimicamente molto diversi: il primo è un alcol, il secondo è un etere. H H H H H C C C C H H H H OH n-butanolo o alcool n-butilico o 1-butanolo H H H C C H H O H H C C H H H dietiletere o etere dietilico o etere 9. ETERI Gli eteri sono composti organici di formula generale R’ – O – R’’ in cui il gruppo funzionale è l’atomo di ossigeno che è legato covalentemente a due gruppi alchilici che possono essere tra loro uguali (eteri semplici o simmetrici) oppure diversi (eteri misti o asimmetrici). 29 L’etanolo CH3CH2OH è un liquido incolore, volatile di odore gradevole. E’ molto solubile in acqua. Viene prodotto con la fermentazione alcolica, processo naturale che consiste nella demolizione enzimatica (da parte di lieviti) di carboidrati presenti in liquidi zuccherini (succhi d’uva o altra frutta, cereali, patate,ecc) ad anidride carbonica e alcol etilico. L’alcol può essere usato come bevanda ma ad elevate quantità risulta tossico per: apparato digerente, fegato e sistema nervoso. Se miscelato a sostanze maleodoranti e colorate, cioè denaturato per evitare un uso alimentare, viene usato come sgrassante e debole disinfettante. M. Ciani – E. Zuccolo – G. Castellani 34 Per nominare questi composti la parola – etere è preceduta dai nomi dei gruppi: metossi etossi - – O – CH3 metossietere – O – CH2 – CH3 etossietere L’etere più comune è l’etere dietilico (figura sopra), che in commercio viene chiamato semplicemente etere. E’ usato come anestetico e come solvente in laboratorio. Molto volatile è altamente infiammabile e quindi pericoloso. B.2 Isomeria ottica o enantiomeria Osservando le mani accostate, apparentemente sembrano uguali ma se si tenta di sovrapporle a palmi entrambi volti verso il basso o entrambi volti verso l’alto, le dita non coincideranno: al pollice dell’una corrisponderà il mignolo dell’altra e viceversa; lo stesso accade per le altre dita. Se invece si pone davanti allo specchio la mano destra, con palmo rivolto allo specchio, quest’ultimo rifletterà esattamente l’immagine del palmo della mano sinistra. Lo stesso accade per la mano destra. Da ciò si può dedurre che ogni mano non è sovrapponibile alla sua immagine speculare. Altre parti godono della stessa proprietà: orecchie, occhi, piedi, scarpe, guanti ecc. Tutte le strutture che godono di questa proprietà si dicono chirali. La chiralità è una proprietà molto diffusa in natura e anche in chimica esistono molecole chirali. Nelle molecole chirali è sempre presente almeno uno stereocentro o centro stereogenico, rappresentato da un carbonio chirale, chiamato anche carbonio asimmetrico che si contrassegna, per convenzione, con un asterisco (c*). Un carbonio è asimmetrico quando è legato a quattro atomi o gruppi di atomi diversi. C* La presenza di un carbonio asimmetrico conferisce alla molecola una proprietà del tutto particolare: quella di esistere in due isomeri diversi, i quali, pur avendo la stessa formula di struttura, differiscono per la disposizione nello spazio degli atomi o dei gruppi di atomi legati allo stereocentro, risultando uno l’immagine speculare dell’altro (quindi mai sovrapponibili). Si definiscono enantiomeri o antipodi ottici gli isomeri a M. Ciani – E. Zuccolo – G. Castellani immagine 35 speculare, tali che le loro strutture spaziali non sono comunque sovrapponibili. Indicando con lettere diverse gli atomi o i gruppi di atomi legati al carbonio asimmetrico le due molecole speculari ottenute si dicono enantiomeri. X X C C Z Z Gli enantiomeri sono sostanze otticamente attive e vengono chiamati isomeri ottici o antipodi ottici. infatti gli enantiomeri hanno le stesse proprietà fisiche con un' unica eccezione: l’opposto comportamento nei confronti della luce polarizzata.30 O C H O C H HO - C*- H H - C*- OH CH2OH CH2OH a) (+)-gliceraldeide b) (-)-gliceraldeide L’isomero a) della gliceraldeide fa ruotare il piano di vibrazione della luce polarizzata verso destra potere rotatorio destrogiro indicato con il segno + o con la lettera d- (minuscolo). L’isomero b) della gliceraldeide fa ruotare il piano di vibrazione della luce polarizzata verso sinistra potere rotatorio levogiro indicato con il segno - o con la lettera l- (minuscolo). Una miscela in parti uguali di due enantiomeri è otticamente inattiva e si definisce racemo. Gli enantiomeri hanno le stesse proprietà chimiche, salvo che nei confronti dei reagenti otticamente attivi, rispetto ai quali manifestano velocità di reazione diverse. 10. ALDEIDI E CHETONI Sono entrambi caratterizzati dalla presenza del gruppo carbonile in cui l’atomo 120° 120° 2 di carbonio è in stato di ibridazione sp . C O 120° 30 La normale luce solare vibra in infiniti piani, tutti perpendicolari alla direzione di propagazione del raggio luminoso. La luce resa polarizzata dall’uso di particolari lenti vibra in un solo piano. Quando un raggio polarizzato attraversa una soluzione di una sostanza otticamente attiva il piano di vibrazione del raggio emergente risulta ruotato di un certo angolo o verso destra (+) o verso sinistra (-). Il potere rotatorio di una sostanza viene misurato con un polarimetro. M. Ciani – E. Zuccolo – G. Castellani 36 Nelle aldeidi il gruppo gruppo R o Ar. C=O è legato ad un atomo di idrogeno e a un O H Nei chetoni la funzione C=O C R' è legata a due gruppi - R o - Ar . O R C R' Nel gruppo carbonilico il doppio legame C=O risulta formato da un legame (tra un orbitale ibrido sp2 di C e un orbitale sp2 di O) e da uno (sovrapposizione di un orbitale non ibrido 2p di C e un orbitale 2p di O), come nel gruppo – ene alchenico; tuttavia la forte elettronegatività dell’ossigeno rispetto al carbonio deforma la nuvola di carica, conferendo al legame una spiccata polarizzazione. 10.1 Nomenclatura Aldeidi Secondo la nomenclatura IUPAC le aldeidi alifatiche derivano il loro nome dal corrispondente idrocarburo con desinenza – ale; CH3 –CH3 CH3 – CHO etano etanale o aldeide acetica o acetaldeide Nelle catene più lunghe la numerazione inizia dal carbonio contenente il gruppo carbonile che ovviamente si deve trovare sempre al termine della catena. O 5 C 3 4 C C 2 C 1 C H Chetoni Anche i chetoni derivano il nome dall’idrocarburo corrispondente con desinenza –one, preceduto dal numero corrispondente alla posizione del gruppo carbonile nella catena idrocarburica. Molto diffusi sono ancora i nomi convenzionali oppure la denominazione dei due gruppi idrocarburici legati al carbonile seguita dal termine chetone. CH3 - CO - CH3 dimetilchetone o propanone o acetone M. Ciani – E. Zuccolo – G. Castellani 1 2 CH3 3 4 CH3 - CO - CH - CH3 3-metil -2-butanone o isopropilmetilchetone 37 Anche in questi composti la numerazione della catena carbonica di base (la più lunga) inizia sempre dall’estremità più vicina al gruppo carbonile (gruppo funzionale). 10.2 Proprietà di aldeidi e chetoni Proprietà fisiche La presenza del gruppo carbonilico fortemente polare aumenta la temperatura di ebollizione rispetto a molecole di egual massa, ma apolari, ed aumenta la solubilità in acqua (almeno in catene fino a 5 C). Proprietà chimiche La presenza del gruppo carbonile: • facilita il distacco degli atomi di H dei C contigui al gruppo carbonile favorendo le reazioni di sostituzione; • manifesta proprietà riducente31, trasformandosi in gruppo carbossilico O R-C H aldeide • + 1/2 O2 R-C O OH acido carbossilico permette reazioni di addizione al doppio legame C=O Le molecole che costituiscono gli esseri viventi contengono gruppi funzionali e si dividono in tre classi principali di sostanze alimentari: glucidi, lipidi e protidi. Queste molecole sono indispensabili per costruire e far funzionare il nostro organismo e per mantenerlo in buone condizioni. 11. GLUCIDI I glucidi, detti anche zuccheri (quelli solubili in acqua), perché alcuni di essi hanno sapore dolce, venivano anche chiamati idrati del carbonio o carboidrati perché la loro formula grezza si può scrivere genericamente Cn(H2O)n, dove n corrisponde al numero degli atomi di carbonio (C3H6O3; C4H8O4; C5H10O5…. ). Sono molecole polifunzionali che contengono i gruppi funzionali alcolico e aldeidico o chetonico. Sono i primi composti che si formano durante la fotosintesi clorofilliana32 e sono importanti nell’alimentazione in quanto hanno un ruolo fondamentale nella produzione di energia. 31 Riducente: una sostanza che provoca riduzione (processo che comporta acquisto di elettroni) viene detto riducente; al contrario una sostanza che provoca ossidazione (processo che comporta la perdita di elettroni) viene detto ossidante: ossidazione e riduzione avvengono sempre contemporaneamente, perché se un atomo perde elettroni un altro li deve acquistare. 32 Fotosintesi clorofilliana : tutti i vegetali verdi e alcuni batteri hanno la capacità di utilizzare l’energia luminosa per trasformare sostanze inorganiche ( anidride carbonica e acqua) povere di energia in composti organici (glucosio) ricchi di energia; la formula che indica la fotosintesi è: M. Ciani – E. Zuccolo – G. Castellani 38 La nomenclatura IUPAC prevede la desinenza –oso per questi composti: glucoso, fruttoso, riboso, saccaroso; ma la nomenclatura tradizionale è ancora molto usata ( glucosio, fruttosio, ribosio, saccarosio..). I glucidi possono essere divisi in tre gruppi: monosi o monosaccaridi ( glucosio, fruttosio, ribosio,ecc) Glucidi disaccaridi o oligosaccaridi (lattosio, saccarosio, maltosio) poliosi polisaccaridi (amido, cellulosa, glicogeno) 11.1 Monosaccaridi I monosaccaridi sono composti in cui tutti gli atomi di carbonio presentano un gruppo funzionale alcolico –OH tranne uno che si presenta con un gruppo funzionale aldeidico –CHO oppure chetonico –CO: nel primo caso si parlerà di aldosi, nel secondo di chetosi. L’aldoso più semplice, un trioso (3C), è la gliceraldeide, con un gruppo alcolico primario e uno secondario; il chetoso più semplice è il diossiacetone. O C H HO - C*- H CH2OH L –(-) -gliceraldeide CH2OH C=O CH2OH diidrossiacetone Esistono poi composti a 4C (tetrosi), a 5C (pentosi) e 6C (esosi). Nella gliceraldeide è presente un centro asimmetrico (C*), quindi esiste una forma destrogira (+)-gliceraldeide (anche d-) e una forma levogira (-)gliceraldeide ( anche l-). Per convenzione, i composti vengono però indicati anche dalle lettere D o L, facenti riferimento solo alle caratteristiche strutturali, che indicano rispettivamente che: D (maiuscolo) l’ossidrile –OH sullo stereocentro più lontano dal gruppo aldeidico o chetonico si trova a destra della catena carbonica (nella struttura lineare); L (maiuscolo) l’ossidrile –OH sullo stereocentro più lontano dal gruppo aldeidico o chetonico si trova a sinistra della catena carbonica (nella struttura lineare). Tutti i monosaccaridi presentano atomi di carbonio asimmetrici e possono quindi avere stereoisomeri destrogiri e levogiri. 6 CO2 + 6 H2 O + energia luminosa M. Ciani – E. Zuccolo – G. Castellani C6 H12O6 + 6 O2 39 O 1 C O H C H HO C OH C OH 2 HO 3 H 4 H 5 6 CH2OH D-(-)-fruttosio C 2 H C OH C H C OH C OH 3 H H 4 5 6 CH2OH 33 1 CH2OH D-(-)-glucosio34 Analizzando alcune proprietà chimiche dei monosaccaridi si è osservato che esse non possono essere spiegate con la struttura lineare che caratterizza le formule di Fischer (ovvero quelle sopra). Per esempio il D-glucosio: - non dà alcune reazioni tipiche delle aldeidi, di cui possiede il gruppo funzionale; - esiste in due forme isomere ( e ) che differiscono per il valore del potere rotatorio della luce polarizzata. Nel 1884, B.C.G. Tollens propose che gli zuccheri in soluzione assumessero una struttura ciclica ottenendo una reazione tra il gruppo aldeidico in C1 e il C in posizione 4 o 5 ( ponte glicosidico). In questo modo si formano le forme isomere e che vengono dette anomeri. Nella rappresentazione di Haworth sottostante le molecole vengono descritte secondo figure geometriche regolari che per il glucosio sono: CH OH 2 6 O H H 5 H 1 4 OH H OH OH 3 2 OH H –D- glucosio CH2OH O OH H 5 H 4 1 OH H OH 3 2 H H OH 6 -D- glucosio Le due configurazioni isomere del glucosio, e , differiscono per l’orientamento spaziale dei gruppi –OH (ossidrile anomerico) legati al C1 (carbonio anomerico). Le forme e , in soluzione, sono in equilibrio tra loro e con quella lineare. 11.2 Disaccaridi Sono composti formati da due monosaccaridi legati tramite legame glicosidico, in cui l’-OH in posizione 1 di una molecola reagisce con l’-OH in posizione 4 della molecola adiacente con eliminazione di una molecola d’acqua. 33 Il fruttosio è molto abbondante in natura, particolarmente nella frutta e nel miele. Il glucosio è il prodotto della fotosintesi clorofilliana e riveste particolare importanza negli animali poiché è il composto nel quale vengono trasformati tutti gli zuccheri introdotti nell’organismo ed è l’unico circolante nel sangue. 34 M. Ciani – E. Zuccolo – G. Castellani 40 H CH2OH OH H OH H O H H 1 H + OH 4 HO OH -glucosio + CH2OH H OH O H H H OH OH H CH2OH OH H OH H H H O H O OH -glucosio CH2OH O H H OH H H OH maltosio + H2O OH + acqua Il legame glicosidico può venire scisso sotto l’azione di acidi o di enzimi (ad esempio nella digestione), con una reazione di idrolisi, riottenendo i composti iniziali. I vari disaccaridi35 differiscono per la natura dei monosaccaridi costituenti e a seconda degli atomi di carbonio fra cui si viene a stabilire il legame glicosidico. CH2OH O H H OH H OH H OH H O O HOH2C CH2OH H OH OH H H saccarosio ( -glucosio + - fruttosio) CH2OH O H OH H H H H OH HO H O CH2OH O H H OH H OH H OH lattosio ( -galattosio + -glucosio) 11.3 Polisaccaridi Sono composti macromolecolari formati dall’unione di molte unità (>100) di monosaccaridi tramite legame glicosidico. In natura esistono l’amido, la cellulosa, l’inulina, il glicogeno. L’amido è il più importante materiale di riserva per i vegetali (semi) ed è un alimento fondamentale per l’uomo e gli animali (pane, pasta ,riso, patate, ecc). Si forma dalla condensazione di un numero molto elevato di molecole di glucosio ( 1000/3000) che formano catene lineari (amilosio – 10/20%) e ramificate (amilopectina – 80/90%). Esempio di catene di amido Il glicogeno è presente come riserva energetica animale nel fegato e nei muscoli e può essere considerato, negli animali, il corrispondente dell’amilopectina (ma ancora più ramificato). 35 Il saccarosio corrisponde allo zucchero propriamente detto e viene estratto dalla canna da zucchero o dalla barbabietola da zucchero e costituisce la maggior parte dei carboidrati del miele. La miscela 50/50 di glucosio e fruttosio che si forma quando il saccarosio viene idrolizzato è detta “zucchero invertito”. Il lattosio è lo zucchero tipico del latte: nel latte di mucca ne sono presenti 45g/L, nel latte di donna 75g/L. Il maltosio esiste allo stato naturale nell’orzo germogliato (malto) ed è un importante prodotto intermedio nella formazione dei polisaccaridi di accumulo negli organismi viventi: glicogeno (negli animali) e amido (nei vegetali). M. Ciani – E. Zuccolo – G. Castellani 41 Si forma dalla condensazione di un numero molto elevato di molecole di glucosio (da 1700 a 600.000). La cellulosa ha funzione di sostegno nel regno vegetale, dove costituisce la parete cellulare delle cellule. Ha massa molecolare molto elevata ed è formata dalla condensazione di molecole di - glucosio; le sue molecole non sono ramificate e quindi assomigliano a quelle dell’amilosio. Quasi tutte le reazioni dei sistemi viventi richiedono enzimi come catalizzatori, e tutti gli enzimi esistenti in natura sono chirali. Ogni composto che subisce una reazione catalizzata da un enzima è detto substrato dell’enzima. Quando una molecola di substrato si avvicina ad un enzima, se le forme delle due molecole non sono complementari e non si adattano l’una all’altra (come la chiave alla propria serratura specificità dell’enzima), non avviene alcuna reazione. enzima C* sito specifico substrato Ecco perché l’L-glucosio non ha alcuna funzionalità biologica o perché la cellulosa non è digeribile dall’uomo. Gli esseri umani sono privi degli enzimi capaci di catalizzare l’idrolisi dei ponti – della cellulosa e quindi l’enorme riserva di cellulosa presente nelle piante di tutto il pianeta non è di alcuna utilità dal punto di vista nutrizionale. Alcuni ceppi batterici presenti nell’apparato digerente dei bovini e di altri animali sono invece in grado di idrolizzarla, ed è questo il motivo per cui gli erbivori possono cibarsi del fieno e di altri vegetali. 12. ACIDI CARBOSSILICI Gli acidi organici sono caratterizzati dalla presenza in molecola del gruppo C carbossile OH O che compare legato ad un gruppo - R o ad un gruppo – Ar. M. Ciani – E. Zuccolo – G. Castellani 42 COOH H - COOH acido metanoico o acido formico acido carbossilico alifatico acido benzoico acido carbossilico aromatico 12.1 Nomenclatura Le norme IUPAC prevedono per gli acidi carbossilici il nome del corrispondente idrocarburo con desinenza –oico, preceduto dalla parola acido: la numerazione della catena inizia dal – COOH CH3 - COOH H - COOH 36 acido metanoico o acido formico acido etanoico38 o acido acetico CH3 - CH2 - CH2 - COOH CH3 - CH2 - CH2 - CH2 - COOH acido butanoico37 o acido butirrico acido pentanoico o valerianico Nel caso di molecole contenenti altri gruppi funzionali, per identificare la posizione del gruppo si usa ancora indicare gli atomi di carbonio della catena con le lettere greche , , cominciando dal carbonio contiguo al gruppo – COOH. È il caso dell’acido -idrossipropanoico o acido 2–idrossipropanoico o acido lattico OH CH3 - CH - COOH Per gli acidi con due carbossili la desinenza è –dioico, anche se sono ancora in uso i nomi tradizionali (acido ossalico, malonico, succinico,citrico) COOH COOH acido etandioico o acido ossalico HOOC - CH2 - CH2 - COOH acido butandioico o acido succinico 36 L’acido metanoico (acido formico), presente nelle formiche rosse, nelle api, nelle ortiche, nelle foglie degli abeti, nelle processionarie, nel sudore è un liquido di odore pungente, caustico, e viene usato come antisettico, come mordente in tintoria e come concia delle pelli. 37 L’acido butanoico (acido butirrico) è un liquido viscoso, con odore di burro rancido. E’ presente nel burro e nei formaggi, unito al glicerolo. 38 L’acido etanoico (acido acetico) è il più importante tra gli acidi organici, per il suo vasto impiego in pratica. Si ottiene dalla fermentazione ossidativa dell’etanolo (processo di inacidimento spontaneo del vino) ad opera del Mycoderma aceti. .Industrialmente si prepara per ossidazione catalitica dell’etanale, a 60-70 °C, sotto debole pressione. M. Ciani – E. Zuccolo – G. Castellani 43 12.2 Proprietà Proprietà fisiche Gli acidi carbossilici hanno molecola polare e, come tali, i primi quattro termini della serie sono solubili in acqua in qualsiasi proporzione, ciò in conseguenza dei legami a idrogeno che si stabiliscono con il solvente: O ........ H -C H OH ...... O legame a idrogeno con l’aumentare del numero degli atomi di carbonio la solubilità diminuisce rapidamente fino ad annullarsi. Proprietà chimiche Il comportamento chimico è strettamente legato alla struttura del gruppo carbossile che risulta formato da un gruppo carbonile e da un ossidrile. Si possono avere: 1. reazioni di ionizzazione degli acidi organici, considerati acidi deboli; ciò è molto importante nell’organismo poiché gli acidi carbossilici che l’organismo produce normalmente con il metabolismo, devono essere neutralizzati (dallo ione idrossido o dallo ione bicarbonato) per impedire che i liquidi organici (es: sangue) possano subire variazioni di pH incompatibili con la vita. 2. reazioni di sostituzione del gruppo –OH. 13. ANIDRIDI Le anidridi rispondono alla formula generale. O R-C con R = R’ (simmetriche) o con R # R’(asimmetriche o miste) O R'- C O Si possono considerare il prodotto della disidratazione intermolecolare degli acidi O CH3 - C acido etanoico + O CH3 - C OH OH acido etanoico M. Ciani – E. Zuccolo – G. Castellani O O H2 O + CH3 - C - O - C - CH3 acqua anidride etanoica 44 14. ESTERI Gli esteri rispondono alla formula generale R-COOR’ nella quale sono presenti un gruppo alchilico di un acido carbossilico R-C=O e un gruppo –OR’, derivato da un alcol, dove –R è una lunga catena idrocarburica. Gli esteri si preparano mediante la reazione di esterificazione tra un acido carbossilico ed un alcol con eliminazione di una molecola d’acqua. O O + HO - R' R-C OH acido alcool R - C - O - R'+ H2 O estere acqua E’ un fatto interessante che gli esteri di acidi maleodoranti (tutti gli acidi con 3 – 10 atomi di carbonio hanno un odore sgradevole) hanno generalmente un odore gradevole e possono essere utilizzati come aromi naturali artificiali. CH(CH3)2CH2CO2H isobutilformiato (lamponi) CH3CO2(CH2)4CH3 pentilacetato (banane) CH3CH2CH2CO2CH2CH3 etilbutirrato (ananas) 15. TRIGLICERIDI ( olii o grassi) I trigliceridi o triacilgliceroli ( olii o grassi) sono esteri del glicerolo (propantriolo) con acidi ad elevata massa molecolare. R,R’,R’’ derivano da acidi organici alifatici a lunga catena, chiamati acidi grassi superiori. CH2 - O - CO - R CH - O - CO - R' CH2 - O - CO - R" Esistono: a) acidi grassi saturi ( in cui la catena idrocarburica presenta solo legami singoli) Esempi: acido laurico C11H23COOH (nel burro 2-5%) acido palmitico C15 H31COOH (nel burro 25-29%) acido stearico C17H35COOH (nel grasso bovino12-18%) M. Ciani – E. Zuccolo – G. Castellani O CH2 CH CH2 C O CH2 O O O C O CH2 C CH2 i legami singoli nella catena idrocarburica dell’acido grasso consentono l’”impacchettamento” e quindi avremo, a temperatura ambiente, un trigliceride allo stato burro, lardo. solido 45 b) acidi grassi insaturi ( in cui la catena idrocarburica può presentare uno o più doppi legami) Esempi: Acido oleico C17H33COOH (olio di oliva 67-84%) O CH2 O CH acido linoleico C17H31COOH (olio di semi di lino 24-25%) C O CH2 O CH2 C O O CH2 C CH2 acido linolenico C17H29COOH (olio di semi di lino 45-60%) I legami doppi nella catena idrocarburica dell’acido grasso non consentono l’”impacchettamento” e quindi avremo, a temperatura ambiente, un trigliceride allo stato liquido gli olii. La reazione di esterificazione per ottenere un trigliceride è la seguente: H2C - OH HC - OH H2C - OH H2C - O - CO - C15H31 HO - CO - C15H31 + HO - CO - C15H31 3 H2 O + H2C - O - CO - C15H31 HO - CO - C15H31 glicerolo acido palmitico HC - O - CO - C15H31 acqua gliceriltripalmitato (grasso) I trigliceridi o grassi naturali, contenuti nelle sostanze di origine animale o vegetale, sono una preziosa fonte di acidi grassi puri. Infatti i grassi, insolubili in acqua, si lasciano facilmente idrolizzare in ambiente basico (NaOH, KOH) ad alte temperature rigenerando il glicerolo e formando il sale di sodio o di potassio dell’acido grasso superiore ( saponificazione) da cui risultano formati. L’idrolisi dei grassi si può ottenere anche mediante enzimi ed è ciò che accade all’interno del nostro organismo sia durante la digestione (nell’intestino tenue dove abbiamo ambiente basico) sia nelle cellule. Reazione di saponificazione: H2C - O - CO - C15H31 HC - O - CO - C15H31 H2C - OH + 3 NaOH H2C - O - CO - C15H31 gliceriltripalmitato M. Ciani – E. Zuccolo – G. Castellani HC - OH H2C - OH + sodio idrossido glicerolo + O 3 C15H31 - C - + O Na + palmitato di sodio (sapone solido) 46 16. AMMINE Le ammine, in cui l’atomo di azoto conserva il proprio doppietto elettronico (2s2) .. N non impegnato, si possono considerare, dal punto di vista formale, come derivate dall’ammoniaca, NH3, in cui uno o più atomi di idrogeno siano stati sostituiti con altrettanti gruppi alchilici –R o arilici –Ar. Si possono avere tre classi di ammine: Ammina secondaria .. H R-N H .. R-N-H Ammina terziaria R .. R-N-R Ammina primaria R 16.1 Nomenclatura In genere si usa il nome dell’ammina preceduto da quello del gruppo o dei gruppi legati all’atomo di azoto: .. CH3 - N - H CH3 - NH2 CH2 - CH3 metilammina a. primaria etilmetilammina a. secondaria 16.2 Proprietà Proprietà fisiche Come l’ammoniaca, le ammine hanno la molecola polare tanto che, ad eccezione delle ammine terziarie, possono formare dei legami intermolecolari a idrogeno. Anche con l’acqua tutte le ammine possono stabilire legami a H e quindi risultano solubili, in particolare quando la catena carbonica non supera i 5C. Proprietà chimiche Grazie alla tendenza delle ammine a condividere spontaneamente il doppietto elettronico libero sull’atomo di azoto, esse presentano caratteristiche chimiche basiche. M. Ciani – E. Zuccolo – G. Castellani 47 17. AMMIDI Le ammidi, sia alifatiche che aromatiche, sono derivati degli acidi carbossilici nei quali l’ossidrile OH del gruppo funzionale acido viene sostituito dal un gruppo –NH2. R-C O NH2 Le proprietà delle ammidi sono legate al gruppo funzionale –CONH2. La presenza del carbonile rende la molecola fortemente polare e quindi in grado di stabilire legami a H molto forti (buona la solubilità in acqua) che avranno come conseguenza l’innalzamento del punto di ebollizione. Le ammidi presentano un atomo di azoto meno basico delle ammine, poiché l’atomo di ossigeno del carbonile richiama verso di sé il doppietto elettronico dell’azoto rendendolo meno disponibile all’aggancio di eventuali reagenti elettrofili. 17.1 Urea Tra le ammidi particolarmente interessante è l’urea, sia dal punto di vista biologico, in quanto è un prodotto del catabolismo delle proteine, sia dal punto di vista industriale. Viene largamente impiegata come fertilizzante o come materia prima dell’industria farmaceutica e nella produzione delle macromolecole di sintesi (resine ureiche e poliuretaniche). Dal punto di vista chimico è una diammide (ammide doppia) dell’acido carbonico. O=C NH2 NH2 18. AMMINOACIDI Tra i composti organici azotati, gli aminoacidi rivestono particolare importanza biologica in quanto sono i componenti elementari delle proteine che costituiscono le strutture portanti di ogni tessuto vivente e entrano nella composizione degli enzimi, fondamentali catalizzatori biologici. Il loro nome deriva dalla presenza sia del gruppo amminico –NH2 che del gruppo carbossilico –COOH presenti nella loro molecola. Tutti gli amminoacidi naturali sono -amminoacidi ovvero presentano i due gruppi funzionali (amminico e carbossilico) legati allo stesso atomo di C( ). H R - C - NH2 COOH M. Ciani – E. Zuccolo – G. Castellani 48 Differiscono invece per la catena laterale –R responsabile delle proprietà delle proteine. Ad eccezione della glicina, tutti gli amminoacidi naturali presentano un centro asimmetrico e quindi sono otticamente attivi e rispondono alla configurazione relativa L, ma possono essere destrogiri (+) o levogiri (-) per quanto riguarda la luce polarizzata. COOH C* H2N H R L– – amminoacido I vari amminoacidi naturali (20) sono stati classificati in base al gruppo funzionale e ai gruppi costituenti la catena laterale –R: - amminoacidi con catena apolare; - amminoacidi con catena acida; - amminoacidi con catena basica; - amminoacidi contenenti zolfo; - amminoacidi con catena contenente un ossidrile (alcolico o fenolico). 18.1 Peptidi e Polipeptidi I peptidi sono prodotti di condensazione (-H2O) ottenuti dalla reazione tra il gruppo –NH2 di un aminoacido e il gruppo –COOH di un altro. Il legame ammidico – NH – CO – che ne risulta viene indicato come legame peptidico: H H H H O H R-C-N R - C - N - C - CH - NH2 + R - C - NH2 H O R COOH COOH C - H2 O OH Dopo la condensazione restano liberi, alle due estremità molecolari, rispettivamente un gruppo –COOH e un gruppo –NH2 disponibili per le condensazioni successive. Con questo meccanismo si formano i polipeptidi ( proteine). Le catene laterali (R) degli aminoacidi influenzano la struttura e le proprietà delle proteine. Quando una lunga catena polipeptidica si ripiega per assumere la forma caratteristica della proteina, i gruppi idrofobi (delle catene laterali) tendono ad avvicinarsi il più possibile l’uno all’altro per “evitare” le molecole d’acqua; viceversa, aminoacidi che contengono gruppi idrofili sono in grado di formare legami a H con l’acqua e si dispongono all’esterno. La conformazione che le catene assumono grazie a questi legami è fondamentale per garantire la funzionalità delle proteine e la loro struttura. M. Ciani – E. Zuccolo – G. Castellani 49 Struttura primaria Sequenza lineare (catena) di aminoacidi uniti da legami peptidici HOOC - CH - NH - CO - CH - NH - CO - CH - NH - CO -CH -NH2 R R' ' ' R' R' ' Struttura secondaria La catena può avvolgersi in forma di -elica e/o lamina grazie a legami a H tra il gruppo CO di un amminoacido e il gruppo NH di amminoacidi vicini ( -elica) o di catene parallele ( -lamina). –elica Struttura terziaria -lamina o foglietto pieghettato Costituita dal polipeptide (in struttura secondaria) che ha subito flessioni, torsioni e piegature grazie a legami intermolecolari tra le catene laterali di aminoacidi anche molto distanti tra loro. Nella figura a fianco è rappresentata dalle singole catene e (in questo caso e non hanno nessun legame con la struttura secondaria). Struttura quaternaria E’ data dalla associazione tra più unità polipeptidiche in struttura terziaria. Quando, per qualche motivo (variazione di pH, di temperatura), la proteina perde la sua conformazione “nativa”, anche se conserva la sua costituzione molecolare originaria, prende il nome di proteina denaturata e perde anche la propria attività biologica. Ciò può avvenire in modo reversibile o anche irreversibile (es. l’albumina dell’uovo nell’uovo sodo). M. Ciani – E. Zuccolo – G. Castellani 50 INDICE 1. CARBONIO 1.1 il carbonio nella tavola periodica 1.2 teoria dell’ibridazione 1.3 il carbonio in natura 2. GLI IDROCARBURI 2.1 Classificazione 3. ALCANI 3.1 Cicloalcani 3.2 Nomenclatura degli alcani 3.3 Gruppi alchilici 3.4 Reattività degli alcani 3.4.1 Reazioni di combustioni 3.4.2 Reazioni di sostituzione ISOMERIA A. Isomeria di struttura A.1 Isomeria di catena A.2 Isomeria di posizione A.3 Isomeria di gruppo funzionale B. Stereoisomeria B.1 Isomeria geometrica B.2 Isomeria ottica 4. ALCHENI 4.1 Nomenclatura 4.2 Reattività degli alcheni e degli alchini 4.3 Reattività degli alcheni 5. ALCHINI 5.1 Nomenclatura 5.2 Reattività degli alchini 6. IDROCARBURI AROMATICI Approfondimento Le reazioni della chimica organica 7. GRUPPI FUNZIONALI 8. ALCOLI 8.1 Proprietà 9. ETERI 10. ALDEIDI E CHETONI 10.1 Nomenclatura 10.2 Proprietà di aldeidi e chetoni 11. GLUCIDI 11.1 Monosaccaridi 11.2 Disaccaridi 11.3 Polisaccaridi 12. ACIDI CARBOSSILICI 12.1 Nomenclatura 12.2 Proprietà 13. ANIDRIDI 14. ESTERI 15. TRIGLICERIDI 16. AMMINE 16.1 Nomenclatura 16.2 Proprietà 17. AMMIDI 17.1 Urea 18. AMMINOACIDI 18.1 Peptidi e polipeptidi M. Ciani – E. Zuccolo – G. Castellani pagina 1 2 5 7 8 10 11 11 16 16 16 14 15 21 33 21 21 34 17 18 22 23 26 26 27 27 30 30 31 32 34 36 36 37 38 38 40 40 42 42 43 43 44 44 46 46 47 47 47 48 48 51 Un particolare ringraziamento al professor Paolo Strazzolini, docente di Chimica Organica della Facoltà di Agraria dell’Università di Udine, per la fattiva collaborazione fornita al progetto. Bibliografia - CHIMICA – Progetto modulare – A. Post Baracchi A. Tagliabue - Lattes Editore ALLA SCOPERTA DELLA CHIMICA – Passananti Sbriziolo Tramontana Editore ELEMENTI DI CHIMICA GENERALE, ORGANICA E BIOLOGICA – John R. Holum – Zanichelli Editore LA MATERIA IN FORMULE – Antonio F. Gimigliano – Giunti Scuola Editore FONDAMENTI DI CHIMICA – Morris Hein Susan Arena – Zanichelli Editore CHIMICA Scienza sperimentale – Daniela Bovi Giancarlo Favero - Etas Libri LE IDEE DELLA CHIMICA – F. Bagatti , M. Braghiroli, E. Corradi, A. Desco, C. Ropa – Zanichelli Editore MODULI DI CHIMICA – Paolo Pistarà – Atlas Editore. Sitologia • • • it.wikipedia.org/wiki/Chimica_organica www.chimicamente.it/ t.encarta.msn.com/encyclopedia_761555199/Chimica_organica.html M. Ciani – E. Zuccolo – G. Castellani 52
Scarica