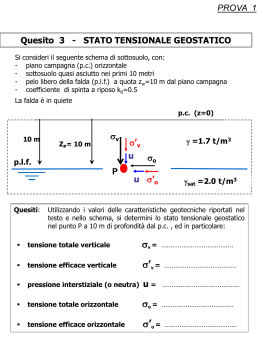
Tensione Superficiale
A) Alcuni valori della Tensione Superficiale di Liquidi
Molti valori della tensione superficiale di liquidi sono riportati sul Perry, capitolo 2, 7a
edizione e su altri testi (Gallant, ecc. ecc.)
B) Metodi di Predizione per Liquidi puri
1) Correlazione di Macleod-Sugden
σ = {[P](dL-dV)/PM}4
σ = Tensione superficiale dyne/cm
[P] = Parametro (Paracoro) indipendente dalla temperatura (vedere Tabella 1)
dL = Densità del Liquido Kg/dm3
dV = Densità del Vapore Kg/dm3 (può essere trascurata dato che normalmente è << di dL)
PM = Peso molecolare del liquido Kg/Kmole
Tabella 1 Contributi Atomici e di Gruppo per il calcolo del Paracoro [P]
Gruppi Atomici
Carbonio-Idrogeno
[P]
C
H
CH3(-CH2-)n n = 1-12
(-CH2-)n n > 12
CH3-CH(CH3)CH3-CH2-CH(CH3)CH3-CH2-CH2-CH(CH3)CH3-CH(CH3)-CH2CH3-CH2-CH(C2H5)CH3-C(CH3)2-
9,0
15,5
55,5
40,0*n
40,3*n
133,3
171,9
211,7
173,3
209,5
170,4
CH3-CH2-C(CH3)2CH3-CH(CH3)-CH(CH3)CH3-CH(CH3)-C(CH3)2C6H5
Gruppi Speciali
H in OH
H in HN
O
-OH
O2 in acidi od esteri
-COO-COOH
N
-NH2
S
P
-CO(NH2)
Si
Si (silani)
Al
207,5
207,9
243,5
189,6
10,0
12,5
20,0
29,8
54,8
63,8
73,8
17,5
42,5
49,1
40,5
91,7
30,3
43,3
55,0
Gruppi Atomici
[P]
Continua Gruppi Speciali
B
13,2
Al
34,9
F
26,1
Cl
55,2
Br
68,0
I
90,3
NO2
74
NO3 (nitrati)
93
Legami Etilenici
Terminale
19,1
Posizione 1,2
Non
indicato
Posizione 2,3
17,7
Posizione 3,4
16,3
Legami Acetilenici
Triplo Legame
40,6
Chiusura Anelli
3 Membri
12,5
4 Membri
6,0
5 Membri
3,0
6 Membri
0,8
7 Membri
4,0
=O (Chetoni)
3 Atomi di Carbonio
22,3
4 Atomi di Carbonio
20,0
5 Atomi di Carbonio
18,5
6 Atomi di Carbonio
17,3
7 Atomi di Carbonio
17,3
8 Atomi di Carbonio
15,1
9 Atomi di Carbonio
14,1
10 Atomi di Carbonio
13,0
11 Atomi di Carbonio
12,6
-
σ
σ
σ
σ
σ
σ
σ
σ
σ
σ
σ
σ
σ
esempio Acqua a 50°C [P] = [2*H + 1*O]
= {[P](dL)/PM}4 ={[2*15,5+20]*0,988/18}4 = 61,4 dyne/cm (68,2 Landolt-Bornstein)
esempio Acqua a 100°C
= {[P](dL)/PM}4 ={[2*15,5+20]*0,960/18}4 = 54,7 dyne/cm (60,6 Landolt-Bornstein)
esempio Ammoniaca a 50°C [P] = [1*-NH2 + 1*H]
= {[P](dL)/PM}4 ={[42.5+15,5]*0,563/17}4 = 13,6 dyne/cm (15 Int.Crit.Tables)
esempio Ammoniaca a -50°C
= {[P](dL)/PM}4 ={[42,5+3*15,5]*0,7/17}4 = 32,5 dyne/cm (37,5 Int.Crit.Tables)
esempio Benzene a 50°C [P] = [1*C6H5 + 1*H]
= {[P](dL)/PM}4 ={[189,6+15,5]*0,835/78,11}4 = 23,1 dyne/cm (25,6 Gallant)
esempio acido Isobutirrico a 0°C [P] = [1*CH3-CH(H3)- + 1*-COOH]
= {[P](dL)/PM}4 ={[133,3+73,8]*0,938/87,12}4 = 24,7 dyne/cm (25 Perry)
esempio Metanolo a 50°C [P] = [1*CH3- + 1*OH-]
= {[P](dL)/PM}4 ={[55,5+29,8]*0,765/32}4 = 17,3 dyne/cm (20 Gallant)
esempio Butanolo a 50°C [P] = [1*CH3- + 2*-CH2- + 1*OH-]
= {[P](dL)/PM}4 ={[55,5+3*40+29,8]*0,775/74,12}4 = 21,23 dyne/cm (21,6 Gallant)
esempio Cumene a 50°C [P] = [1*C6H5 + 1*C + 1*H + 1*-CH2- + 1*CH3-]
= {[P](dL)/PM}4 ={[189,6+9+15,5+40+55,5]*0,84/120,2}4 = 21,9 dyne/cm (25,6 Gallant)
esempio TrimetilAmmina a 50°C [P] = [1*N + 3*CH3]
= {[P](dL)/PM}4 ={[17,5+3*55,5]*0,59/59,11}4 = 11,38 dyne/cm (10,7 Gallant)
esempio Cloruro di Vinile a 50°C [P]= [2*C+ 3*H+ 1*Cl+ 1 legame etilenico]
= {[P](dL)/PM}4 ={[2*9+3*15,5+55,2+17,7]*0,86/62,5}4 = 12,78 dyne/cm (12 Gallant)
esempio PerCloroEtilene a 50°C [P] = [2*C + 4*Cl+ 1 legame etilenico]
= {[P](dL)/PM}4 ={[2*9+4*55,2+17,7]*1,56/165,8}4 = 33,9 dyne/cm (28 Gallant)
esempio BromoBenzene a 50°C [P] = [1*C6H5 1*Br]
= {[P](dL)/PM}4 ={[189,6+68]*1,45/157}4 = 32 dyne/cm (32,8 Gallant)
2) Variazione della tensione superficiale con la temperatura
La variazione della tensione superficiale con la temperatura può essere ricavata
direttamente con il Metodo di Macleod-Sugden precedentemente riportato, σ = {[P](dLdV)/PM}4,da cui si ricava che la tensione superficale σ2 a T2 può essere ricavata dalla
tensione superficiale σ1 T1 mediante la formula
σ2 = σ1*[(dL2-dv2)/(dL1-dv1)]4
conoscendo un valore σ1 alla temperatura T1 σ2 alla temperatura T2 può essere anche così
calcolato:
σ2 = σ1*[(1-Tr2)/(1-Tr1)]1,12 dove:
Tr1;Tr2 sono i valori di temperatura ridotta T/Tc (Tc = Temperatura Critica)
3) Variazione della tensione superficiale con la pressione
Presso alcune società di ingegneria viene utilizzata la formula
σp = σ1*(1-KP/200)
σp
σ1
K
P
=
=
=
=
Tensione superficiale alla pressione P
Tensione superficiale a P 1 Atmosfera
Vedi Tabella
Pressione del sistema in Atm
Tabella 2
Componente
Fase Gassosa
K
He
0,0
H2
0,093
N2
0,25
CH4
0,535
C2H6
1,5
CO2
1,9
Altri
2
C) Miscele di liquidi solubili
1) Soluzioni non acquose
σi}
σm = Σi=1/n{Xiσ
ΣXiPMi)}4
σm = Σi=1/n{[Pi](XidLm-YidVm)/(Σ
[Pi] = Parametro (Paracoro) indipendente dalla temperatura (vedere Tabella1)
dLm = Densità media Liquido Kg/dm3
dVm = Densità media Vapore Kg/dm3 (può essere trascurata dato che normalmente è << di dLm)
PMi = Peso molecolare del componente i del liquido Kg/Kmole
Xi = Frazione molare del componente i in fase liquida
Yi = Frazione molare del componente i in fase Vapore
2) Soluzioni acquose di composti organici
La valutazione della tensione superficiale di soluzione acquose di prodotti organici è di
difficile valutazione e le formule riportate nella letteratura sono di difficile uso nel
campo dell’ingegneria.
Di seguito si riporta un metodo spesso usato in alcune società di ingegneria di più semplice
applicazione, tenendo conto del fatto che l’utilizzo della tensione superficiale è limitato
quasi esclusivamente al calcolo della velocità di flooding delle colonne di distillazione
e/o di assorbimento in cui tra l’altro l’influenza della stessa è relativamente modesta.
Il valore della tensione superficiale in questi casi viene così ricavato:
- Sono noti il valore di tensione superficiale dell’acqua (Fig.1) e della fase organica
(dalla letteratura o dal metodo di cui al punto B.1)
- Riportare i due suddetti valori sul diagramma di Fig.2 e quindi congiungerli con una
retta.
- Ricavare il valore della tensione superficiale della miscela leggendolo sull’ordinata,
sulla intersezione con la retta di cui al precedente punto, in corrispondenza della
verticale tracciata in corrispondenza della concentrazione di composto organico riportato
sull’ascissa.
D) Miscele di liquidi immiscibili
Ogni strato mantiene il proprio valore.
E) Miscele liquidi solubili con solidi solubili
Per elettroliti mantenere il valore della tensione superficiale dell’acqua.
F) Dispersioni di solidi insolubili in liquidi
Nel caso di dispersioni di solidi insolubili ignorare la presenza del solido.
BIBLIOGRAFIA
Perry. Chemical Engineers’ Handbook
Gallant. Physical properties of Hydrocarbons
Reid, Prausnitz, Sherwood. The Properties of Gases and Liquids
Tredici. Impianti Chimici I
Scaricare