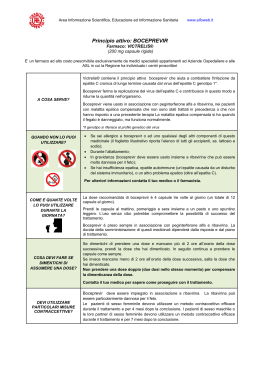
Nuovi farmaci HCV: telaprevir e boceprevir Dai 130 ai 210 milioni d’individui nel mondo sono affetti da infezione cronica da virus dell’Epatite C. Nell’Europa occidentale, la prevalenza è stimata nel 0,4-3% ed è più alta nell’est Europa e nel Medio Oriente, sebbene non esattamente quantificabile. L’Egitto è il paese al mondo con più alta prevalenza: 9% nelle aree urbane, fino a raggiungere il 50% in alcune aree rurali. In Italia, si stima che il numero di soggetti con infezione da virus dell’Epatite C cronicamente viremici superi il milione e mezzo (3% della popolazione), ma il numero preciso di persone infettate da HCV è difficile da calcolare: esiste un enorme sommerso, derivato dalla latenza clinica del virus, che impedisce una diagnosi in tempo utile, a meno che essa avvenga quasi per caso (donazioni di sangue, interventi chirurgici, screening per la prevenzione delle malattie). Mancano dati certi, ma sembra che il contagio abbia un netto gradiente Nord-Sud, visto che si stima che al Sud, in alcune Regioni, la prevalenza di HCV rasenta il 6-7% dell’intera popolazione (1). L’HCV comprende almeno sette genotipi che si distinguono per distribuzione geografica, trasmissione e progressione della malattia (2). Nei principali paesi europei la prevalenza del genotipo 1 varia dal 44% al 65% (3). Obiettivo della terapia antivirale è l’ottenimento di una risposta virologica sostenuta (SVR), definita come assenza di HCV-RNA nel siero per 4 settimane dopo la cessazione del trattamento (4). L’opzione terapeutica ottimale era, fino ad oggi, rappresentata dall’interferone pegilato (Peg-IFN) alfa e dalla ribavirina a cui ora è possibile associare agenti antivirali che agiscono direttamente sul virus: boceprevir o telaprevir. Entrambi sono inibitori non strutturali della serino-proteasi (NS3/4) del virus dell’epatite C. La terapia con telaprevir prevede la somministrazione del farmaco sperimentale durante le prime 12 settimane di trattamento, per poi completare il ciclo terapeutico con 12 o 36 settimane di duplice terapia con interferone pegilato e ribavirina a seconda dei tempi di negativizzazione dell’HCV RNA. In particolar modo i pazienti che risultano HCV RNA negativi sia alla quarta che alla dodicesima settimana di trattamento antivirale possono effettuare una terapia della durata complessiva di 24 settimane. Se la negativizzazione di HCV-RNA è invece meno veloce, oppure il paziente ha fallito un precedente ciclo terapeutico o è affetto da cirrosi epatica, sono necessarie 48 settimane di terapia complessiva. La terapia con boceprevir inizia dopo 4 settimane di duplice terapia con PEG-IFN e ribavirina (fase di lead-in) e prosegue poi con la triplice combinazione. La durata della somministrazione dei tre farmaci è guidata ancora una volta dal tempo di negativizzazione dell’HCV RNA, e varia da 28 a 36 o 48 settimane a seconda dei livelli di HCV RNA ottenuti dopo 8 e 24 settimane di trattamento. La fase di lead-in è una strategia terapeutica molto interessante che permette di individuare una categoria di pazienti con grande sensibilità alla terapia convenzionale che, raggiungendo la negativizzazione già alla quarta settimana - la cosiddetta risposta virologica rapida (RVR) - non hanno bisogno del terzo farmaco. E’ importante sottolineare che nei pazienti con un precedente fallimento terapeutico che hanno presentato una riduzione dei livelli di HCVRNA inferiore ad un logaritmo nei primi tre mesi del precedente ciclo terapeutico (null responder) non ottengono un grande beneficio dal ritrattamento con telaprevir e boceprevir, dal momento che le percentuali di guarigione sono del 30% circa. Inoltre in presenza di cirrosi epatica la probabilità di guarigione si riduce ulteriormente fino al 15% circa. In questa tipologia di pazienti risulta inoltre elevato il rischio di sviluppare resistenze, dal momento che la scarsa responsività alla terapia interferonica trasforma la triplice terapia in una monoterapia funzionale con il solo farmaco antivirale e che questi farmaci di prima generazione hanno una barriera genetica non elevata. Attualmente i potenziali candidati per la triplice terapia con boceprevir o telaprevir in associazione con interferone e ribavirina, sono i pazienti adulti con epatite cronica C, genotipo 1 con epatopatia compensata (cirrosi compensata): che siano naive al trattamento; che siano stati trattati in precedenza con interferone alfa in monoterapia o in associazione a ribavirina, compresi pazienti recidivanti, partial responder e null responder. Considerate le gravi conseguenze che possono insorgere in seguito al fallimento del trattamento in pazienti con infezione cronica da virus dell'epatite C (HCV), ottimizzare l'efficacia del trattamento e la sicurezza è essenziale sia per prevenire lo sviluppo di morbidità che per aumentare tassi di sopravvivenza (5-7). La gestione degli eventi avversi (ADR) durante il trattamento antivirale svolge un ruolo importante nel migliorare l'aderenza alla terapia e l’interruzione precoce del trattamento Inoltre, le interazioni fra i diversi farmaci nel regime terapeutico possono influenzare la efficacia e / o la sicurezza della terapia e devono essere gestiti in modo appropriato per ogni paziente. Mentre le interazioni farmaco-farmaco e le ADR sono generalmente conosciute per la terapia standard con peg-interferone (PEG-IFN) / ribavirina (RBV (8-10), l'aggiunta di agenti antivirali ad azione diretta (DAAS) comporterà una maggiore attenzione nella gestione del paziente. Gli effetti collaterali più comuni riportati includono prurito, rash, anemia e disturbi dell’apparato gastrointestinale (fastidio anorettale, prurito anale, emorroidi, nausea e diarrea); i quali, se ben gestiti, possono evitare l’interruzione del trattamento (11-13). REAZIONI AVVERSE DERMATOLOGICHE: l’eruzione cutanea è un effetto collaterale ben descritto nei pazienti trattati con Peg-INF alfa e ribavirina, ma la frequenza e la gravità dell’eruzione sono risultati maggiori nei pazienti trattati con la triplice terapia (14). Negli studi clinici oltre il 90% delle eruzioni cutanee è stato di gravità lieve o moderata, e solo il 5,8% dei pazienti trattati con telaprevir ha interrotto il trattamento a causa di questi effetti. Reazioni dermatologiche con PEG-IFN/RBV sono ben conosciute e tendono ad essere di tipo uniforme: prurito generalizzato e xerosi cutanea, con lesioni di tipo eczematose e da papule eritematose, microvescicole, prevalentemente localizzate alle estremità e su siti cutanei del tronco maggiormente esposto alla frizione (15). Queste eruzioni possono essere gestite utilizzando lo stesso approccio per l'eczema cronico (corticosteroidi topici, a poco a poco sostituito da emollienti), e di solito non c'è bisogno di interrompere il trattamento antivirale (16). La triplice terapia con DAA comporta disturbi di natura dermatologica più frequenti e più gravi, istologicamente si presenta come dermatite spongiforme con infiltrazione perivascolare a prevalenza eosinofila. ANEMIA: nei pazienti trattati con Peg-INF alfa e ribavirina, l’anemia è un effetto collaterale abbastanza frequente che però aumenta ulteriormente in seguito alla somministrazione di telaprevir o boceprevir. Per la gestione dell’anemia sono state adottate riduzioni del dosaggio di ribavirina. I farmaci stimolanti l’eritropoiesi sono stati vietati negli studi clinici di fase 2 e 3 e utilizzati solo nell1% dei pazienti. Il meccanismo è legato alla soppressione dei reticolociti, almeno fino all’ottava settimana di trattamento, successivamente a questo periodo l’inadeguato indice di produzione reticolocitaria sembra indicare che esista un ulteriore effetto sull’eritropoiesi (14). DISTURBI ANORETTALI: altri disturbi frequentemente associati all’uso di telaprevir e boceprevir risultano essere emorroidi, disturbo anorettale, prurito anale e bruciore rettale. In questo caso viene suggerito l’uso di topici ad azione locale, antistaminici sistemici (14). INTERAZIONI FARMACOLOGICHE: le interazioni con farmaci somministrati in concomitanza ai nuovi antivirali possono indurre lo sviluppo di resistenza da parte del virus (17) . I meccanismi di interazione farmaco-farmaco riguardano l’assorbimento, il metabolismo gastrointestinale o il trasporto, e il metabolismo epatico o di trasporto. Per esempio, enzimi epatici come il citocromo P450 (CYP) 3A e trasportatori come P-glicoproteina (P-gp) possono influire sulle concentrazioni plasmatiche del farmaco. E’ controindicata la somministrazione di telaprevir e boceprevir contemporaneamente a farmaci altamente dipendenti dal CYP 3A (TVR) o CYP 3A4 / 5 (BOC), associazioni che potrebbero portare a gravi effetti collaterali e mettere in pericolo la vita del paziente. In sintesi telaprevir e boceprevir sono controindicati in associazione con: antagonisti alfa1, antiaritmici, anticonvulsivamti, antimicobatterici, antipsicotici, benzodiazepine, farmaci che stimolano la motilità intestinale, derivati dell’ergot, prodotti fitoterapici, statine, inibitori delle tirosinchinasi. Maggiori informazioni sulle interazioni farmaco-farmaco, può essere consultata la tabella allegata (Allegato 1) www.hep-druginteractions.org. Un ultima precisazione va fatta sulle norme di farmacovigilanza che riguardano questi farmaci. Entrambi i principi attivi sono inseriti nel Registro AIFA dei farmaci sottoposti a monitoraggio intensivo. Con lettera del 4 Dicembre 2012, l’Agenzia Italiana del Farmaco ha invitato gli Assessorati regionali a comunicare urgentemente alla stessa AIFA l’elenco degli Ospedali autorizzati alla prescrizione dei nuovi farmaci. Contestualmente alla lista dei centri, dovranno essere comunicati anche i nomi degli specialisti autorizzati dall’ospedale a prescrivere i nuovi farmaci. Una volta inviato l’elenco, ogni singolo medico si deve “accreditare” attraverso il portale AIFA come medico prescrittore, tramite apposite istruzioni (Allegato 2). L’AIFA effettua una verifica con quanto comunicato dalla Regione e, se tutto corrisponde, invia al medico un manuale di istruzioni per la prescrizione di telaprevir e boceprevir. Da quel momento, il medico è in grado di prescrivere i nuovi farmaci ad azione antivirale diretta e la segnalazione delle eventuali ADR spetta al centro prescrittore. BIBLIOGRAFIA 1. www.quotidianosanità.it 2. Sharma SD. Hepatitis C virus: molecular biology and current therapheutic options. Indian J Med Res 2010; 131: 17-34. 3. Deuffic-Burban S, et al. Predicted effects of treatment for HCV infection vary among European countries. Gastroenterology 2012; 143: 974-985. 4. Ghany MG, et al. Diagnosis, management, and treatment of hepatitis C: an update. Hepatology 2009; 49: 1335-1374. 5. Shepard CW, Finelli L, Alter MJ. Global epidemiology of hepatitis C virus infections. Lancet Infect Dis 2005; 5:558–67. 6. Poynard T, Mchutchison J, Manns M, et al. Impact of peylated interferon alfa-2b and ribavirin on liver fibrosis in patients with chronic hepatitis C. Gastroenterology 2002; 122: 1303–13. 7. Shiratori Y, Ito Y, Yokosuka O, et al. Antiviral therapy for cirrhotic hepatitis C: association with reduced hepatocellular carcinoma development and improved survival. Ann Intern Med 2005; 142: 105–14. 8. Fried MW, Shiffman ML, Reddy KR, et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med 2002; 347: 975–82. 9. McHutchison JG, Lawitz EJ, Shiffman ML, et al. Peginterferon alfa-2b or alfa-2a with ribavirin for treatment of hepatitis C infection. N Engl J Med 2009; 361: 580–93. 10. EASL clinical practice guidelines: management of hepatitis C virus infection. J Hepatol 2011; 55: 245–64. 11. Jacobson IM, McHutchison JG, Dusheiko G, et al. Telaprevir for previously untreated chronic hepatitis c virus infection. N Engl J Med 2011; 364: 2405–16. 12. Zeuzem S, Andreone P, Pol S, et al. Telaprevir for retreatment of HCV infection. N Engl J Med 2011; 364: 2417–28. 13. Telaprevir EU Summary of Product Characteristics. Available at http://www.ema.europa.eu 14. FDA Advisory Committee. Telaprevir 375-mg film-coated tablet for the treatment of genotype 1 chronic hepatitis C. Briefing document, NDA 201-917. 2011; 1-147. 15. Lu¨bbe J, Kerl K, Negro F, et al. Clinical and immunological features of hepatitis C treatment-associated dermatitis in 36 prospective cases. Br J Dermatol 2005; 153: 1088–90. 16. Lu¨bbe J. Dermatological side effects. Hot Topics Viral Hep 2008; 9: 29–35. 17. Seden K, Back D, Khoo S. Antiretroviral drug interactions: often unrecognized, frequently unavoidable, sometimes unmanageable. J Antimicrob Chemother 2009; 64: 5–8.
Scaricare