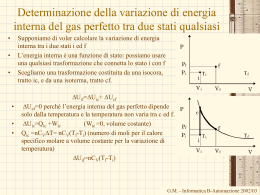
Liceo Scientifico “Gaspare Aselli” A.S. 2006/2007 Classe IV E Gruppo 1: Cortellini Livio, Denti Marco, Forcella Barbara, Mondini Mikela IL 1° PRINCIPIO DELLA TERMODINAMICA E SUE APPLICAZIONI Il Primo principio della termodinamica • Enunciato e sua spiegazione • Esperimento di Joule Applicazioni: le trasformazioni termodinamiche • Trasformazione isocora • Trasformazione isobara • Trasformazione isoterma • Trasformazione adiabatica Bibliografia e sitografia IL PRIMO PRINCIPIO DELLA TERMODINAMICA L’energia acquistata dal sistema (ovvero quella interna acquistata dal gas e quella gravitazionale acquistata dal corpo e dallo stantuffo) coincide con quella fornita al gas ∆Et=∆U+∆Eg dove: • ∆Et è l’energia termica fornita al gas • ∆U è l’energia interna acquistata dal gas • ∆Eg è l’energia gravitazionale acquistata dal corpo e dallo stantuffo In breve: al sistema viene fornita una quantità di calore Q e viene emesso un determinato lavoro L. ∆U Q=L+(U2-U1)=L+∆U Q ed L sono quantità positive se rappresentano rispettivamente il calore fornito al sistema e il lavoro prodotto. Se invece al sistema viene fornito lavoro e sviluppa calore, l’equazione non cambia, ma Q ed L assumono valore negativo. Q=L+∆U traduce il primo principio della termodinamica. Esperimento di Joule • permette di stabilire l'equivalenza fra lavoro e calore in termini fisici; • permette di stabilire l'equivalenza fra lavoro e calore in termini di unità di misura. MA SOPRATTUTTO… • consente di mostrare che calore e lavoro hanno un’unica anima: il movimento. Dispositivo sperimentale • Viene fatta cadere la massa mettendo così in moto il sistema di pale; • L’acqua si riscalda • Si potrebbe ottenere lo stesso effetto prodotto dal lavoro fornendo calore TRASFORMAZIONE ISOCORA il volume del gas non varia •Il gas non può espandersi, allora non può compiere alcun lavoro L contro l'esterno; •Il calore Q fornito viene utilizzato per aumentare l'energia interna ∆U e per aumentare di ∆T la temperatura del gas. Q=L+∆U=0+∆U=∆U Q=Cm∆T Q=∆U=CVm∆T dove CV indica il calore specifico associato ad un riscaldamento che avviene a volume costante. Se non utilizziamo il calore specifico riferito all’unità di massa del gas, ma quello riferito all’unità di mole del gas (calore specifico molare a volume costante) la formula diventa: ∆U=CmVn∆T Con CmV che indica il calore specifico molare a volume costante e n il numero di moli del gas. Nel piano PV l’isocora è rappresentata da una retta verticale. TRASFORMAZIONE ISOBARA La pressione del gas non varia •Inizialmente la pressione P è identica a quella dell'ambiente esterno •Il sistema riceve calore in modo che la sua pressione rimanga invariata. Q= CmPn∆T La formula del calore fornito è Poiché il rifornimento di calore tende ad aumentare la temperatura del gas la trasformazione sarà accompagnata da una variazione di volume ∆V. Quindi il lavoro prodotto è L=PΔV L=PΔV=nR∆T L’aumento dell’energia interna è ∆U=CmVn∆T CmPn∆T= nR∆T+ CmVn∆T Dalla quale si ha la relazione di Mayer CmP=R+CmV Nel piano PV l’isobara è rappresentata da una retta orizzontale. TRASFORMAZIONE ISOTERMA La temperatura del gas non varia • Poiché la temperatura resta costante (∆T=0), dall’associazione energia interna-temperatura, si ha ∆U=0 • Si avrà una espansione del volume del gas con diminuzione della pressione. Il lavoro si calcolerà L = n R T ln (V2 / V1) nella quale n= numero di moli di cui è costituito il gas; T= temperatura assoluta in corrispondenza della quale avviene l’isoterma; V1= volume iniziale del gas; V2= volume finale del gas. Poiché ∆U=0, Q=L Q= n R T ln (V2 / V1) Nel piano PV l’isoterma è rappresentata da un’iperbole equilatera. TRASFORMAZIONE ADIABATICA non avvengono scambi di calore con l'ambiente esterno • Togliendo uno dopo l’altro i pesi il gas si espande; • Il volume del gas aumenta e la sua pressione diminuisce PVγ = costante in cui: C mP C mV γ risulta sempre >1 in base alla relazione di Mayer dove CmP > CmV Per calcolare il lavoro dovuto ad un aumento di volume, essendo Q=0, si ha: L = -∆U ∆U=CmVn∆T L = - CmVn∆T Nel piano PV l’adiabatica è rappresentata da una curva simile all’isoterma, ma più verticale . BIBLIOGRAFIA • U. Amaldi, “L’Amaldi -introduzione alla fisica-”, Zanichelli, Bologna, 2004 • Alpha Test “ Teoritest 6 -TestUniversitari, teoria ed esercizi per le prove d’ammissione-”, Alpha Test, Milano, 2005 • M.E. Bergamaschini, P. Marazzini, L. Magazzini, “L’indagine nel mondo fisico”, Carlo Signorelli Editore, Milano, 2006 SITOGRAFIA • http://www.uniss.it/istituti/matfis/bottigli/public_html/LEZIONI%20SV OLTE/08_20-03-06_Biol.pdf • http://web.tiscali.it/vanni_38/gener20.htm • http://www.mondovi.polito.it/docenti/tresso/lesson9.ppt • http://www.ips.it/scuola/concorso_99/termodinamica/Testi/applicazio ni_del_primo_principio.htm Il gruppo 1 è stato lieto di offrirVi: Il primo principio della Testi e layout: Forcella Barbara & Mondini Mikela termodinamica e sue Animazioni ed effetti speciali: Cortellini Livio & Denti applicazioni Marco FINE
Scarica