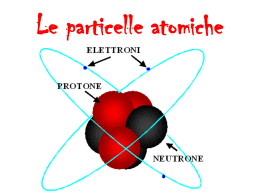
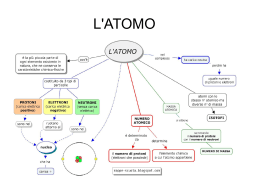
LA STRUTTURA DELL’ATOMO L’atomo è formato da una parte centrale, detta nucleo, con elettroni orbitanti. Il nucleo è composto da protoni e neutroni (particelle subatomiche). I NUCLEONI (protoni e neutroni) sono costituiti da particelle fondamentali : i quark Solo i quark di prima generazione (up e down) esistono spontaneamente in natura. I quark up e down si combinano tra loro in gruppi di tre quark per protone e neutrone. Il protone è formato da due quark up e un down con carica totale di +1. Un neutrone, invece, è formato da due quark down e un quark up, che danno carica totale pari a zero. ELETTRONI Carica negativa Orbitale NUCLEO Nessuna carica Carica positiva NEUTRONI PROTONI Up quark Carica + ⅔ Down quark Carica (- ⅓ - ⅓ + ⅔) = 0 Carica - ⅓ Carica (+ ⅔ + ⅔ - ⅓ ) = 1 LA STRUTTURA DELL’ATOMO Numero atomico Il numero atomico Z indica il numero di protoni (p+) presenti nel nucleo. Numero di massa Il numero di massa A corrisponde invece alla somma tra protoni e neutroni presenti nel nucleo protoni e neutroni sono indicati complessivamente con il termine di nucleoni). Il numero di neutroni N si calcola applicando la seguente formula: N=A–Z Le proprietà chimiche di un elemento dipendono solo dal numero dei protoni. Aumentare il numero dei neutroni di un nucleo, non cambia in alcun modo le proprietà chimiche del rispettivo atomo. Carica positiva Nessuna carica PROTONI NUCLEO NEUTRONI Quark Quark ELETTRONI Carica negativa NUMERO ATOMICO SIMBOLO CHIMICO O 8 Numero dei protoni Ossigeno NOME ELEMENTO 16 MASSA ATOMICA Numero dei protoni e dei neutroni NUMERO PROTONI = NUMERO ELETTRONI NUMERO PROTONI = NUMERO ELETTRONI MASSA ATOMICA NUMERO ATOMICO Trovare una bilancia in grado di pesare un atomo è impensabile perché i valori son molto piccoli perciò si usa la massa relativa, cioè masse atomiche che sono rapportate ad una grandezza di riferimento. L’atomo che viene scelto come riferimento è quello del Carbonio-12 (1,99∙10-26 kg). L’unità scelta non è l’atomo intero, ma la sua 12 esima parte , che corrisponde circa a 1,66∙10-27 kg. Tale unità viene chiamata unità di massa atomica (uma) (oppure dalton). La massa atomica relativa di un elemento indica quante volte la massa di un atomo è maggiore rispetto a un dodicesimo della massa del carbonio-12. SIMBOLO CHIMICO O 8 Numero dei protoni Ossigeno NOME ELEMENTO 16 MASSA ATOMICA Numero dei protoni e dei neutroni L’Ossigeno ha massa atomica 16 u: non significa che pesa 16 g ma che la sua massa è 16 volte più grande di quella dodicesima parte del C12 Massa molecolare relativa La massa di una molecola, detta massa molecolare, è uguale alla somma delle masse di tutti gli atomi che compongono la molecola. Vediamo come eseguire il calcolo della massa molecolare di CH3CH2Cl 2 atomi di C = 2 · 12,01 = 24,02 uma 5 atomi di H = 5 · 1,01 = 5,05 uma 1 atomi di Cl = 1 · 35,45 = 35,45 uma --------------massa molecolare = 64,52 uma ISOTOPI Il termine isotopo deriva dal greco che significa “stesso posto”. Gli isotopi di un elemento chimico, infatti, hanno lo stesso numero atomico Z (stesso numero di protoni) e quindi occupano lo stesso posto nella tavola periodica, ma un differente numero di neutroni N. Inoltre, pur avendo masse differenti, non differiscono nel loro comportamento chimico, perché hanno lo stesso numero di protoni e quindi lo stesso numero di elettroni. La maggior parte degli elementi ha isotopi stabili e radioattivi a partire dal numero atomico 84, ossia il polonio. Il cloro, ad esempio, è una miscela di due isotopi che vengono così rappresentati: 17 Cl Cloro 35 17 Cl Cloro 37 Entrambi gli atomi di cloro hanno 17 protoni (ciò contraddistingue gli atomi di cloro). I due isotopi però differiscono nel numero di massa A poiché hanno un diverso numero di neutroni. Per l'isotopo 35Cl si ha: N = A - Z = 35 - 17 = 18 neutroni Per l'isotopo 37Cl si ha: N = A - Z = 37 - 17 = 20 neutroni Isotopi dell'Idrogeno L'idrogeno è una miscela di tre isotopi: prozio, deuterio, trizio. Un po’ di numeri La carica elettrica del nucleo è data dal numero atomico Z moltiplicato per la carica elementare e = 1,6∙10-19 C Q = Z∙e In particolare, per A < 40 si ha che N ≈ Z; per nuclei più pesanti N aumenta più velocemente di Z. Tutti i nucleoni (protoni e i neutroni) subiscono indistintamente la forza nucleare attrattiva, mentre solo i protoni subiscono la forza elettrostatica repulsiva. Quando Z cresce, la stabilità del nucleo tende a diminuire a causa della repulsione coulombiana, le forze nucleari attrattive devono quindi aumentare ed è necessario un numero N di neutroni percentualmente maggiore. L’ordine di grandezza della nuvola elettronica e quindi delle dimensioni di un atomo è di 0,1 nm (nanometro = un miliardesimo di metro = 10-9 m). Il nucleo ha un raggio variabile: 1,4∙10-15 m ≤ R ≤ 8,7∙10-15 m Il diametro del protone è di circa 1 fm (femtometro = 10-15 m = un milionesimo di nanometro). I diametri dei nuclei variano da 1 a 10 fm per gli atomi pesanti La massa del protone è ~ 1830 volte più grande di quella dell’elettrone: eppure hanno la stessa carica elettrica - massa dell'elettrone me = 0,9 . 10-31 Kg - massa del protone mp ≈ 1 836 me - massa del neutrone mN ≈ 1 838 me mp = mN qp = qe Nel nucleo dell'atomo è concentrata la gran parte della massa dell'atomo (oltre il 99%) ma esso risulta 10 000 volte più piccolo dell'atomo. Tra questo nucleo ed i lontanissimi elettroni vi è un vuoto immenso. nucleo 1 km elettrone LA STRUTTURA DELL’ATOMO CIASCUNO È FORMATO 3 QUARK Mappa concettuale CARICA ELETTRICA Proprietà elettriche della materia: note fin dall’antichità (es. attrazione per strofinio); ma normalmente “nascoste” nella struttura atomica Costituzione dell’atomo: nucleo con protoni (carica + e) e neutroni (carica 0) elettroni (carica – e) orbitanti attorno al nucleo Carica elettrica = proprietà intrinseca della materia grandezza fisica fondamentale (Vedi corrente elettrica) unità di misura: coulomb (C) Proprietà fondamentali: • 3 stati di carica: positiva, negativa, neutra • sempre multipla di ±e = 1,6·10-19 C → carica elementare • si conserva (non si crea e non si distrugge,ma si separa/unisce) FORZA DI COULOMB Tra due corpi puntiformi di carica q1 e q2, posti a distanza r, si esercita sempre una forza di attrazione o di repulsione - diretta lungo la congiungente tra i due corpi - Proporzionale alle due cariche - inversamente proporzionale al quadrato della loro distanza r Dove ε0 = 8,854 ∙ 10-12 C²/Nm² (costante dielettrica del vuoto) K = 8,99 ∙ 109 Nm²/C² ≈ 9 ∙ 109 Nm²/C² (costante di Coulom nel vuoto) FORZA COULOMBIANA e GRAVITAZIONALE m p = 1,6724·10-27 kg q p = 1,60210·10-19C r = 10-10 m Analogie fra forza coulombiana e forza gravitazionale - dirette lungo la congiungente tra i due corpi - proporzionale alle due cariche / alle due masse - inversamente proporzionale al quadrato della loro distanza m e = 9,1094·10-31 kg q e = 1,60210·10-19C Differenze fra forza coulombiana e forza gravitazionale Coulombiana Attrattiva o repulsiva K = 8,99 ∙ 109 Nm²/C²(molto grande) Gravitazionale attrattiva G = 6,674 ∙ 10-11 Nm²/kg² (molto piccola) Tra protone e elettrone nell’atomo FG = G mp me/r² = (6,674∙10-11)∙(1,6724∙10-27)∙(9,1094∙10-31)/(10-10)² = 1,02 ∙ 10-47 N FC = K qp qe/r² = (8,99∙109)∙(1,6021∙10-19)∙(1,6021∙10-19)/(10-10)² = 2,31∙ 10-8 N La forza coulombiana è 1039 volte più grande di quella gravitazionale LE STRANEZZE DELL’ATOMO Nel nucleo bisogna considerare un tipo di forza, che è molto più intensa solo a piccolissime distanze (inferiori alle dimensioni di un protone o un neutrone) e si annulla rapidamente quando queste distanze diventano maggiori o uguali alle dimensioni di un singolo nucleone (intorno ai 10-16 metri): la forza nucleare. Quindi i protoni del nucleo sono respinti tra loro dalle forze elettriche ma queste forze sono molto più piccole di quelle nucleari che invece li fanno attrarre (all'aumentare della distanza, le forze nucleari non si fanno più sentire mentre si fanno sentire le forze elettriche). Queste forze nucleari tengono insieme anche neutroni con neutroni, protoni con neutroni e neutroni con protoni.. Forza repulsiva tra 2 protoni Fp = K qp qp/r² = (8,99∙109)∙(1,6021∙10-19)²/(10-15)² = 231 N Forza attrattiva tra protone/ elettrone Fe = 2,31∙ 10-8 N (vedere slide precedente) Facendo il rapporto tra Fp ed Fe , otteniamo: = = 1010 Risulta quindi che la forza Fp repulsiva tra i due protoni dovrebbe essere più intensa di circa 10 miliardi di volte quella Fe che tiene un elettrone legato in un atomo: i due protoni dovrebbero schizzare via come due proiettili supersonici!!! Perché i protoni non si respingono l’un l’altro mandando all’aria l’universo intero? 1. Forza Nucleare Forte: 100 volte più grande di quella elettrica e agisce solo quando le particelle sono molto vicine (i protoni sono posti ad una distanza di 100 millesima parte di 1 miliardesimo di cm, essi si attaccano in modo quasi inscindibile) 2. I neutroni si dispongono tra i protoni agendo quasi da “schermo” rendendo stabile il nucleo dell’atomo
Scarica