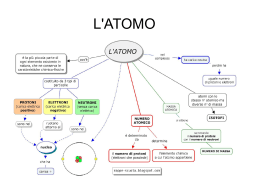
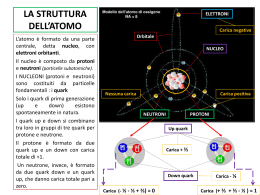
CHIMICA CLASSE 2 AR Anno scolastico 2011 - 2012 Docente corso PAS Prof.ssa Paola Panico Docente di CHIMICA Prof. Raffaele Petrucci La temperatura assoluta E’ una grandezza intensiva Ha come unità di misura il grado kelvin (k). Per cambiarla, da gradi centigradi a gradi kelvin, basta aggiungere il valore 273.15 (fattore di conversione) o levarlo se è al contrario. La materia È tutto ciò che ci circonda: ha una massa e occupa uno spazio Gli stati fisici della materia sono tre: solido , liquido e gassoso. solido liquido gassoso volume proprio proprio occupa tutto il volume disponibile forma propria assume forma del recipiente assume forma del recipiente densità alta media bassa pressione incomprimibile incomprimibile comprimibile La fase Porzione di materia fisicamente distinguibile; ha un volume definito e le molecole che la costituiscono hanno le stesse proprietà. I miscugli omogenei sono chiamati soluzioni Le soluzioni sono formate dal soluto e dal solvente Il soluto è la sostanza che si trova in minor quantità nella soluzione Il solvente è la sostanza che si trova in maggior quantità nella soluzione La quantità di soluto che si trova all’interno di una soluzione è definita concentrazione della soluzione Le reazioni chimica Cambiano la conformazione atomico- molecolare della materia. schema.: A+b C+d Una reazione chimica parte dai reagenti per formare i prodotti. Materia di partenza Materia di arrivo reagenti prodotti Reagenti e prodotti sono formati da molecole con struttura e proprietà completamente diverse. Caratteristiche degli elementi (metalli, non metalli e semimetalli) METALLI SEMIMETALLI NON METALLI Si trovano tutti allo stato Si trovano tutti allo stato solido, tranne il mercurio solido. che è liquido. Si trovano per la maggior parte allo stato solido e gassoso, tranne il bromo che è liquido Sono ottimi conduttori, sia di calore che di elettricità. Sono ottimi conduttori sia Non sono conduttori né di di calore che di elettricità calore né di elettricità. solo in alcune condizioni. Sono duttili (resistenti a forze come trazione e compressione) e malleabili (si possono lavorare senza provocare la rottura). Sono poco duttili (resistenti a forze come trazione e compressione) e poco malleabili (si possono lavorare senza la rottura). Non sono duttili (resistenti a forze come trazione e compressione) né malleabili (si possono lavorare senza provocare la rottura). Struttura dell’atomo L’atomo è formato da tre tipi di particelle: PROTONI, NEUTRONI ed ELETTRONI. Queste tre particelle prendono il nome di particelle subatomiche, cioè più piccole dell’atomo. PROTONI NEUTRONI ELETTRONI Protoni e neutroni hanno masse simili e si trovano in una zona molto piccola e molto densa al centro dell’atomo chiamata NUCLEO. Gli elettroni hanno una massa molto piccola, tanto da poter essere considerata trascurabile rispetto a quelle dei protoni e neutroni intorno al nucleo con orbite ben definite. I protoni sono carichi positivamente (+) Gli elettroni hanno carica negativa (-) I neutroni non hanno carica; si dice, quindi, che sono neutri Gli ioni Si dice che l’atomo è in forma ionica (ione) quando il numero di elettroni e protoni sono diversi IONI Si dividono in: ANIONI: gli elettroni sono in numero maggiore rispetto ai protoni; quindi, se sommiamo le cariche positive e quelle negative presenti nell’atomo, avremo un valore negativo o meglio uno IONE NEGATIVO. CATIONI: gli elettroni sono in numero minore rispetto ai protoni; quindi, se sommiamo le cariche positive e quelle negative presenti nell’atomo avremo un valore positivo o meglio uno IONE POSITIVO. Il calore È un’energia termica Reazioni chimiche che avvengono assorbendo calore all’ambiente. Reazioni che avvengono cedendo calore all’ambiente. Reazioni endotermiche Reazioni esotermiche La formula del calore è q=m*c* t “q” è il calore; “m” è la massa; “c” è il calore specifico; “t” è la differenza di temperatura. Il calore ha come unità di misura la caloria (cal) joule (j) Per passare da calorie a joule, bisogna moltiplicare per 4.18 mentre, viceversa, si divide per 4.18. Il calore specifico Indica la quantità di calore assorbita o ceduta da un grammo di campione per innalzare o abbassare la sua temperatura di grado centigrado o grado kelvin. L’ unità di misura del calore specifico è cal/g*°c;j/g*°c Molecole, composti, elementi. Elementi: sono la parte più piccola della materia chimica (sostanza); possono essere formati da uno o più atomi i quali possiedono stesse proprietà e caratteristiche. Molecole: derivano dall’unione di due o più atomi dello stesso tipo; ad esempio ossigeno, idrogeno, ozono ecc. Composti: derivano dall’unione di due o più elementi diversi. Nel linguaggio scientifico anche i composti si chiamano molecole (non si dice un composto d’acqua, ma una molecola d’acqua). Rappresentazione degli elementi, molecole, composti. Elementi: si rappresentano con il simbolo corrispondente al nome. Le molecole: sono indicate con il simbolo dell’elemento da cui sono formate e, in basso a destra del simbolo dell’elemento, si indica il numero di atomi dell’elemento che forma la molecola. Tale numero prende il nome di indice stechiometrico. I composti: sono indicati con i simboli dell’elemento che lo compongono e i rispettivi indici stechiometrici. I numeri scritti davanti alla formula del composto si chiama coefficiente stechiometrico. Massa atomica e massa molecolare La massa di ogni singolo elemento viene chiamata massa atomica e si abbrevia con M.A. La massa atomica è troppo piccola per essere espressa in grammi(g), quindi si adopera un’altra unità di misura: “unità di massa atomica” (si esprime con il simbolo u). La massa molecolare è la somma delle massa degli elementi che costituiscono una molecola e si abbrevia con M.M. Sistema internazionale Classifica le grandezze e le loro unità di misura Grandezze fondamentali Grandezze derivate Grandezze Unità di misura Grandezze Unità di misura Lunghezza m (metro) Area m\2 (metro quadro) Quantità di sostanza mol (mole) Volume m\3 (metro cubo) Massa Kg (chilogrammo) Densità Kg/m\3 (chilogrammo su metro cubo) Grandezze intensive Grandezze estensive NON dipendono dalle dimensioni Dipendono dalle dimensioni del campione Esempio di grandezza intensiva (volume). Esempio di grandezza estensiva (densità).
Scaricare