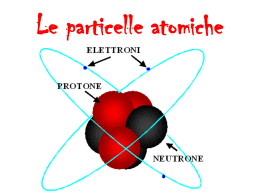
CENNI DI CHIMICA GENERALE ED INORGANICA La chimica è una scienza che si occupa di razionalizzare le trasformazioni della materia. Secondo la fisica classica, la materia rappresenta tutto ciò che ha massa e che occupa spazio. Questo però non è valido per la fisica moderna (es.: fisica quantistica), perché le particelle subatomiche (cioè più piccole dell’atomo) che conosciamo, occupano uno spazio vuoto. La materia è soggetta a variazioni che possono essere: REVERSIBILI ciò che si trasforma può essere riportato allo stato iniziale (il ghiaccio che si trasforma in acqua può essere riportato allo stato di ghiaccio) IRREVERSIBILI ciò che si trasforma non può essere riportato allo stato iniziale (bruciando del legno si ottiene carbono, il quale non può essere ritrasformato in legno) L’unità fondamenta le della materia è L’ ATOMO La parola deriva dal greco àtomos -, indivisibile, perché nell’antichità si pensava che questa fosse la particella più piccola della materia. Oggi sappiamo che l’atomo è composto da: PROTONI CARICA POSITIVA NEUTRONI NEUTRI ELETTRONI CARICA NEGATIVA Contenuti nel nucleo orbitano intorno al nucleo Ogni atomo possiede caratteristiche proprie. In particolare, gli elementi vengono distinti tra loro mediante: NUMERO ATOMICO (Z) n° di protoni NUMERO DI MASSA (A) n° di protoni + n° di neutroni Allo stato fondamentale (cioè, quando l’atomo non riceve stimoli) il nnumero di protoni corrisponde a quello degli elettroni, quindi, possiamo dire che nel suo stato fondamentale l’atomo ha una carica neutra, perché le cariche + (protoni) vengono bilanciate da cariche – (elettroni). Un’altra grandezza caratteristica dell’atomo è la massa atomica che serve a determinare il peso dell’atomo. Una unità di massa atomica equivale a 1/12 della massa del carbonio 12 (12C). TAVOLA PERIODICA DEGLI ELEMENTI Non è altro che una tabella in cui si trovano classificati gli atomi secondo il loro numero atomico Z. La tavola è formata da righe (gruppi) e colonne (periodi). Gli elementi sono indicati con la sigla del loro nome in latino. I diversi colori con cui sono indicati gli elementi si riferiscono alle loro caratteristiche chimico fisiche. gruppo periodo Z GLI IONI Gli atomi sono in continuo cambiamento. Instaurano legami, si scindono da molecole, e soprattutto scambiano elettroni. Infatti gli elementi sono in grado di acquistare o cedere gli elettroni. In questo caso si dice che diventano IONI. Perché avvenga questa reazione però, è necessario che siano vicini tra loro due o più atomi; perché gli elettroni se vengono persi da qualcuno devono essere acquisiti da altri. Se un atomo perde un elettrone, allora diventa positivo (rimane scoperta una carica di un protone che trova nel nucleo; se invece lo acquista diventa uno ione negativo (le cariche + contenute nel nucleo non bastano a bilanciare quella in più del nuovo elettrone) - + + Ione negativo (anione) Ione positivo catione LEGAMI CHIMICI Gli atomi sono in grado di legarsi tra loro. Quando due o più atomi formano legami si forma una MOLECOLA e si dice che avviene una reazione chimica. Le molecole possono essere indicate con le FORMULE BRUTE (cioè vengono scritti solo quali e quanti sono gli atomi che le compongono) H2O due atomi di idrogeno un atomo di ossigeno Oppure con le FORMULE DI STRUTTURA che ci indicano anche COME sono disposti gli atomi. O Così sappiamo che gli atomi di H sono Entrambi legati all’O H H LE REAZIONI CHIMICHE Si scrivono in questo modo: -Si indicano i reagenti (cioè le sostanze di partenza che reagiscono tra loro) a sinistra -Si indicano i prodotti (cioè le nuove sostanze che si sono formate dalla reazione dei reagenti) a destra -Si indica il verso della reazione (di solito da sinistra a destra) con una freccia REAGENTE_1 + REAGENTE_2 PRODOTTI H2SO4 + 2 NaOH Na2SO4 + 2 H2O REAGENTI PRODOTTI LE REAZIONI VANNO BILANCIATE Cioè, il numero di atomi che c’è a destra deve corrispondere a quello che c’è a sinistra: H2 + O2 H2O Questo vuol dire che a sinistra ci sono 2 atomi di H e 2 di O, mentre a destra 2 di H e 1 di ossigeno. La reazione NON è bilanciata, perché gli atomi di O devono essere 2 anche a destra. H2 + O2 2H2O Adesso ho 2 di O a destra (2 va moltiplicato con l’ossigeno) e due a sinistra. Però ce ne sono 4 di H (2 va moltiplicato per il 2 alla pendice di H) e destra e solo 2 a sinistra. 2 H2 + O2 2H2O Ora ho 4 di H a sinistra (il 2 va moltiplicato per il 2 alla pendice di H) e 4 di H a destra; 2 di O a sinistra e 2 di O a destra. La reazione è bilanciata. LEGAMI CHIMICI Esistono diversi tipi di legame. I più importanti sono: -LEGAME IONICO È quello che si forma tra ioni. Quindi la molecola si forma grazie a forze elettrostatiche. È tipico dei Sali. In pratica due atomi con diversa elettronegatività si scambiano gli elettroni e acquisiscono delle cariche opposte. Queste cariche si attraggono tra loro e fanno si che gli atomi formino una molecola. +Na Cl Il cloro strappa l’elettrone al sodio perché è più elettronegativo, cioè ha sodio cloro una maggiore capacità di attrarre elettroni. Gli elementi più elettronegativi si trovano a sinistra della tavola periodica, mentre quelli meno elettronegativi a sinistra. Na+ + Cl NaCl NB: l’ossigeno non è l’elemento più a destra della tavola, eppure è quello più elettronegativo di tutti. Ione Sodio ione cloro cloruro di sodio -LEGAME COVALENTE Si forma tra atomi simili fra loro. Gli elementi mettono in compartecipazione (cioè in comune) i loro elettroni formando dei legami molto forti. Cl Cl Cl + Cl Cl2 -LEGAME A IDROGENO (ponte idrogeno) È un legame molto particolare. Avviene tra molecole dipolari, cioè che possiedono una parte caricata positivamente ed un’altra negativamente. Una di queste molecole è l’acqua. Questa infatti è formata da due atomi di H (molto elettropositivo) ed uno di O (molto elettronegativo). Quando sono legati tra loro, l’ossigeno tendo comunque ad attirare verso di se gli elettroni degli H. Gli H essendo poco elettronegativi tendono a cederli, e questo genera un flusso di cariche che conferisce agli atomi di O una leggera carica -, e agli H una leggera carica +. O δ- Flusso di elettroni Quando due molecole di acqua si trovano vicine, la parte positiva di una, attrae la parte negativa dell’altra. Si forma così il legame idrogeno. δ+ H H δ+ O δ+ H δ- H δ+
Scaricare