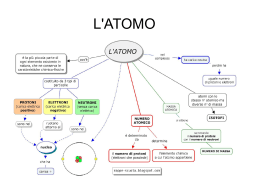
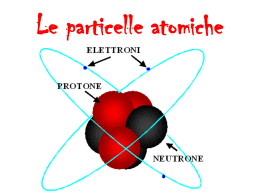
Scuola media “A. Mendola” – Favara – Classe 2D IL LINGUAGGIO DELLA CHIMICA Gli atomi sono formati da una parte centrale chiamata nucleo, in cui è concentrata tutta la massa dell’atomo e da una parte periferica, rappresentata da un certo numero di elettroni, che si muovono continuamente nello spazio che circonda il nucleo. Nel nucleo degli elementi chimici, diversi dall’idrogeno, oltre ai protoni, che determinano il numero atomico, sono presenti anche i neutroni ed il loro numero complessivo si chiama numero di massa. Due atomi che hanno lo stesso numero di protoni e di elettroni, ma numero di neutroni diverso, si chiamano isotopi. Secondo il modello di Bohr, gli elettroni ruotano attorno al nucleo tracciando orbite ben definite. Gli atomi legandosi tra loro, tramite gli elettroni dell’ultimo strato (elettroni di valenza), formano le molecole. Gli atomi che hanno lo stesso numero di elettroni nello strato esterno sono chimicamente simili. Prendiamo per esempio il litio e il sodio, avendo entrambi 1 solo elettrone nello strato esterno, sono detti chimicamente simili e sono monovalenti. Prosegui Basandosi sul numero di elettroni presenti nello strato esterno, tutti gli elementi chimici possono essere classificati in gruppi, formando il sistema periodico degli elementi. Un legame chimico fra due atomi si forma quando almeno due elettroni sono attratti contemporaneamente da due nuclei diversi. Questi elettroni si chiamano elettroni di legame. Gli atomi che hanno più di un elettrone di valenza possono formare più legami. Ad esempio: gli atomi dell’ossigeno hanno 6 elettroni nello strato esterno e possono formare due legami. Se dovessimo rappresentare la molecola dell’anidride carbonica, la rappresenteremo con l’atomo di carbonio posto al centro tra i due atomi di ossigeno. Esistono 3 tipi di legami: il legame eteropolare, il legame omopolare ed il legame ionico. Gruppo di lavoro: Casà Maria Chiara, Distefano Clelia, Montalbano Luana Classe 2D Torna indietro Fine Presentazione Gli atomi Gli atomi sono gli elementi che costituiscono le molecole. La loro struttura è composta da un nucleo interno, contenente protoni e neutroni, e da elettroni situati esternamente ad esso. L’ atomo più semplice è quello dell’idrogeno, formato da un solo protone ed elettrone. Menù Modello di Bohr Menù IL numero atomico Il numero atomico è il numero dei protoni contenuti nel nucleo. Per esempio, gli atomi dell’elio, avendo 2 protoni, hanno numero atomico 2, mentre gli atomi del carbonio, avendo 6 protoni, hanno numero atomico 6. Menù Il numero di massa Il numero di massa è il numero complessivo dei protoni e dei neutroni presenti nel nucleo. Per esempio: il nucleo dell’idrogeno è formato da 1 solo protone, quindi il suo numero di massa è 1. Nel litio, invece, il nucleo è formato da 3 protoni e da 3 neutroni, quindi il suo numero di massa è 6. Menù Gli isotopi Gli isotopi sono atomi di uno stesso elemento che hanno stesso numero di protoni e di elettroni ma un diverso numero di neutroni. L’Elio 3 e l’Elio 4 differiscono per un neutrone. Menù Le molecole Combinandosi tra loro, gli atomi formano le molecole. Esse possono essere: apolari (O2) quando sono prive di poli elettrici; polari (HCl) quando ai loro poli ci sono due cariche elettriche diverse. Menù O2 HCl Ossigeno Acido Cloridrico Anidride carbonica CO2 Menù Atomo di litio Menù Atomo di sodio Menù Tavola periodica degli elementi Menù
Scaricare