2
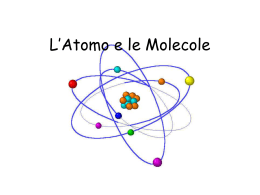
L’atomo è costituito da particelle più piccole
chiamate subatomiche. E’ formato da un nucleo
centrale, caricato positivamente, in cui all’interno
vi sono i protoni positivi e i neutroni
elettricamente neutri. Il nucleo è circondato
dalla nuvola elettronica dove vi sono i livelli
energetici in cui sono distribuiti gli elettroni,
caricati negativamente.
Più atomi insieme formano una molecola. Le
molecole possono essere formate da atomi dello
stesso elemento o da atomi di elementi diversi.
• Gli isotopi sono atomi che hanno lo stesso numero di protoni, ma un numero
differente di neutroni nel nucleo. Gli isotopi hanno, cioè, lo stesso numero
atomico ma un numero di massa differente. I tre isotopi dell’idrogeno sono:
idrogeno o prozio, deuterio e trizio.
♥ Il carbonio ne ha tre:
Numero atomico
Numero di massa
Simbolo dell’atomo
• Nel 1869, il chimico russo Mendeleev, disponendo i 60 elementi chimici fino ad allora
conosciuti in ordine di peso atomico crescente rilevò che alcune loro proprietà
(chimiche e fisiche) si ripetevano ad intervalli regolari. Egli chiamò periodi questi insiemi
di elementi disposti orizzontalmente e tavola periodica il loro insieme complessivo. I
periodi hanno delle proprietà chimiche e fisiche simili e per tale ragione si creano dei
gruppi,disposti verticalmente. La tavola periodica moderna si differenzia da quella di
Mendeleev perchè non si basa sul peso atomico, bensì sul numero atomico. Tra le
proprietà più importanti dell’atomo di un elemento vi è la capacità di combinazione
chiamata valenza. La valenza è il numero di elettroni che si spostano nelle reazioni
chimiche.
L’ idrogeno è monovalente, perché un suo atomo si può combinare al
massimo con un solo atomo di un altro elemento, mentre l’ossigeno
è bivalente, perché un suo atomo si può combinare con due atomi di un
altro elemento.
♦ Il numero atomico è il numero di protoni degli atomi di un certo elemento
e comunemente viene indicato con la lettera Z. Esso determina le
proprietà di un elemento e lo rende differente da tutti gli altri.
♣ Il numero di massa indica la somma del numero di protoni e di neutoni
presenti in un atomo e generalmente viene indicato con la lettera A.
La massa di un atomo dipende quasi del tutto dai suoi protoni e neutroni
perché gli elettroni non hanno praticamente massa.
♥ Il peso atomico equivale alla massa atomica relativa di un elemento ed è
un numero che esprime quante volte l’atomo di quell’elemento pesa
rispetto alla dodicesima parte dell’isotopo …
• Gli atomi si uniscono a formare molecole. Le molecole possono essere formate da
atomi dello stesso elemento o da atomi di elementi diversi.
♦ Le forze che tengono insieme gli atomi di una molecola vengono chiamate legami
chimici.
Per capire come questi legami si formano dobbiamo prendere in considerazione i
livelli energetici degli atomi dei vari elementi.
Un atomo raggiunge il massimo della sua stabilità quando tutti i suoi livelli energetici,
in particolare quello più esterno, sono completi.
Quando il livello energetico più esterno non è completo si dice reattivo.
Per la maggior parte degli atomi, il livello energetico più esterno è
completo con otto elettroni. In alcuni casi, come nell’idrogeno e nell’elio,
i livelli energetici più esterni sono completi con soli due elettroni.
• Due atomi si combinano insieme quando il legame chimico che si viene a formare
fra loro consente a entrambi di completare i loro livelli energetici più esterni.
Questo completamento può avvenire in due modi differenti:
- gli elettroni vengono ceduti da un atomo all’altro, che li acquista {legame ionico} ;
- gli elettroni vengono condivisi da due atomi {legame covalente}.
♦ Un atomo caricato positivamente viene chiamato ione positivo.
♦ Un atomo caricato negativamente viene chiamato ione negativo.
Legami chimici
Legami chimici
ARNONE ALESSIA
FICHERA MANUELA
MILIOTO MARTINA
GIANCANI MICHELE
CARAMAZZA ALESSIA
CUCCHIARA ANTONINO
Classe 2 D
Scaricare