ELEMENTI DI FISICA
NUCLEARE
a cura di
Claudia Monte
PROGETTO FORMATIVO EDA
“TECNICHE ERBORISTICHE:
COSMESI NATURALE E
FITOTERAPIA”
Maggio 2006
1
Parte 1
L’ATOMO
• Premesse storiche
• Primi esperimenti
• Le particelle subatomiche
• Modelli atomici
Maggio 2006
2
Premesse storiche
Sin dai tempi degli antichi filosofi greci, l’uomo ha cercato di
spiegare la struttura microscopica della materia:
Nel 440 a.C. circa, Empedocle immaginò che la materia fosse
costituita da quattro elementi: acqua, aria, terra, fuoco;
Democrito (470-370 a.C.), invece, immaginò che tutta la
materia fosse costituita da particelle invisibili in continuo
movimento e che i diversi tipi di materia che vediamo ad occhio
nudo fossero il risultato della combinazione di queste
particelle.
•Democrito le chiamò atomi, con la parola greca che significa
“indivisibile”.
Maggio 2006
3
John Dalton propose la prima teoria atomica scientifica:
La teoria atomica di Dalton (1803-1810) si può riassumere nei
seguenti punti fondamentali:
1.
Gli elementi sono costituiti da particelle indivisibili chiamate atomi.
2. Tutti gli atomi di uno stesso elemento hanno la stessa massa e le
stesse dimensioni.
3.
Gli atomi di elementi diversi hanno massa e dimensioni diverse.
4. I composti chimici si formano per unione di due o più atomi di
diversi elementi.
5. Per formare composti chimici, gli atomi si combinano in rapporti
numerici semplici espressi da numeri interi (1 a 2, 2 a 1, 2 a 2 ,
ecc.).
6. Gli atomi di due elementi possono combinarsi in diversi rapporti
numerici per formare composti diversi.
Maggio 2006
4
LA STRUTTURA DELLA MATERIA E
DEL CORPO UMANO
Il Corpo Umano
Un organo: la pelle
Struttura dei cristalli
Le cellule
Le molecole
L’ATOMO
Un solido: il diamante
Maggio 2006
5
I primi esperimenti
Esperimenti
sull’elettrolisi
Esperimenti con
gas rarefatti
L’ATOMO NON E’ INDIVISIBILE
MA HA UNA SUA STRUTTURA
INTERNA BEN PRECISA
Maggio 2006
6
1. Il fenomeno dell’elettrolisi
o Michael Faraday (1834), riassunse gli aspetti quantitativi del
fenomeno di elettrolisi in due leggi che portano il suo nome.
I legge di Faraday. La massa della sostanza che compare o
scompare ad ogni elettrodo di una cella elettrolitica è
proporzionale alla quantità di elettricità che passa attraverso il
liquido.
II legge di Faraday. La quantità di carica elettrica che deve
fluire in una cella per far comparire o scomparire una mole di
sostanza a ciascun elettrodo è di 96.487 Coulomb, oppure un
multiplo intero di tale quantità (ad es. il doppio, il triplo, ecc.).
(*) Elettrolisi. Con questo termine si indicano quei fenomeni che si
osservano quando, in certi liquidi, si immergono due sbarrette metalliche,
dette elettrodi, collegate ad un generatore di corrente continua (ad es. una
pila). La vaschetta che contiene il liquido con immersi gli elettrodi collegati
rispettivamente al polo positivo (anodo) e a quello negativo (catodo) del
generatore di corrente continua, si chiama “cella elettrolitica”.
Maggio 2006
7
o Nel 1874 il fisico inglese George Johstone Stoney suppose che
fossero i singoli atomi o le singole molecole a trasportare un ben
preciso frammento di carica elettrica e a queste supposte
particelle cariche di elettricità assegnò un nome.
Esse vennero chiamate ioni (un termine che deriva dal verbo
greco "hiemi" che vuol dire corro, mi affretto, a sottolineare la
caratteristica mobilità di questi corpuscoli).
Le cariche elettriche possono essere positive o negative: gli ioni
con carica positiva sono detti cationi, perché durante l’elettrolisi
si dirigono verso il catodo, quelli con carica negativa anioni,
perché sono attratti dall’anodo.
Lo stesso Stoney propose il nome di elettrone per indicare la
carica elettrica elementare (positiva o negativa) trasportata
dagli ioni.
Maggio 2006
8
o Inizialmente si riteneva che fosse il passaggio della corrente
elettrica a determinare la separazione (lisi) dei componenti della
soluzione, ma successivamente, il chimico svedese Svante
Arrhenius (1859-1927) intuì che essi potevano anche essere
interpretati immaginando che in soluzione, indipendentemente dal
passaggio della corrente, fossero già presenti frammenti di
materia carichi positivamente e negativamente.
Con Arrhenius si faceva quindi strada l'idea che gli atomi non
fossero entità indivisibili, ma strutture complesse, scindibili in
frammenti più piccoli carichi di elettricità.
La teoria di Arrhenius prese il nome di "dissociazione
elettrolitica" e rappresentò, per così dire, l'aspetto chimico
dell'ipotesi della natura complessa dell'atomo.
Maggio 2006
9
2.
La scarica elettrica nei gas rarefatti
Quando il tubo è pieno d'aria, anche applicando agli elettrodi una
differenza di potenziale molto elevata non si osserva alcun fenomeno
in quanto l'aria (e più in generale i gas) a pressione normale, non
conduce l'elettricità.
Se però si estrae
l'aria dal tubo
fino a ridurre la
pressione a pochi
millimetri di
mercurio, si nota
il passaggio della
corrente
elettrica.
Tale corrente elettrica appare prima sotto forma di una scintilla che
procede a zigzag, poi sotto forma di una luminosità diffusa che riempie
il tubo fino a fargli assumere l'aspetto familiare di quelli al neon.
Maggio 2006
10
Si può dare un’interpretazione di questo fenomeno ipotizzando che
ci sia un qualcosa che si sprigiona dal catodo eccitando prima la
materia che si trova nel tubo e poi, quando questa è stata
praticamente eliminata, la zona del tubo posta di fronte ad esso.
Nel 1876, il fisico tedesco Eugen Goldstein,
nella convinzione di avere a che fare con una
qualche forma di energia, dette, alla
radiazione che emanava dal catodo, il nome di
"raggi catodici".
Maggio 2006
11
William Crookes, per indagare sulla natura della radiazione
catodica, apportò alcune modifiche ai tubi di scarica.
I suoi esperimenti mettevano in evidenza che la radiazione
che usciva dal catodo non poteva essere della stessa
natura della luce. Le evidenze sperimentali suggerivano che
doveva trattarsi di uno sciame di corpuscoli.
In seguito, Johann Wilhelm Hittorf (1824-1914) dimostrò
che i raggi catodici venivano deviati sia da un campo
magnetico, sia da un campo elettrico, e concluse che non
solo doveva trattarsi di particelle, ma che queste dovevano
possedere anche una carica elettrica, la quale, tenuto
conto del senso della deviazione, doveva essere di segno
negativo. Fu infine deciso di riservare a queste particelle,
e non alle cariche elettriche, come si era fatto in
precedenza, il nome di elettroni.
Maggio 2006
12
Glossario:
Il campo magnetico.
Si tratta di un campo vettoriale: associa, cioè, ad ogni
punto nello spazio un vettore che può variare nel tempo.
Più specificatamente il campo magnetico è un campo di
forze che associa ad ogni punto dello spazio una forza in
generale proporzionale alla corrente elettrica e
inversamente proporzionale al quadrato della distanza del
punto ove si vuole calcolare il campo.
La direzione del campo è la direzione indicata
all'equilibrio dall'ago di una bussola immersa nel campo.
La terminologia oggi utilizzata è la seguente: il campo
magnetico nel vuoto è indicato con B e quello in un
materiale con H.
Maggio 2006
13
La carica elettrica.
Dati alcuni fatti sperimentali come l'attrazione e la
repulsione tra sostanze trattate in maniera opportuna
(per esempio per strofinìo), si sono definiti due stati di
elettrizzazione della materia: positiva e negativa.
Corpi elettrizzati entrambi positivamente o entrambi
negativamente si respingono mentre corpi elettrizzati
in modo opposto si attraggono.
La carica elettrica è una misura quantitativa dello
stato di elettrizzazione della materia.
Mettendo a contatto un corpo carico (cioè elettrizzato,
in qualche modo) con un corpo non carico, quello che
succede è semplicemente che una certa quantità di
carica si trasferisce all'altro corpo.
Maggio 2006
14
Il campo elettrico.
Un corpo carico elettricamente produce nello spazio
circostante (al limite in tutto lo spazio circostante), la
presenza di un nuovo stato di cose: se introduciamo
un'altra carica elettrica, questa risente l'effetto di una
forza, appunto la forza elettrica che è direttamente
proporzionale al prodotto delle due cariche e inversamente
proporzionale al quadrato della loro distanza.
Questo nuovo stato di cose è quello che chiamiamo campo
elettrico, che è un campo vettoriale di forze.
Quindi se nello spazio poniamo una carica elettrica Q
possiamo determinare la forza che produce (e che subisce)
rispetto ad un'altra carica posta nelle vicinanze detta
carica di prova q0.
Maggio 2006
15
Le particelle subatomiche
1. LA DETERMINAZIONE DEL RAPPORTO CARICA/MASSA
DELL'ELETTRONE (1897, Thomson)
Nel 1897, l'inglese
Joseph John Thomson
(1856-1940) modificò
opportunamente le
apparecchiature con cui
si erano studiati
precedentemente
i raggi catodici
allo scopo di effettuare la misurazione del percorso seguito dai
raggi stessi sotto l'effetto dei campi elettrico e magnetico.
Maggio 2006
16
Nel caso dell'elettrone, indicando con m la sua massa, con e la sua
carica elettrica, con v la sua velocità e con B l'intensità del campo
magnetico entro il quale è costretto a muoversi, si può dimostrare
che il raggio r della traiettoria circolare percorsa da questo
corpuscolo si calcola:
e
r v
m
B
il valore del rapporto che risulta pari a 1,76∙108 Coulomb/g.
Maggio 2006
17
(*) La velocità degli elettroni (v) viene determinata per via indiretta.
E' possibile infatti, calibrando la carica elettrica sulle piastre
metalliche esterne, in modo tale da controbilanciare esattamente
l'effetto del campo magnetico, ottenere il risultato di far procedere
gli elettroni in linea retta, verso il punto che sta di fronte al catodo.
Il valore della forza elettrica agente sull'elettrone è pari a
(con e carica dell'elettrone ed E intensità del campo elettrico)
e E
ll valore della forza magnetica è uguale a (con e carica dell'elettrone,
v velocità dell'elettrone e B intensità del campo magnetico)
In condizioni di equilibrio deve risultare:
da cui:
Maggio 2006
ev B
e E ev B
E
v
B
18
2. LA DETERMINAZIONE DELLA MASSA DELL'ELETTRONE
(1909, Millikan)
Millikan osservò che le
cariche elettriche portate
dalle goccioline d'olio che
rimanevano
sospese
a
mezz’aria fra gli elettrodi
carichi, pur essendo di
diverso valore, tuttavia
erano sempre multiple della
stessa grandezza.
Mai avveniva che una
gocciolina portasse su di sé
una
carica
elettrica
inferiore al valore di
1,6 10
19
C
Egli allora considerò questa quantità minima, la carica dell'elettrone.
Maggio 2006
19
Una volta misurata la carica, fu possibile determinare la massa
dell'elettrone. Infatti, sostituendo in e/m il valore di e, si
ottenne:
e
m
9,11028 g 0,51 MeV 2
e
c
m
L'elettrone diventava così la più piccola
particella di materia mai conosciuta.
Esso pesa 1836 volte di meno del peso dell'atomo di idrogeno, il più
leggero che esista in natura.
1eV 1,602 1019 joule
Maggio 2006
20
3.
I "RAGGI CANALE" O PROTONI
La materia, in condizioni normali, si presenta elettricamente
neutra.
Era quindi logico pensare che se da essa si era riusciti ad
estrarre corpuscoli carichi di elettricità negativa, gli elettroni
appunto, dovessero essere presenti residui carichi positivamente.
Era altrettanto naturale attendersi che tali frammenti di materia
avrebbero dovuto seguire, nell'interno del tubo di scarica, un
percorso in senso contrario a quello degli elettroni.
Fu così possibile rendere evidente una radiazione, a cui fu
assegnato, da Eugen Goldstein (1850-1930),
il nome provvisorio di "raggi canale“.
Maggio 2006
21
Quando fu possibile misurare la carica elettrica di questi nuovi
corpuscoli, e risultò essere dello stesso valore di quella trovata
per l'elettrone (anche se di segno opposto), fu possibile
conoscere la massa di tali particelle: essa risultava praticamente
identica a quella degli atomi o delle molecole che riempivano il
tubo di scarica:
1,672 10 24 g 938,3 MeV
c2
I raggi canale, quindi, non erano altro che ioni positivi.
A queste particelle fu assegnato pertanto il nome di
protone, parola che in greco significa
"di primaria importanza”.
Maggio 2006
22
I modelli atomici
1. IL MODELLO ATOMICO DI THOMSON (1904)
Secondo lo scienziato inglese l'atomo doveva
essere costituito da una sfera omogenea di elettricità
positiva, ma senza peso, nella quale si trovavano
disseminati gli elettroni, come si trattasse di uvetta
nel panettone. Per questo motivo all'atomo di
Thomson venne anche assegnato il nome irriverente
(ma efficace) di "modello a panettone".
Thomson pensava (erroneamente) che la massa degli atomi fosse dovuta
esclusivamente agli elettroni, e poiché un elettrone pesa 1/1836 della massa
dell'atomo di idrogeno, quest'atomo avrebbe dovuto contenere 1836
elettroni. Gli altri atomi, pesano decine e centinaia di volte di più dell'atomo
di idrogeno e quindi avrebbero dovuto contenere al loro interno decine e
centinaia di migliaia di elettroni. Un atomo con tanti elettroni a muoversi al
suo interno pareva, già "ad occhio", una struttura poco verosimile!!
Maggio 2006
23
2.
IL MODELLO ATOMICO DI RUTHERFORD (1911)
• L'esperimento di Rhuterford
Maggio 2006
24
Le particelle alfa, secondo il modello di Thomson (sinistra), non
dovrebbero deviare, mentre secondo il modello di Rutherford (destra)
vengono deviate.
L’osservazione sperimentale confermava la seconda ipotesi!!!!
Maggio 2006
25
Conclusione di Rutherford:
l'atomo, nel suo complesso, è un edificio vuoto, con tutta la
massa concentrata in un nucleo centrale carico positivamente,
molto piccolo e di conseguenza anche molto denso.
Gli elettroni, necessariamente, devono muoversi su ampie orbite,
intorno al nucleo, come i pianeti ruotano intorno al Sole.
Per questo motivo, il modello atomico di
Rutherford, venne anche detto
modello planetario.
Maggio 2006
26
Problemi del modello di Rutherford
Il modello di Rhuterford aveva il difetto di essere
assolutamente incompatibile con le leggi della meccanica e
dell'elettrodinamica.
Secondo queste leggi infatti, un corpo carico di elettricità che
si muova con moto che non sia rettilineo ed uniforme, irradia
energia a scapito della propria.
L'elettrone pertanto, nel suo moto circolare intorno al nucleo,
poiché è soggetto ad una continua accelerazione centripeta, e
cambia quindi velocità ad ogni istante, dovrebbe irradiare e
subire una progressiva diminuzione della propria energia.
Ciò lo porterebbe a cadere, seguendo una traiettoria a spirale,
sul nucleo.
E' stato calcolato che l'atomo, se fosse costruito secondo il
modello proposto da Rutherford, sarebbe destinato a
disintegrarsi in una frazione di secondo.
L'atomo, invece, per nostra fortuna, è stabile.
Maggio 2006
27
3.
Maggio 2006
LA SPETTROSCOPIA OTTICA
28
Esempi di spettri
Spettro continuo
Spettro a righe
Spettro di
assorbimento
Maggio 2006
29
Le righe spettrali dell’atomo di idrogeno
La serie di Balmer:le righe spettrali dell'idrogeno non erano
poste a caso, ma secondo un preciso ordine esprimibile con la
seguente formula:
n2
3645,6 2
Å
n 4
dove n è un numero intero. Dando ad n i valori 3, 4, 5 e 6 si
-8
ottengono le lunghezze d'onda (l), espresse in Å (dove 1Å 10 cm )
La serie di Rydberg:
con
Maggio 2006
1
1
RH 2 2
n
2
1
n 3,4,5...e RH 10967757,6m 1
30
4.
L’ATOMO DI BOHR (1913)
Nel 1913 il fisico danese Niels Bohr accettò per buona l'idea
del nucleo centrale con gli elettroni esterni, proposto da
Rutherford. Poi però vi apportò delle modifiche sostanziali
avvalendosi della teoria dei quanti di Planck.
Infatti proprio in quelli stessi anni il fisico tedesco Max Plank
introdusse l’idea che l’energia sia quantizzata, cioè che possa
essere emessa e assorbita solo in quantità discrete dette
quanti.
Bohr ipotizzò che nell’atomo gli elettroni possono occupare solo
ben definite orbite, ciascuna con una ben definita energia,
secondo la distanza dal nucleo.
Quindi ogni orbita corrisponde ad un definito livello energetico:
l’orbita più vicina al nucleo corrisponde al più basso livello
energetico mentre le altre orbite, a distanza crescente dal
nucleo, corrispondono al secondo, al terzo, al quarto… livello
energetico.
Maggio 2006
31
In condizioni normali, l’atomo tende sempre a scegliere la
configurazione corrispondente alla minore energia, cioè si trova,
come si dice, nel suo stato fondamentale. Nel caso dell’atomo di
idrogeno, lo stato fondamentale corrisponde alla situazione in cui
l’unico elettrone occupa il primo livello energetico, cioè quello più
vicino al nucleo.
Può capitare, però, che l’atomo assorba uno o più quanti di
energia: la conseguenza è che il suo elettrone “salta” dalla sua
orbita ad una più alta (la seconda, la terza, ecc. a seconda della
quantità di energia assorbita); si dice allora che l’atomo è in uno
stato eccitato.
Normalmente gli atomi in uno stato eccitato tendono sempre a
tornare nello stato fondamentale e quindi l’elettrone “cade”
dall’orbita più esterna verso una più interna, di minore energia.
L’energia persa dall’elettrone in questo passaggio viene quindi
ceduta all’esterno sotto forma di radiazione elettromagnetica di
una ben definita lunghezza d’onda.
Maggio 2006
32
Stato fondamentale
Maggio 2006
33
I raggi delle orbite circolari per l’atomo di idrogeno sono
caratterizzati con un numero, detto numero quantico, indicato
con la lettera n (n = 1, 2, 3…).
La prima orbita, corrispondente
allo stato fondamentale
dell’atomo di idrogeno (n = 1),
ha un raggio pari a:
r 5,3 10 11 m 0,5Å
A tale orbita deve corrispondere un’energia che per
convenzione è negativa (per indicare lo stato legato in cui si
trova l’elettrone) ed è pari a:
E 13,6eV
Maggio 2006
34
Il valore di energia (negativo) dello stato fondamentale, con segno
cambiato, rappresenta l'energia necessaria per allontanare
l'elettrone dalla prima orbita e portarlo a distanza infinita
(praticamente fuori dall'influenza del nucleo).
L'atomo, privato di uno o più elettroni, come già sappiamo, è un
sistema con carica positiva che prende il nome di ione;
l'energia spesa per l'allontanamento degli elettroni viene detta
energia di ionizzazione.
L'energia della seconda orbita (n = 2) vale 1/4 di quella della
prima, quella della terza (n = 3), vale 1/9 della prima, e così via.
I valori dell'energia relativa ad alcuni livelli dell'atomo di
idrogeno crescono all'aumentare della distanza dal nucleo.
Il valore massimo (cioè il valore zero) si ha quando la distanza
dal nucleo è infinita e corrisponde in sostanza alla situazione di
elettrone libero.
Maggio 2006
35
5.
L’ATOMO DI SOMMERFELD (1916)
Con l'aiuto di spettroscopi molto perfezionati, si era potuto
osservare che molte delle righe dello spettro dell'idrogeno erano
in realtà costituite da un certo numero di altre righe molto vicine
fra loro, corrispondenti a piccolissime variazioni dell'energia.
Il modello di Bohr non era in grado di giustificare questa
struttura fine dello spettro dell'idrogeno.
D'altra parte, l'orbita circolare di un corpo che si muove intorno
ad un altro è infatti un caso particolare delle più generali orbite
ellittiche. L'elettrone quindi, girando intorno al nucleo, avrebbe
dovuto percorrere, oltre all'orbita circolare, un'infinità di altre
orbite ellittiche.
Nel 1916, il fisico tedesco Arnold Sommerfeld, tentò di dare un
significato alla struttura fine dell'idrogeno introducendo anche
le traiettorie ellittiche per il moto degli elettroni.
Maggio 2006
36
Poiché i fatti sperimentali mostravano che le righe della
struttura fine erano in numero limitato, anche il numero delle
orbite possibili sarebbe dovuto essere limitato!
Sommerfeld dimostrò che per ciascun valore del numero quantico
n doveva esistere un numero determinato di orbite ellittiche
(oltre a quella circolare).
Per descrivere il momento angolare dell'elettrone che viaggia su
orbite ellittiche, Sommerfeld introdusse un nuovo numero
quantico, ℓ, detto numero quantico azimutale mentre n fu
denominato numero quantico principale.
Si dimostra che ℓ può assumere tutti i valori interi positivi
compresi fra 0 ed n-1. Questo numero oggi viene anche detto
numero quantico secondario e determina, come abbiamo spiegato
sopra, la forma dell'orbita.
n = numero quantico principale
l = numero quantico azimutale (n valori): 0 ….. , n-1
Maggio 2006
37
Esempi di orbite Sommerfeld
n = 2
Stato fondamentale
n = 1
ℓ=1
ℓ =0
ℓ=0
+
+
n = 3
ℓ=2
Orbite circolari
di Bohr
ℓ=1
ℓ=0
Maggio 2006
+
38
6. ULTERIORI MODIFICHE DEL MODELLO DI
SOMMERFELD
Si era osservato che sottoponendo alcuni
elementi all'azione di un campo magnetico, si
verificava lo sdoppiamento di alcune righe
spettrali. Il fenomeno è detto, dal nome del
suo scopritore, “effetto Zeeman”.
Per comprendere il meccanismo di questo
fenomeno, dobbiamo considerare che
l'elettrone, oltre ad una massa, possiede
anche una carica elettrica. Secondo le
leggi dell'elettromagnetismo, una carica
elettrica che percorre un circuito chiuso,
genera un campo magnetico, come
qualsiasi corrente elettrica che percorre
una spira.
Si viene così a creare, all'interno dell'atomo, per effetto del moto
dell'elettrone, un minuscolo magnete, il quale, tuttavia, non produce alcun
effetto, così come un ago magnetico, da solo, non subisce alcuna forza.
Maggio 2006
39
Quando però si applica un campo magnetico all'esterno, questo interagisce
con il "magnetino" (elettrone in rotazione) presente nell'atomo
costringendolo a sistemarsi secondo determinate posizioni, così come un
ago calamitato subisce uno spostamento per l'azione di una calamita.
Si introdusse un terzo numero quantico, detto numero quantico
magnetico e simboleggiato con la lettera m.
Il numero m può assumere tutti i valori interi compresi fra -ℓ e +ℓ,
incluso lo zero.
m = -l, -l+1,…, 0,…, +l -1, +l
Oltre all'effetto Zeeman, rimaneva ancora da spiegare il fatto che
nella struttura fine di alcuni metalli si osservava un numero di righe
ancora superiore a quello previsto dalla teoria delle orbite ellittiche di
Sommerfeld. Si trattava di una particolare "struttura a doppietti" che
si riscontrava per esempio nel sodio, nel magnesio e nel mercurio.
Nel 1926 due fisici statunitensi di origine olandese, George Eugene
Uhlenbeck e Samuel Abraham Goudsmit seppero dare una spiegazione
teorica anche alle nuove righe spettrali.
Maggio 2006
40
Essi immaginarono che l'elettrone, oltre che girare intorno al nucleo,
potesse girare anche su sé stesso come fosse una trottola.
In questo modo l'elettrone, dotato di carica, creerebbe un suo
proprio campo magnetico del tutto distinto da quello che lo stesso
produce girando intorno al nucleo.
Anche in questo caso
fu necessario
quantizzare la
rotazione attraverso
l'introduzione di un
quarto numero
quantico, s (o ms),
detto numero quantico
(magnetico) di spin ("to
spin", in inglese,
significa girare).
Poiché possiamo immaginare l'elettrone girare su sé stesso, o in senso
orario, o in senso antiorario, i valori che s può assumere sono solo due:
+½ e -½ .
Maggio 2006
41
7.
Maggio 2006
RIEPILOGO: I NUMERI QUANTICI
42
8.
IL PRINCIPIO DI ESCLUSIONE DI PAULI (1925)
Due elettroni, per poter stare vicini, dovevano avere spin opposti: gli
elettroni che girano su sé stessi, si comportano infatti come
magneti, e l'esperienza insegna che due magneti, orientati nello
stesso senso, si respingono, mentre, se sono orientati in senso
opposto, si attraggono.
Allo stesso modo, due elettroni con lo stesso spin producono campi
magnetici di segno uguale e si respingono, mentre se hanno spin
opposti il campo magnetico dell'uno annulla quello dell'altro e si
attraggono.
Ora, poiché per gli elettroni stare vicini vuol dire occupare la stessa
orbita, Pauli concluse che su una stessa orbita non potevano stare
più di due elettroni (con spin opposto).
Questa limitazione è espressa dal cosiddetto "principio di
esclusione" che può essere enunciato nel modo seguente:
"In un medesimo atomo non possono esistere due elettroni con
identici valori di tutti e quattro i numeri quantici".
Maggio 2006
43
9.
LA CONFIGURAZIONE ELETTRONICA
Il principio di esclusione di Pauli consente anche di stabilire quanti
elettroni possono stare, al massimo, su ciascun livello energetico.
Il numero massimo di elettroni per livello si ricava semplicemente
dalla espressione 2n².
Pertanto:
il primo livello energetico, n =1, potrà contenere al massimo due soli
elettroni (2·1²);
il secondo livello, n =2, potrà contenere al massimo 2∙2²= 8
elettroni;
il terzo livello energetico conterrà, al massimo 2·3²=18 elettroni,
e così di seguito per gli altri.
Maggio 2006
44
Il numero atomico è il numero degli elettroni presenti nei rispettivi
atomi e viene indicato con la lettera Z.
Il modo in cui sono disposti gli elettroni intorno al nucleo viene detto
"struttura elettronica" dell'atomo. La distribuzione degli elettroni
nei singoli atomi segue un criterio preciso che noi esporremo nel
corso della costruzione grafica degli atomi più semplici esistenti in
natura.
Convenzioni:
a) l'orbita vuota è rappresentata da un quadratino
b) un quadratino con una freccia all'interno, rivolta verso il basso o
verso l'alto, a seconda dello spin, indica un'orbita percorsa da un
elettrone ↑
c) un quadratino con due frecce contrapposte indica un'orbita con
due elettroni
Maggio 2006
45
La configurazione elettronica dell’Idrogeno e
dell’Elio
Ordine crescente dei livelli energetici a partire da
quello più basso (vicino al nucleo) a quello più alto:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, ecc.
Maggio 2006
46
10.
IL NEUTRONE
Il neutrone rappresenta la terza particella subatomica.
Esso fu l’ultima particella, in ordine temporale, ad essere scoperta.
Infatti, poiché l’atomo è complessivamente neutro, una volta scoperti
gli elettroni (negativi) ed i protoni (positivi), non c’era ragione di
sospettare l’esistenza di altre particelle all’interno dell’atomo!!!!!!
Dai valori delle masse atomiche risultò però che c’era un cosiddetto
DIFETTO DI MASSA:
MASSA NUCLEO > SOMMA MASSA PROTONI!!!!!!
Il nucleo non poteva essere costituito da soli protoni, ma in esso
dovevano essere presenti anche altre particelle che dovevano essere
neutre, per rispettare la complessiva neutralità dell’atomo!.
Questa ipotesi era stata avanzata già da Rutherford nel 1911, ma il
neutrone fu scoperto solo nel 1932 da Chadwick!!!!
Maggio 2006
47
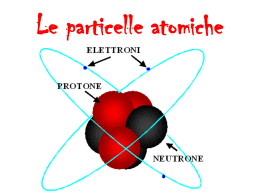
CONCLUSIONE:
• L’ATOMO è costituito da 3 tipi di particelle subatomiche:
l’ elettrone (e) carico - ;
il protone (p) carico + ;
il neutrone (n) neutro .
• I protoni ed i neutroni costituiscono il NUCLEO ATOMICO, mentre
gli elettroni ruotano attorno al nucleo seguendo determinate orbite
corrispondenti a determinate energie;
• In un atomo, in condizioni normali ci sono Z elettroni e Z protoni
per rispettare la complessiva neutralità. Z rappresenta il NUMERO
ATOMICO. Da questo numero dipendono molte proprietà dell’atomo
stesso.
• N indica il numero di neutroni presenti nel nucleo;
• A rappresenta la MASSA ATOMICA ed è ottenuta sommando il
numero dei protoni e dei neutroni:
A = N + Z
Maggio 2006
48
LA STRUTTURA
INTERNA DELL’ ATOMO
Le masse degli
elementi costitutivi
dell’atomo sono:
me 0,51 MeV
Maggio 2006
c2
M p 938,28 MeV
c2
M n 939,57 MeV
c2
49
11.
GLI ISOTOPI
Tutti gli elementi chimici sono formati dall'insieme di più specie atomiche
di massa diversa.
Gli atomi diversi dello stesso elemento chimico vennero chiamati isotopi.
Anche l'idrogeno risulta costituito da una pleiade di tre tipi diversi di
atomi: il più leggero, di massa unitaria, prende il nome di protio (o prozio),
quello di massa doppia si chiama deuterio e il terzo, di massa tripla, tritio
(o trizio). Il peso atomico dell'elemento idrogeno è 1,008.
Maggio 2006
50
Per indicare gli isotopi si usa scrivere il simbolo dell'elemento
con a fianco due numeri; l'uno, scritto in alto, detto numero di
massa, indica, in pratica, il peso atomico dell'isotopo e l'altro,
scritto in basso, detto numero atomico, individua la specie
chimica.
(*) Isotopo deriva dalle parole greche isos e topos che significano
"stesso posto". Ciò si riferisce al fatto che gli isotopi di uno
stesso elemento occupano la stessa posizione (cioè la stessa
casella) all'interno del Sistema periodico di Mendeleev.
Maggio 2006
51
12.
LA TAVOLA PERIODICA DEGLI ELEMENTI
Nel 1869 il russo Dimitrij Ivanovič Mendeleev e il tedesco Lothar
Meyer elaborarono indipendentemente, un sistema per classificare
gli elementi chimici secondo la massa atomica crescente: nacque così
la famosa tavola di Mendeleev.
Mendeleev sistemò in una tabella i 63 elementi allora conosciuti
incolonnando in gruppi quelli che avevano proprietà chimiche simili.
Molti spazi rimanevano vuoti e perciò egli riuscì a prevedere che
dovevano esistere altri elementi chimici (che non erano ancora stati
scoperti) e, in base alla loro posizione nella tavola periodica, riuscì a
prevederne le proprietà chimiche e fisiche.
La tavola periodica era costruita partendo dall’ idea che le proprietà
degli elementi variano in modo periodico secondo le masse atomiche.
In realtà ben presto ci si rese conto che questo criterio non era
corretto. Alcuni anni più tardi, la scoperta degli isotopi e i lavori del
fisico inglese H.G. Moseley che chiarì l’importanza del numero
atomico per identificare gli elementi, portarono a riformulare la
tavola periodica secondo il numero atomico crescente.
Maggio 2006
52
Maggio 2006
53
La moderna tavola periodica degli elementi è suddivisa in righe orizzontali,
dette periodi, e colonne verticali dette gruppi.
I periodi sono numerati da 1 a 7, mentre i gruppi da I a VII e suddivisi in
gruppi A (elementi rappresentativi)e B (elementi di transizione), anche
se nella moderna nomenclatura, si numerano i gruppi da 1 a 18.
Si può stabilire una stretta correlazione tra la configurazione elettronica
degli elementi rappresentativi e la loro posizione nella tavola periodica,
secondo alcune regole.
Il numero del gruppo di appartenenza (di tipo A) corrisponde alla somma
degli elettroni s e p del livello energetico più esterno.
Il numero del periodo indica il livello energetico principale degli elettroni
più esterni.
Ad esempio al primo periodo appartengono H (1s1) ed He (1s2) che hanno
come numero quantico principale n = 1.
Al secondo periodo, appartengono otto elementi (dall’ He al Ne) con gli
elettroni più esterni nell’orbitale con n = 2, e così via.
Maggio 2006
54
Ad esempio al gruppo IA (metalli alcalini), appartengono tutti gli
elementi con una configurazione elettronica esterna del tipo ns1.
Li: 1s2 2s1
Na: 1s2 2s2 2p6 3s1
K: 1s1 2s2 2p6 3s2 3p6 4s1
Cs: 1s1 2s2 2p6 3s2 3p6 4s2 4p6 5s2 5p6 6s1
Ciascuno di questi elementi possiede un elettrone esterno in un
sottolivello s; questo spiega perché i metalli alcalini mostrano
proprietà chimiche molto simili.
Invece, gli elementi del gruppo IIA avranno una configurazione
elettronica esterna del tipo ns2, cioè con l’ultimo sottolivello s
pieno; analogamente gli elementi del gruppo IIIA avranno una
configurazione elettronica esterna del tipo ns2np1, quelli del
gruppo IVA del tipo ns2np2, e così via.
Maggio 2006
55
Scarica