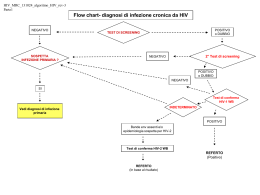
Sierologia infezioni connatali 23 ottobre 2004 Laura Galli Ospedale Meyer - Firenze HIV - Ab STANDARD TEST + test conferma Western Blot + infezione ripetere il test dopo 3 mesi nessun fattore di rischio riferita esposizione recente non infezione non infezione Dipartimento di Pediatria Università di Firenze CDC, revised guidelines for HIV counselling testing and referral MMWR 2001 WESTERN BLOT INDETERMINATO ripetere il test dopo 1 mese WB + WB INDETERMINATO possibile recente esposizione o segni / sintomi HIV - correlati HIV DNA o RNA Dipartimento di Pediatria Università di Firenze INFEZIONE PRIMARIA non riferita recente esposizione- assenza sintomi HIV - correlati NON INFEZIONE CDC, revised guidelines for HIV counselling testing and referral, MMWR 2001 SCREENING DEL SANGUE DI POTENZIALI DONATORI DI ORGANI O CORNEA Miedouge et al, J Med Virol 2002; 66:571-5 HIV Ab indeterminato in donatori di cornea (14.4%) vs donatori di organi (1.8%) P < .001 PCR indeterminata in 17.6% donatori di cornea - RACCOLTA DI CAMPIONI EMATICI PER LA SIEROLOGIA PER PCR < 48 h dal decesso Dipartimento di Pediatria Università di Firenze affidabilità nella diagnosi di infezione primaria Hecht FM et al. AIDS 2002; 16: 1119-1129 sensibilità [%] specificità [%] ELISA III generazione 79 97 p24 79 99 PCR DNA 100 95 PCR RNA 100 97 Dipartimento di Pediatria Università di Firenze classi immunoglobuliniche in età pediatrica % del valore nell’adulto 100 IgM IgG 50 IgA IgG materne 0 1 Dipartimento di Pediatria Università di Firenze 2 4 6 8 età (anni) 10 12 14 16 IgG anti-HIV materne IgG anti-HIV bambino viremia 0 Dipartimento di Pediatria Università di Firenze 6 12 mesi di vita 18 diagnosi sierologica dell’infezione perinatale da HIV nel neonato CDC, revised recommendations for HIV screening of pregnant women, MMWR 2001 test HIV-IgM : non specifico possibilità falsi positivi test HIV-IgA : specificità 95 – 100% sensibilità scarsa <3 mesi di vita 65 – 97% età 3-6 mesi di vita Dipartimento di Pediatria Università di Firenze diagnosi di infezione perinatale da HIV Revised Classification System for Pediatric HIV Infection, CDC 1993 < 18 mesi di età (se HIV Ab + o nato da madre HIV+): almeno 2 risultati positivi - coltura virale - polymerase chain reaction (PCR) - antigene p24 - o diagnosi clinica di AIDS > 18 mesi di età : - anticorpi anti-HIV + (EIA e WB) in 2 determinazioni Dipartimento di Pediatria Università di Firenze algoritmo diagnostico per il neonato da madre HIV+ nelle prime 24-48 h: emocromo, prima PCR HIV-1 e 2, WB HIV-1 (madre e bambino) ogni 7-10 gg fino a 6 sett.: emocromo, SGPT, LDH entro il 1° mese: seconda PCR per HIV-1 e 2 (se negativo->) entro il 3° mese: terza PCR per HIV-1 e 2 (se negativo->) a 6-9 mesi: WB per HIV-1 + emocromo, SGPT (se WB in negativizz.->) a 15-18 m: ELISA per HIV-1 e 2 ogni 12-18 m fino a 5 a: controllo clinico +/- ELISA per HIV-1 e emocromo DIAGNOSI SIEROLOGICA DA CONFRONTO WB MADRE-BAMBINO madre WB: p24 gp120 bambina WB: p24 Dipartimento di Pediatria Università di Firenze 1 mese p24 WB: p24 p31 gp120 gp160 6 mesi p24 + WB: p24 p31 gp120 gp160 8 mesi p24 + WB: p24 p31 gp120 gp160 p66 gp41 CONTEMPORANEA SIEROCONVERSIONE MADRE-FIGLIO madre 1 mese WB: p24 Antigene PCR WB: p24 p 31 gp120 gp160 6 mesi Antigene + PCR + WB: p24 p31 gp120 gp 160 8 mesi Antigene PCR+ WB: p24 p31 gp120 gp160 gp 41 bambina WB: p24 Dipartimento di Pediatria Università di Firenze 1 mese Antigene PCR WB: p24 p31 gp120 gp160 6 mesi Antigene + PCR + WB: p24 p31 gp120 gp160 8 mesi Antigene + PCR + WB: p24 p31 gp120 gp160 p66 gp41 DIAGNOSI SIEROLOGICA IN SIEROCONVERSIONE TARDIVA madre: non ha effettuato terapia durante la gravidanza, parto vaginale, ha allattato il bambino fino all’età di 11 mesi WB: gp160+++ gp120+++ gp41+++ p66+-- p31/34++p55++p24++p17+-- bambino 1 mese 8 mesi 15 mesi PCR - PCRELISA + WB: gp160+++ gp120++gp41++- Dipartimento di Pediatria Università di Firenze 17 mesi ELISA - 22 mesi ELISA + WB: gp160+-gp120--p55+-p24+++ 24 mesi PCR+ WB:gp160+++ gp120++p55+++ p24+++ p66++p17/18+++ sintesi anticorpi anti-HIV dopo immunoricostituzione linfociti circolanti CD4+ Log10 plasma HIV-1 RNA WB:gp160+++ gp120+++ gp41+++ p66+-p31+++ Linfociti circolanti CD4+ /mL 600 p31+++ p55+++ p24+++ p17+++ 7 6 500 5 400 4 300 3 200 2 Inizio chemioterapia 100 1 0 0 5 Dipartimento di Pediatria Università di Firenze 6 7 8 monoterapia 9 10 11 12 13 duplice terapia 14 15 16 HAART Log10 plasma HIV-1 RNA/mL WB:gp160+++ gp120+++ gp41+++ p66+++ 700 altri test per HIV test rapidi su sangue risultato in 10-15’ sensibilità: 99% specificità: 99.6% J AIDS 1993;6:115 JAMA 1997;277:254 J Virol Methods 2002;16:183 utilizzo: paziente fonte di esposizione professionale operatori sanitari a rischio donne gravide non testate pre-partum settings a basso ritorno di soggetti testati Dipartimento di Pediatria Università di Firenze affidabilità del test rapido per anticorpi anti-HIV in fase di sieroconversione tasso anticorpi anti-HIV Makuwa M et al. J Virol Methods 2002; 103: 183-190 8 giorni positivizzazione test rapido positivizzazione ELISA convenzionale di terza generazione tempo Dipartimento di Pediatria Università di Firenze altri test per HIV test su saliva esiti pari al 99.9% positivi e al 99% negativi con sierologia standard risultato in 1 settimana non invasivo basso rischio biologico impiegabile anche in strutture non sanitarie utilizzo: aree estese comunità centri per tossicodipendenze centri sanitari scolastici od universitari Dipartimento di Pediatria Università di Firenze MMWR 2001; 50 (RR19):1-80 altri test per HIV test su urine sensibilità >99% conferma con sierologia risultato in una settimana non invasivo basso rischio biologico impiegabile anche in strutture non sanitarie utilizzo: aree estese comunità centri per tossicodipendenze centri sanitari scolastici od universitari MMWR 2001; 50 (RR19):1-80 Dipartimento di Pediatria Università di Firenze altri test per HIV home kits su spot con puntura del dito risultato dopo 1 settimana sensibilità e specificità: 99.9% conferma con sierologia elevata complessità tecnica utilizzo: aree estese aree rurali soggetti che desiderano mantenere l’anonimato Dipartimento di Pediatria Università di Firenze MMWR 2001; 50 (RR19):1-80 altri test per HIV VIDAS HIV DUO: test di IV generazione di screening per p24 ed anticorpi anti-HIV-1 ed HIV-2 Weber B et al. J Clin Microbiol 2002; 40: 1420-1426 anti-p24 MoAb anti-p24 MoAb gp41 HIV-1 gruppo O gp160 HIV-1 gp36 HIV-2 anti-p24 MoAb Dipartimento di Pediatria Università di Firenze point-of-care whole blood or saliva rapid tests for detecting HIV antibodies MMWR January 30, 2004 moderate complexity no specimen processing 99.8 [99.2 – 100] % sensitivity 99.1 [98.8 – 99.4] % specificity results within 15 minutes Department of Paediatrics University of Florence chi deve essere sottoposto al test per HIV [I] MMWR 2001, 50:RR19 soggetti seguiti per condizioni ad incrementato rischio in centri di medicina scolastica ad alta incidenza di MTS nelle carceri nelle carceri minorili nei centri per il trattamento dell’alcolismo nei centri per homeless nei centri per MTS nei centri per la tubercolosi Dipartimento di Pediatria Università di Firenze chi deve essere sottoposto al test per HIV [II] MMWR 2001, 50:RR19 prevalenza < 1%: - chi presenti segni clinici suggestivi di infezione da HIV - chi sia effetto da altre MTS o abbia contratto altre infezioni trasmissibili con sangue - chiunque riferisce fattori di rischio o richiede il test prevalenza > 1%: - chiunque indipendentemente dalla prevalenza o dal fattore di rischio: - chiunque con possibile esposizione occupazionale - chiunque con esposizione sessuale o scambio di aghi con HIV+ - donne in gravidanza Dipartimento di Pediatria Università di Firenze PREVENZIONE RISCHIO BIOLOGICO Via di Trasmissione delle Infezioni Via parenterale: rientrano in questa categoria i microorganismi che si trasmettono sia mediante inoculazione tramite aghi, lame, ecc.contaminati (via percutanea), sia attraverso il contatto di sangue, o altro materiale biologico infetto, con la cute lesa ( microferite, abrasioni ecc) o le mucose (esposizione mucocutanea). Hanno una trasmissione parenterale il virus dell’epatite B, C e l’HIV. PREVENZIONE RISCHIO BIOLOGICO 1985 PRECAUZIONI UNIVERSALI Decreto 28.9.90 “Norme di protezione dal contagio professionale da HIV nelle strutture sanitarie”: “Tutti gli Operatori devono adottare misure di barriera idonee a prevenire l’esposizione della cute e delle mucose nei casi in cui sia prevedibile un contatto accidentale con il sangue o con altri liquidi biologici quali liquido seminale, secrezioni vaginali, liquidi cerebrospinale, sinoviale, pleurico, peritoneale, pericardico e amniotico.” PREVENZIONE RISCHIO BIOLOGICO 1994 PRECAUZIONI STANDARD + precauzioni basate sulla modalità di trasmissione PREVENZIONE RISCHIO BIOLOGICO ITALIA, Studio SIROH-Epinet Esposizioni percutanee ad HIV; distribuzione per area funzionale Altri Laboratorio 3% 4% Malattie Infettive Unità di Terapia 2% intensiva 6% Chirurgia 48% Medicina 37% PREVENZIONE RISCHIO BIOLOGICO PREVENZIONE RISCHIO BIOLOGICO Tassi annui di lesioni percutanee specifici per occupazione (numero medio di lesioni /anno per operatore; Italia, 1986) personale di manutenzione e amministrativi tecnici (laboratorio, radiologia, patologia) medici non chirurghi infermieri chirurghi tasso medio 0 0,1 0,2 0,3 0,4 0,5 0,6 PREVENZIONE RISCHIO BIOLOGICO esposizioni percutanee con siringa standard dopo l'uso ma prima dell'eliminazione 23% durante l'eliminazione 8% reincappuciando 28% durante l'uso 41% PREVENZIONE RISCHIO BIOLOGICO esposizioni percutanee con ago a farfalla durante l'eliminazione 21% dopo l'uso ma prima dell'eliminazione 28% durante l'uso 45% reincappuciando 6% PREVENZIONE RISCHIO BIOLOGICO Prevalenza popolazione generale Prevalenza HBV Prevalenza HCV Prevalenza HIV 1-2 % 3-16 % 0.1 % Prevalenza nella popolazione afferente alle strutture Ospedaliere Prevalenza HBV Prevalenza HCV Prevalenza HIV 2% 4% 1% Prevalenza negli operatori sanitari Prevalenza HBV Prevalenza HCV Prevalenza HIV 2% 2% < 0.1 % ( Istituto Superiore di Sanità : Consensus Conference su HIV HBV HCV 1999 ) Rischio occupazionale per HIV, HCV e HBV HBV da sangue HBsAg+ e HBeAg+ : 22-31% sviluppano epatite B 37-62% sieroconvertono HIV da puntura percutanea da HIV+: 0.3% da contatto di mucose : 0.09% HCV da puntura percutanea da HCV+: 1.8% MMWR, 2001 PREVENZIONE RISCHIO BIOLOGICO Casi di sieroconversione per HIV osservati in Italia negli operatori sanitari caso numero 1 2 Tipo di esposizione congiuntivale ago di siringa 3 4 5 ago con catetere i.v. taglio con bisturi congiuntiva Paziente fonte asintomatico Tossicodipendente HIV-Ab negativo AIDS asintomatico siero residuo contenente HIV CLASSIFICAZIONE DEL LIVELLO DI RISCHIO DI INFEZIONE DA HIV IN FUNZIONE DELLA MODALITÀ DI ESPOSIZIONE EMATICA Ad alto rischio1 1. Lesione profonda da ago cavo, pieno di sangue 2. Contatto diretto con virus concentrato A rischio 1. Puntura con ago o ferita con presidio visibilmente contaminato da sangue 2. Esposizione di cute lesa o della congiuntiva a sangue o a liquidi biologici visibilmente contaminati da sangue 1 1 A basso rischio 1. Lesione superficiale 2. Esposizione di lesione cicatrizzata, o di una mucosa diversa dalla congiuntiva, a sangue o a liquidi biologici visibilmente contaminati da sangue 3. Contatto prolungato di una vasta area cutanea con sangue; ferita da morso Nessun rischio documentato 1. Contaminazione di cute integra (piccola superficie) con sangue 2. Lesioni con presidi non visibilmente contaminati da sangue 1 Il rischio è ulteriormente aumentato se il paziente fonte è nello stadio terminale di AIDS o nella “fase finestra” dell’infezione da HIV. case-control study of HIV seconversion in health care workers after percutaneous exposure Cardo DM et al, NEJM 1997; 337:1485-1490 OR 95% CL 15 6-41 injury with a device visibly contaminated with blood 6.2 2.2-21 needle placed in artery or vein 4.3 1.7-12 source patient died of AIDS within 2 months afterwards 5.6 2-16 deep injury ZVD prophylaxis 0.19 0.06-0.52 PREVENZIONE RISCHIO BIOLOGICO Profilassi post-esposizione in personale sanitario MMWR 1999 Determinare grado di esposizione (sangue) cute lese e mucose cute integra percutanea volume NO PPE gravità poche gocce 1 quantità maggiori o per più tempo 2 superficie 2 lesione profonda, sangue visibile sull’ago, ago appena estratto da vena o arteria 3 Profilassi post-esposizione in personale sanitario MMWR 1998 Determinare HIV + della fonte di esposizione HIV+ asintomatico CD4 elevati e bassa carica virale 1 sierologia per HIV sconosciuta fonte sconosciuta AIDS o infezione primaria o CD4 bassi o elevata carica virale 2 ND Profilassi post-esposizione in personale sanitario MMWR 1998 Raccomandazioni: Tipo di esposizione HIV+ fonte di esposizione Protocollo 1 1 PPE da valutare 1 2 Base 2 1 Base 2o3 1o2 Aggressivo 2o3 ND Base se setting a rischio Farmaci per profilassi post-esposizione per HIV Protocollo base zidovudina + lamivudina lamivudina + stavudina didanosina + stavudina Protocollo aggressivo* base + * Da concordare con un infettivologo indinavir nelfinavir efavirenz abacavir ritonavir amprenavir lopinavir/ritonavir MMWR, 2001 Profilassi post-esposizione per HBV Stato vaccinale dell’operatore sanitario non vaccinato paziente HBsAg+ HBsAg- sconosciuto HBIg x 1 vaccinare vaccinare vaccinare nessuno nessuno nessuno non responder HBIG X 1 rivaccinare nessuno se paziente alto rischio come HBsAg+ risposta anticorpale sconosciuta test anti-HBs nessuno se <10mIU/ml HBIg x 1 e booster se paziente alto rischio come HBsAg+ vaccinato responder MMWR, 2001 Gestione post-esposizione per HCV •dosaggio basale anti-HCV e transaminasi •anti-HCV e transaminasi a 4-6 mesi •se opportuna diagnosi precoce HCV-RNA a 4-6 settimane •immunoglobuline o antivirali non raccomandati MMWR, 2001 Infezione congenita da CMV infezione congenita più frequente : 1% [0.47- 2.2%] dei nati vivi (Alford et al, Rev Infect Dis 1990 Griffiths et al, Br J Obstet Gynecol 1991 Casteels et al, J Perinat Med 1999 Barbi et al, Eur J Epidemiol 1998 Revello et al, J Infect Dis 1999) INFEZIONE MADRE-FIGLIO DA VIRUS CITOMEGALICO MADRE IN GRAVIDANZA con anticorpi anti-CMV [55%] riaccensione infezione del figlio [<1%] infezione clinicamente evidente [15%] sequele [90%] senza anticorpi anti-CMV [45%] infezione primaria infezione del figlio [40%] Infezione inapparente [85%] sequele [15%] Stagno, 1996 Infezione congenita da CMV Trasmissione: - transplacentare durante tutta la gravidanza - intrapartum (26-57%) - con allattamento materno (30-70%) ESCREZIONE DI CMV [Stagno, Clin Obstet Gynecol 1982] % madri positive 15 10 5 1° trimestre 2° trimestre 3° trimestre cervice uterina 1° mese latte manifestazioni dell’infezione congenita da CMV nel neonato prematurità piccolo per l’età gestazionale epatosplenomegalia ittero ipertransaminasemia emolisi manifestazioni emorragiche piastrinopenia manifestazioni neurologiche Bozzana et al, Pediatr Infect Dis J 1992 50 % bambini sintomatici 100 Sequele nel bambino da infezione congenita da CMV % 60 50 40 30 20 10 0 sintomatici sordità neurosensoriale corioretinite microcefalia, convulsioni e paralisi convulsioni decessi asintomatici sordità bilaterale QI<70 microcefalia paresi/paralisi Pass, Fowler et al, Proceedings of the Third International CMV Workshop, 1991 Test diagnostici per infezione congenita da CMV IgG ELISA IgM EIA/ELISA (possono persistere anche 3-6 mesi dopo la fase acuta) IgM WB (permette di identificare reinfezioni, da preferire se IgM+ oltre la 18-20a sett. di gravidanza) IgG avidity (bassa avidità fino a 18-20 settimane) antigenemia (sensibilità 50% nel 1° mese dall’infezione) viremia (sensibilità 25% nel 1° mese dall’infezione) DNA - PCR qualitativa [su liquido amniotico (basso PPV) o su PBL] DNA - PCR quantitativa [su liquido amniotico o su PBL (nel neonato correla con severità mamifestazioni cliniche e con risposta alla terapia)] nuove metodiche: LC-PCR (light cycler PCR-system) IEmRNA (immediate early RNA) PCR 1 donna pre-gravidanza Maine et al Exp Rev Mol Diagn 2001;1:19-29 determinare sierologia CMV immune non immune (counselling prevenzione) screening sierologico in gravidanza (0-12, 12-18, >30 settimana) non infezione Infezione CMV diagnosi prenatale diagnosi postnatale follow-up neonato e trattamento 2 test sensibili IgG e IgM per CMV G- M- non ulteriori tests elevata G+ M- G- M+ G+ M+ CMV IgG avidity test bassa Maine et al Exp Rev Mol Diagn 2001;1:19-29 test dopo 3 settimane G+ M+ Infezione primaria diagnosi prenatale a 21-22 settimane G- M+ Maternal IgG avidity and IgM detected by blot To identify women at risk of transmitting CMV at 20-23 weeks Lazzarotto et al Viral Immunology 2000;13:137-141 AI low (n=37) medium/high/nd (n=50) congenital infection yes no sens 10 27 6 44 62 Blot IgM at-risk profile* (n=31) no-risk profile (n=56) 12 4 19 52 75 13 24 3 47 AI + Blot IgM low AI and at-risk profile (n=37) no low AI and no-risk profile (n=50) * at-risk profile: >=4 bands 81 spe PPV NPV 62 27 88 73 38.7 92 66.2 35.1 94 Indicatori prenatali dell’infezione congenita da CMV Lazzarotto et al J Pediatr 2000; 137:90-5 infezione da CMV PCR positiva PCR negativa SI 0 12 NO 33 12 sensibilità:100%, specificità:73.3%, PPP:50%, PPN:100% >=103 <103 SI 3 9 NO 12 0 sensibilità:75%, specificità:100%, PPP:100%, PPN:80% >=105 <105 asintomatici 7 1 16 sintomatici 0 sensibilità:87%, specificità:100%, PPP:100%, PPN:94% Infezione congenita da CMV: valore diagnostico e prognostico dei tests eseguiti nelle prime 3 settimane di vita Revello, J Clin Virol 1999 sensibilità (%) CMV DNA sangue antigenemia viremia IgM CMV DNA viremia 100 42.5 28.2 70.7 specificità (%) 100 100 100 100 significativamente più elevati nei sintomatici infezione perinatale da CMV: diagnosi Stagno, 2000 Barbi, 1997 isolamento virale nei tessuti CMV DNA + (PCR qualitativa e/o quantitativa) su urine e/o saliva antigeni precoci p72 e p54 (sensibilità:94%,specificità:100%) IgM ELISA (sensibilità:70%, specificità:95%) monitoraggio: antigenemia p65 PCR quantitativa <=2 settimane di vita: congenita >2 settimane di vita: postnatale Infezione congenita da CMV: diagnosi su Guthrie cards % nested PCR+ su blood spot test/bambini con coltura virale + sensibilità:100% specificità: 99% 72+/72 CMV+ 4+/437 CMV- Barbi et al, J Clin Virol 2000 CMV DNA PCR su carte da filtro conservate per 12-18 anni 13+ 3 - /16 con isolamento virale + su urine 6 deb+ /16 con isolamento virale Johansson et al, Scand J Infect Dis 1997 CASO CLINICO: ELEONORA •PN 3310 g, L 50 cm, CC 32 cm , IA 9-9, non ittero •CC < 3° p •Ecografia cerebrale: dilatazione del sistema ventricolare ex-vacuo e calcificazioni diffuse periventricolari e dei nuclei della base •Colestasi •nel follow-up: •microcefalia e arresto dello sviluppo psicomotorio •4 crisi di assenza, nonostante il trattamento con carbamazepina 7° giorno 1° mese 1 m 15 gg IgG antiCMV IgM antiCMV PCR liquor neg PCR plasma 1140 genomi/ml <500 genomi/ml <500 genomi/ml Ag precoci sangue neg PCR sangue 410 genomi/100000PMN 140 genomi/100000PMN <100 genomi/100000PMN Ag precoci urine pos Es. colturale urine pos PCR urine >1000000 genomi/ml 24350 genomi/ml 770 genomi/ml 2° mese 6° mese pos neg neg neg Ganciclovir 15 mg/kg/die per 6 settimane Immunoglobuline antiCMV 200 UI/kg/die per 1 mese pos pos CASO CLINICO: FRANCESCO •Madre esegue al III trimestre di gravidanza test per infezione sintomatica da CMV del marito IgG anti CMV + IgM anti CMV + •PN: 2970 g, L: 50 cm, CC: 35 cm, IA: 9-9, non ittero IgG antiCMV IgM antiCMV Ag precoci sangue PCR qualit. sangue PCR quantit. sangue Es. colturale samgue Ag precoci urine PCR quantit. urine Es. colturale urine 3° giorno 194,5 neg pos pos 10° giorno neg neg neg neg pos 17380 genomi/ml pos 1° mese neg neg 3° mese pos pos 11170 genomi/ml pos pos TOXOPLASMOSI CONGENITA: tasso di trasmissione e severità dell’infezione nel neonato in rapporto all’età gestazionale di acquisizione dell’infezione materna 6% 2% 0% infezione severamente sintomatica 80% 3% 10 infezione congenita 24 30 parto Dunn, Lancet 1999 FOLLOW-UP OFTALMOLOGICO A 20 ANNI DI 11 SOGGETTI CON TOXOPLASMOSI CONGENITA NON TRATTATA n° soggetti con patologia oculare 10 5 5 10 15 20 anni Koppe, Eur J Obstet Gynecol Reprod Biol 1974 TOXOPLASMOSI CONGENITA: linee guida il trattamento Remington, 2000 pirimetamina 2 mg/kg/die x 2 gg, poi 1 mg/kg/die x 2- 6 m, poi 1 mg/kg/die a gg alterni per 1 anno sulfadiazina + ac. folinico 100 mg/kg/die : 2dosi per 1 anno 10 mg x 3 v/sett per 1 anno prednisone 1 mg/kg se retinite o proteinorrachia + DIAGNOSI SIEROLOGICA DELLA TOXOPLASMOSI: Montoya, J Infect Dis 2002, 39185:S73-82 IgG (Dye test, ELISA, IFA, test di agglutinazione diretta) IgM (ELISA, IFA, immunosorbent agglutination assay o ISAGA) IgA (ELISA, ISAGA) IgE (ELISA, IFA) 1-2 sett. 1-2 mesi mesi DIAGNOSI SIEROLOGICA DELLA TOXOPLASMOSI: Montoya, J Infect Dis 2002, 39185:S73-82 IgG+, IgM IgA IgE ELISA - pattern infezione cronica IgG ++, IgM IgA IgE ELISA + pattern infezione acuta IgG +, IgM ELISA + IgA IgE ELISA - dubbia interpretazione ripetere se invariato: infezione pregressa se incremento IgM: infezione acuta Test di avidità IgG ma cutoff alta avidità variabile [25-50% (Liensenfeld, J Infect Dis 2001)] bassa alta infezione recente infezione pregressa TOXOPLASMOSI CONGENITA: necessità di diagnosi precoce Remington, 2000 se segni clinici nei primi 6 mesi di vita in assenza di sierologia materna se sieroconversione materna in gravidanza Identificazione dei bambini infetti Iniziare terapia e follow-up PROBLEMI NELLA DIAGNOSI SIEROLOGICA DELLA TOXOPLASMOSI CONGENITA: Pinon et al, J Clin Microbiol 2001, 39:2267-71 Anticorpi di origine materna trasmessi passivamente (IgG) [fino a 6-12 mesi di vita] o by leakage (IgM o IgA) [fino a 10 gg di vita] TOXOPLASMOSI CONGENITA: linee guida per la valutazione del neonato da madre con toxoplasmosi in gravidanza esame clinico completo esame neurologico esame oftalmologico esame audiologico esame emocromocitometrico completo funzionalità epatica ( con bilirubina e gGT) dosaggio immunoglobuline sieriche es. chimico fisico liquor, sierologia toxo e PCR TAC cerebrale con MdC sierologia toxo: dye test, IgG, IgM, IgA e IgE ISAGA/ELISA se IgM e/o IgA + : trattare infezione esclusa: IgG - >12 mesi di vita 6 mesi dopo sospensione terapia Remington, 2000 Evaluation of methods comparing mothers and newborns (0-10 days) and standard methods for postnatal detection of IgG, IgM and IgA Pinon et al, J Clin Microbiol 2001, 39:2267-71 ISAGA-M ISAGA-A EIA-M EIA-A ELIFA-G ELIFA-M IB-G IB-M sens 67.5 72.5 61.5 71.4 64.2 16.6 40 56.7 spec 77.7 77.7 88.8 85.1 100 100 96.2 100 ISAGA-M + ISAGA-A EIA-M + EIA-A ELIFA-G + ELIFA-M IB-G + IB-M ELIFA-G + ELIFA-M + EIA-M + EIA-A ELIFA-G + ELIFA-M + ISAGA-M + ISAGA-A IB-G + IB-M + EIA-M + EIA-A IB-G + IB-M + ISAGA-M + ISAGA-A 76.9 80.9 73 64.8 92.1 88.8 81 87.5 74 77.7 100 96.2 74 77.7 70.3 81.4 Transitoria negatività della sierologia e rebound postterapia in bambini con toxoplasmosi congenita Wallon et al, Eur J Ped 2001;160:534-40; Jaisson-Hot Presse Med 2001, 30:1001-4 terapia ELISA, IFA IgG Media: 5 mesi Sifilide congenita: manifestazioni cliniche - morte del feto, idrope fetale, prematurità - neonato asintomatico - < 2 anni: manifestazioni precoci SGA e arresto accrescimento ittero ed epatosplenomegalia rinite persistente pemfigo sifilitico, rash maculopapulare linfoadenopatia lesioni mucocutanee osteocondrite e pseudoparalisi anemia emolitica e trombocitopenia - >2 anni: tardive SNC: ritardo mentale, convulsioni, idrocefalo ossa: osteocondrite, periostite, osteomielite denti di Hutchinson occhio: cheratite interstiziale, corioretinite cute: ragadi orecchio: sordità da neurite dell’VIII Sifilide congenita: epidemiologia Trasmissione: - transplacentare durante tutta la gravidanza - intrapartum - non evidenza di trasmissione con latte materno (descritti casi da balia con lesioni attive sul capezzolo) Tasso di trasmissione: - stadio materno primaria non trattata: 29% (Sheffield, Am J Obstet Gynecol 1999) 40% (Red Book 2000) secondaria non trattata: 59% (Sheffield, Am J Obstet Gynecol 1999) 60-100% (Red Book 2000) sifilide congenita: quali bambini valutare? Nati da madre a rischio di trasmettere - sifilide non trattata o non adeguatamente trattata - non decremento di 4 v tests non treponemici nella madre nonostante il trattamento - terapia solo nell’ultimo mese prima del parto - terapia pre gravidica, ma non follow-up in gravidanza Bambino sintomatico sifilide congenita: valutazione del neonato - tests non treponemici (VDRL, RPR) e treponemici (FTA-ABS, TPHA) quantitativi - IgM anti treponema - cellularità e proteinorrachia e VDRL su liquor - radiografia ossa lunghe - esame emocromocitometrico e funzionalità epatica sifilide congenita: diagnosi di infezione Red Book 2000 test non treponemici* (VDRL, RPR) test treponemici§ (FTA-ABS, TPHA) madre bambino madre bambino + + - - falso + madre + +/- + + sifilide materna possibile infezione neonato - - + + sifilide materna efficacemente trattata nel bambino non infetto: * negativi a 4-6 mesi; § a 1 anno interpretazione SIFILIDE CONGENITA follow-up successivo alla profilassi od al trattamento dopo profilassi in gravidanza o alla nascita VDRL alla nascita e poi ogni 3 mesi fino a negativizzazione ricerca anticorpi anti-treponema dopo 15 mesi dopo trattamento per sifilide congenita VDRL ogni 3 mesi fino a 15 mesi; poi ogni 6 mesi fino a negativizzazione o stabilizzazione di un titolo basso ricerca anticorpi anti-treponema dopo 15 mesi esame del LCR 6 mesi dopo il trattamento [se presenti alterazioni all’inizio] o alla comparsa di qualunque manifestazione neurologica accurato follow-up di udito [VIII] e vista [ glaucoma tardivo] Rathbun, 1983; Ingam, 1996 Epatite C (HCV) tasso di trasmissione madre-figlio: 5% (95% LC: 1.6-12) Infants born to anti-HCV positive/HCV-RNA negative mothers. In the absence of symptoms and signs of liver disease: anti-HCV and ALT at 18-24 months of life In the case of normal ALT activity and lack of anti-HCV: not infected In the presence of abnormal ALT activity: perform PCR test for HCV-RNA even in absence of anti-HCV. Infants born to anti-HCV positive/HCV-RNA positive mothers. HCV-RNA and ALT activity at 3 months (90% sensitivity). Repeat HCV-RNA at 6 months: if positive infected. If HCV-RNA negative at 3 months, but abnormal ALT: additional HCV RNA screening. If HCV-RNA negative, and with normal ALT activity at the age of 3 months: uninfected additional anti-HCV assay and a further ALT evaluation at age 18-24 months. persistence of anti-HCV at 24 months, in constant absence of HCV viremia and with normal ALT, should be considered as a marker of past infection. possibili conseguenze dell’infezione perinatale da parvovirus B19 feto morte idrope malformazioni neonato 9% 1% microftalmia atrofia cerebrale calcificazioni cerebrali calcificazioni surrenali cardiopatia Barton et al Am Heart J 1997 Vogel et al Pediatr Pathol Lab Med 1997 Wiersbitzky et al Pediatr Hematol Oncol 1999 miocardite pericardite pleurite (e ipoplasia polmonare) vasculite sistemica necrotizzante anemia Trasmissione verticale del parvovirus B19 tasso di trasmissione: 33% *- 51%§ morte feto: 1.66 - 9% età gestazionale trasmissione: dalla 7- 8a settimana§ trasmissione con latte materno: tasso infezione sintomatica: *Public Health Laboratory Service Working Party on Fifth Disease, BMJ 1990 § Koch et al, Pediatr Infect Dis J 1998 Diagnosi infezione recente materna: anti - B19 IgM o incremento del titolo IgG in 2 campioni Valutazione sierologica e virologica in 43 neonati da madre con infezione primaria da parvovirus B19 Koch et al, Pediatr Infect Dis J 1998 solo IgM+ 6/43 solo PCR+ 4/43 PCR+ e IgM+ 1/43 PCR+ e IgA+ 2/43 PCR+, IgM+ e IgA+ 5/43 solo IgA+ 4/43 totale 22/43 (51%) Follow-up sierologico e virologico in 13 neonati da madre con infezione primaria da parvovirus B19 nascita 4m 1 anno _______________________________________________________ Anticorpi: IgG 13/13 9/10 3/11 IgM 4/13 0/10 0/11 IgA 5/13 1/10 0/11 siero 2/13 1/10 0/10 urine 2/12 1/10 0/5 saliva 2/6 2/5 0/4 PCR su: Koch et al, Pediatr Infect Dis J 1998
Scarica