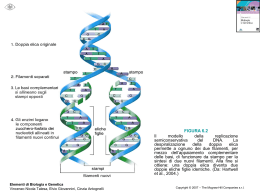
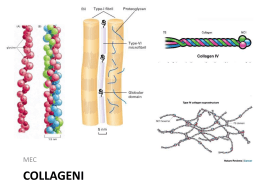
COLLAGENE Informazioni aggiuntive http://web.mit.edu/3.082/www/team1_f02/collagen.htm Informazioni strutturali sul collagene - 1 Il collagene consiste di tre catene polipeptidiche sinostrorse, ciascuna contenente circa 1000 residui di aminoacidi. Il contenuto in aminoacidi del collagene è circa 1/3 di glicina e circa 22% di prolina e idrossiprolina, L’elica peptidica è composta da ripetizioni della sequenza aminoacidica Gly-X-Y dove X e Y sono spesso prolina e idrossiprolina. Ogni giro dell’elica contiene 3.3 residui di aminoacidi. La presenza di glicina nella terza posizione è essenziale in quanto questo aminoacido è sufficientemente piccolo per inserirsi in uno spazio ristretto all’interno dell’elica. I residui laterali voluminosi della prolina e dell’idrossiprolina sono rivolti verso l’esterno. La struttura terziaria del collagene consiste in tre eliche sinistrorse formando un avvolgimento destrorso. La struttura della triplice elica è stabilizzata da legami di idrogeno intermolecolari fra i gruppi NH- e CO- del legame peptidico delle tre catene polipeptidiche e dalla presenza di molti resisui di prolina e idrossiprolina. Dato che la prolina e l’idrossiprolina sono aminoacidi ciclici rigidi, essi limitano la rotazione dell’impalcatura polipeptidica e perciò contribuiscono alla stabilità della triplice elica. http://www.uni-regensburg.de/Fakultaeten/nat_Fak_IV/Organische_Chemie/Didaktik/Keusch/D-gummy_bears-e.htm Informazioni strutturali sul collagene - 2 Triplice elica Informazioni strutturali sul collagene - 3 • Diverse molecola a triplice elica si impacchettano lateralmente [Attenzione: con sfalsamento costante] generando una fibra resistente. • Le fibre collagene formate mediante interazioni intermolecolari fra le triplice eliche di collagene sono stabilizzate mediante legami incrociati tra residui di lisina e di idrossilisina. • I residui di lisina (o i residui di idrossilisina) sono modificati post-traduzionalmente a derivati aldeidici (allisine o idrossiallisine) dall’enzima lisina ossidasi. • Due gruppi aldeidici reagiscono per formare un gruppo aldolico, che viene disidratato dando un gruppo insaturo a,b. • Si forma un legame incrociato covalente molto stabile che riunisce gli amino- e carbossiterminali non elicoidali di un filamento con la porzione elicoidale di un filamento adiacente. http://www.uni-regensburg.de/Fakultaeten/nat_Fak_IV/Organische_Chemie/Didaktik/Keusch/D-gummy_bears-e.htm Informazioni strutturali sul collagene - 4 http://www.uniregensburg.de/Fakultaeten/nat_Fak_IV/Organische_Chemie/Didaktik/Keusch/Dgummy_bears-e.htm Informazioni strutturali sul collagene - 5 • Quando il collagene viene riscaldato e denaturato con acidi o basi, diventa solubile in acqua: si produce la gelatina. • La configurazione a triplice elica viene alterata da riscaldamento; dopo raffreddamento dell’idrogel, la gelatina riprende parzialmente la struttura a triplice elica, e crea legami incrociati fra le catene. La catena assume una disposizione casuale. http://catalog.flatworldknowl edge.com/bookhub/reader/3 728?e=zimmerman_1.0ch06_s02
Scaricare